Динамика эффективности фиксации CO 2 штаммом Bracteacoccus minor при различной доступности азота
Автор: Кочубей А.В., Мальцева И.А., Мальцев Е.И., Яковийчук А.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Ботаника
Статья в выпуске: 4, 2024 года.
Бесплатный доступ
Чрезмерное выделение и накопление углекислого газа в атмосфере является серьезной проблемой, имеющей ряд негативных экологических последствий, включая глобальное потепление. Для борьбы с этими последствиями используются различные подходы, при этом основное внимание уделяется сокращению выбросов углекислого газа и достижению нулевого углеродного баланса. В дополнение к сокращению добычи и использованию ископаемых видов топлива в качестве потенциального решения рассматривается биосеквестрация. Микроводоросли особенно перспективны в этом отношении, поскольку они могут служить поглотителями углекислого газа при использовании в биотехнологических процессах. Некоторые штаммы микроводорослей, например, из рода Bracteacoccus Tereg, были изучены на предмет их способности синтезировать ценные продукты, хотя способность поглощать углекислый газ данными объектами не изучалась, в частности при изменении концентрация доступного азота в питательной среде. В ходе исследования было установлено, что высокие уровни биодоступного азота увеличивают среднюю скорость поглощения углекислого газа, в то время как максимальное поглощение происходит, когда культура выходит из lag-фазы. Скорость фиксации углекислого газа и его количество, поглощенное Bracteacoccus minor (MZ-Ch31), напрямую зависят от продуктивности биомассы и концентрации хлорофилла.
Биосеквестрация, биомасса, продуктивность, хлорофилл, среда культивирования, bbm, 3n bbm, f, f2
Короткий адрес: https://sciup.org/147247240
IDR: 147247240 | УДК: 551.4 | DOI: 10.17072/1994-9952-2024-4-366
Текст научной статьи Динамика эффективности фиксации CO 2 штаммом Bracteacoccus minor при различной доступности азота
Увеличение объемов использования ископаемой энергии на основе углерода, уничтожение лесов и другие изменения в землепользовании привели к еще большему количеству отходов в виде парниковых газов, а также к снижению способности планеты поглощать их [White, 2012]. Проблема эмиссии углекислого газа в атмосферу приобретает все более глобальные масштабы [Li et al., 2023], что связано в первую очередь с индустриализацией, увеличением численности населения и использованием ископаемой энергии [White, 2012]. Накопление парниковых газов имеет ряд негативных экологических последствий, одно из которых – глобальное потепление [Venkata Mohan et al., 2016; Zhu et al., 2016; Sangeetha et al., 2022], а также ряд сопутствующих проблем, что в комплексе стало серьезной угрозой для экологической устойчивости и безопасности человечества в целом [Ma et al., 2022]. В связи с этим все более актуальной становится стратегия нулевого углеродного баланса [Ma et al., 2022]. По вопросам изменения климата и снижения выбросов парниковых газов разработан ряд регламентирующих документов международного статуса, в которых Российская Федерация является стороной взаимодействия [Cherepovitsyna, Dorozhkina, Kostyleva, 2023].
Большие перспективы по снижению эмиссии углекислого газа может иметь биосеквестрация. Она предполагает возможность снижения эмиссии углекислого газа путем восстановления различного рода экосистем или введения в эксплуатацию не возделываемых территорий, акваторий и др. Однако данные мероприятия обычно продолжительны во времени, а для лесных экосистем требуют десятилетий. Ввиду данных ограничений микроводоросли выглядят как довольно перспективный объект биосеквестрации, а их использование в данном контексте становится все шире [Cheah et al., 2015; Zhu et al., 2016; Ma et al., 2022; Zhao et al., 2022; Li et al., 2023]. Известен положительный опыт применения некоторых штаммов микроводорослей для снижения выбросов CO 2 с дымовыми газами. Поглощение CO 2 клетками водорослей усиливается при синтезе вторичных метаболитов [Venkata Mohan et al., 2016]. Спектр синтезируемых микроводорослями метаболитов очень широк [Barkia, Saari, Manning, 2019; Dolganyuk et al., 2020; Coulombier, Jauffrais, Lebouvier, 2021; Ramos-Romero et al., 2021]. Объемы биомассы микроводорослей, выращиваемой для целей биотехнологических производств, постоянно растут.
Широко распространенной практикой активизации биосинтеза ценных метаболитов является культивирование в стрессовых условиях, в том числе выращивание в средах с ограниченной доступностью азота [Rios et al., 2015; Mudimu et al., 2017; Zhang et al., 2018; Janssen, Wijffels, Barbosa, 2019; Chen et al., 2022; Şirin, Serdar, 2024]. И хотя накопление вторичных метаболитов сопряжено с усилением поглощения CO 2 , сами процессы биосеквестрации при ограничении азота исследованы мало [Farooq, 2022]. Однако они представляют значительный интерес с точки зрения достижения нулевого углеродного баланса.
В качестве биотехнологических объектов интенсивно исследуются представители рода Bracteacoccus Tereg, что связано с их способностью синтезировать при определенных условиях культивирования каротиноиды, липиды и ценные жирные кислоты [Ratha et al., 2013; Minyuk, Chelebieva, Chubchikova, 2014; Mamaeva et al., 2018; Maltsev et al., 2020; Chekanov et al., 2022; Lukavský et al., 2022; Malik et al., 2022]. В этом аспекте один из представителей – Bracteacoccus minor (Chodat) Petrova исследован довольно слабо, хотя является космополитным видом и довольно широко распространен. Эффективность поглощения CO 2 данным видом пока не изучалась, хотя его широкое распространение в сочетании с биотехнологическим потенциалом может стать основой разработки проектов, объединяющих в себе решение проблем секвестрации углекислого газа и получения ценных метаболитов в промышленных масштабах.
Цель – изучить динамику биофиксации CO 2 штаммом Bracteacoccus minor (MZ-Ch31) в условиях различной доступности азотного питания.
Материалы и методы исследований
Выделенный из почвы штамм Bracteacoccus minor MZ-Ch31 (насаждение Robinia pseudoacacia L., парк им. Горького, г. Мелитополь, Россия), выращивали на стандартной среде BBM (Bischoff and Bold, 1963). Штамм в культуре поддерживается при 15±2°C в пробирках, освещенных белыми диодами с интенсивностью света 120 Лк и режимом освещения 16:8 ч (свет/темнота) на среде BBM. Для эксперимента клетки иннокулировали в 150 мл свежей среды BBM. При наступлении экспоненциальной фазы роста (через 5 дней) эту культуру использовали для постановки эксперимента. В качестве реакторов использовались плоскодонные колбы объемом 250 мл с герметичными крышками и системой обеспечения постоянства состава газовоздушной смеси в колбе. Культуры аэрировали воздухом с помощью аквариумного компрессора Hailea ACO-308 (Hailea, China). Воздух подавали через стеклянную трубку с внутренним диаметром 4 мм со скоростью 0.1 л мин-1. Для предотвращения бактериального загрязнения культуры использовали бактериальный вентиляционный фильтр (GSV, Italy) диаметром 40 мм, который устанавливался в разрыв между компрессором и стеклянной трубкой. Это позволило поддерживать культуру в альгологически чистом состоянии. Выращивание штамма проводили в стандартных условиях: интенсивность света – 5000 Лк; режим освещения – 16:8 ч (свет/ темнота); температура окружающей среды – 20±1°С. Начальная концентрация – 2.89×105 клеток мл-1.
Для постановки эксперимента использовали стандартную и модифицированную по содержанию азота среду BBM. Исследовали 4 варианта питательной среды, обозначенные как группа-1, группа-2, группа-3, группа-4. Группы отличались между собой содержанием в питательной среде общего азота (N) в форме нитратов (NO 3 –). Концентрации подбирались в соответствии с содержанием N в широко применяемых средах культивирования (3N BBM, BBM, F, F2). Соответственно концентрация азота в группах составляла: группа-1 – 0.124 г л-1; группа-2 – 0.04 г л-1; группа-3 – 0.025 г л-1; группа-4 – 0.012 г л-1. Группа-2 выступала в качестве контрольной, т.к. имела стандартное для среды BBM содержание азота.
Плотность биомассы (B) определяли гравиметрически, путем выдерживания 1 мл биомассы в сушильном шкафу на протяжении 6 часов при 120°С и последующим взвешиванием сухого остатка.
Рост микроводорослей оценивали путем измерения сухого веса (СВ). Измеренный сухой вес выражали в г л - 1 . Объемная продуктивность биомассы (P) рассчитывалась по формуле в соответствии с источником [Morais, Costa, 2007]:
Р (г СВ л-1 день-1) = У, где X1 – сухой вес (г СВ л-1) во время t1 (день), и X2 – сухой вес (г СВ л-1) во время t2 (день).
Биофиксацию СО 2 (F) рассчитывали на продуктивность биомассы (Р) по уравнению [Morais, Costa, 2007] с уточнениями:
F — pQ м— )
, где Р – продуктивность биомассы (г СВ л-1 день-1), C C – содержание С в биомассе (%), M (CO 2 ), (MC) – молярная масса CO 2 и С соответственно.
Содержание углерода в биомассе Bracteacoccus minor принимали равным 48.5%, что соответствует среднему значению для различных зеленых микроводорослей [Harwati, Willke, Vorlop, 2018].
Содержания хлорофиллов -a, -b (Chl a, b) определяли по методу [Yang et al., 1998]. Экстракцию пигментов из микроводорослей проводили 80.0% ацетоном. Для этого 10 мг отделенных от среды центрифугированием (10 мин. при 3 000 об/мин-1, 530 g) клеток подвергали 3-кратному замораживанию- размораживанию с целью разрушения клеточных оболочек. После чего добавляли 4 мл ацетона с целью создания соотношения биоматериал-экстрагент 1:40 (масса: объем) и дополнительно гомогенизировали биомассу путем растирания с кварцевым песком. Полученную смесь герметично закрывали и оставляли на 24 часа при температуре 25°С в темном месте для полной экстракции пигментов. Далее ацетоновый экстракт отделяли от осадка центрифугированием при 10 000 об/мин-1 (6 000 g) и температуре 4°С на протяжении 10 мин. Анализировали интенсивность поглощения экстракта пигментов на спектрофотометре Ulab 102 (China) при длинах волн: 663.6; 646.6 нм, что соответствует максимуму поглощения для Chl a и Chl b. Расчеты проводили по следующей формуле:
.
Содержание суммы хлорофиллов выражали в мг г-1 СВ путем преобразования расчетных единиц µг мл-1 с учетом коэффициента разведения и навески сухой биомассы.
Все измерения проводились минимум в трех повторностях, на графиках и в таблицах приведены средние величины и ошибки средней которые высчитывали по ANOVA с применением встроенных функций программы Microsoft Excel (v. 1903). Достоверными считали различия при p≤0.05. Корреляционный анализ проводили с применением встроенной функции попарных корреляций Пирсона в программном обеспечении IBM SPSS Statistics v. 27. Достоверными считали корреляции при уровне значимости p≤0.10.
Результаты
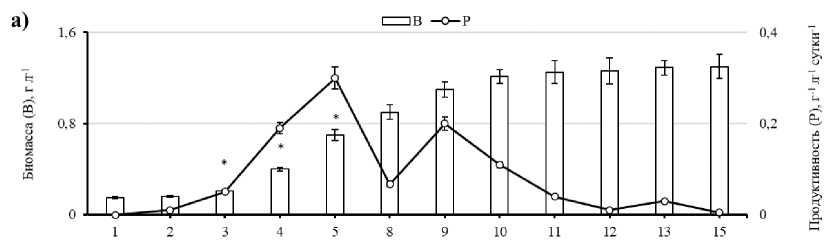
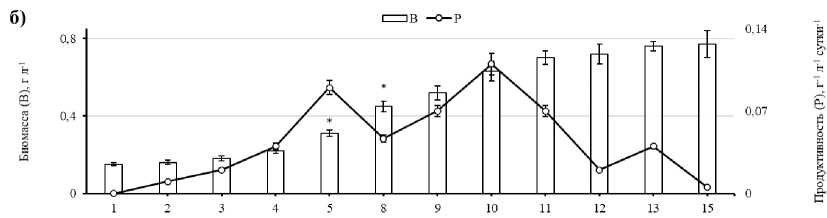
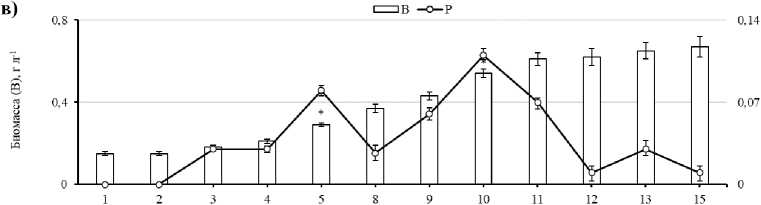
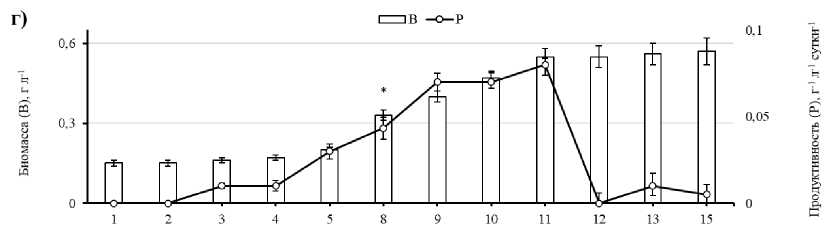
В ходе эксперимента плотность биомассы Bracteacoccus minor (MZ-Ch31) в контрольной группе (группа-2) на 15 сутки культивирования достигла 0.77 г СВ л-1, максимальный прирост биомассы наблюдался между 4–5 и 5–8 сутками (0.11 и 0.14 г СВ л-1) (рис. 1б). Более низкое содержание доступного азота в питательной среде (3 и 4 группа) сопровождалось уменьшением накопления биомассы штаммом и удлинением lag-фазы (рис. 1в, 1г). Наиболее сильно снижалась концентрация биомассы при минимальной концентрации азота в среде культивирования (группа-4) и составляла – 0.57 г СВ л-1, при этом lag-фаза была максимальной и длилась 8 суток (рис. 1г).
Время культивирования, суток
Время культивиров ания, суток
Время культивирования, суток
-.SMH^OhLKd) qlooHaHXMABOdu
Время культивиров ания, суток
Рис. 1. Скорость роста (B), продуктивность (P) и биофиксация CO 2 (F) Bracteacoccus minor (MZ-Ch31) при культивировании в различных вариантах эксперимента:
а) – 0.124; б) – 0.04; в) – 0.025; г) – 0.012 г л-1. * – разница достоверна относительно предыдущего значения на уровне p≤0.05
[Growth rate (B), productivity (P) and bio-fixation of CO 2 (F) Bracteacoccus minor (MZ-Ch31) during cultivation in various experimental variants:
-
а) – 0.124; б) – 0.04; в) – 0.025; г) – 0.012 g L-1. Note: * – the difference is significant relative to the previous value at the p≤0.05 level]
В группе-4 между 11–12 сутками культивирования прирост биомассы не был отмечен, а максимальный достоверный прирост (0.13 г СВ л-1; p≤0.05) установлен между 5 и 8 сутками. Стоит отметить, что по мере снижения концентрации азота достоверные приросты биомассы смещаются на более поздние сроки.
Ограничение доступности азота в среде лимитирует рост и деление клеток, приводит к удлинению lag-фазы, сокращению логарифмической фазы и выходу на стационарную стадию роста культуры раньше относительно контроля. При повышении концентрации азота до 0.124 г л-1 (группа-1), что в 3.1 раза больше относительно стандартной BBM, отмечено наибольшее накопление биомассы среди всех исследованных экспериментальных групп. Максимальный прирост биомассы был между 4–5 сутками и составлял 0.30 г СВ л-1 (p≤0.05). Также в группе-1 установлена максимальная в эксперименте плотность биомассы 1.30 г СВ л-1 и самая короткая lag-фаза – 3 суток. Следует отметить, что плотность биомассы имела прямую зависимость от содержания азота в среде культивирования, что подтверждено коэффициентом корреляции (r=1.0; p≤0.05).
.HHIX3ъeOu j - (巴 ^оо KHIIEJXHtHg
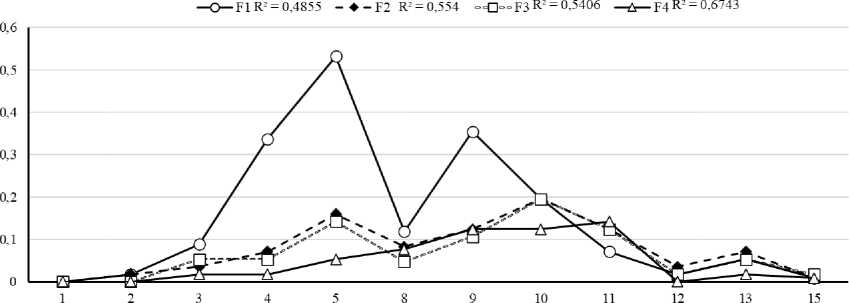
Время культивирования, суток
Рис. 2. Биофиксация CO 2 (F) Bracteacoccus minor (MZ-Ch31) при культивировании в различных вариантах эксперимента:
концентрация азота в среде: F1 – 0.124; F2 – 0.04; F3 – 0.025; F4 – 0.012 г л-1. R2 – величина достоверности аппроксимации (полиноминальная линия тренда)
[Bio-fixation of CO 2 (F) Bracteacoccus minor (MZ-Ch31) during cultivation in various experimental variants: Nitrogen concentration in medium: F1 – 0.124; F2 – 0.04; F3 – 0.025; F4 – 0.012 g L-1. Note: R2 – approximation accuracy (polynomial trend line)]
Максимальная среди исследованных групп продуктивность биомассы установлена для группы-1 с наибольшим содержанием азота в питательной среде. Она достигала максимального значения (0.3 г СВ л-1сутки-1) на 5 день культивирования с дальнейшим снижением до минимума в конце эксперимента. В стандартной среде BBM (группа-2) максимум продуктивности составлял 0.11 г СВ л-1 сутки-1, так же, как и в группе-3. В эксперименте с минимальным количеством азота в среде (группа-4) максимум продуктивности приходился на 10 сутки – 0.08 г СВ л-1 сутки-1.
Стоит отметить, что при культивировании штамма в экспериментальных группах 1 – 3 наблюдался рост продуктивности с двумя пиками, в группе-1 – на 5 и 9 сутки, в группе-2 – на 5 и 10 сутки. Далее происходило резкое снижение продуктивности, связанное, очевидно, с нарастающим истощением питательных компонентов в среде и замедлением роста и деления клеток. В группе-4 пик продуктивности приходится на 11 сутки с дальнейшим резким снижением.
Ежедневные показатели биофиксации CO 2 в контрольной группе (группа-2) снижались по мере старения культуры (рис. 2). Максимальная эффективность поглощения СО 2 штаммом в стандартной среде BBM (группа-2) наблюдалась на 10 сутки и составляла 0.2 г CO 2 л-1 сутки-1, а минимальная – на 2 и 15 сутки культивирования, что связано с низким приростом биомассы. В группе-1 максимум фиксации CO 2 составлял 0.53 г CO 2 л-1 на 5 сутки роста. Это самый высокий показатель в эксперименте (рис. 1а). В группе-4 максимальное поглощение было значительно ниже – всего 0.14 г CO 2 л-1 сутки-1 и отмечено на 11 сутки культивирования.
Средняя скорость биофиксации углекислого газа за весь период культивирования снижалась с уменьшением концентрации азота в питательной среде (r=1.0; p≤0.05) (табл. 1). В группе-4 она была наименьшей. Также минимальным в этой группе было и общее количество утилизированного за 14 суток эксперимента CO 2 . Относительно контрольной группы данные показатели были меньше в 1.6 раз. Повышение концентрации азота в питательной среде приводит к повышению как средней скорости биофиксации CO 2, так и общего количества поглощенного углекислого газа почти в 2 раза относительно стандартной среды BBM.
Таблица 1
Биомасса и биофиксация CO2 Bracteacoccus minor MZ-Ch31 в различных вариантах эксперимента (M±SD; n = 3)
[Biomass and bio-fixation of CO2 Bracteacoccus minor MZ-Ch31 in various experimental variants (M±SD; n = 3)]
|
Варианты эксперимента |
Биомасса на 14 сутки, г СВ л-1 |
Содержание хлорофиллов ( a, b ) на 14 сутки, мг г-1 СВ |
Средняя скорость биофиксации CO 2 за 14 суток, г CO 2 л-1 день-1 |
Утилизированный CO 2 за 14 суток, г л-1 |
Содержание азота в среде, мг л-1 |
|
Группа-1 |
1.3±0.03# |
2.34±0.24*# |
0.16 |
1.8±0.17# |
0.124 |
|
Группа-2 (BBM) |
0.77±0.17* |
1.72±0.18* |
0.08 |
0.93±0.06* |
0.040 |
|
Группа-3 |
0.67±0.07 |
1.13±0.12*# |
0.07 |
0.81±0.06 |
0.025 |
|
Группа-4 |
0.57±0.03# |
0.58±0.07*# |
0.05 |
0.58±0.05*# |
0.012 |
Примечание. * – разница достоверна относительно предыдущей группы на уровне p≤0.05; # – разница достоверна относительно группы-2 (BBM) на уровне p≤0.05.
Содержание хлорофиллов ( a, b ) определяли в конце эксперимента на 14 сутки. Стоит отметить, что снижение концентрации азота в среде привело к уменьшению содержания хлорофиллов (r=1.000; p≤0.01). Результаты корреляционного анализа показали (табл. 2), что содержание хлорофиллов может быть одним из показателей секвестрационных характеристик штамма, так как для Bracteacoccus minor MZ-Ch31 установлена прямая (достоверная) корреляционная зависимость между концентрацией хлорофилла, параметрами биофиксации и утилизированного CO 2 . Это обусловлено тем, что фотосинтез сопровождается поглощением углекислого газа и является основным метаболическим шлюзом, обеспечивающим накопление прекурсоров для биосинтеза первичных и вторичных метаболитов, необходимых для роста и деления клеток.
Обсуждение
Скорость поглощения CO 2 для Bracteacoccus minor (MZ-Ch31) хорошо коррелирует с ростом биомассы, поскольку более высокое поглощение CO 2 в фотоавтотрофных условиях приводит к высокой продуктивности биомассы. Такая же зависимость установлена для Chlorella sp. и, как предполагают авторы, заметное увеличение продуктивности биомассы может быть объяснено усиленной фотосинтетической активностью и функцией ключевых фотоавтотрофных ферментов [Butti, Venkata Mohan, 2018]. Скорость биофиксации углекислого газа у Bracteacoccus minor MZ-Ch31 имела прямую зависимость от концентрации хлорофиллов в клетке (r = 0.918; p≤0.10). Азотное голодание в качестве инструмента повышения биофиксации CO 2 неэффективно, поскольку приводит к снижению общего количества биомассы, а также количества хлорофиллов.
Таблица 2
Результаты корреляционного анализа [The results of the correlation analysis]
|
Показатели |
B |
Chl |
F |
CU |
N |
|
|
B |
Корреляция Пирсона |
1 |
0.918* |
0.999*** |
0.999*** |
1.000*** |
|
знач. (двухсторонняя) |
0.082 |
0.001 |
0.001 |
<0.001 |
||
|
Chl |
Корреляция Пирсона |
0.918* |
1 |
0.918* |
0.923* |
0.908* |
|
знач. (двухсторонняя) |
0.082 |
0.082 |
0.077 |
0.092 |
||
|
F |
Корреляция Пирсона |
0.999*** |
0.918* |
1 |
1.000*** |
0.998** |
|
знач. (двухсторонняя) |
0.001 |
0.082 |
<0.001 |
0.002 |
||
|
CU |
Корреляция Пирсона |
0.999*** |
0.923* |
1.000*** |
1 |
0.997** |
|
знач. (двухсторонняя) |
0.001 |
0.077 |
0 |
0.003 |
||
|
N |
Корреляция Пирсона |
1.000*** |
0.908* |
0.998** |
0.997** |
1 |
|
знач. (двухсторонняя) |
<0.001 |
0.092 |
0.002 |
0.003 |
||
Примечания: B – биомасса Bracteacoccus minor MZ-Ch31 на 14 сутки, г СВ л-1; Chl – содержание хлорофиллов (a, b) на 14 сутки, мг г-1 СВ; F – средняя скорость биофиксации CO2 за 14 суток, г CO2 л-1 день-1; CU – утилизированный CO2 за 14 суток, г л-1; N – содержание азота в питательной среде, мг л-1; n = 4. * – корреляция достоверна на уровне p≤0.10; ** – корреляция достоверна на уровне p≤0.05; *** – корреляция достоверна на уровне p≤0.01.
Максимальная описанная на данный момент способность поглощать углекислый газ установлена для Chlorella vulgaris – от 3.45 г CO 2 л-1 день-1 до 6.24 г CO 2 л-1 день-1, Aphanothece microscopica Nageli – 5.44
г CO 2 л-1 день-1 [Fan et al., 2008; Ho et al., 2011]. Также высокие значения отмечены для Nannochloropsis gaditana – 1.7 г CO 2 л-1 день-1 [Adamczyk, Lasek, Skawińska, 2016], Synechocystis aquatilis SI-2 – 1.5 г CO 2 л-1 день-1 [Murakami, Ikenouchi, 1997]. В среднем биофиксация CO 2 для представителей микроводорослей различных филогенетических и экологических групп варьирует от 0.02 до 6.24 г CO 2 л-1 день-1 [Ho et al., 2011]. Большая вариативность данных может быть следствием как индивидуальных особенностей видов водорослей, так и условий культивирования, включая исходную концентрацию биомассы водорослей. Для Bracteacoccus minor (MZ-Ch31) в условиях нашего эксперимента наибольшее поглощение углекислого газа было 0.53 г CO 2 л-1 день-1, среднее – 0.16 г CO 2 л-1 день-1. Дальнейшие исследования позволят получить более полные характеристики биофиксации CO 2 штаммом.
Заключение
Скорость биофиксации и общее количество поглощенного CO 2 Bracteacoccus minor (MZ-Ch31) зависит от концентрации азота в питательной среде. Повышение доступности азота увеличивает среднюю скорость поглощения углекислого газа с 0.05 г CO 2 л-1 сутки-1 до 0.16 г CO 2 л-1 сутки-1. Максимум поглощения углекислого газа соответствовал 0.53 г CO 2 л-1 сутки-1 и был достигнут в момент выхода культуры с lag-фазы. Скорость биофиксации и количество поглощенного углекислого газа Bracteacoccus minor (MZ-Ch31) прямо зависит от концентрации биомассы (r= 0.999 и r= 0.999; p≤0.01) и хлорофиллов (r= 0.918 и 0.923; p≤0.10).
Список литературы Динамика эффективности фиксации CO 2 штаммом Bracteacoccus minor при различной доступности азота
- Adamczyk M., Lasek J., Skawinska A. CO2 biofixation and growth kinetics of Chlorella vulgaris and Nannochloropsis gaditana // Applied Biochemistry and Biotechnology. 2016. Vol. 179, № 7. P. 1248-1261.
- Barkia I., Saari N., Manning S.R. Microalgae for high-value products towards human health and nutrition // Marine drugs. 2019. Vol. 17, № 5. Art. 304.
- Butti S.K., Venkata Mohan S. Photosynthetic and lipogenic response under elevated CO2 and H2 conditions - high carbon uptake and fatty acids unsaturation // Frontiers in Energy Research. 2018. Vol. 6. Art. 27.
- Cheah W.Y. et al. Biosequestration of atmospheric CO2 and flue gas-containing CO2 by microalgae // Bio-resource technology. 2015. Vol. 184. P. 190-201.
- Chen X. et al. Nitrogen starvation enhances the production of saturated and unsaturated fatty acids in Aurantio-chytrium sp. PKU#SW8 by regulating key biosynthetic genes // Marine drugs. 2022. Vol. 20, № 10. Art. 621.
- Chekanov K. et al. Differential responses to UV-A stress recorded in carotenogenic microalgae Haemato-coccus rubicundus, Bracteacoccus aggregatus, and Deasonia sp. // Plants. 2022. Vol. 11, № 11. Art. 1431.
- Cherepovitsyna A.A., Dorozhkina I.P., Kostyleva V.N. Sequestration and use of carbon dioxide: the essence of technology and approaches to the classification of the projects // Russian Journal of Industrial Economics. 2023. Vol. 15, № 4. P. 473-487.
- Coulombier N., Jauffrais T., Lebouvier N. Antioxidant compounds from microalgae: a review // Marine drugs. 2021. Vol. 19, № 10. Art. 549.
- Dolganyuk V. et al. Microalgae: A promising source of valuable bioproducts // Biomolecules. 2020. Vol. 10, № 8. Art. 1153.
- Fan L.-H. et al. Evaluation of a membrane-sparged helical tubular photobioreactor for carbon dioxide biofixation by Chlorella vulgaris // Journal of Membrane Science. 2008. Vol. 325, № 1. P. 336-345.
- Farooq W. Maximizing energy content and CO2 bio-fixation efficiency of an indigenous isolated micro-alga Parachlorella kessleri HY-6 through nutrient optimization and water recycling during cultivation // Front. Bioeng. Biotechnol. 2022. Vol. 10, № 9. Art. 804608.
- Harwati T.U., Willke T., Vorlop K.D. Characterization of the lipid accumulation in a tropical freshwater microalgae Chlorococcum sp. // Bioresource Technology. 2018. Vol. 121. P. 54-60.
- Ho S.-H. et al. Perspectives on microalgal CO2-emission mitigation systems - A review // Biotechnology Advances. 2011. Vol. 29, № 2. P. 189-198.
- Janssen J.H., Wijffels R.H., Barbosa M.J. Lipid production in Nannochloropsis gaditana during nitrogen starvation // Biology. 2019. Vol. 8, № 1. Art. 5.
- Li S. et al. Production of sustainable biofuels from microalgae with CO2 bio-sequestration and life cycle assessment // Environmental research. 2023. Vol. 227. Art.115730.
- Lukavsky J. et al. The alga Bracteacoccus bullatus (Chlorophyceae) isolated from snow, as a source of oil comprising essential unsaturated fatty acids and carotenoids // Journal of Applied Phycology. 2022. In Review. preprint. DOI: 10.21203/rs.3.rs-2125780/v1.
- Ma Z. et al. Microalgae-based biotechnological sequestration of carbon dioxide for net zero emissions // Trends in biotechnology. 2022. Vol. 40, № 12. P. 1439-1453.
- Malik S. et al. Characterization of a newly isolated self-flocculating microalga Bracteacoccus pseudomi-nor BERC09 and its evaluation as a candidate for a multiproduct algal biorefinery // Chemosphere. 2022. Vol. 304. Art. 135346.
- Maltsev Y.I. et al. Biotechnological potential of a new strain of Bracteacoccus bullatus (Sphaeropleales, Chlorophyta) as a promising producer of omega-6 polyunsaturated fatty acids // Russian Journal of Plant Physiology. 2020. Vol. 67. P. 185-193.
- Mamaeva A. et al. Simultaneous increase in cellular content and volumetric concentration of lipids in Bracteacoccus bullatus cultivated at reduced nitrogen and phosphorus concentrations // Journal of Applied Phy-cology. 2018. Vol. 30. P. 2237-2246.
- Minyuk G.S., Chelebieva E.S., Chubchikova I.N. Secondary carotenogenesis of the green microalga Bracteacoccus minor (Chodat) Petrova (Chlorophyta) in a two-stage culture // International Journal on Algae. 2014. Vol. 16, № 4. P. 354-368.
- Morais M.G., Costa J.A.V. Carbon dioxide mitigation with Chlorella kessleri, Chlorella vulgaris, Scenedesmus obliquus and Spirulina sp. cultivated in flasks and vertical tubular photobioreactors // Biotechnol. Lett. 2007. Vol. 29. P. 1349-1352.
- Mudimu O. et al. Screening of microalgae and cyanobacteria strains for a-tocopherol content at different growth phases and the influence of nitrate reduction on a-tocopherol production // Journal of Applied Phycology. 2017. Vol. 29. P. 2867-2875.
- Murakami M., Ikenouchi M. The biological CO2 fixation and utilization project by rite (2) - screening and breeding of microalgae with high capability in fixing CO2 - // Energy Conversion and Management. 1997. Vol. 38. P. 493-497.
- Ramos-Romero S. et al. Edible microalgae and their bioactive compounds in the prevention and treatment of metabolic alterations // Nutrients. 2021. Vol. 13, № 2. Art. 563.
- Ratha S.K. et al. Exploring nutritional modes of cultivation for enhancing lipid accumulation in microalgae: Exploring nutritional modes of cultivation // Journal of Basic Microbiology. 2013. Vol. 53, № 5. P. 440450.
- Rios L.F. et al. Nitrogen starvation for lipid accumulation in the microalga species Desmodesmus sp. // Applied biochemistry and biotechnology. 2015. Vol. 175, № 1. P. 469-476.
- Sangeetha M. et al. Biosequestration of carbon dioxide using carbonic anhydrase from novel Streptomy-ces kunmingensis // Archives of microbiology. 2022. Vol. 204, № 5. Art. 270.
- §irin P. A., Serdar S. Effects of nitrogen starvation on growth and biochemical composition of some microalgae species // Folia microbiologica. 2024. Vol. 69, № 4. Р. 889-902.
- Venkata Mohan S. et al. A circular bioeconomy with biobased products from CO2 sequestration // Trends in biotechnology. 2016. Vol. 34, № 6. P. 506-519.
- White W.A. Biosequestration and ecological diversity. Boca Raton: CRC Press, 2012. 250 p.
- Yang C.-M. et al. Methods for the determination of the chlorophylls and their derivatives // Taiwania. 1998. Vol. 43, № 2. P. 116-122.
- Zhang W.W. et al. Enhancing astaxanthin accumulation in Haematococcus pluvialis by coupled light intensity and nitrogen starvation in column photobioreactors // Journal of microbiology and biotechnology. 2018. Vol. 28, № 12. P. 2019-2028.
- Zhao Y. et al. Screening and application of Chlorella strains on biosequestration of the power plant exhaust gas evolutions of biomass growth and accumulation of toxic agents // Environmental science and pollution research international. 2022. Vol. 29, № 5. P. 6744-6754.
- Zhu X. et al. An informatics-based analysis of developments to date and prospects for the application of microalgae in the biological sequestration of industrial flue gas // Applied microbiology and biotechnology. 2016. Vol. 100, № 5. P. 2073-2082.


