Динамика накопления микотоксинов в силосе на разных этапах хранения
Автор: Лаптев Г.Ю., Новикова Н.И., Ильина Л.А., Йылдырым Е.А., Солдатова В.В., Никонов И.Н., Филиппова В.А., Бражник Е.А., Соколова О.Н.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Корма: проблема санитарного качества
Статья в выпуске: 6 т.49, 2014 года.
Бесплатный доступ
Присутствие в сырье микотоксинов - продуктов жизнедеятельности плесневых грибов представляет серьезную проблему во всем мире. Вследствие неправильной заготовки силоса происходит его загрязнение микотоксинами. На сегодняшний день практически отсутствуют сведения по их накоплению в сочных кормах в процессе силосования, а также остается невыясненным вопрос о способах, позволяющих предотвратить или снизить контаминацию кормов микотоксинами. Нами впервые в России изучена динамика накопления микотоксинов в силосе на разных этапах хранения. С этой целью в лабораторном эксперименте мы определили содержание микотоксинов (афлатоксинов, охратоксина А, Т-2 токсина, зеараленона и дезоксиниваленола) в исходном кормовом растительном сырье, оценили динамику этих показателей на разных этапах силосования ежи сборной Dactylis glomerata L., а также исследовали влияние биологических заквасок для силосования кормов биотроф и биотроф-111 (ООО «Биотроф+», г. Санкт-Петербург) и химических консервантов AIV 3 Plus или AIV 2000 Plus («KEMIRA OYJ», Финляндия) на снижение количества токсичных грибных метаболитов. Анализ микотоксинов в образцах проводили с использованием иммуноферментного метода (AgraQuant TM, «Romer Labs, Inc.», Австрия). Установлено, что «полевые» грибы начинают продуцировать микотоксины еще в период вегетации растений, и этот процесс активно продолжается в течение всего срока хранения силоса. Использование биологических заквасок позволило сдерживать накопление микотоксинов по сравнению с контролем без добавок. В конце срока хранения силоса в вариантах с применением заквасок биотроф и биотроф-111 количество афлатоксинов было ниже контроля соответственно на 17,7 и 9,1 %, охратоксина А - на 21,4 и 34,9 %, Т-2 токсина - на 20,1 и 32,8 %, зеараленона - на 17,7 и 10,4 % и дезоксиниваленола - на 0,8 и 55,8 %. Поскольку в России в настоящее время ПДК микотоксинов для силоса не установлены, для сравнения мы использовали величину нормированных ПДК микотоксинов для фуражного зерна овса, пшеницы и ячменя как злаковых культур, по таксономической принадлежности близких к многолетним травам, к которым относится ежа сборная. В отличие от овса, пшеницы и ячменя кукуруза, будучи злаковым растением, в Северо-Западном регионе России традиционной кормовой культурой не считается. Наибольшим эффектом сдерживания накопления микотоксинов обладала закваска на основе бацилл Bacillus subtilis. Использование химического консерванта приводило к некоторому снижению содержания отдельных микотоксинов по сравнению с контролем, однако токсичность силоса, за которую мы принимали суммарное превышение полученных показателей над референтными значениями по всем проанализированным микотоксинам относительно такового в варианте с применением химического консерванта была высокой и значительно превышала контроль во второй половине срока хранения. Известно, что в результате резкого изменения условий окружающей среды продукция микотоксинов у микроскопических грибов усиливается. В нашем эксперименте воздействие химического консерванта могло послужить стрессовым фактором, спровоцировавшим активный синтез микотоксинов.
Микотоксины, силос, биологическая закваска для силосования, химический консервант для силосования
Короткий адрес: https://sciup.org/142133549
IDR: 142133549 | УДК: 636.085:619:579.64 | DOI: 10.15389/agrobiology.2014.6.123rus
Текст научной статьи Динамика накопления микотоксинов в силосе на разных этапах хранения
Силос — один из основных компонентов рациона крупного рогатого скота. В результате использования некачественного силоса животные испытывают дефицит питательных веществ, что непременно сказывается на их продуктивности, здоровье и сдерживает увеличение рентабельности производства. Проблемы, связанные с неполноценным кормлением, сопряжены в первую очередь с несоблюдением технологий выращивания и хранения кормового растительного сырья. Как известно, вследствие неправильной заготовки силоса, помимо ухудшения биохимических показа-
Исследование выполнено при поддержке гранта Российского научного фонда по научному проекту «Выявление биоразнообразия и трофического статуса микробиоты кормовых культур в связи с созданием качественных и биологически безопасных кормов» № 14-16-00114.
телей его качества, происходит загрязнение микотоксинами — продуктами жизнедеятельности плесневых грибов (1).
Снижение содержания микотоксинов в сырье составляет серьезную проблему, решение которой ищут специалисты во всем мире, поскольку поступление микотоксинов в организм с кормами вызывает микотоксикозы — заболевания, при которых снижается продуктивность, ухудшаются репродуктивные качества и иммунный статус животных (2). В малых дозах микотоксины приводят к уменьшению продуктивности и прироста живой массы, создают благоприятные условия для развития многих инфекционных заболеваний. Отдаленные последствия действия микотоксинов проявляются в виде иммунодепрессивных, канцерогенных, мутагенных, аллергенных, нейротоксичных и тератогенных эффектов, а также в подавлении воспроизводительной функции. К тому же в зараженных кормах микотоксины, как правило, находятся в сочетании, взаимно усиливая негативное воздействие (3).
Традиционно считается, что проблема микотоксикозов и зараженности кормов микотоксинами для крупного рогатого скота менее актуальна, чем для птицы и свиней. Однако было установлено, что некоторые микотоксины обладают ярко выраженными антимикробными свойствами, вызывая снижение численности полезных микроорганизмов, в том числе целлюлозолитиков, бацилл, лактатутилизирующих бактерий. Нарушения в составе микробиоценоза могут негативно влиять как на процессы пищеварения и усвояемость питательных веществ, так и на эффективность защитных функций полезной микрофлоры в желудочно-кишечном тракте. Стоит отметить, что наибольшая восприимчивость к негативному воздействию микотоксинов проявляется у высокопродуктивных коров, поскольку рост продуктивности всегда сопровождается повышенной чувствительностью к стрессам. Помимо этого, микотоксины, поступающие в организм крупного рогатого скота с кормами, могут проникать в молоко, представляя опасность для здоровья человека. Так, остатки афлатоксина M i (метаболит афлатоксина В 1 ) в молоке составляют 0,3-6,0 % от потребленного афлатоксина В 1 (1).
В настоящее время практически отсутствуют сведения по накоплению микотоксинов в сочных кормах в процессе силосования, а также остается невыясненным вопрос о способах решения этой проблемы.
В задачу наших исследований входил анализ содержания микотоксинов на различных этапах силосования, а также исследование влияния биологических заквасок и химического препарата для консервирования кормов на снижение количества токсичных грибных метаболитов.
Методика . В модельном лабораторном эксперименте по консервированию использовали ежу сборную Dactylis glomerata L. первого укоса, убранную с поля в фазу выхода в трубку при влажности 65 %. При силосовании использовали штаммы бактерий, входящие в состав коммерческих заквасок биотроф и биотроф-111 (ООО «Биотроф + », г. Санкт-Петербург), а также препарат AIV 3 Plus («KEMIRA OYJ», Финляндия). Препарат био-троф-111 вносили в количестве 0,007 мл/кг зеленой массы (1 л на 150 т), AIV 2000 Plus — в количестве 4 мл/кг (4 л/т) зеленой массы. Зеленую массу (320 г) в вакуумных полиэтиленовых пакетах помещали в термостатную комнату при температуре 26±1 ° С. Образцы для анализа микотоксинов отбирали до силосования, а также на 3-и, 7-е, 14-е и 30-е сут хранения.
Количество микотоксинов (афлатоксинов, охратоксина А, Т-2 токсина, зеараленона, дезоксиниваленола) в образцах исходного кормового растительного сырья определяли с применением иммуноферментного ана- лиза (ИФА) (4), используя тест-систему AgraQuantTM («Romer Labs, Inc.», Австрия) согласно рекомендациям производителя. Микотоксины, за исключением дезоксиниваленола, экстрагировали из проб 70 % метанолом, дезоксиниваленол — дистиллированной водой. Стандартами служили растворы пяти анализируемых микотоксинов известной концентрации. В качестве остановочного раствора при анализе на наличие зеараленона и Т-2 токсина служила 10 % соляная кислота, афлатоксина, охратоксина А и де-зоксиниваленона — 10 % фосфорная кислота. Оптическую плотность (OD) измеряли при X = 450 нм на микростриповом фотометре Stat Fax 303+ («Awareness Technology, Inc.», США), сопоставляя показатели для образца и для стандартов. Поскольку в России в настоящее время ПДК микотоксинов для силоса не установлены, для сравнения использовали предельнодопустимые концентрации микотоксинов для фуражного зерна овса, пшеницы и ячменя как злаковых культур, по таксономической принадлежности близких к многолетним травам, к которым относится ежа сборная, исходя из значений, приведенных в Единых ветеринарных (ветеринарносанитарных) требованиях, предъявляемых к товарам, подлежащим ветеринарному контролю (надзору) (утверждены Решением Комиссии таможенного союза ЕврАзЭС от 18 июня 2010 года № 137): для афлатоксинов — 0,004 мг/кг, охратоксина А — 0,005 мг/кг, Т-2 токсина — 0,06 мг/кг, зеараленона — 0,1 мг/кг, дезоксиниваленола — 1,0 мг/кг (5).
Математическую и статистическую обработку результатов проводили стандартными методами дисперсионного анализа (6) с использованием программного обеспечения Microsoft Excel 2010.
Результаты . Биотроф — закваска, которая представляет собой размноженную чистую культуру полезных бактерий, идентифицированных с помощью анализа первичной последовательности фрагмента 16S-рибосом-ной РНК как Lactobacillus plantarum (7). Биопрепарат предназначен для консервирования различных культур, в том числе подвяленных растений с низкой влажностью. Применение этой закваски обеспечивает быстрое подкисление консервируемой растительной массы за счет накопления молочной кислоты и подавление нежелательных микробиологических процессов (8). Биотроф-111 — закваска на основе размноженной чистой культуры бактерий, идентифицированных по первичной последовательности фрагмента р16S РНК как Bacillus subtilis . Биопрепарат рекомендован для консервирования любых культур, в том числе трудносилосуемых (бобовозлаковые смеси, козлятник восточный, клевер, люцерна и др.). При применении закваски биотроф-111 за счет высокой антагонистической активности бактерий в консервируемой массе ингибируется развитие гнилостной микрофлоры, плесневых грибов — продуцентов микотоксинов, дрожжей, что обеспечивает быстрое консервирование и созревание силоса (9). В состав химического консерванта AIV 2000 Plus входит смесь органических кислот (муравьиной, пропионовой, бензойной).
В кормовом растительном сырье, предназначенном для закладки на хранение, были обнаружены афлатоксины (0,0053±0,00025 мг/кг), зеарале-нон (0,0115±0,00048 мг/кг) и дезоксиниваленол (1,3±0,0062 мг/кг) (табл.). При этом количество афлатоксинов и дезоксиниваленола превышало значения предельно-допустимой концентрации для кормов растительного происхождения, принятые нами за референтные, в 1,3 раза. Следовательно, загрязнение микотоксинами кормовых культур происходит еще в период роста растений в результате развития фитопатогенных грибов. При этом содержание охратоксина А и Т-2 токсина было ниже предела достоверного определения методом ИФА.
Содержание микотоксинов (мг/кг сухого вещества) в силосе из ежи сборной Dactylis glomerata L. при применении биопрепаратов и консерванта ( M±m, лабораторный опыт)
|
Время си- |
Контроль (K), мг/кг |
Биопрепарат |
Химический |
|||
|
лосования, |
на основе лактобактерий |
на основе бацилл |
консервант |
|||
|
сут |
мг/кг |
|к К, % |
мг/кг |
|к К, % |
мг/кг к К, % |
|
Афлатоксины (ПДК = 0,004 мг/кг)
|
0 |
0,0053±0,00025 |
0,0053±0,00025 |
0,0053±0,00025 |
0,0053±0,00025 |
||
|
3 |
0,0101±0,00040 |
0,0088±0,00040 |
87,1 0,0057±0,00026 |
56,4 |
0,0110±0,00040 |
108,9 |
|
7 |
0,0113±0,00047 |
0,0086±0,00042 |
76,1 0,0092±0,00043 |
81,4 |
0,0152±0,00065 |
134,5 |
|
14 |
0,0213±0,00800 |
0,0184±0,00070 |
86,4 0,0198±0,00080 |
93,0 |
0,0270±0,00094 |
126,8 |
|
30 |
0,0209±0,00100 |
0,0172±0,00060 |
82,3 0,0190±0,00047 |
90,9 |
0,0144±0,00071 |
68,9 |
|
0 3 |
< п.д.о. 0,0068±0,00023 |
Охратоксин А (ПДК = 0,005 мг/кг) < п.д.о. < п.д.о. 0,0053±0,00020 77,9 0,0060±0,00025 |
88,2 |
< п.д.о. 0,0089±0,00040 |
130,8 |
|
|
7 14 |
< п.д.о. 0,0127±0,00059 |
< п.д.о. 0,0059±0,00023 |
0,0003±0,00001 46,5 0,0031±0,00015 |
24,4 |
0,0009±0,00003 0,0739±0,00310 |
581,9 |
|
30 |
0,0295±0,00140 |
0,0232±0,00090 |
78,6 0,0192±0,00058 |
65,1 |
0,2720±0,01200 |
922,0 |
|
0 3 |
< п.д.о. 0,0937±0,02300 |
Т-2 т о к с < п.д.о. 0,0930±0,00410 |
и н (ПДК = 0,06 мг/кг) < п.д.о. 99,3 0,1025±0,00370 |
109,4 |
< п.д.о. 0,1089±0,00410 |
116,2 |
|
7 |
0,0391±0,01600 |
0,0396±0,00170 |
101,3 0,0140±0,00048 |
35,8 |
0,0336±0,00160 |
85,9 |
|
14 |
0,1221±0,00370 |
0,1118±0,00520 |
91,6 0,0965±0,00220 |
79,0 |
0,0834±0,00420 |
68,3 |
|
30 |
0,1116±0,00510 |
0,0892±0,00320 |
79,9 0,0750±0,00350 |
67,2 |
0,1191±0,00480 |
106,7 |
|
0 3 |
0,0115±0,00048 0,0213±0,00100 |
3 е а р а л е 0,0115±0,00048 0,0144±0,00036 |
нон (ПДК = 0,1 мг/кг) 0,0115±0,00048 67,6 0,0168±0,00065 |
78,9 |
0,0115±0,00048 0,0142±0,00061 |
66,7 |
|
7 |
0,0475±0,00170 |
0,0893±0,00410 |
188,0 0,0909±0,00380 |
191,4 |
0,1167±0,00350 |
245,7 |
|
14 |
0,1514±0,00360 |
0,1407±0,00670 |
92,9 0,1345±0,00630 |
88,8 |
0,0977±0,00320 |
64,5 |
|
30 |
0,1290±0,00610 |
0,1062±0,00051 |
82,3 0,1156±0,00460 |
89,6 |
0,0790±0,00290 |
61,2 |
|
0 3 |
1,3000±0,00620 0,6800±0,02800 |
Дезоксинив 1,3000±0,00620 0,4200±0,01800 |
а л е н о л (ПДК =1,0 мг/кг) 1,3000±0,00620 61,8 0,6900±0,03450 101,5 |
1,3000±0,00620 0,8100±0,02400 |
119,1 |
|
|
7 |
5,1200±0,22000 |
4,6600±0,20000 |
91,0 3,8100±0,12000 |
74,4 |
4,1200±0,19000 |
80,5 |
|
14 |
1,4000±0,04100 |
3,1900±0,12000 |
227,9 0,9900±0,03900 |
70,7 |
4,1700±0,20000 |
297,9 |
|
30 |
1,2900±0,05200 |
1,2800±0,03500 |
99,2 0,5700±0,02600 |
44,2 |
1,5000±0,06500 |
116,3 |
Примечание. < п.д.о. — ниже предела достоверного определения методом ИФА. Химический консервант AIV 3 Plus («KEMIRA OYJ», Финляндия).
При исследовании силоса из ежи сборной первого укоса на 3-и, 7-е, 14-е и 30-е сут хранения было обнаружено значительное накопление афлатоксинов, охратоксина А, Т-2 токсина, зеараленона и дезоксинивале-нола (см. табл.).
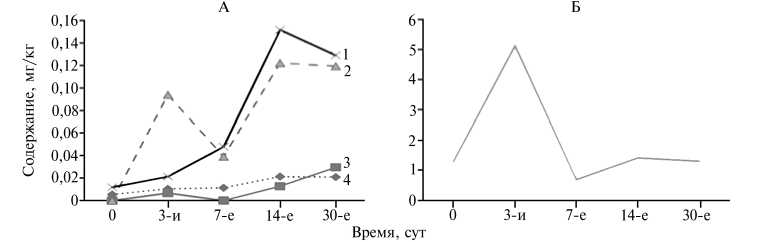
Динамика накопления зеараленона (1) , Т-2 токсина (2), охратоксина А (3), афлатоксинов (4) (А) и дезоксиниваленола (Б) в процессе силосования ежи сборной Dactylis glomerata L. без добавок биопрепаратов и химического консерванта (лабораторный опыт).
Представленные графики (рис., А) наглядно иллюстрируют, что в процессе силосования ежи сборной наблюдалось резкое возрастание содержания зеараленона и Т-2 токсина, незначительное увеличение показателя по афлатоксинам и охратоксину А (по сравнению с исходным растительным сырьем). При этом количество указанных микотоксинов (кроме охратоксина А) уменьшалось во второй половине срока хранения. Содер-126
жание дезоксиниваленола на 3-и сут резко возрастало (см. рис., Б), а на 7-е сут стремительно падало.
Отметим, что продуцентами зеараленона, Т-2-токсина и дезоксиниваленола служат грибы рода Fusarium , которые начинают вырабатывать микотоксины в течение вегетации растений, и образование микотоксинов может продолжаться в период хранения кормов (10). Известно, что в результате резкого изменения условий окружающей среды (температура, влажность, воздействие химических веществ) продукция микотоксинов усиливается (11-15). В нашем эксперименте воздействие условий окружающей среды в процессе силосования могло, возможно, послужить стрессовым фактором, спровоцировавшим активный синтез зеараленона и Т-2 токсина микроскопическими грибами вплоть до 14-х сут хранения силоса . После 14-х сут, вероятно, произошла остановка развития и гибель грибов с последующим микробиологическим разложением токсичных продуктов их метаболизма. Грибы — продуценты дезоксиниваленола, вероятно, в силосе практически не развиваются. После 3-х сут хранения дезоксиниваленол, скорее всего, подвергался деструкции под воздействием микроорганизмов.
Продуцентами афлатоксина и охратоксина А служат грибы родов Aspergillus и Penicillium , для развития которых условия силосования благоприятны (10). Вследствие этого указанные микроорганизмы не испытывали необходимости в инициации механизмов защиты (продуцирование значительного количества микотоксинов), поэтому скорость накопления афлатоксина и охратоксина А в течение нашего эксперимента была невелика.
Величина, соответствующая ПДК и принятая нами за референтную, по афлатоксинам оказалась превышена в 1,4-6,8 раза, по охратоксину А — в 1,2-54,4 раза, Т-2 токсину — в 1,4-1,8 раза, зеараленону — в 1,2-1,5 раза, дезоксиниваленолу — в 1,3-5,1 раза (см. табл.). В связи с этим консервирующие препараты, используемые для силосования, должны не только обеспечивать получение качественного корма, сбалансированного по содержанию белка, энергетической питательности, биологической ценности, но и обладать мощной антифунгальной активностью, сдерживая накопление микотоксинов, продуцируемых грибами. Известно, что потенциальной способностью к подавлению развития микроскопических грибов, а также к деструкции токсичных продуктов их метаболизма обладают некоторые штаммы молочнокислых бактерий и бацилл (16).
Действительно, применение биологических заквасок на основе молочнокислых бактерий (биотроф) и бацилл (биотроф-111) позволило уменьшить содержание афлатоксинов соответственно на 12,9-23,9 и 7,043,6 % в течение всего периода силосования по сравнению с контролем. В конце срока хранения силоса количество афлатоксинов в вариантах с применением этих заквасок было соответственно на 17,7 и 9,1 % ниже по сравнению с контрольным вариантом. В варианте с применением химического консерванта на 3-и, 7-е и 14-е сут хранения количество афлатоксинов было на 8,9, 34,5 и 26,8 % выше контрольного, а на 30-е сут хранения оно снизилось на 31,1 % по сравнению с контролем.
Использование заквасок на основе молочнокислых бактерий и бацилл приводило к значительному снижению содержания охратоксина А на протяжении всего периода силосования по сравнению с контролем. Исключение составляют 7-е сут, когда этот токсин был обнаружен в варианте с применением биопрепарата биотроф-111 (0,0003±0,000007 мг/кг), тогда как в контроле содержание охратоксина А было ниже предела достоверного определения методом ИФА. В конце срока хранения силоса количество охратоксина А в вариантах с применением заквасок биотроф и биотроф-111 оказалось соответственно на 21,4 и 34,9 % ниже, чем в контроле. При использовании химического консерванта на протяжении всего периода силосования содержание охратоксина А было значительно выше контрольного. В конце опыта количество охратоксина А на 822 % превысило соответствующий показатель в контроле.
Применение закваски биотроф-111 (на основе бацилл) и химического консерванта на 3-и сут хранения приводило к некоторому увеличению содержания Т-2 токсина относительно контроля. Начиная с 7-х сут вплоть до конца срока хранения, происходило значительное снижение количества названного токсина (за исключением 30-х сут в варианте с использованием химического консерванта, когда содержание Т-2 токсина было выше контроля на 6,7 %). При использовании препарата биотроф на основе молочнокислых бактерий с середины срока и вплоть до окончания опыта этот показатель уменьшался.
В присутствии заквасок биотроф, биотроф-111 и химического консерванта на протяжении всего силосования также значительно снижалось количество зеараленона. Исключение составили 7-е сут, когда содержание этого токсина во всех опытных вариантах было выше, чем в контроле.
Закваски на основе бацилл снижали содержание дезоксиниваленола на 25,6-55,8 % с 7-х по 30-е сут хранения силоса. Использование закваски на основе молочнокислых бактерий приводило к уменьшению количества дезоксиниваленола на 3-и и 7-е сут. В конце срока хранения содержание дезоксиниваленола в варианте с применением биотрофа практически не отличалось от контроля. В то же время при применении химического консерванта количество дезоксиниваленола на 3-и, 14-е и 30-е сут значительно (на 16,3-197,9 %) возрастало.
Известно, что токсичные метаболиты грибов в кормах действуют как синергисты, дополняя и усиливая токсические эффекты друг друга (17-20). Поскольку в исследованном нами силосе из ежи сборной микотоксины присутствовали в сочетании, то для уточнения и сравнения характера воздействия изученных препаратов мы условно определили токсичность силоса как сумму превышений по афлатоксинам, охратоксину А, Т-2 токсину, зеараленону и дезоксиниваленолу относительно значений, принятых в этой работе в качестве референтных.
В течение всего силосования такая суммарная токсичность образцов в вариантах с использованием биопрепаратов биотроф (на основе лактобактерий) и биотроф-111 (на основе бацилл) была ниже, чем в контроле. Наименьшую суммарную токсичность силоса отмечали в варианте с закваской биотроф-111. При этом соответствующий показатель в случае химического консерванта оказался наибольшим, значительно превысив во второй половине периода хранения контрольные значения. Как отмечалось выше, в результате резкого изменения условий окружающей среды (температуры, влажности, воздействия химических веществ) продукция микотоксинов у микроскопических грибов усиливается (21, 22). В связи с этим в нашем эксперименте воздействие химического консерванта могло послужить стрессовым фактором, спровоцировавшим активный синтез микотоксинов.
Таким образом, впервые в России изучена динамика накопления микотоксинов в силосе на разных этапах хранения. Нами показано, что еще в течение вегетации растений полевые изоляты грибов начинают вырабатывать микотоксины, и этот процесс активно продолжается в период хранения силоса. Применение заквасок на основе молочнокислых бакте-128
рий Lactobacillus plantarum (биотроф) и бацилл Bacillus subtilis (биотроф-111) позволило сдержать накопление микотоксинов по сравнению с контролем (без добавок). Наибольшим эффектом обладала закваска на основе Bacillus subtilis (биотроф-111). Использование химического консерванта приводило к частичному снижению содержания некоторых микотоксинов по сравнению с контролем, однако суммарная токсичность силоса была высокой и во второй половине срока хранения оказалась значительно выше контрольных показателей. Известно, что в результате резкого изменения условий окружающей среды продукция микотоксинов у микроскопических грибов усиливается. В нашем эксперименте воздействие химического консерванта могло послужить стрессовым фактором, спровоцировавшим активный синтез микотоксинов. Следовательно, очень актуальным представляется создание биопрепарата на основе бацилл, необходимого для уничтожения микроскопических грибов и разложения микотоксинов в силосе, поскольку применение химических консервантов не обеспечивает решения этой проблемы.
ООО «Биотроф+», Поступила в редакцию
196602 Россия, г. Санкт-Петербург—Пушкин, 8 се^тября 2014 года
DYNAMICS OF MYCOTOXIN ACCUMULATION IN SILAGE DURING
STORAGE
G.Yu. Laptev, N.I. Novikova, L.A. Il’ina, E.A. Yyldyrym, V.V. Soldatova,
I.N. Nikonov, V.A. Filippova, E.A. Brazhnik, O.N. Sokolova


