Динамика накопления молочной и уксусной кислот в процессе направленной ферментации белокочанной капусты сорта Парус
Автор: Кондратенко Владимир Владимирович, Посокина Наталья Евгеньевна
Журнал: Овощи России @vegetables
Рубрика: Агрохимия
Статья в выпуске: 5 (55), 2020 года.
Бесплатный доступ
Актуальность и методика. На сегодняшний день капуста белокочанная является самым популярным видом растительного сырья, используемого для ферментации не только в России, но и в других странах. Для получения разнообразных вкусов и оттенков аромата при квашении в капусту добавляют различные овощные (морковь, сладкий перец), фруктовые (яблоки, клюква) и пряно-ароматические добавки (тмин, семя укропа и т.д.). В процессе ферментации, в продукте остаются не только исходные компоненты сырья (витамин С, макро- и микронутриенты), но и значительно увеличивается количество молочнокислых микроорганизмов -основных «участников» процесса. Одним из основных продуктов метаболизма молочнокислых микроорганизмов является молочная кислота. В концентрации 0,5% она начинает ингибировать развитие многих микроорганизмов. При достижении концентрации 1-2% микробиологический ферментолиз, как правило, прекращается. Накопление уксусной кислоты позволяет судить об интенсивности гетероферментативного этапа ферментации с использованием штаммов молочнокислых микроорганизмов. Результаты. Консорциум L. plantarum + L. casei показал синергическое взаимодействие по накоплению молочной кислоты, т.к. количество кислоты, произведённой консорциумом, значительно превышает количество кислоты, произведённой каждым штаммом в отдельности. Данный момент отмечен и по накоплению уксусной кислоты. В консорциуме L. brevis + L. casei наблюдается противоположная ситуация: при использовании культур в отдельности накопление молочной кислоты происходит в большей степени, нежели при использовании двух культур одновременно. По накоплению уксусной кислоты явных отличий между монокультурами и консорциумом не наблюдается. В случае консорциума L. plantarum + L. brevis мы наблюдаем синергическое взаимодействие, причём доминирующую роль в данном консорциуме играет L. plantarum, а вклад L. brevis в накопление молочной кислоты является незначительным. При этом суммарная результирующая накопления уксусной кислоты значимо меньше результата каждого штамма в отдельности, что может говорить о негативном взаимном действии участников процесса. Кислотной деградации полисахаридного матрикса клеточных стенок в течение всего процесса ферментирования не происходит.
Белокочанная капуста, ферментирование, молочная кислота, уксусная кислота, штаммы молочнокислых микроорганизмов, консорциум, модельная среда
Короткий адрес: https://sciup.org/140250333
IDR: 140250333 | УДК: 635.342:663.15 | DOI: 10.18619/2072-9146-2020-5-88-92
Текст научной статьи Динамика накопления молочной и уксусной кислот в процессе направленной ферментации белокочанной капусты сорта Парус
, e-mail:
, e-mail:
Relevance and methodology. Today, white cabbage is the most popular type of vegetable raw materials used for fermentation not only in Russia, but also in other countries. To obtain a variety of flavors and shades of flavor, various vegetables (carrots, sweet peppers), fruit (apples, cranberries) and spicy-aromatic additives (cumin, dill seed, etc.) are added to the cabbage during fermentation. During fermentation, the product contains not only the initial components of the raw material (vitamin C, macro-and micronutrients), but also significantly increases the number of lactic acid microorganisms – the main "participants" in the process.
One of the main products of the metabolism of lactic acid microorganisms is lactic acid. At a concentration of 0.5%, it begins to inhibit the development of many microorganisms. When reaching a concentration of 1-2% microbiological enzymatic hydrolysis, as a rule, ceases. The accumulation of acetic acid allows us to judge the intensity of the heterofermentative stage of fermentation using strains of lactic acid microorganisms.
Results. The L. plantarum + L. casei consortium has shown a synergistic interaction in the accumulation of lactic acid, since the amount of acid produced by the consortium significantly exceeds the amount of acid produced by each strain separately. This point is also noted for the accumulation of acetic acid. In the L. brevis + L. casei consortium, the opposite situation is observed: when using cultures separately, the accumulation of lactic acid occurs to a greater extent than when using two cultures simultaneously. There are no obvious differences between monocultures and the consortium in terms of acetic acid accumulation. In the case of the L. plantarum + L. brevis consortium, we observe a synergistic interaction, with the dominant role in this consortium played by L. plantarum , and the contribution of L. brevis to the accumulation of lactic acid is insignificant. At the same time, the total resulting accumulation of acetic acid is significantly less than the result of each strain separately, which may indicate a negative mutual effect of the participants in the process. Acid degradation of the polysaccharide matrix of cell walls does not occur during the entire fermentation process.
В последнее время в российской и зарубежной пищевой и перерабатывающей промышленности широко используются технологии переработки растительного сырья, направленные на улучшение качества, в том числе и органолептических показателей готовой продукции [1]. Одной из старейших технологий переработки овощей и фруктов является их ферментация (квашение, мочение, соление). Основой ферментации являются биохимические процессы. Преобладающий микробиологический процесс – молочнокислое брожение. Вся технология направлена на то, чтобы способствовать этому процессу, поскольку именно от концентрации молочнокислых микроорганизмов и продолжительности их присутствия в продукте, зависят его потребительские, функциональные свойства и безопасность.
Одним из основных продуктов метаболизма молочнокислых микроорганизмов является молочная кислота. В концентрации 0,5% она начинает ингибировать развитие многих микроорганизмов. При достижении концентрации 1-2% микробиологический ферментолиз, как правило, прекращается [1,2].
В целом, продуктами метаболизма молочнокислых микроорганизмов, кроме непосредственно молочной кислоты, могут быть уксусная кислота, этиловый спирт, углекислый газ и др. [3]. В зависимости от состава конечных продуктов молочнокислое брожение разделяют на гомо- и гетероферментативное. В процессе гомоферметативного брожения углеводы метаболизируются посредством гликолиза, вследствие чего основным продуктом является преимущественно молочная кислота (рис. 1). В качестве минорных продуктов процесса выступают этанол, уксусная кислота и др. Однако их совокупная массовая доля не превышает 10%.
При гетероферментативном процессе сбраживание углеводов идёт по пентозофосфатному пути, а массовая доля молочной кислоты среди продуктов занимает не более 50 % – остальное приходится на уксусную кислоту (доминанта среди минорных компонентов), этанол и углекислый газ. При этом содержащиеся в субстрате гексозы сбраживаются либо по гомоферментативному механизму, либо подвергаются предварительной изомеризации во фруктозу с дальнейшим сбраживанием уже по пентозо-фосфатному пути [3,4]. Таким образом, гетерофермента-тивный процесс более комплексный, а способность к нему формируется у молочнокислых микроорганизмов в качестве адаптационного механизма к условиям существования в среде, богатой пентозами (рис. 2).
При этом при реализации гетероферментативного брожения молочнокислые бактерии приобретают конкурентное преимущество перед дрожжами и плесневыми грибами [4,5,6], что целевым образом способствует повышению микробиологической безопасности продуктов ферментирования и предохранения их от микробиологической порчи.
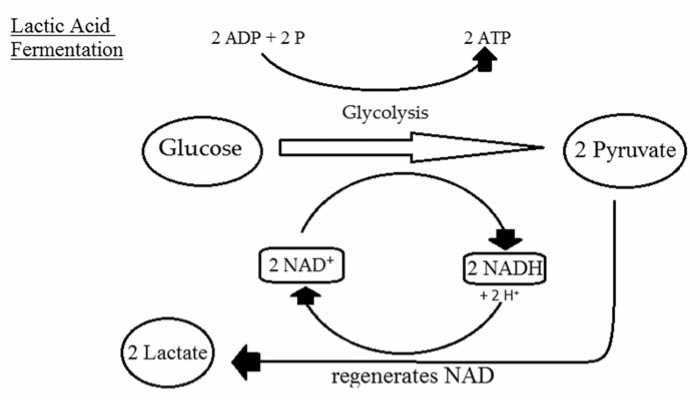
Рис. 1. Схема гомоферментативного молочнокислого брожения [3]
Fig. 1. Scheme of homofermentative lactic acid fermentation [3]
г (hi
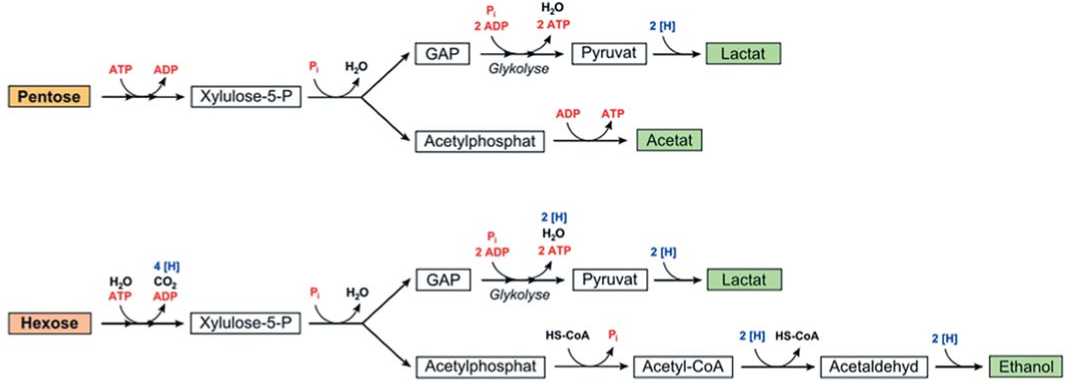
Рис.2. Схема гетероферментативного молочнокислого брожения [7]
Fig. 2. Scheme of heterofermentative lactic acid fermentation [7]
Цели и задачи Объектами исследования являются: чистые культуры видов микроорганизмов Lactobacillus casei, L. brevis, L. plantarum и их парные консорциумы;
Цель работы – Исследовать динамику продуцирования органических кислот в модельной среде на базе капусты белокочанной сорта Парус после предварительного ферментирования.
Материалы и методы
Объектами исследований выбраны:
– микроорганизмы вида Leuconostoc mesenteroides [8], Lactobacillus brevis [9], Lactobacillus casei [10] и Lactobacillus plantarum [11], предоставленные ВНИИПБ (филиал ФГБУН ФИЦ «Питания, биотехнологии и безопасности пищи»);
– стерильная модифицированная модельная среда на основе белокочанной капусты сорта Парус, (исходное сырье предоставлено ФГБНУ «Федеральный научный центр овощеводства»).
Модельную среду готовили следующим образом: у вымытых кочанов капусты сорта Парус удаляли кочерыгу, разрезали на произвольные сегменты и шинковали стружкой толщиной 3-5 мм. Затем капусту подвергали бланшированию в кипящей воде (2 мин) и охлаждению холодной проточной водой. После охлаждения капустную массу измельчали на лабораторном гомогенизаторе до получения однородной кашицеобразной массы. В полученную массу вносили пищевую соль (NaCl ) в количестве 1,5% от массы капусты, перемешивали до полного растворения соли, затем фасовали в стеклянные банки объёмом 0,1 дм3 с винтовым типом укупорки, герметично укупоривали и стерилизовали при 100°С в течение 20 мин с последующим охлаждением до температуры 25-30°С.
Поскольку при термической обработке капусты (бланширование, стерилизация) витамин С разрушается, т. к. является термолабильным элементом, было принято решение довести содержание витамина С в модельной среде до исходного его содержания. Для этого в стерильных условиях в модельную среду вносили аскорбиновую кислоту (х.ч.) в количестве 35 мг на 100 г капустной массы, перемешивали до полного растворения и вторично укупоривали также в стерильных условиях. Таким образом, была получена модельная среда, освобожденная от нативной микрофлоры для чистоты эксперимента. Добавление аскорбиновой кислоты до первоначального его содержания в свежей капусте позволило максимально приблизить условия исследований к исходному сырью. Добавление 1,5% пищевой соли аналогично внесению соли при квашении капусты традиционным способом.
Процесс ферментации осуществляли поэтапно. На первом этапе (предварительном) – в капустную массу вносили суспензию L. mesenteroides с концентрацией микроорганизмов 107 КОЕ/г в количестве 1,75 % от массы капусты, перемешивали стерильными инструментами и термостатировали при температуре 23…25°С в течение 72 ч в стерильной посуде в анаэробных условиях. На втором (основном) этапе в капустную массу, прошедшую первый этап ферментирования, вносили L. brevis, L. casei и L. plantarum ) и их парные консорциумы (« L. brevis + L. casei », « L. brevis + L. plantarum » и « L. plantarum + L. casei »). Общая концентрация молочнокислых микроорганизмов составила 108 КОЕ/г в количестве 1,73% от массы капусты. Ферментацию проводили в анаэробных условиях при температуре +25°С до накопления 0,7% молочной кислоты, затем ферментацию проводили при температуре -1…+4°С.
С целью минимизации статистической погрешности каждый эксперимент проводили с отбраковкой статистически недостоверных данных в трёхкратной повторности.
Определение содержания молочной и уксусной кислот проводили методом капиллярного электрофореза на приборе «КАПЕЛЬ-105М» ( ООО «ЛЮМЭКС») следующим образом:
Навеску ~1г модельной среды, взвешивали на аналитических весах ВЛ-224В (ГОСМЕТР) с точностью до 0,001 г.
Навеску количественно переносили в стеклянную коническую колбу объемом 0,01 дм3, доводили объем до метки дистиллированной водой, закрывали лабораторной лентой («Parafilm M») и выдерживали в течение 40 мин на водяной бане JKI при температуре 80±2°С. В течение этого времени несколько раз пробу интенсивно перемешивали. По истечении времени выдержки, содержимое колбы разливали в пластиковые пробирки типа «Эппендорф». Пробу центрифугировали на центрифуге Eppendorf MiniSpin в течение 5 мин при 9000 об/мин. Надосадочную жидкость аккуратно переносили в новые пробирки типа Эппендорф и повторно центрифугировали 1 мин при 9000 об/мин. Анализ проводили методом капиллярного гельэлектрофореза с использованием системы капиллярного электрофореза «Капель-105М» при длине волны 254 нм.
Приготовление растворов и реактивов для анализа проводили по [12] Для уменьшения статистической погрешности, каждый эксперимент проводили в трёхкратной повторности с отбраковкой статистически недостоверных данных.
Математическую обработку и моделирование проводили с использованием табличного процессора Microsoft Excel 2010 (Microsoft Corporation) с установленными надстройками «Анализ данных», «Поиск решения» и «Подбор параметра», а также специализированного программного обеспечения – TableCurve 2D v.5.01 (SYSTAT Software Inc.) и Wolfram Mathematica v.10.4 (Wolfram Research Inc.)
Результаты
Накопление молочной кислоты в процессе ферментации – это один из основных показателей «правильного» течения процесса. Накопление уксусной кислоты позволяет судить об интенсивности гетероферментативного этапа ферментации с использованием штаммов молочнокислых микроорганизмов.
Данные изменения концентрации молочной кислоты в модельной среде представлены на рисунках 3-5.
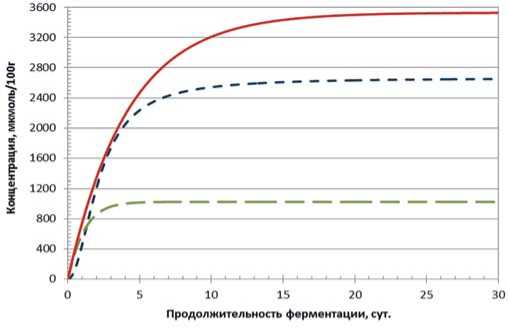
Анализируя данные по накоплению молочной кислоты в данном консорциуме L. plantarum, L. casei, можно сделать заключение о том, что количество кислоты, произведённой консорциумом, значительно превышает количество кислоты, произведённой каждым штаммом в отдельности. Таким образом, можно сделать предположение о синергическом влиянии соседствующих молочнокислых микроорганизмов.
В случае микроорганизмов L. brevis и L. casei наблюдается противоположная ситуация: в случае использования монокультуры L. brevis – накопление молочной кислоты происходит в большем количестве, нежели при использовании консорциума. Из этого следует, что L. casei негативным образом действует на L. brevis , т.е. предположительно, мы наблюдаем антагонистическое взаимодействие.
— — L plantarum — - L easel -----L. easel ♦ L plantarum
Рис. 3. Динамика накопления молочной кислоты в модельной среде с использованием L. plantarum, L. casei и их консорциума от продолжительности основного этапа ферментации
Fig. 3. Dynamics of lactic acid accumulation in the model medium using L. plantarum, L. casei and their consortium from the duration of the main fermentation stage
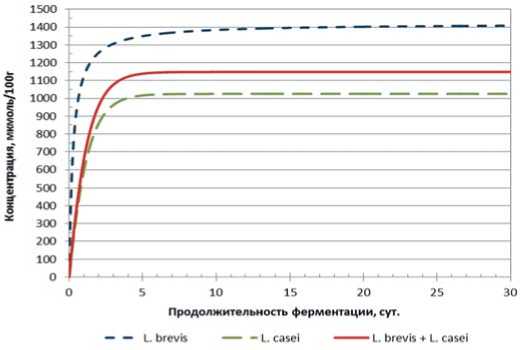
Рис.4. Динамика накопления молочной кислоты в модельной среде с использованием L. brevis, L. casei и их консорциума от продолжительности основного этапа ферментации
Fig.4. Dynamics of lactic acid accumulation in the model medium using L. brevis, L. casei and their consortium from the duration of the main fermentation stage
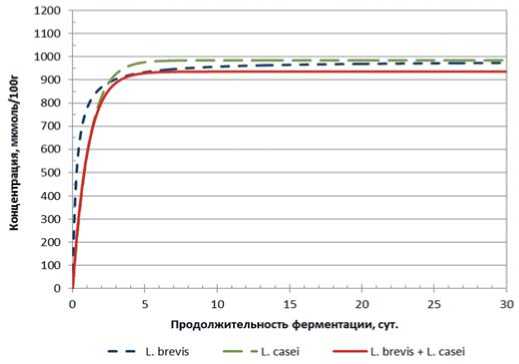
Рис.7. Динамика накопления уксусной кислоты в модельной среде с использованием L. brevis, L. casei и их консорциума от продолжительности основного этапа ферментации
Fig.7. Dynamics of acetic acid accumulation in the model medium using L. brevis, L. casei and their consortium from the duration of the main fermentation stage
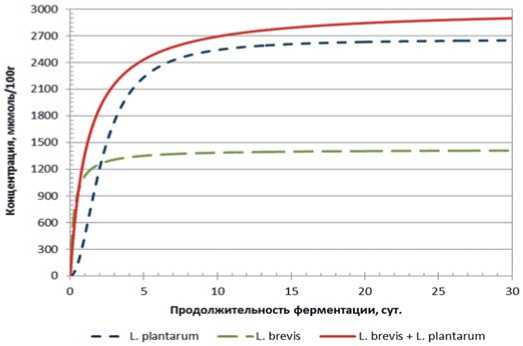
Рис. 5. Динамика накопления молочной кислоты в модельной среде с использованием L. plantarum, L. brevis и их консорциума от продолжительности основного этапа ферментации
Fig. 5. Dynamics of lactic acid accumulation in the model environment using L. plantarum, L. brevis and their consortium from the duration of the main fermentation stage
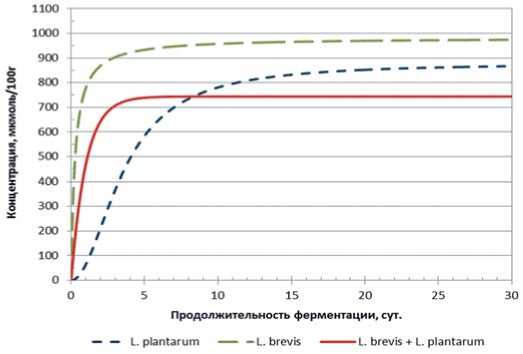
Рис.8. Динамика накопления уксусной кислоты в модельной среде с использованием L. plantarum, L. brevis и их консорциума от продолжительности основного этапа ферментации
Fig. 8. Dynamics of acetic acid accumulation in the model medium using L. plantarum, L. brevis and their consortium from the duration of the main stage of fermentation
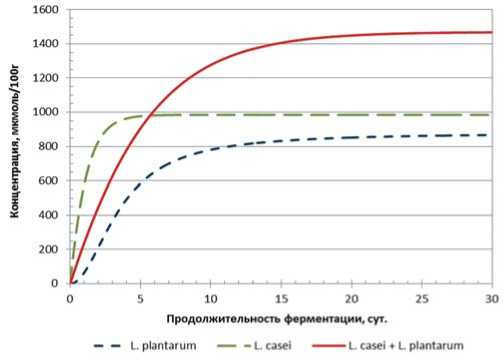
Рис.6. Динамика накопления уксусной кислоты в модельной среде с использованием L. plantarum, L. casei и их консорциума от продолжительности основного этапа ферментации Fig.6. Dynamics of acetic acid accumulation in the model medium using L. plantarum, L. casei and their consortium from the duration of the main stage of fermentation
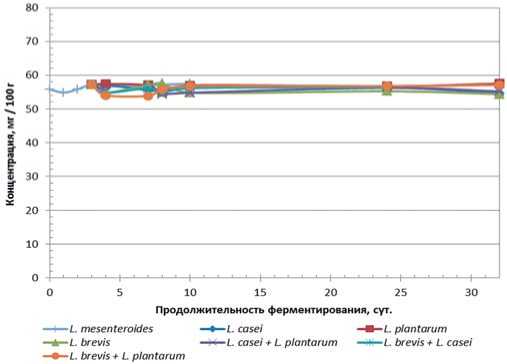
Рис.9. Динамика накопления Са2+ в модельной среде в процессе ферментации
Fig.9. The dynamics of accumulation of Ca2+ in a model environment in the fermentation process
В случае консорциума L. plantarum и L. brevis мы наблюдаем синергическое взаимодействие, причём очевидно, что доминирующую роль в данном консорциуме играет L. plantarum, а вклад L. brevis в накопление молочной кислоты является незначительным.
При анализе данных по накоплению уксусной кислоты (рис. 6-8) в случае консорциума L. plantarum и L. casei , суммарный результат превосходит по значениям результат отдельных микроорганизмов. В данном случае мы видим синергическое взаимодействие.
В случае консорциума L. brevis и L. casei, мы видим практически идентичный результат как в отношении консорциума, так и – исходных монокультур.
В консорциуме L. plantarum и L. brevis суммарная результирующая накопления уксусной кислоты значимо меньше результата каждого штамма в отдельности, что может говорить о негативном взаимном действии участников процесса.
Накопление в среде кислот и продолжительная экспозиция предполагают наличие параллельного протекания процесса кислотной деградации полисахаридного комплекса клеточных стенок субстрата (даже в используемом варианте модельная среда представляет собой суспензию материала клеточных стенок исходного сырья). Явным маркёром могут выступать катионы Ca2+, высвобождаемые из матрикса клеточных стенок в процессе его деструкции.
Динамика накопления Ca2+ в процессе ферментации
Экспериментальные данные по динамике накопления Са2+ в модельной среде в процессе предварительного и основного этапов ферментирования представлены на рисунке 9.
Анализ результатов исследований позволяет сделать однозначный вывод об отсутствии кислотной деградации полисахаридного матрикса клеточных стенок в течение всего процесса ферментирования – по меньшей мере, это справедливо в отношении эндодеструкции, затрагивающей глубинные метаморфозы субстрата и значимо влияющей на качественные показатели конечного продукта.
Выводы
-
1. По накоплению молочной кислоты консорциум L. Plantarum + L. Casei показал синергическое взаимодействие и количество кислоты, произведённой консорциумом, значительно превышает количество кислоты, произведённой каждым штаммом в отдельности. Этот момент мы наблюдаем и по накоплению уксусной кислоты.
-
2. В консорциуме L. brevis + L. casei наблюдается противоположная ситуация: при использовании культур в отдельности накопление молочной кислоты происходит в большей степени, нежели при использовании двух культур одновременно. По накоплению уксусной кислоты явных отличий между монокультурами и консорциумом не наблюдается.
-
3. В случае консорциума L. plantarum + L. brevis мы наблюдаем синергическое взаимодействие, причём доминирующую роль в данном консорциуме играет L. plantarum , а вклад L. brevis в накопление молочной кислоты является незначительным. При этом суммарная результирующая накопления уксусной кислоты значимо меньше результата каждого штамма в отдельности, что может говорить о негативном взаимном действии участников процесса.
-
4. Кислотной деградации полисахаридного матрикса клеточных стенок в течение всего процесса ферментирования не происходит.
Об авторах:
Vladimir V. Kondratenko – Deputy Director for Research, Cand. Sci. (Techn.),
Associate Professor,
Nataliya E. Posokina – Head of the laboratory, Cand. Sci. (Techn.),
23 p. (In Russ.)
Список литературы Динамика накопления молочной и уксусной кислот в процессе направленной ферментации белокочанной капусты сорта Парус
- Биотехнология продуктов растительного происхождения: учебное пособие. СПб.: Издательство Лань, 2019. 232 с.
- Guizani N, Mothershaw A. Fermentation. In: Handbook of Food Science, Technology and Engineering. Hui Y H, editor. 2006;(2). Boca Raton: CRC Press. P. 63.
- Молочнокислое брожение. Википедия. [2007-2019]. Дата обновления: 26.05.2019. URL: https://ru.wikipedia.org/?oldid=100051 э96 (дата обращения: 26.11.2019).
- Куранова Н.Г., Купатадзе Г.А. Микробиология. Часть 2. Метаболизм прокариот. - М., 2017. 100 с.
- Saravacos G., Kostaropoulos A.E. Design of food processes and food processing plants. In: Handbook of Food Processing Equipment. Springer, Boston, MA. 2016. P.1-50. DOI: 10.1007/978-3-319-25020-5
- Осипян Б.А. Эффективность применения биопрепаратов на основе гетероферментативных молочнокислых бактерий при силосовании кукурузы и трав / Автореферат диссертации на соискание ученой степени кандидата сельскохозяйственных наук. Москва, 2018. 23 с.
- Caplice E, Fitzgerald GF. Food fermentations: role of microorganisms in food production and preservation. Int J Food Microbiol. 1999;50(1-2):131-149.
- DOI: 10.1016/s0168-1605(99)00082-3
- Паспорт на штамм Leuconostoc mesenteroides subsp mesenteroides 37Y выданный Всероссийской Коллекцией Промышленных Микроорганизмов ФГУП ГосНИиГенетика, дата выдачи 01 12 2016.
- Паспорт на штамм Lactobacillus brevis B-1309, получен во Всероссийском начно-исследовательском институте пищевой биотехнологии - филиале Федерального государственного бюджетного учреждения науки Федерального исследовательского центра питания, биотехнологии и безопасности пищи, дата выдачи 28 05 2019
- Паспорт на штамм Lactobacillus casei 536/17, полученный во Всероссийском научно-исследовательском институте пищевой биотехнологии - филиале ФГБУН "ФИЦ питания и биотехнологии", дата выдачи 08 04 2019
- Паспорт на штамм Lactobacillus plantarum 578/26, полученный во Всероссийском научно-исследовательском институте пищевой биотехнологии - филиале ФГБУН "ФИЦ питания и биотехнологии", дата выдачи 08 04 2019
- Методика ООО "Люмэкс" М 04-47-2012 "Методика измерений массовой концентрации органических кислот и их солей".


