Динамика образования гликопротеинов и высокомолекулярных фенолов грибом Lentinus edodes в условиях глубинного культивирования
Автор: Ветчинкина Е.П., Никитина В.Е., Бабицкая В.Г., Щерба В.В., Пучкова Т.А., Смирнов Д.А., Осадчая О.В.
Журнал: Самарская Лука: проблемы региональной и глобальной экологии @ssc-sl
Рубрика: Научные сообщения
Статья в выпуске: 2 т.17, 2008 года.
Бесплатный доступ
Обнаружено, что грибы рода Lentinus образуют в процессе развития гликополимеры и высокомолекулярные фенольные соединения - меланины, обеспечивающие высокую антиоксидантную активность грибов и их гепатопротекторное действие. Между синтезом меланинов и эндогликопротеинов прослеживается общая закономерность: с увеличением в мицелии пигмента растет и количество эндогликопротеинов. При всех способах выращивания больше всего меланиновых пигментов синтезируется на свету
Эндогликопротеины, меланины, глубинное культивирование
Короткий адрес: https://sciup.org/148313141
IDR: 148313141
Текст научной статьи Динамика образования гликопротеинов и высокомолекулярных фенолов грибом Lentinus edodes в условиях глубинного культивирования
Поиск новых источников физиологически активных соединений с целью получения эффективных и безопасных продуктов является одной из важнейших задач современной биотехнологии. Лекарственные грибы представляют огромный потенциал в качестве источников биологически активных метаболитов углеводной, липидной, белковой природы, терпеноидов, стероидов, алкалоидов, фенольных соединений, витаминов, мине- ральных элементов. Особое внимание уделяется лекарственному грибу Lentinus edodes (шиитаке), о чём свидетельствует постоянное увеличение объёмов его выращивания в разных странах (Konno, 1995). Шиитаке используют в народной медицине стран Юго-Восточной Азии в течение нескольких тысяч лет для повышения иммунитета, лечения некоторых онкологических, сердечно-сосудистых заболеваний, регуляции содержания холестерина и сахара в крови, при синдроме хронической усталости. Он обладает антиоксидантными и противовирусными свойствами, является хорошим адаптогеном (Bender, 2001).
Биологическую активность большинства грибов во многом определяют биополимеры углеводной природы, содержание которых достигает до 50% от сухой биомассы. Уникальные свойства и полифункциональность гликополимеров позволяют их использовать для создания диагностических и лечебно-профилактических препаратов. До настоящего времени изучались гликополимеры растительного происхождения и плодовых тел, эти соединения глубинного мицелия грибов практически не изучены.
Кроме того, известно, что природные меланины обладают широким спектром биологического действия: антиоксидантным, генопротекторным, фото- и радиопротекторным, могут быть использованы в качестве сорбентов ряда нуклеотидов и тяжелых металлов. Базидиомицеты наряду с другими физиологически активными соединениями, синтезируют пигменты – меланины, которые обеспечивают более высокую биологическую активность грибов.
Исходя из выше сказанного, целью работы явилось изучение образования метаболитов гликопротеиновой природы и меланинов ксилотрофного базидиомицета Lentinus edodes (шиитаке) в условиях глубинного культивирования.
Материалы и методы исследования
Объекты исследований и условия культивирования. В работе использовали 25 штаммов гриба Lentinus edodes . Часть грибов находится в коллекции высших базидиальных грибов лаборатории экспериментальной микологии института микробиологии НАН Беларуси, часть получена из коллекции культур шляпочных грибов института ботаники им. Н.Г. Холодного НАН Украины, часть выделена из коммерческих плодовых тел.
Грибы выращивали в колбах Эрленмейера на качалке на глюкозопептонной среде. Стационарное культивирование проводили на той же среде без перемешивания. Количество инокулюма составляло 10%. Температура культивирования была оптимальной для данного вида и составляла 260С.
После выращивания грибов мицелий отделяли от культуральной среды, промывали дистиллированной водой и использовали для проведения соответствующих исследований.
Для определения эндогликопротеинов измельчённую навеску сухого мицелия в количестве 100 мг помещали в пробирку объёмом 20 мл, приливали 5 мл 1 М NaOH, закрывали пробкой и экстрагировали в термостате при 600С в течение 1 ч, периодически перемешивая (Tang, 2002). Полученный экстракт центрифугировали 20 мин при 8000 об/мин. Осадок отделяли и в супернатанте определяли содержание гликопротеинов фенолсернокислотным методом (Dubois, 1956). 1,0 мл супернатанта переносили в пробирку объёмом 20 мл, добавляли 1,0 мл 5% водного раствора фенола и тщательно перемешивали. К полученному раствору быстро добавляли 5 мл концентрированной серной кислоты при непрерывном встряхивании. Давали раствору отстояться в течение 10 мин, перемешивали и помещали в водяную баню при 25-300 С на 10-20 мин. Измерения вели на фотоэлектроколориметре при 490 нм в кювете 5 мм. Контролем служил раствор, содержащий вместо супернатанта 1 мл дистиллированной воды, 1 мл 5% водного раствора фенола и 5 мл концентрированной серной кислоты.
Для определения экзогликопротеинов культуральную жидкость упаривали в 2-3 раза, осаждали этиловым спиртом (1:1), оставляли при температуре 40 С до полного осаждения, затем осаждённые гликопротеины отделяли центрифугированием, диализовали 3 сут. против дистиллированной воды, переосаждали спиртом, отделяли центрифугированием и сушили при температуре 40 С (Babitskaya, 2000). Белок в мицелии определяли по Лоури ( Lowry, 1951 ), в гликопротеинах – по Бредфорд (Bradford, 1976).
Экстракцию меланина проводили 2% раствором NaOH в течение 2 ч на кипящей водяной бане. Полученный экстракт охлаждали, подкисляли HCl до рН 2,0 и коагулировавший пигмент отделяли центрифугированием при 6000 g 15 мин. Осадок растворяли в 2% растворе NaOH. Для идентификации пигмента использовали качественные реакции с KMnO 4 , H 2 O 2 , FeCl 3 (Щерба, 1999).
Результаты и обсуждение
Поскольку существенных различий между штаммами не наблюдалось, динамика роста и образования гликополимеров при глубинном культивировании показана на примере штаммов гриба L. edodes 19 и 25. Как следует из рис. 1, накопление биомассы, экзо- и эндогликополимеров происходит параллельно, достигая максимума на 8/10 сутки роста культуры. Урожай биомассы составил 13-14 г/л, выход экзогликополимеров – 3,7-4,5 г/л, эндогликополимеров – 10-11%. Следует отметить, что содержание эндогликополимеров было практически постоянным, начиная с 5/7 суток после инокуляции. Значение рН, на вторые сутки культивирования, снижалось с 6,0 до 3,7, после чего оставалось на уровне 3,2-3,0. Активное потребление глюкозы грибом начиналось на 3 сутки, а к концу ферментации не превышало 0,4-0,2 г/л.
Также было отмечено образование грибом тёмно-коричневого пигмента, который ранее нами был выделен и изучен (Щерба, 1999). Полученные результаты дали основание утверждать, что пигмент, образуемый грибом L. edodes, является меланином. Меланины, получаемые при выращивании L. edodes в различных условиях идентичны по физико- химическим свойствам. С четвертых суток гриб синтезировал до 1% меланина.
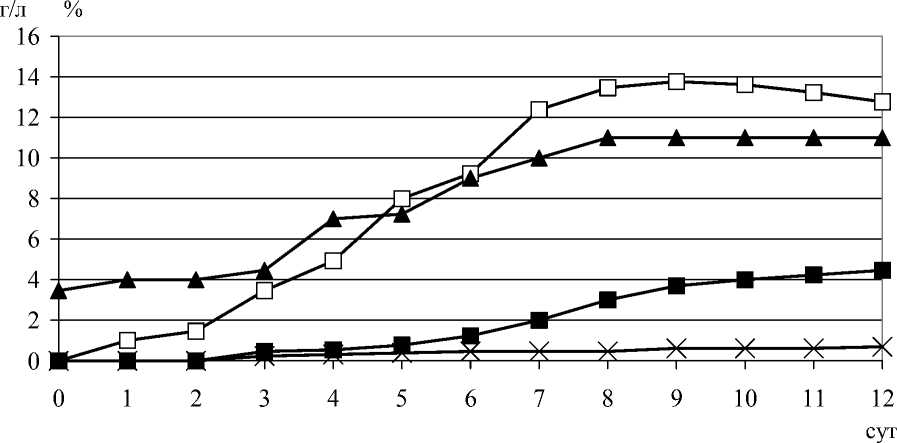
Рис. 1. Динамика роста гриба L. edodes 19 в условиях глубинного культивирования. □ – биомасса, г/л; ▲ – эндогликополимеры, %; ▄ – экзогликополимеры, г/л; х – меланин, %
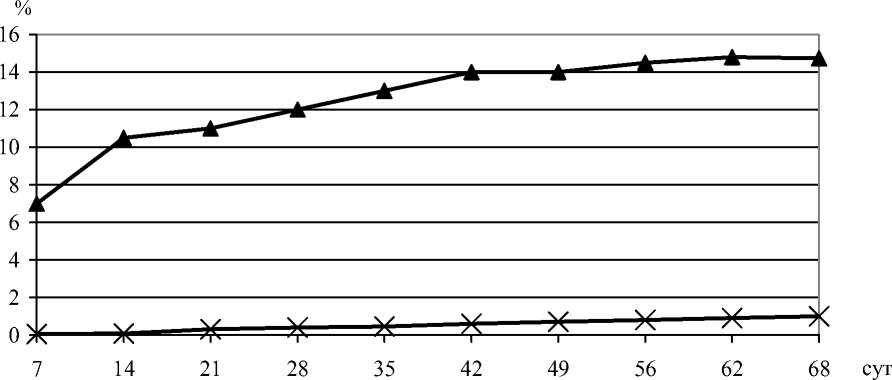
Рис. 2. Рост гриба L. edodes 19 в стационарных условиях. ▲ – эндогликополимеры, %; х – меланины, %
При выращивании в стационарных условиях (без перемешивания) на 20/30 сутки культивирования гриб образовывал плотную мицелиальную пленку. По мере выращивания пленка приобретала светло-коричневый цвет. Из пленки выделен пигмент, который также на основании физикохимических свойств отнесен к высокомолекулярным фенольным соединениям – меланинам.
Исследование динамики роста L. edodes 19 в стационарных условиях показало, что гриб к концу ферментации накапливает 9,0-10,0 г/л биомассы. Содержание гликополимеров в биомассе составило 10-14%. При этом их количество изменялось незначительно на протяжении роста гриба. Поскольку содержание гликополимеров определяли серно-кислотным методом, есть основания полагать, что в их состав частично вошли и свободные углеводы (глюкоза, трегалоза), входящие в пул запасных питательных веществ. Биомасса содержала до 1% меланина. Между синтезом меланинов и эндогликопротеинов прослеживалась закономерность: с увеличением в мицелии пигмента росло и количество эндогликополимеров (рис. 2).
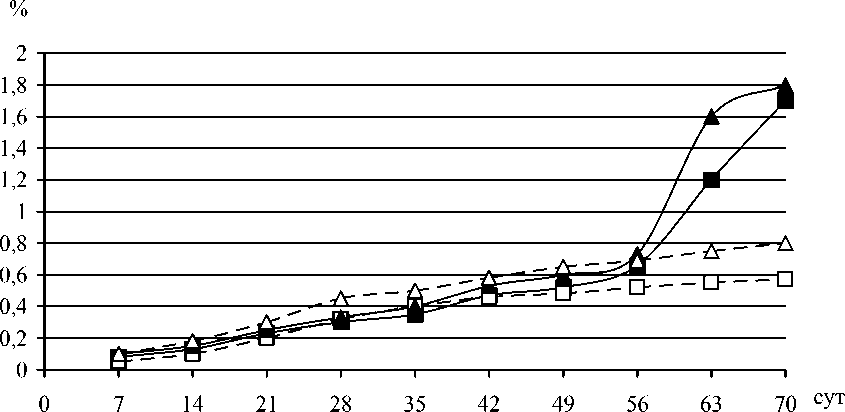
Рис. 3. Образование меланинов грибами L. edodes.
■ - меланины L. edodes 19 на свету; □ - меланины L. edodes 19 в темноте;
▲ - меланины L. edodes 25 на свету; ▲ - меланины L. edodes 25 в темноте.
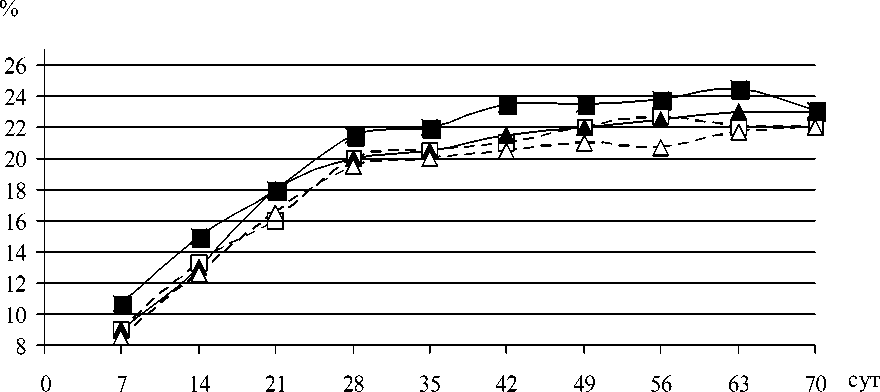
Рис. 4. Образование гликополимеров грибами L. edodes.
■ - гликополимеры L. edodes 19 на свету; □ - гликополимеры L. edodes 19 в темноте; ▲ - гликополимеры L. edodes 25 на свету; ▲ - гликополимеры L. edodes 25 в темноте.
Изучали образование гликополимеров и меланинов у гриба L. edodes в условиях стационарного культивирования на свету и в темноте. Динамика образования показана на примере штаммов шиитаке 19 и 25. Как следует из рис. 3 и 4, при различных условиях культивирования накопление гликополимеров идет параллельно накоплению меланинов, причем наибольшее количество эндогликополимеров и меланинов синтезируется на свету. И если разница в образовании эндогликополимеров не столь существенная, то разница в синтезе меланинов достигает 2-3 раз.
Таким образом, грибы рода Lentinus образуют в мицелии не только гликополимеры, но и высокомолекулярные фенольные соединения – меланины. Есть все основания полагать, что наличие именно этих соединений обеспечивает высокую антиоксидантную активность грибов и их гепато-протекторное действие.
Проведенные исследования показали, что между синтезом меланинов и эндогликопротеинов прослеживается общая закономерность: с увеличением в мицелии пигмента растет и количество эндогликопротеинов. Такая закономерность свойственна глубинной культуре шиитаке как при стационарном культивировании, так и при перемешивании. При всех способах выращивания наибольшее количество меланинов синтезируется на свету.
Работа выполнена при поддержке Гранта РФФИ № 06-04-81042 Бел_а.
Список литературы Динамика образования гликопротеинов и высокомолекулярных фенолов грибом Lentinus edodes в условиях глубинного культивирования
- Babitskaya, V.G., V.V. Scherba, N.Y. Mitropolskaya Exopolysaccharides of some medicinal mushrooms: production and composition // Int. J. of Medicinal Mushrooms. 2000. Vol. 2. - P. 51 - 54.
- Bender S., Lonergan G. T., Backhaus J., Cross R. F., Dumitrach-Anghel C. N., Baker W. L. The antibiotic activity of the edible and medicinal mushroom Lentinus edodes (Berk.) Sing. // Int. J. Medicinal Mushrooms. 2001. V. 3. № 2 - 3. - 118 p.
- Bradford M.M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding // Anal. Biochem. 1976. Vol. 72, № 1 - 2. - P. 248 - 254.
- Dubois, M., Gilles, K.A., Hamilton, J.K., Rebers, P.A., and Smith, F., Colorimetric Method for Determination of Sugars and Related Substances // Anal. Chem. 1956. Vol. 28. - P. 350 - 356.
- Konno K. Biologically active components of poisonous mushrooms // Food Rev. Intern. 1995. V. 11. №1. - P. 83 - 107.
- Lowry O.M. Protein measurement with the Folin phenol reagent // J. Biol. Chem. 1951. № 193. - P. 265 - 275.
- Tang, Y.J., J.J. Zhong Fed-batch fermentation of Ganoderma lucidum for hyperproduction of polysaccharide and ganoderic acid // Enzyme and Microbial Technology. 2002. Vol. 31. - P. 20 - 28.
- Щерба В.В. Меланиновые пигменты некоторых базидиомицетов // Весцi АН Беларусi. Сер. бiял. навук. 1999. № 2. - С. 49 - 53.


