Динамика относительного содержания лимфоцитов крови после механической травмы бедра в эксперименте
Автор: Ланичева А.Х., Семченко В.В., Вихарева Л.В., Валеевa Р.Р.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Статья в выпуске: 4, 2025 года.
Бесплатный доступ
Механическая травма мягких тканей сопровождается изменениями в иммунной системе, что проявляется сдвигами в лимфоцитарном профиле крови. В остром периоде после высококинетического механического повреждения отмечается снижение относительного содержания CD4+-лимфоцитов-хелперов, CD8+-цитотоксических лимфоцитов и NK-лимфоцитов. Далее относительное содержание Т-лимфоцитов частично восстанавливается, но остается ниже контрольных значений, в то время как относительное содержание B-лимфоцитов восстанавливается до контрольных цифр. Это свидетельствует об угнетении T-клеточного звена иммунитета и частичной компенсации B-клеточного звена. Цель исследования. Изучить влияние механической травмы бедра белых крыс на относительное содержание лимфоцитов в крови, а также корреляцию между их типами и субпопуляциями в динамике. Материалы и методы. Эксперимент проведен на 18 белых крысах-самцах с моделированной механической травмой бедра. Животных разделили на контрольную (n=6) и опытную (n=12) группы. Через 3 и 14 сут после травмы проводили забор крови и иммуноцитохимический анализ субпопуляций лимфоцитов (CD3+, CD4+, CD8+, CD19+, CD56+) с использованием моноклональных антител. Статистическую обработку данных выполняли методами непараметрической статистики с представлением результатов в виде медианы и квартилей. Результаты. Установлено, что через 3 сут после механической травмы бедра в крови белых крыс происходило снижение относительного содержания Т-цитотоксических лимфоцитов, Т-хелперов, NK-лимфоцитов и В-лимфоцитов. Через 14 сут после травмы наблюдалось увеличение содержания T-хелперов, NK-лимфоцитов и Т-цитотоксических лимфоцитов по сравнению с данными, полученными на 3-и сут, но значения оставались ниже контрольных, в то время как В-клеточное звено восстанавливалось до контрольного уровня. Изменение относительного содержания иммунокомпетентных клеток лимфоцитарного профиля (CD3+, CD4+, CD8+, CD19+, CD56+) сопровождалось реорганизацией стохастических связей между ними: формировались новые положительные связи между относительным содержанием В-лимфоцитов, Т-цитотоксических лимфоцитов и NK-лимфоцитов, не наблюдавшиеся в контрольной группе. Выводы. Обнаруженные нами сдвиги в лимфоцитарном профиле крови отражают системные реактивные изменения иммунной системы в ответ на механическое повреждение мягких тканей бедра у экспериментальных животных. Увеличение Т-лимфоцитопении свидетельствует о нарушении взаимодействия иммунорегуляторных клеток, а зафиксированное резкое уменьшение относительного содержания субпопуляции лимфоцитов с цитотоксическим действием (NK-клеток) в остром периоде (по прошествии 3 сут) после механической травмы может стать патогенетическим основанием для снижения иммунологической резистентности.
Механическая травма, кровь, СD4+-лимфоциты хелперы, CD8+-цитотоксические лимфоциты, CD19+-В-лимфоциты, CD56+-NK-лимфоциты
Короткий адрес: https://sciup.org/14134216
IDR: 14134216 | УДК: 616-001.1 | DOI: 10.34014/2227-1848-2025-4-106-117
Текст научной статьи Динамика относительного содержания лимфоцитов крови после механической травмы бедра в эксперименте
Введение. Механическая травма приво- так и адаптивных иммунных реакций, что под-дит к нарушению регуляции как врожденных, вергает раненых людей риску развития отсро- ченных нарушений, включая замедленное заживление ран, развитие воспаления, сепсис, синдром полиорганной дисфункции и острый респираторный дистресс-синдром, которые определяют повышенную заболеваемость, инвалидизацию и смертность [1–3]. Механизмы, с помощью которых развиваются эти осложнения, сложны и включают дисбаланс иммунной системы, приводящий к выраженному системному воспалению, вызванному интенсивным образованием иммуномодифицирующих агентов при повреждении мягких тканей [4–6].
Общим маркером для всех Т-лимфоцитов является молекулярный комплекс TCR-CD3+. Клетки, несущие этот комплекс, составляют в норме 60–80 % лимфоцитов крови. Среди них примерно 30–45 % – это CD4+-T-хелперы, 40–75 % – CD8+-цитотоксические T-клетки [7]. Субпопуляция CD4+CD8+ (DN-T-лимфо-циты) составляет лишь 1–3 % всех CD3+-T-клеток [8, 9]. Кроме этого, около 5–20 % лимфоцитов крови – это NK-клетки, являющиеся важной частью врожденного иммунитета. Таким образом, TCR-CD3+-клетки доминируют среди всех лимфоцитов, но внутри этой популяции наблюдаются значительные вариации по субтипам; NK-лимфоциты также вносят значительный вклад в иммунологический профиль крови [10, 11].
Цель исследования. Изучить влияние механической травмы бедра белых крыс на относительное содержание лимфоцитов в крови, а также корреляцию между их типами и субпопуляциями в динамике.
Материалы и методы. Исследование было выполнено на 18 белых половозрелых самцах беспородных крыс массой 180–200 г. Для моделирования механического повреждения бедра применяли усовершенствованную установку с падающим грузом, позволяющую воспроизводить высококинетическую травму мягких тканей [12]. Травму наносили в область правой задней конечности. Воздействие осуществлялось с помощью ударника с бойком, имеющим круглый наконечник диаметром 3 мм, по которому груз массой 10 кг падал с высоты 430 мм. Дополнительная ки- нетическая энергия не прикладывалась. В результате формировалась открытая сквозная травма с нарушением целостности кожных покровов и мягких тканей, сопровождающаяся наружным кровоизлиянием; костная ткань при этом не травмировалась.
Все манипуляции с лабораторными животными проводились под эфирным наркозом и в соответствии с требованиями приказа Министерства здравоохранения Российской Федерации № 199н от 01.04.2016 «Об утверждении Правил надлежащей лабораторной практики» и санитарно-эпидемиологическими нормами СП 2.2.1.3218-14 «Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментальнобиологических клиник (вивариев)» (утверждены постановлением главного государственного санитарного врача РФ от 29.08.2014 № 51).
Проведение исследования было одобрено локальным этическим комитетом ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России (протокол № 3 от 18.03.2021).
Распределение животных осуществлялось методом рандомизации с использованием генерации случайных чисел. Было сформировано 2 группы: контрольная (n=6) и опытная (крысы с индуцированной механической травмой, n=12). Животных содержали в идентичных условиях вивария с обеспечением стандартного рациона и свободного доступа к воде и корму. Летальных исходов в ходе эксперимента не наблюдалось.
Забор крови осуществляли из хвостовой вены в утренние часы через 3 и 14 сут после травмирования. Количество лейкоцитов в 1 л крови определяли по методу Шиллинга (четырехпольная схема). Далее рассчитывали относительные показатели содержания отдельных типов и субпопуляций лимфоцитов. Для этого кровь, собранную в пробирки с антикоагулянтом, разбавляли физиологическим раствором и наслаивали на разделительную среду Fi-coll P, после чего центрифугировали. Полученную фракцию лимфоцитов отмывали буфером PBS.
Типовой и субпопуляционный состав лимфоцитов оценивали с использованием панели моноклональных антител. Определяли экспрессию CD3+ (общие Т-лимфоциты), CD4+ (Т-хелперы), CD8+ (Т-цитотоксические лимфоциты), CD19+ (В-лимфоциты) и CD56+ (NK-клетки).
Для фиксации клеток предметные стекла с лунками предварительно обрабатывали 0,1 % раствором поли-L-лизина (Serva, Германия). На каждую лунку наносили 20 мкл клеточной суспензии (5×106 кл./мл) и инкубировали во влажной камере, фиксировали 70 % этанолом, после чего трехкратно промывали в фосфатном буфере PBS (по 5 мин). На подготовленные клетки наносили специфические моноклональные антитела к CD-маркерам (Dako, Дания) в разведении 1:100 (по 20 мкл на лунку), проводили инкубацию при комнатной температуре в течение 30 мин. После троекратного промывания в PBS добавляли вторичные антитела (20 мкл, экспозиция 10 мин), затем – стрептавидин, конъюгированный с пероксидазой (20 мкл, 10 мин). Окрашивание осуществляли с использованием 3-диаминобензидина тетрахлорида, приготовленного ex tempore, после чего образцы промывали дистиллированной водой и высушивали. Визуализацию CD-позитивных клеток выполняли с применением светового бинокулярного микроскопа Axio-scop (Carl Zeiss, Германия). Иммунопозитив-ные лимфоциты имели характерное коричневое окрашивание. Подсчет проводили в 20 полях зрения, определяя долю (%) CD-экс-прессирующих клеток в контрольной группе, а также через 3 и 14 сут после травмы.
Статистическую обработку данных выполняли с использованием программного пакета Statistica v.7.0 (StatSoft Inc., США).
Для подбора критериев проверки гипотез анализировали распределение переменных (критерии Колмогорова – Смирнова и Шапиро – Уилка) и их дисперсию. Ввиду огра- ниченного объема выборки и отклонения распределений от нормального закона применяли методы непараметрической статистики. Сравнение независимых выборок (контроль, 3-и и 14-е сут после травмы) проводили по критерию Манна – Уитни. Корреляционные связи оценивали с использованием коэффициента ранговой корреляции Спирмена (R, p<0,05).
Для анализа взаимосвязей между параметрами использовались кластерный анализ и метод многомерного шкалирования, позволившие визуализировать многомерные данные и выявить структуру связей между переменными. Проверку адекватности моделей предсказания осуществляли посредством построения диаграммы Шепарда: расположение точек вдоль прямой указывало на корректность модели. Совмещение кластерного анализа с многомерным шкалированием позволило установить множественные зависимости между исследуемыми параметрами. Влияние независимых переменных (например, содержания В-лимфоцитов) на зависимую (Т-лимфоциты) оценивали методом линейной регрессии. Статистические показатели представлены в виде Me (Q1–Q3), где Ме – медиана (Q2, 50 %), Q1 – нижний (25 %), Q3 – верхний (75 %) квартили. Критический уровень значимости принимали равным 0,05.
Результаты и обсуждение. Нами установлено, что через 3 сут после травмы в крови экспериментальных животных относительное содержание Т-лимфоцитов, В-лимфоцитов и NK-лимфоцитов статистически значимо уменьшалось (в разной степени) в сравнении с контрольными животными. Через 14 сут после травмы происходило полное восстановление относительного содержания В-лимфоцитов и частичное – остальных (рис. 1). То есть сохранялся выраженный дефицит всех изученных субпопуляций Т-лимфоцитов и NK-лимфоцитов, что свидетельствовало о признаках иммунодефицита после травмы.
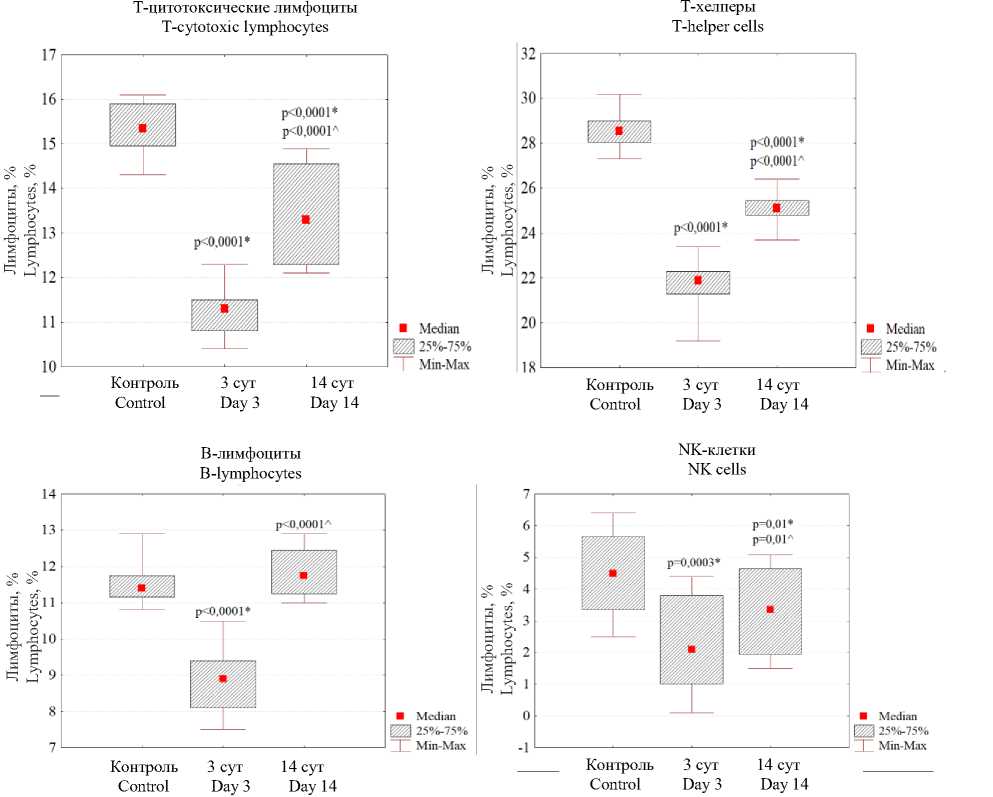
Рис. 1. Относительное содержание лимфоцитов (%) в крови белых крыс в контроле, через 3 и 14 сут после травмы (различия достоверны по сравнению с: * – контролем, ^ – показателями через 3 сут (критерий Манна – Уитни))
Fig. 1. Relative lymphocyte content (%) in the blood of white rats in the control, 3 and 14 days after injury (* – the differences are significant compared with the control, ^ – the differences are significant compared with the parameters 3 days after injury (Mann-Whitney test)
При анализе характера изменения пула иммунокомпетентных клеток крови большое значение имеет не только определение их абсолютного и относительного содержания, но и выявление парных и многомерных корреляционных связей. Нами установлено, что экспериментальная травма бедра изменяла структуру последних. Так, в контроле и через 3 сут после воздействия выявлено по одной паре разных связей между относительным содер- жанием В- и Т-лимфоцитов крови. Через 14 сут было обнаружено уже три пары сильных положительных связей между Т-, В- и NK-лимфоцитами (табл. 1). Это свидетельствует о посттравматической перестройке в системе клеточного и гуморального иммунитета организма к этому сроку. Увеличение относительного содержания Т-лимфоцитов сопровождалось увеличением относительного содержания В- и NK-лимфоцитов.
Таблица 1
Table 1
Результаты парного корреляционного анализа независимых переменных, характеризующих относительное содержание лимфоцитов крови у крыс в посттравматическом периоде
Results of paired correlation analysis of independent variables characterizing the relative content of blood lymphocytes in rats in the post-traumatic period
|
Пары Pair |
Valid |
Spearman |
t(N-2) |
p-level |
|
Контроль Control group |
||||
|
T-лимфоциты хелперы и B-лимфоциты T-helper lymphocytes & B-lymphocytes |
20 |
-0,46 |
-2,18 |
0,043 |
|
3-и сут Day 3 |
||||
|
T-цитотоксические лимфоциты и B-лимфоциты T-cytotoxic lymphocytes & B-lymphocytes |
20 |
0,75 |
4,87 |
0,0001 |
|
14-е сут Day 14 |
||||
|
T-цитотоксические лимфоциты и B-лимфоциты T-cytotoxic lymphocytes & B-lymphocytes |
20 |
0,85 |
6,80 |
0,0000 |
|
T-цитотоксические лимфоциты и NК-лимфоциты T-cytotoxic lymphocytes & NK-lymphocytes |
20 |
0,88 |
7,69 |
0,0000 |
|
B-лимфоциты & NК-лимфоциты B-lymphocytes & NK-lymphocytes |
20 |
0,83 |
6,27 |
0,0000 |
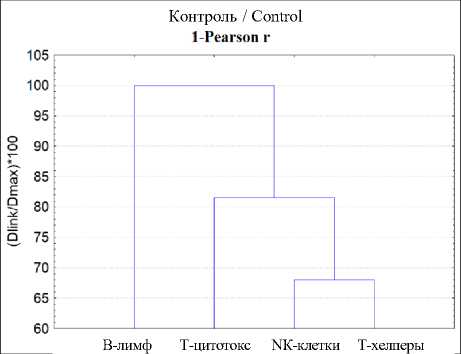
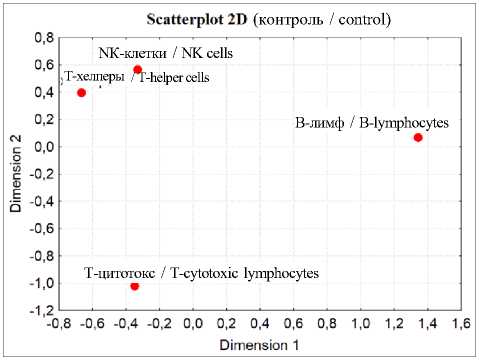
Более глубокий анализ взаимоотношений изученных независимых переменных проведен с помощью кластерного анализа и многомерного шкалирования (рис. 2).
На рис. 2 видно, что кластерные деревья и пространственное распределение точек при многомерном шкалировании в контроле и после травмы различаются. При этом полученные при кластерном анализе результаты подтверждались многомерным шкалированием (рис. 2), адекватность моделей которого подтверждена с помощью диаграммы Шепарда. Точки графика распределялись на ступенчатой линии (рис. 3).
Следовательно, парный корреляционный и кластерный анализы, а также метод многомерного шкалирования подтвердили предположение о влиянии травмы бедра на стохастические связи изученных переменных. Наибольшие изменения происходили через 14 сут после травмы бедра. Объяснить данные результаты можно неравномерным изменением содержания разных типов и субпопуляций лимфоцитов.
По данным, полученным с помощью метода линейной регрессии, у животных через 3 сут после травмы увеличение относительного содержания В-лимфоцитов на 1,0 % сопровождалось ростом относительного содержания Т-цитотоксических лимфоцитов на 0,5 % (р=0,0002). Через 14 сут после травмы увеличение относительного содержания В-лим-фоцитов на 1,0 % сопровождалось ростом относительного содержания Т-цитотоксических лимфоцитов на 1,5 % (р=0,0000), а NK-лимфоцитов – на 1,8 % (р=0,0000). Кроме этого, изменение относительного содержания NK-лимфоцитов на 1,0 % сопровождалось изменением относительного содержания Т-цитоток-сических лимфоцитов на 0,82 % (р=0,0000).
B-lymphocytes T-cytotoxic NK cells T-helper cells lymphocytes
Scatterplot 2D (3 сут / day 3)
Травма, 3 сут / Trauma, day 3
NК-клетки B-лимф T-цитотокс T-хелперы
NK cells B-lymphocytes T-cytotoxic T-helper cells lymphocytes
1,0 0,8 0,6 0,4
С 0.2 О с 0,0 Ф 5 "°'2
-0,4
-0.6
-0,8
-1,0
-0.8 -0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 1.0 1.2 1,4 1,6
B-лимф / B-lymphocytes
T-цитотокс / T-cytotoxic lymphocytes
NК-клетки / NK cells
T-хелперы / T-helper cells
Dimension 1
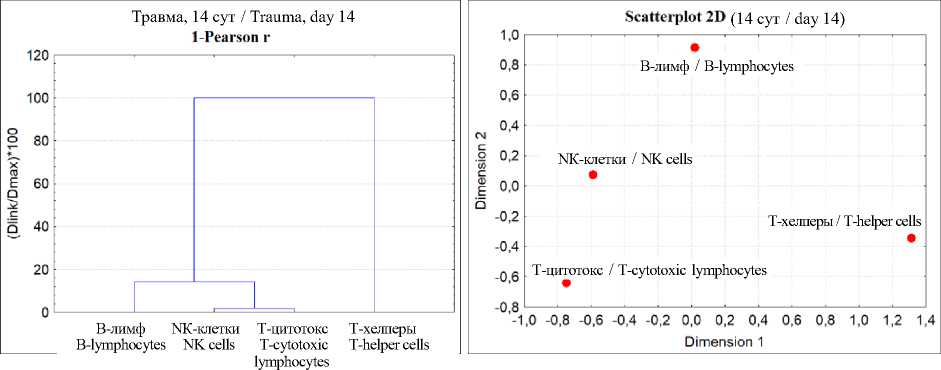
Рис. 2. Результаты кластерного анализа (кластерное дерево) и многомерного шкалирования (распределение в пространстве), проведенных на основе корреляционной матрицы четырех независимых переменных
Fig. 2. Results of cluster analysis (cluster tree) and multidimensional scaling (spatial distribution) based on the correlation matrix of four independent variables
Рис. 3. Диаграммы Шепарда, используемые для проверки моделей многомерного шкалирования по четырем переменным
Fig. 3. Shepard diagrams for testing multidimensional scaling models based on four variables
Таким образом, при экстремальных состояниях относительное содержание иммунокомпетентных клеток крови изменяется и отражает трансформацию иммунного статуса организма. При этом происходит реорганизация стохастических связей между относительным содержанием разных типов и субпопуляций лимфоцитов, что позволяет количественно характеризовать регрессивные аспекты их взаимодействий. Кровь является тканью, в которую лимфоциты поступают из органов, прежде всего иммунной системы. Они циркулируют в ней в течение нескольких часов или суток, а затем мигрируют через сосуды мик-роциркуляторного русла в периваскулярную соединительную ткань, где и реализуют свои функции [13, 14].
Заключение. Лимфоциты выделяют разнообразные цитокины, включая интерлейкины, интерфероны и фактор некроза опухоли,
которые играют ключевую роль в регуляции иммунного ответа и активируют другие иммунные клетки, участвуют в дифференцировке других лимфоцитов и управлении воспалительными процессами. Любое травматическое воздействие, вызывающее локальные изменения в балансе про- и антивоспалительных цитокинов, может привести к развитию асептического воспаления на локальном или системном уровнях [15, 16]. Это означает, что при травме активируются воспалительные механизмы, способствующие возникновению местного воспаления в поврежденной области и системного воспаления, затрагивающего весь организм. Провоспалительные цитокины, такие как интерлейкины (IL-1 и IL-6) и факторы некроза опухоли (TNF-α), играют ключевую роль в инициации и поддержании воспаления [17]. Они способствуют привлечению иммунных клеток к месту повреждения и активируют
процессы, направленные на восстановление тканей. Антивоспалительные цитокины, такие как IL-10 и трансформирующий фактор роста-бета (TGF-β), способствуют ограничению воспаления и стимулированию заживления. Несбалансированное взаимодействие про- и ан-тивоспалительных цитокинов может привести к чрезмерной реакции воспаления, что в свою очередь может вызвать повреждение окружающих тканей и системные проявления [18]. Например, системное воспаление может сопровождаться такими признаками, как лихорадка, мышечная боль и ухудшение общего состояния пациента. Обострение системного воспаления может также привести к более серьезным осложнениям, включая сепсис и по-лиорганную недостаточность [19, 20].
Таким образом, понимание молекулярных и клеточных механизмов, сопутствующих травматическому воздействию, является ключевым для разработки эффективных стратегий лечения и профилактики воспалительных состояний. Травматический стресс, вызывающий асептическое системное воспаление, неизбежно приводит к реакции со стороны органов иммунной системы, что проявляется в изменении клеточного состава крови.
Обнаруженные нами сдвиги в лимфоцитарном профиле крови отражают системные реактивные изменения иммунной системы в ответ на механическое повреждение мягких тканей бедра у экспериментальных животных. Через 3 сут после воздействия наблюдается снижение относительного содержания CD4+-лимфоцитов-хелперов, CD8+-цитотоксических лимфоцитов и NK-лимфоцитов. Через 14 сут наблюдения относительное содержание различных субпопуляций Т-лимфоцитов частично восстанавливается, но остается ниже контрольных значений. Относительное содержание B-лимфоцитов в этот период достигает уровня контроля. Это указывает на угнетение T-клеточного звена иммунитета и частичную компенсацию B-клеточного звена. Увеличение Т-лимфоцитопении свидетельствует о нарушении взаимодействия иммунорегуля-торных клеток, а зафиксированное резкое уменьшение относительного содержания субпопуляции лимфоцитов с цитотоксическим действием (NK-клеток) в остром периоде (по прошествии 3 сут) после механической травмы может стать патогенетическим основанием для снижения иммунологической резистентности.


