Динамика перфузии миокарда в рубцовой ткани по данным стресс-МРТ у пациентов, подвергаемых эндоваскулярной реканализации хронической окклюзии правой коронарной артерии
Автор: Курбатов Владислав Петрович, Обединский Антон Андреевич, Обединская Наталья Ростиславовна, Пономарев Дмитрий Николаевич, Покушалов Евгений Анатольевич
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Ишемическая болезнь сердца
Статья в выпуске: 3 т.19, 2015 года.
Бесплатный доступ
Актуальность Хронические окклюзии коронарных артерий в большинстве случаев ассоциируются с наличием постинфарктного кардиосклероза в заинтересованном бассейне кровоснабжения. Этот факт ставит под сомнение целесообразность чрескожного коронарного вмешательства при данной патологии. Магнитно-резонансная томография (МРТ) сердца является наиболее точным методом верификации ишемии миокарда и определения объема постинфарктного кардиосклероза (ПИКС). Представляет интерес изучение значения данной методики для оценки перфузии в зоне ПИКС до и после реканализации хронической окклюзии коронарной артерии. Цель Оценить перфузию рубцовой ткани в заинтересованном бассейне кровоснабжения до и после ЧКВ при наличии хронической окклюзии правой коронарной артерии (ХО ПКА) по данным МРТ с отсроченным контрастированием и фармакологическим стресс-тестом. Материал и методы Проспективное рандомизированное исследование включает две группы пациентов с ХОПКА и ПИКС. В первой группе провели успешное чрескожное коронарное вмешательство, вторая группа получала только консервативную терапию. Всем пациентам выполняли МРТ с отсроченным контрастированием и стресс-тестом исходно и через 2 мес. результаты При контрольной МРТ в первой группе отметили достоверное снижение среднего количества сегментов рубцовой ткани с наличием стресс-дефекта перфузии с 2,84 (1,64) до 2,00 (1,61), средняя разница составила -0,84 сегмента, 95% ДИ для разницы -1,23___-0,46, р
Постинфарктный кардиосклероз, стресс-мрт, чрескожное коронарное вмешательство, хроническая окклюзия правой коронарной артерии, сто of right coronary artery
Короткий адрес: https://sciup.org/142140688
IDR: 142140688 | УДК: 616.127-089:616.24
Текст научной статьи Динамика перфузии миокарда в рубцовой ткани по данным стресс-МРТ у пациентов, подвергаемых эндоваскулярной реканализации хронической окклюзии правой коронарной артерии
Доказано, что магнитно-резонансная томография (МРТ) сердца с отсроченным контрастированием является наиболее точным методом для верификации и определения объема постинфарктного кардиосклероза (ПИКС) [3, 4]. Крупные исследования (CE-MARC) и многочисленные работы доказали, что МРТ c фармакологическим стресс-тестом обладает высокой чувствительностью и специфичностью в выявлении дефектов перфузии миокарда [5, 6], с этой целью используется фармакологическая проба с аденозином.
В научной литературе отсутствуют рандомизированные клинические исследования относительно применения МРТ с аденозиновым стресс-тестом для определения нарушений перфузии в зоне ПИКС до и после реканализации ХОКА, что определяет необходимость данной работы.
Цель исследования: оценить перфузию рубцовой ткани в заинтересованном бассейне кровоснабжения до и после ЧКВ при наличии хронической окклюзии правой коронарной артерии (ХО ПКА) по данным МРТ с отсроченным контрастированием и фармакологическим стресс-тестом.
Материал и методы
За период с октября 2010 г. по апрель 2014 г. на базе центра эндоваскулярной хирургии и лучевой диагностики ФГБУ «ННИИПК им. акад. Е.Н. Мешалкина» Минздрава России обследовали 72 пациента с наличием ХО ПКА, которым выполняли чрескожную транслюминальную коронарную ангиопластику (ЧТКА) со стентированием. Критерии включения: стабильная стенокардия напряжения I–IV функционального класса (ФК), правый тип кровоснабжения сердца по данным селективной коронарографии, отсутствие хирургически значимого атеросклеротического поражения других коронарных артерий (стенозы менее 65%). Допускалось наличие ранее стентированных артерий без признаков значимого рестеноза и высокого риска ишемии миокарда по данным МРТ с аденозиновым стресс-тестом.
Среди обследованных больных были выделены две группы пациентов. В первую группу вошли 39 пациентов, которым была выполнена успешная ЧКВ ХО ПКА. Во вторую группу включены 33 пациента, не подвергающиеся оперативному лечению, находящиеся исключительно на консервативной терапии. Пациенты в обеих группах сопоставимы по демографическим показателям и исходной тяжести состояния.
Всех пациентов обследовали на магнитнорезонансном томографе Initial Achieva 1,5 Т, Philips (Голландия).
Стандартный протокол исследования предусматривал сканирование в области сердца в аксиальной плоскости в режимах с черной (TSE_BBsense) и белой (M2D_B_TFE) кровью толщиной среза 8 мм, интервалом 0,8 мм. При этом позиционирование срезов проводили в стандартной последовательности. Морфологию левого желудочка (ЛЖ), в частности его форму, толщину стенок и показатели сократимости, оценивали в кинорежиме B_TFE в двух-, трех- и четырехкамерных плоскостях, а также по короткой оси сердца, при необходимости выполняли дополнительный срез через выходной тракт ЛЖ. Наличие отека миокарда ЛЖ диагностировали в плоскости по короткой оси на Т2_BB_ SPIR.
Для выявления и оценки распространенности рубцовых изменений миокарда ЛЖ анализировали отсроченное накопление контрастного вещества в плоскости по короткой оси, в двух- и четырехкамерной плоскостях в режиме Т1_TFE_SPIR и 3DT1_TFEPSIR. Время задержки сатурационного импульса TFE Prepulse для подавления сигнала от миокарда выбирали на серии предварительного просмотра в режиме LookLoсker или IR_TFE_LL.
Для детальной оценки сократимости и массы миокарда ЛЖ просматривали серию срезов в коронарной плоскости с использованием программ Philips MR Cardiac Explorer или Philips MR Cardiac Analysis. Перфузию миокарда исследовали на трех уровнях в плоскости по короткой оси сердца, проходящей через середину расстояния между кольцом митрального клапана и серединой ЛЖ, через середину ЛЖ, а также на середине расстояния между верхушкой и серединой ЛЖ.
Для проведения стресс-перфузии миокарда использовали стандартный протокол [7]. Миокардиальную перфузию ЛЖ оценивали с использованием 17-сегмен-тной схемы (АНА, 2002). Согласно европейским рекомендациям по стабильной стенокардии напряжения, клинически значимой ишемией миокарда для стресс-МРТ являлся дефект перфузии в двух и более сегментах [8], что соответствует 10% и более объема миокарда [9]. Сумму стресс-индуцированных сегментов учитывали в соответствии с кровоснабжением бассейна правой коронарной артерии. Три врача отделения лучевой и функциональной диагностики оценивали дефекты перфузии независимо друг от друга.
Для верификации наличия ХОКА, а также определения коллатералей и морфологии окклюзированного сосуда всем больным проводили диагностическую коронарографию по стандартной методике M.P. Judkins на моноплановой ангиографической установке «Aдван-ткс LCV» или биплановой ангиографической установке «Aдванткс LC/LP» (Дженерал электрик, США).
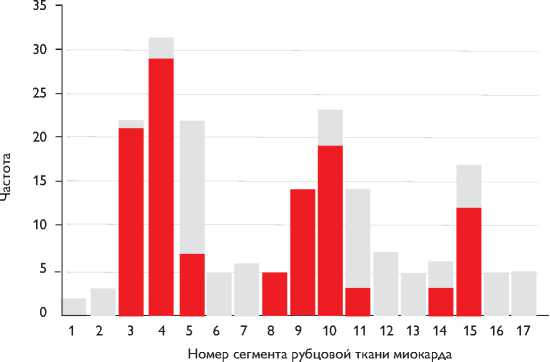
■ Стресс-дефект перфузии
Рис. 1. Исходное распределение рубцовой ткани и стресс-дефектов перфузии миокарда по сегментам в первой группе
Все пациенты получали антиангинальную терапию: нитраты, бета-блокаторы или антагонисты кальция в индивидуальных дозировках. При наличии показаний (артериальная гипертензия (АГ), выраженная сердечная недостаточность, гиперхолестеринемия) назначались также диуретики, ингибиторы ангиотензин-превращающего фермента и статины. Кроме того, все пациенты длительно принимали препараты ацетилсалициловой кислоты в индивидуальных дозировках.
Для статистической обработки данных использовали методы описательной статистики, параметрические и непараметрические статистические методы. Для обзора серийных измерений применяли регрессионный анализ повторных измерений. Для межгруппового анализа качественных признаков применяли критерий хи-квадрат Пирсона либо точный тест Фишера. Количественные признаки сравнивали с применением теста Манна – Уитни. Для внутригруппового анализа количественных и качественных признаков
■ Стресс-дефект перфузии
ll. -ll -I
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17
Номер сегмента рубцовой ткани миокарда
Рис. 2. Распределение рубцовой ткани миокарда и стресс-дефектов перфузии по сегментам в первой группе через 2 мес. после стентирования правой коронарной артерии на этапах исследования применяли тесты Фридмана и МакНемара соответственно. Количественные характеристики представлены как медиана (25-й; 75-й процентили), если не указано иное. Качественные признаки представлены как число (%). Статистический анализ выполнен с применением программного обеспечения R Core Team (2013). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL:
Результаты и обсуждение
Согласно данным стандартного обследования, ПИКС был зафиксирован у 24 (64,9%) в первой и 22 (68,8%) пациентов во второй группах, достоверных межгрупповых различий не обнаружено (р = 0,81). В то же время, по данным МРТ, наличие рубцовой ткани хотя бы в одном сегменте миока б рда зафиксировали у 35 (89,7%) в первой и 27 (81,8%) пациентов во второй группах (р = 0,49). Исходно 14 (19,4%) пациентов в двух группах имели рубцовую ткань в области 4 сегментов. Локализация рубца в пределах трех и двух сегментов отмечалась в 9 (12,5%) случаях. Всего у 72 пациентов зафиксировано 285 сегментов рубцовой ткани миокарда, из них 200 (70,2%) сегментов имели дефект перфузии.
В первой группе рубцовая ткань охватывала область четырех сегментов в 6 (15,4%) случаях, у 5 пациентов в каждом случае рубец занимал 6, 7, и 8 (12,6%) сегментов. Во второй группе также наиболее часто – в 8 (21,1%) случаях – встречалась локализация рубцовой ткани в области 4 сегментов. Распространение рубца на область 3 и 2 сегментов миокарда было отмечено в 7 (21,9%) и 5 (15,6%) случаях соответственно. Достоверных межгрупповых различий количества сегментов рубцовой такни миокарда не обнаружено (р = 0,51).
В двух группах наиболее часто рубцовая ткань располагалась в области четвертого – в 54 (75,0%) случаях, десятого – в 42 (58,3%), третьего – в 35 (48,6%) и пятнадцатого сегмента – в 23 (31,9%) случаях . Стресс-дефект перфузии этих сегментов зарегистрирован в 51 (70,8%), 38 (52,8%), 35 (100,0%) и 18 (25,0%) случаях соответственно.
В первой и второй группах преобладающей локализацией рубцовой ткани являлись четвертый (29 (74,4%) и 25 (73,5%) случаев), десятый (23 (58,9%) и 19 (55,9%) случаев), третий (22 (56,4%) и 14 (41,2%) случаев) и пятнадцатый (17 (43,6%) и 6 (17,4%) случаев)
Стресс
Покой
Отсроченное контрастирование
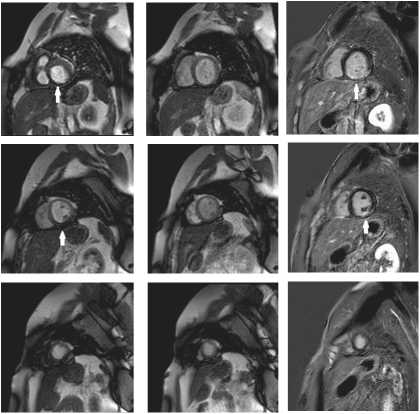
б
Рис. 3. МРТ сердца со стресс-тестом (а) и отсроченным контрастированием миокарда (б) до ЧКВ сегменты соответственно. Дефект перфузии отмечался в 21 (53,8%), 19 (48,7%), 21 (53,8%) и 12 (30,8%) случаях в первой группе и в 24 (70,6%), 19 (100,0%), 13 (100,0%) и 6 (100,0%) случаях во второй группе. Статистически достоверных межгрупповых различий в исходном характере распределения сегментов рубцовой ткани, демонстрирующих стресс-дефект перфузии, не обнаружено (р = 0,67).
При контрольной МРТ через 2 мес. в первой группе отмечено достоверное снижение среднего количества сегментов рубцовой ткани, демонстрирующих стресс-дефект перфузии, с 2,84 (1,64) до 2,00 (1,61), средняя разница составила –0,84 сегмента, 95% ДИ для разницы –1,23… –0,46, р<0,01. Динамика количества сегментов со стресс-дефектом перфузии в первой группе представлена на рис. 1 и 2. Во второй группе при контрольной МРТ через 2 мес. после рандомизации среднее (стандартное отклонение) количество сегментов с дефектом перфузии осталось неизменным и составило 2,36 (1,61); р = 0,91.
При межгрупповом сравнении количества сегментов, демонстрирующих стресс-дефект перфузии при контрольной МРТ через 2 мес. после рандомизации, статистически достоверных различий не обнаруже-
Стресс
Покой
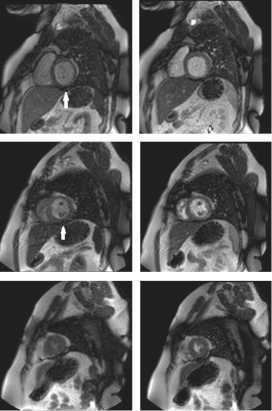
Рис. 4. МРТ сердца со стресс-тестом ( а ) и отсроченным контрастированием миокарда ( б ) после ЧКВ
Отсроченное контрастирование
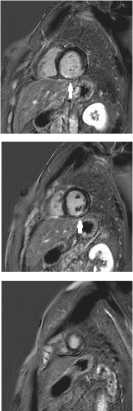
б
но. Среднее (стандартное отклонение) составило 2,00 (1,57) в первой и 2,33 (1,63) во второй группах. Средняя разница (первая – вторая группа) составила –0,33 сегмента, 95% ДИ для разницы –0,41… 1,08, р = 0,37. Этот факт объясняется тем, что среднее количество сегментов рубцовой ткани с дефектом перфузии исходно было выше в первой группе (2,84, (1,64)), чем во второй группе (2,36 (1,61)), хотя достоверных различий не было (р = 0,51).
Таким образом, ЧКВ при ХО ПКА улучшает перфузию миокарда в сегментах с рубцовыми изменениями, по данным МРТ с фармакологическим стресс-тестом (рис. 3 и 4). Заключение коррелирует с результатами исследований в молекулярной и клеточной биологии. Доказано, что постинфарктный рубец состоит из фенотипически трансформированных фибробластоподобных клеток, называемых миофибробластами [10, 11]. Эти клетки питаются посредством неососудов и находятся в постинфарктной зоне. Постинфарктный рубец – метаболически активная ткань, васкуляризированная и способная сокращаться [12, 13]. Развитие обратимой миокардиальной дисфункции называется «гибернирующим миокардом» [14]. Гибернация миокарда – защитный механизм, с помощью которого возможно частично восстановить сократительную функцию в области повреждения [15]. Опыты на крысах показали, что при микроскопическом исследовании сердца в определенных случаях наблюдаются небольшие островки живого миокарда в зоне ПИКС. Эти участки способствуют сохранению формы и объема левого желудочка [16]. Таким образом, возможно предположить, что ЧКВ при ХО ПКА способно уменьшить постинфарктное ремоделирование сердца и прогрессирование сердечной недостаточности.
Выводы
Согласно результатам исследования, эндоваскулярная реканализация ХО ПКА у больных постинфарктным кардиосклерозом улучшает перфузию в зоне ПИКС. Метод МРТ с аденозиновым стресс-тестом целесообразно использовать для диагностики регресса ишемии в зоне ПИКС после успешной реканализации коронарных артерий.
Список литературы Динамика перфузии миокарда в рубцовой ткани по данным стресс-МРТ у пациентов, подвергаемых эндоваскулярной реканализации хронической окклюзии правой коронарной артерии
- De Wood M.A., Spores J., Notske R. et al.//N. Engl. J. Med. 1980. Vol. 303. P. 897-902.
- Olivari Z., Rubartelli P., Piscione F. et al.//J. Am. Coll. Cardiol. 2003. Vol. 41. P. 1672-1678.
- Осиев А.Г., Кретов Е.М., Найденов Р.А. и др.//Патология кровообращения и кардиохирургия 2013. № 3. С. 46-49.
- Kim R.J., Fieno D.S., Parrish T.B. et al.//Circulation. 1999. Vol. 100. P. 1992-2002.
- Greenwood J.P., Maredia N., Younger J.F. et al.//Lancet. 2012. Vol. 379. P. 453-456.
- Nandalur K.R., Dwamena B.A., Choudhri A.F. et al.//J. Am. Coll. Cardiol. 2007. Vol. 50. P. 1343-1353.
- Курбатов В.П., Гензель Н.Р., Обединский А.А. и др.//Радиология практика. 2012. № 4. С. 27-34.
- Montalescot G., Sechtem U., Achenbach S. et al.//Eur. Heart J. 2013. Vol. 34. P. 2949-3003.
- Davies R.F., Goldberg A.D., Forman S. et al.//Circulation. 1997. V. 95. P. 2037-2043.
- Sun Y., Weber K.T.//J. Mol. Cell Cardiol. 1996. Vol. 28. P. 851-858.
- Vracko R., Thorning D.//LabInvest. 1991. Vol. 65. P. 214-227.
- De Mey J.G.R., Fazzi G.E.//Hypertension. 1996. Vol. 28. P. 696.
- Gabbiani G., Hirschel B.J., Ryan G.B., et al.//J. Exp. Med. Vol. 67. P. 719-734.
- Camici P.G., Prasad S.K., Rimoldi O.E. et al.//Circulation. 2008. Vol. 117. P. 103-114.
- Ross J.Jr.//Circulation. 1991. Vol. 83. P. 1076-1083.
- lhaddad I.A., Kloner R.A., Hakim I. et al.//Am. Heart. J. 1996. Vol. 131. № 3. P. 451-457.


