Динамика показателей липидного метаболизма у больных ишемической болезнью сердца после коронарного шунтирования (предварительное сообщение)
Автор: Аверко Н.Н., Тузиков Ф.В., Чернявский А.М., Тузикова Н.А., Волченко И.Л., Кузнецова Т.В., Синцова О.А., Галимов Р.В.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Ишемическая болезнь сердца
Статья в выпуске: 4 т.11, 2007 года.
Бесплатный доступ
Проведен анализ результатов клинико-инструментального обследования пациентов с ишемической болезнью сердца (ИБС) до и после операции коронарного шунтирования (КШ) с использованием показателей липидного спектра крови, определенных методом малоуглового рентгеновского рассеяния (МУРР). Получены результаты, свидетельствующие о перспективности использования метода МУРР для решения как теоретических, так и практических задач прогностического и лечебного плана у больных ИБС. В частности, получаемые при исследовании сывороточных липопротеинов (ЛП) крови у больных ИБС новые данные об их фракционном и субфракционном составе могут быть важны при определении риска хирургического вмешательства и послеоперационных осложнений, а также при формировании дифференцированного подхода к программам реабилитации и определения научно обоснованных сроков назначения гиполипидемической терапии после операции КШ.
Короткий адрес: https://sciup.org/142233389
IDR: 142233389
Текст научной статьи Динамика показателей липидного метаболизма у больных ишемической болезнью сердца после коронарного шунтирования (предварительное сообщение)
Н.Н. Аверко*, Ф.В. Тузиков**, А.М. Чернявский*, Н.А. Тузикова**, И.Л. Волченко*, ТВ. Кузнецова*, О.А. Синцова*, Р.В. Галимов**
* ФГУ «Новосибирский НИИ патологии кровообращения им. акад. Е.Н. Мешалкина Росмедтехнологий» ** Институт катализа им. Г.К. Борескова СО РАН, Новосибирск
Проведен анализ результатов клинико-инструментального обследования пациентов с ишемической болезнью сердца (ИБС) до и после операции коронарного шунтирования (КШ) с использованием показателей липидного спектра крови, определенных методом малоуглового рентгеновского рассеяния (МУРР). Получены результаты, свидетельствующие о перспективности использования метода МУРР для решения как теоретических, так и практических задач прогностического и лечебного плана у больных ИБС. В частности, получаемые при исследовании сывороточных липопротеинов (ЛП) крови у больных ИБС новые данные об их фракционном и субфракционном составе могут быть важны при определении риска хирургического вмешательства и послеоперационных осложнений, а также при формировании дифференцированного подхода к программам реабилитации и определения научно обоснованных сроков назначения гиполипидемической терапии после операции КШ.
Коронарное шунтирование в настоящее время является общепризнанным эффективным методом лечения ИБС, широко вошедшим в клиническую практику [2-4, 12, 13]. Однако методы хирургической реваскуляризации миокарда у пациентов с ИБС не останавливают дальнейшего течения системного атеросклероза (АС), поэтому КШ считается лишь одним из этапов лечения ИБС [2]. Кроме того, послеоперационные осложнения раннего и позднего периодов требуют специального восстановительного лечения. В связи с этим актуальной проблемой становится выявление молекулярных маркеров [8-9], позволяющих прогнозировать характер дальнейшего течения АС, риск коронарных рестенозов и сердечно-сосудистых осложнений, возникающих после КШ.
Экспериментальными и клиническими исследованиями установлена выраженная связь между высоким уровнем холестерина (ХС), особенно ХС сывороточных липопротеинов (ЛП) низкой плотности (НП) и развитием АС. Фракции ЛП крови представляют собой гетерогенный класс биологических наноструктур (сложных белков), внутри которого обнаружены субпопуляции (субфракции) частиц различных по физико-химическим свойствам и биологическим функциям [1-3, 7-11,13-15]. В связи с этим исследование ЛП крови имеет важное значение для понимания патогенетических механизмов АС и может быть использовано в практике кардиохирургической клиники при прогнозировании послеоперационных осложнений и коронарных рестенозов у оперированных больных [2].
Цель данной работы - изучение изменений субфракционного состава сывороточных ЛП крови у больных ИБС после операции коронарного шунтирования.
МАТЕРИАЛ И МЕТОДЫ
Хирургическое лечение выполнялось у 18 больных ИБС с использованием аппарата искусственного кровообращения (ИК). До операции всем больным проводилась селективная коронарография на ангиографической установке «Advantex LS/LP Jeneral Electric» (США) по методике Judkins (1967) трансфеморальном доступом с селективным контрастированием коронарных артерий по Сельдингеру [1,7]. Обследование проводилось непосредственно перед операцией КШ и на 11-16 сутки после операции.
Стенокардия напряжения ФК 2-3 по ССS (1976) была выявлена у всех 18 больных, ранняя постинфарктная стенокардия у 2 (11,1%) больных, инфаркт миокарда (Q+) до КШ перенесли 10 (55,6%) больных. Преобладало трехсосудистое поражение коронарного русла у 11 пациентов (61,1%), а у 12 (66,7%) больных была диагностирована сочетанная артериальная гипертония (АГ) IV степени риска (ВОЗ/МОАГ, 1999). Осложненное течение послеоперационного периода было отмечено у 5 (27,8%) больных: нарушения ритма у 4 человек, острое нарушение коронарного кровообращения с аритмией у 1 пациента. Мультифокальное (МФК) атеросклеротическое поражение сосудистого русла наблюдалось у 11 (61,1%) пациентов, у остальных 7 больных был изолированный коронарный АС.
Из факторов риска АС на первом месте по частоте были выявлены нарушения липидного обмена, на втором АГ, затем отягощенная наследственность по сердечно-сосудистым заболеваниям, нарушения толерантности к углеводам, ожирение, сахарный диабет. Один фактор риска выявлен у одного пациента, два и более факторов - у 15 (83,3%) больных.
Кровь для анализа у больных ИБС брали утром натощак из локтевой вены (2 мл) не ранее чем через 12-14 ч после последнего приема пищи. Сыворотку крови готовили по стандартным методикам [1, 7]. Определение концентраций общего ХС, ХС-ЛПВП и общих ТГ сыворотки крови до и после проведения КШ проводили на биохимическом анализаторе «Konelab». Для контроля точности анализа сывороточных ЛП использовали стандартные образцы сывороток крови фирмы «Вектор-Бест» (Россия) с известными значениями концентраций общего ХС, общих ТГ и ХС-ЛПВП.
Определение фракционно-компонентного состава сывороточных липопротеинов крови проводили методом малоуглового рентгеновского рассеяния [6]. Измерения рентгенограмм МУРР от анализируемых образцов проводились на малоугловом рентгеновском дифрактометре совместного прозводства фирм «Siemens» (Германия), «Anton Paar» и «Hecus-Braun» (Австрия) с малоугловой камерой Кратки с возможностью термостабилизации образцов от 0 до 70 °С с точностью до ±0,1 °С. Длина волны используемого излучения
%
= 1,54 А (CuK
a
), температура образцов при измерении рентгенограмм 20 °С. Рентгенограммы МУРР измеряли в угловом диапазоне: 0,013
- угол рассеяния. В рентгенограммы МУРР вносили поправки на фоновое рассеяние, поглощение, проводили сглаживание. Вычисление концентраций компонентов сывороточных ЛП крови, по данным МУРР, выполняли с использованием алгоритмов и вычислительных программ [8-10, 15].
Полученные результаты обрабатывались методом вариационной статистики с применением t-критерия Стьюдента для средних арифметических (р<0,05).
РЕЗУЛЬТАТЫ
В табл. 1 приведены сравнительные результаты определения концентраций основных липидов ЛП в крови больных (до операции) биохимическим методом (БХ) и методом малоуглового рентгеновского рассеяния (МУРР) и коэффициенты корреляции (КК) этих же параметров.
Из табл. 1 видно, что в пределах доверительных интервалов средние значения концентраций общего ХС, ХС-ЛПВП и общих ТГ, определенных традиционным БХ методом и новым методом МУРР, достоверно не различаются. На это же указывают достаточно высокие (0,8) значения КК между массивами параметров ЛП исследуемой выборки пациентов, что согласуется с данными предыдущих исследований [810, 15].
Основываясь на клинических данных, мы сформировали следующие группы больных: первая (I) в зависимости от тяжести течения послеоперационного периода разделенная на подгруппы неосложненного (I-a) и осложненного (I-b) течения; вторая (II), по тяжести исходного состояния с разделением на подгруппы II-a (без перенесенного инфаркта миокарда (ИМ)) и II-b (с ИМ в анамнезе); третья (III), по вовлеченности в атеросклеротический процесс различных бассейнов кровообращения с выделением группы изолированного поражения коронарно-
Таблица 1
Усредненные значения концентраций (С) и коэффициенты корреляции (КК) сывороточных липидов ЛП в крови пациентов (n=16) по данным БХ и МУРР (кровь из вены до операции, мг/дл)
|
Параметры |
Общий ХС |
Общие ТГ |
ХС-ЛПВП |
|||
|
Метод |
БХ |
МУРР |
БХ |
МУРР |
БХ |
МУРР |
|
С, мг/дл |
214,0±24,9 |
192,3±26,5 |
133,7±27,5 |
179,7±34,7 |
42,2±4,8 |
40,9±4,8 |
|
КК |
0,8 |
0,8 |
0,75 |
|||
го бассейна (III-a) и группы с мультифокальным AC (III-b).
В табл. 2 приведены полученные методом МУРР значения концентраций фракций и субфракций сывороточных ЛП крови у больных ИБС. Видно, что после операции КШ происходит снижение большей части атерогенных показателей спектра ЛП, наиболее выраженное во фракции ЛПОНП.
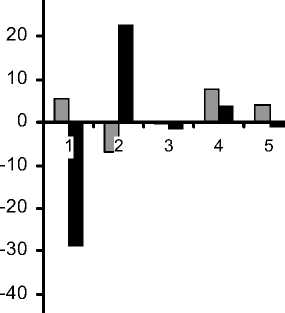
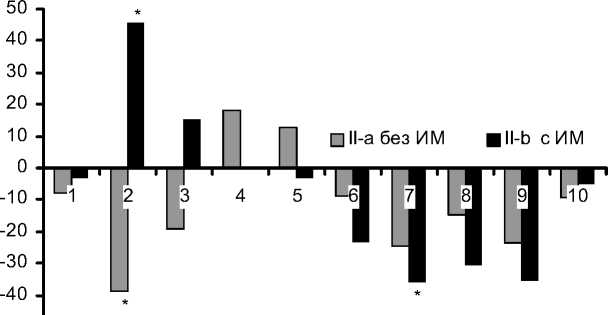
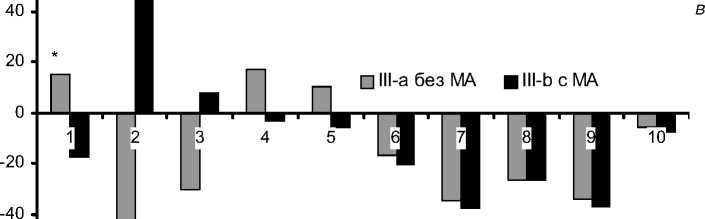
Анализ липидного спектра сывороточных ЛП крови в зависимости от тяжести течения послеоперационного периода и исходного состояния показал как их общие черты, так и различия (рис.). Во всех клинических группах выявлено наличие достоверных изменений в концентрациях ЛП и в наибольшей степени -во фракциях ЛП высокой плотности (ЛПВП), очень низкой плотности (ЛПОНП) и их субфракциях ЛПВП3, ЛПВП2, ЛПОНП1-2, ЛПОНП3-5. В субфракции ЛППП снижение концентрационного показателя во всех группах было недостоверно, выражено в меньшей степени, и еще меньше изменений было во фракции ЛПНП, где показатели субфракции ЛПНП1-3 при более легких вариантах течения послеоперационного периода (I-a, II-a, III-a) даже возросли.
Снижение концентраций атерогенных субфракций ЛПОНП3-5, ЛПОНП1-2, ЛПОНП, ЛППП, ЛПНП1-3 и ЛПНП после операции КШ преобладало в более тяжелых клинических подгруппах - осложненного раннего послеоперацион-
Таблица 2
Концентрации общего холестерина, фракций и субфракций сывороточных ЛП (по ХС) в венозной крови у больных ИБС (n=16) до и после операции КШ
Концентрация антиатерогенной фракции ЛПВП и ее субфракций ЛПВП 3 , ЛПВП 2 имела иную динамику после операции. Так, например, концентрация субфракции ЛПВП 3 снизилась во всех подгруппах более тяжелого течения (I-b, II-b, III-b), в то же время в подгруппах с более легким течением послеоперационного периода (I-a, II-a, III-a) концентрация ЛПВП3 увеличилась (рис.).
Концентрации субфракции ЛПВП 2 во всех группах при тяжелых вариантах течения (I-b, II-b, III-b) достоверно возросла на 22,7%, 45,5% и 44,0%, соответственно, в то время как при более легких вариантах течения послеоперационного периода (I-a, II-a, III-a) было отмечено ее достоверное снижение (рис.).
ОБСУЖДЕНИЕ
Известно, что при кардиохирургических вмешательствах в ответ на агрессивное воздействие операционного стресса и периоперационного периода обычно развивается адаптивная генерализованная перестройка метаболизма, затрагивающая, согласно полученным результатам, и обмен липидов [2-4].
Снижение уровня ХС и ТГ в крови после хирургического вмешательства некоторыми авторами расценивается как прогностический критерий тяжести течения послеоперационного периода, отражающий процессы адаптации организма, вследствие повреждающего действия факторов хирургической агрессии и ИК [12, 13]. Анализ липидного спектра ЛП, полученных методом МУРР, в отличие от существующих работ [2-4, 11-14], впервые показал, что хирургическое вмешательство реваскуляризации миокарда (КШ) вносит существенные изменения в субфракционный состав сывороточных ЛП крови больных ИБС.
Сегодня наиболее изучены функции ЛПВП, ЛПНП и ЛПОНП и их субфракции. Так, например, антиатерогенная субфракция ЛПВП3 участвует в образовании иммунных комплексов IgG, IgM [5] и поэтому тенденция к снижению концентраций этой субфракций после операции КШ, выраженное при тяжелых вариантах ИБС (I-b, II-b, III-b), может отражать иммунодепрес-
□ l-a без осложн. el-b с осложн.

а
б
-60 ■
Отклонение от значений (%) исходных показателей липидного спектра сывороточных ЛП (по ХС) после операции КШ у больных ИБС при неосложненном и осложненном течении:
а - I группа; б - II группа; в - III группа.
1 - ЛПВП3; 2 - ЛПВП2; 3 - ЛПВП; 4 - ЛПНП1-3; 5 - ЛПНП; 6 - ЛППП; 7 - ЛПОНП3-5; 8 - ЛПОНП1-2; 9 - ЛПОНП; 10 - ХС.
* p<0,05 различия достоверны сию, вызванную операционной травмой и ИК, отмечаемую при исследовании иммуновоспали-тельного ответа после операций на открытом сердце [4]. Известно также, что белок апо-А1 из субфракции ЛПВП3 идет на регенерацию тканей организма, поэтому снижение концентрации ЛПВП3 может свидетельствовать не только об ослаблении противоинфекционной защиты после операции, но и о снижении возможностей организма по регенерации тканей (заживление послеоперационной раны) [5]. Субфракция ЛПВП2 отвечает за вывод (катаболизм) отработанных липидов из клеток всех тканей, поэтому повышение ее концентрации после операции при тяжелых вариантах (I-b, II-b, IIIb) может свидетельствовать об адаптационной трансформации липидного метаболизма в связи с хирургической травмой и ИК. Другая субфракция - ЛПНП1-3 с выраженными атерогенными свойствами является акцептором эфиров холесте- рина [11], поэтому после операции КШ она играет, скорее, защитную, чем проатерогенную роль. Может быть, поэтому в проведенном исследовании во всех группах больных ИБС снижение ЛПНП1-3 было минимальным, недостоверным и наблюдалось только в тяжелых вариантах заболеваний (I-b, II-b, III-b). Также известно, что субстратами для ЛПВП и ЛПНП1-3 являются ЛППП и ЛПОНП1-2 [11, 14]. Именно в связи с этим, по-видимому, концентрации фракции ЛПОНП и субфракций ЛППП, ЛпОнП1-2 и ЛПОНП3-5 после операции КШ достоверно снижались практически во всех исследуемых группах больных ИБС.
Очевидно, что в сложных молекулярных механизмах изменения субфракционного спектра ЛП после операций КШ у больных с ишемической болезнью сердца многое еще остается не ясным. Поэтому процессы нарушения липидного метаболизма после операции КШ и его восстановления в процессе реабилитации, происходящие в субфракциях ЛП, требуют дальнейшей клинической оценки и продолжения исследования с определением субфракционного состава ЛП крови.
Полученные результаты свидетельствуют о перспективности данного направления исследований для решения целого ряда как теоретических, так и практических задач прогностического и лечебного плана у этой тяжелой категории больных. В частности, этот подход может быть важен при определении риска хирургического вмешательства и послеоперационных осложнений, при формировании дифференцированных программ реабилитации и определении научно обоснованных сроков назначения гиполипиде-мической терапии после операции КШ.
ВЫВОДЫ
-
1. Уровень общего ХС, ХС-ЛПВП, общих ТГ, полученных традиционным биохимическим методом и методом малоуглового рентгеновского рассеяния у больных ИБС, достоверно не различаются, что свидетельствует о сопоставимости этих методов анализа сывороточных ЛП крови.
-
2. Впервые получены данные о субфракционном составе сывороточных ЛП венозной крови больных ИБС после операций КШ. Операции КШ сопровождаются тенденцией к снижению концентраций большинства фракций и субфракций ЛП и общих липидов крови, наиболее выраженное в ЛПОНП.
-
3. Концентрация субфракции ЛПВП2 в группах больных с осложненным течением послеопера
-
4. Концентрация субфракции ЛПВП3 достоверно снижается в группе больных с осложненным течением послеоперационного периода, а достоверно повышается только в группе с изолированным атеросклеротическим поражением коронарных артерий.
ционного периода, с перенесенным инфарктом миокарда и с мультифокальным атеросклерозом достоверно возрастает, а в группах больных без мультифокального атеросклероза и перенесенного инфаркта миокарда ЛПВП2 достоверно снижается.
Список литературы Динамика показателей липидного метаболизма у больных ишемической болезнью сердца после коронарного шунтирования (предварительное сообщение)
- Камышников В.С. Клинико-биохимическая лабораторная диагностика. Справочник. Минск: Интерпрессервис, 2003. Т. 1. 495 с.
- Карпов Р.С., Дудко В.А. Атеросклероз. Патогенез, клиника, функциональная диагностика, лечение. Томск: SST, 1999. 656 с.
- Климов А.Н., Никульчева Н.Г. Обмен липидов и липопротеидов и его нарушения. Руководство для врачей. М. Харьков. Минск: Питер, 1999. 505 с.
- Мухоедова Т.В. Кинетика иммуновоспалительного ответа после операций на открытом сердце: Автореф. дис. … д-ра мед. наук. Новосибирск, 2002. 290 с.
- Панин Л.Е., Клейменова Е.Ю., Русских Г.С. // Бюл. СО РАМН. 2005. № 4. С. 42-45.
- EDN: HRPNEN


