Динамика про- и эукариотического микробиома соломы при её разложении на поверхности почвы
Автор: Орлова О.В., Гладков Г.В., Зверев А.О., Шапкин В.М., Лисина Т.О., Курчак Н., Кичко А.А., Архипченко И.А., Андронов Е.Е.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Микробиология, метагеномика
Статья в выпуске: 1 т.60, 2025 года.
Бесплатный доступ
Технологии no-till приобретают все большее распространение, поскольку позволяют получать высокие урожаи с меньшими затратами, при этом снижая деградацию почв (G.A. Thomas с соавт., 2007). Одним из ключевых вопросов при no-till остается регулирование количества и качества мульчи. При no-till обязательно использование гербицидов и пестицидов, что увеличивает опасность накопления в мульче их остаточного количества. Для решения этих проблем может использоваться разработанный во Всероссийском НИИ сельскохозяйственной микробиологии биологически активный препарат БАГС, способный разлагать прометрин и обладающий высокой целлюлозолитической активностью. В настоящей работе впервые показано значительное изменение сукцессии и состава микробиомов соломы под влиянием БАГС, однако, несмотря на повышение активности микроорганизмов, за 68 сут существенного роста эффективности деструкции в варианте с биопрепаратом не обнаружено. Цель работы - изучить динамику про- и эукариотического микробиомов соломы в условиях, когда ее разложение происходит на поверхности почвы в присутствии препарата БАГС. Лабораторный опыт с компостированием соломы овса (Avena sativa L.) на поверхности почвы был поставлен в пластиковых контейнерах объемом 1 л. На поверхность почвы укладывали капроновую ткань, на которую помещали по 15 г измельченной соломы. Предварительно солому замачивали на 2 ч в растворе NH4NO3 из расчета 5 г N/кг соломы. Контролем служила солома без обработки препаратом БАГС. В опытном варианте во влажную солому вносили 10 % БАГС. В начале опыта и через 30 и 68 сут в соломе определяли численность грибов и бактерий методом ПЦР в реальном времени (ПЦР-РВ), содержание нитратов, водорастворимого углерода, зольность и дыхание, а также общую потерю массы. В те же сроки проводили анализ прокариотических и эукариотических микробных сообществ соломы при помощи глубокого секвенирования ампликонных библиотек гена 16S рРНК (прокариоты) и ITS (эукариоты). Солома овса быстро разлагалась - на 30-е сут потеря массы составила 31-35 %. Внесение БАГС увеличило выделение углекислоты на 30-е сут (569±36 против 394±67 мг СО2·м-2·ч-1 в контроле), на 68-е сут разница составляла 8 %. Высокая активность микроорганизмов привела к большему потреблению ими легкодоступных питательных веществ, что было видно по уменьшению количества водорастворимых органических соединений в 1,6-1,8 раза и нитратного азота в 1,8-1,4 раза относительно контроля. Вероятно, в условиях опыта недостаток минерального азота стал одним из факторов слабой эффективности БАГС как деструктора соломы по сравнению с контролем: на 68-е сут зольность оказалась выше на 11,6 %, а потеря массы соломы - на 5 %. Пересчет абсолютного числа копий гена 16S рPНК и ITS (ПЦР-РВ) в число клеток показал, что при деструкции соломы численность бактерий превышала численность грибов в 3,6-4,1 раза, однако, если учесть разницу в массе и объеме про- и эукариотических клеток, биомасса грибов может превышать бактериальную в сотни (до 500) раз. Анализ альфа-разнообразия для грибов выявил классическую картину сукцессии (низкий индекс Шеннона и меньшее число видов в начале опыта с последующим ростом биоразнообразия), что может служить косвенным подтверждением ведущей роли грибов в процессе деструкции соломы. Показано, что до 60 % представителей исходных прокариотического и эукариотического сообществ соломы не принимали значимого участия в ее разложении и замещались другими микроорганизмами. Наибольшие изменения состава микробиомов происходили в течение первых 30 сут, различия между показателями на 30-е и 68-е сут оказались невелики. Наряду с грибами при анализе эукариот (ITS) были выявлены и другие их представители, в частности растения, нематоды и протисты. Нематоды и протисты занимали заметное место в микробиоме - соответственно до 17,9 и 21,4 %. Биопрепарат БАГС оказал существенное влияние на эукариотическое сообщество на 30-е и 68-е сут: относительная представленность протистов возросла в 4-10 раз по сравнению с контролем, уменьшилась роль базидиомицетов. На 68-е сут соотношение аскомицетов и базидиомицетов составляло соответственно 1,49 и 4,30. Доля Coprinopsis radiata (навозник радиальный) уменьшилась на 30-е сут в 2 раза, а на 68-е сут - в 11 раз. Биопрепарат БАГС в условиях нашего эксперимента слабо повлиял на численность микроорганизмов и скорость деструкции соломы за 68 сут, однако под его воздействием существенно изменялась структура про- и эукариотических микробных сообществ и их сукцессия. Условия повышения эффективности применения БАГС, учитывая его потенциал по деградации пестицидов, предполагается более детально проанализировать в дальнейших экспериментах.
Мульча, багс, ген 16s ррнк, пцр в реальном времени, высокопроизводительное секвенирование, деструкция соломы овса, сукцессия микробных сообществ
Короткий адрес: https://sciup.org/142244140
IDR: 142244140 | УДК: 579.64:574.472:631.46 | DOI: 10.15389/agrobiology.2025.1.82rus
Текст научной статьи Динамика про- и эукариотического микробиома соломы при её разложении на поверхности почвы
В настоящее время особое внимание уделяется ресурсосберегающим почвозащитным технологиям обработки почвы (1-3). Нулевая (no-till) технология характеризуется формированием мульчирующего слоя и прямым посевом семян в необработанную почву, что снижает антропогенное воздействие на экосистемы. Это позволяет получать высокие урожаи, способствует восстановлению деградированных почв и сокращает энергетические, трудовые и финансовые затраты.
Преимущества no-till связаны в первую очередь с созданием и сохранением мульчирующего слоя (не менее 3-5 см) из растительных остатков предшествующих культур, что благоприятствует накоплению и сохранению большего количества влаги в корнеобитаемом слое почвы (1, 4, 5), снижению водной и ветровой эрозии (1, 5, 6), повышению биологической активности почв и росту содержания в них органического вещества (5, 6). Среди недостатков no-till отмечают увеличение засоренности посевов (1, 7, 8), повышенное поражение растений болезнями и вредителями (1, 3, 7, 8), снижение всхожести как следствие влияния фенолкарбоновых кислот и алле-лохимикатов, которые выделяются из соломы при ее разложении (3, 7), дифференциацию пахотного слоя по степени плодородия (3, 6, 9). Наиболее сильно эти недостатки проявляются при большом количестве послеуборочных остатков и в годы перехода на новые технологии. Следовательно, как достоинства, так и многие из недостатков приемов no-till связаны с количеством неразложившейся мульчи, что ставит задачу по регулированию ее деcтрукции.
Один из способов сделать это — применение биопрепаратов для ускорения трансформации послеуборочных растительных остатков (10-12). При no-till обработке обязательно использование гербицидов и пестицидов, что увеличивает опасность накопления их остаточного количества в мульче (3, 8, 13), поэтому биопрепараты должны быть устойчивы к этим ксенобиотикам или разлагать их. В качестве такого биологически активного препарата может рассматриваться БАГС, который способен разлагать прометрин (14) и при этом обладает высокой целлюлозолитической активностью. Препарат разработан во Всероссийском НИИ сельскохозяйственной микробиологии (15).
Процесс разложения соломы в почве и на ее поверхности существенно различается не только по физико-химическим условиям, но и по степени участия почвенных микроорганизмов. Большинство работ посвящены разложению пожнивных остатков, внесенных в почву, и их влиянию на ее плодородие. Поэтому представляет значительный интерес изучить микробиологические процессы при разложении мульчи и влияние на них биопрепарата.
В настоящей работе впервые представлены результаты лабораторного испытания биопрепарата БАГС в качестве ускорителя разложения мульчи (солома овса) и определена динамика структуры прокариотических и эукариотических микробных сообществ соломы с помощью глубокого секвенирования ампликонных библиотек для гена 16S рРНК и ITS. Показано значительное изменение сукцессии и состава микробиомов соломы под влиянием БАГС, однако, несмотря на повышение активности микроорга- низмов, за 68 сут существенного роста эффективности деструкции в варианте с биопрепаратом мы не обнаружили.
Цель работы — изучить динамику про- и эукариотического микробиомов соломы в условиях, когда ее разложение происходит на поверхности почвы в присутствии препарата БАГС.
Методика. Опыт по компостированию соломы овса ( Avena sativa L.) (зольность 7,83±0,06 %, С:N 42,7) на поверхности почвы (чернозем, С общ. — 4,48±0,06 %, N общ. — 0,394±0,002 %, рН вод. 6,31±0,01) проводили в пластиковых контейнерах объемом 1 л. На поверхность почвы укладывали капроновую ткань (для удобства определения потерь массы соломы), на которую помещали по 15 г измельченной соломы. Предварительно солому замачивали на 2 ч в растворе NH 4 NO 3 из расчета 5 г N/кг соломы. В опытном варианте вносили 10 % БАГС, контролем служила солома без обработки биопрепаратом (по 9 контейнеров на вариант). Влажность в сосудах поддерживали периодическим опрыскиванием с помощью пульверизатора.
В начале опыта (0 сут), через 30 и 68 сут определяли массу соломы, основные химические характеристики процессов ее разложения и проводили высокопроизводительное секвенирование ампликонных библиотек гена 16S рРНК (прокариоты) и ITS (эукариоты).
Ампликонные библиотеки получали с парами праймеров f515 5´-GTGCCAGCMGCCGCGGTAA-3´/r806 5´-GGACTACVSGGGTATCTAAT-3' для участков прокариотических генов 16S рРНК и ITS3 5' - GCATCG-ATGAAGAACGCAGC-3´/ITS4 5´-TCCTCCGCTTATTGATATGC-3´ для последовательностей эукариотических ITS при помощи ПЦР на приборе T100 Thermal Cycler («Bio-Rad Laboratories», США) согласно стандартному протоколу (16-18).
Нуклеотидные последовательности амплифицированных фрагментов (секвенатор Illumina MiSeq, «Illumina, Inc.», США) определяли согласно стандартному протоколу производителя. Анализ прочтений осуществляли на основе пакетов dada2 (v1.14.1) (19), phyloseq (v1.30.0) (20) в программной среде R (v.4.2.0). Основными этапами обработки были фильтрация по качеству, формирование вариантов ампликон-сиквенсов (amplicon sequence variants, ASVs), таксономическая аннотация, удаление химерных последовательностей. При таксономической аннотации в качестве референсных использовали базы SILVA (v.138.1) для последовательностей гена 16S рРНК (21) и UNITE для последовательностей ITS (22).
Различия между полученными микробиомами количественно оценивали на двух уровнях — альфа-разнообразия (внутри выборки) и бета-разнообразия (между выборками). Для расчета индексов альфа-разнообразия ампликонные библиотеки были нормализованы методом разрежения по минимальному размеру. Оценка альфа-разнообразия включала определение общего числа ASVs, индекса Шеннона и обратного индекса Симпсона. Визуализацию бета-разнообразия проводили методом неметрического многомерного шкалирования (non-metric multidimensional scaling, NMDS) по дистанции Брея-Кертиса. Для расчета индексов разнообразия и визуализации данных использовали пакеты vegan (2.6.8) , phyloseq (1.44.0) и tidyverse (2.0.0) (20, 23).
Число копий генов 16S рРНК и ITS на 1 г образца определяли методом ПЦР в реальном времени (ПЦР-РВ) с праймерами Eub338 5' -ACTCCTACGGGAGGCAGCAG-3 '/Eub518 5' -ATTACCGCGGCTGCTGG-3' для бактерий (24) и ITSlf 5' - TCCTAGGTGAACCTGCGG-3'/5.8s 5' -CGCTGCGTTCTTCATCG-3´ для грибов (25) на приборе QuantStudio5 («Thermo Fisher Scientific», США). Использовали реактивы PowerTrack SYBR Green Master Mix («Thermo Fisher Scientific», США) согласно рекомендациям производителя, а также матричную ДНК в 10-кратном разведении, объем реакционной смеси 10 мкл. Стандартами служили серии 10-кратных разведений фрагментов 16S рДНК Escherichia coli и Helicobacter pilori и ITS Saccharomyces cerevisiae. Амплификацию и количественные измерения проводили с использованием системы CFX96 Real-Time PCR Detection System («Bio-Rad», Германия) по протоколу 3 мин при 95 °C; 20 с при 95 °C, 20 с при 50 °C, 20 с при 72 °C (40 циклов). ПЦР-РВ выполняли в 3-кратной повторности. Для определения числа клеток прокариот и грибов в образцах абсолютное число копий гена 16S рPНК и ITS умножали на коэффициенты соответственно 0,20 и 0,05 (26).
Зольность и содержание общего азота в соломе определяли общепринятыми методами (27). Потерю массы соломы измеряли при взвешивании на аналитических весах Е42 («Gibertini Elettronica S.R.L.», Италия). Функциональную активность сообщества микроорганизмов оценивали по дыханию методом И.Н. Штатнова (28) в 5-кратной повторности и по содержанию нитратного азота и водорастворимого углерода (соотношение со-лома:вода 1:10) в 4-кратной повторности из среднего образца. Содержание органического углерода в водной вытяжке определяли сжиганием в хромовой смеси по Н.С. Паникову с соавт. (29) в сушильном шкафу с детекцией на спектрофотометре (Ultraspec, «LKB», Швеция) при λ = 340 нм. Содержание нитратного азота измеряли с салицилатом натрия на фотоколориметре КФК 2 (АО «ЗОМЗ», Россия).
Статистическую обработку результатов химических анализов осуществляли в программе Microsoft Excel. Рассчитывали средние значения (М) и стандартное отклонение (±SD) не менее чем для трех повторностей. Для оценки достоверности различий между микробиомами по альфа-разнообразию использовали дисперсионный анализ с тестом Тьюки в составе пакета rstatix (0.7.2) .
Результаты. Опыт по изучению динамики про- и эукариотического микробиомов соломы мы проводили с добавлением БАГС — препарата на основе природного консорциума микроорганизмов, формирующегося при компостировании торфо-соломисто-минеральной смеси и способного к минерализации трудноразлагаемых органических соединений как искусственного (пестициды), так и естественного (гуматы, лигноцеллюлозный комплекс) происхождения (14, 15).
1. Химические показатели соломы овса ( Avena sativa L.) при разложении на поверхности почвы в зависимости от присутствия БАГС ( М ±SD)
|
Показатель |
Контроль |
БАГС |
||||
|
0 сут |
30 сут |
68 сут |
0 сут |
30 сут |
68 сут |
|
|
Потери массы соломы, г/сосуд ( n = 4) |
0 |
4,98±0,76 |
6,81±0,37 |
0 |
4,66±0,05 |
6,83±0,05 |
|
Зольность, % ( n = 4) Дыхание, СО 2 • м - 2 • ч - 1 |
7,83±0,06 |
9,70±0,62 |
12,55±0,56 |
9,05±0,08 |
9,83±0,08 |
14,01±0,70 |
|
( n = 5) Углерод водорастворимый, |
Не определяли |
394±67 |
635±128 |
Не определяли |
569±36 |
686±38 |
|
С мг/100 г ( n = 4) Нитраты, N-NO 3 мг/100 г |
1180 ± 50 |
306±3 |
411±54 |
1202±44 |
188±8 |
227±10 |
|
( n = 4) |
25,0±3,2 |
70,9±0,0 |
50,1±8,9 |
28,4±4,4 |
37,0±7,0 |
35,9±4,0 |
Солома овса, содержащая значительное количество водораствори- мых органических веществ (1,18±0,05 г/100 г) и дополнительно обогащенная минеральным азотом, быстро разлагалась — на 30-е сут потеря массы составила 31-35 % (табл. 1). При внесении БАГС на 30-е сут увеличилось выделение углекислого газа (569±36 против 394±67 мг СО2 м-2 ч-1 в контроле), а на 68-е сут разница составляла 8 %. Высокая активность микроорганизмов привела к большему потреблению ими легкодоступных питательных веществ, что было видно по уменьшению количества водорастворимых органических соединений в 1,6-1,8 раза и нитратного азота в 1,8-1,4 раза относительно контроля. Вероятно, в условиях опыта недостаток минерального азота стал одним из факторов слабой эффективности БАГС как деструктора соломы по сравнению с контролем: на 68-е сут зольность оказалась выше на 11,6 %, потеря массы соломы — на 5 %.
Результаты ПЦР-РВ нередко используют для сравнения обилия про- и эукариот в образце (26). В нашем опыте через 30 сут их число увеличилось в среднем на 2 порядка от исходного (рис. 1) и сохранялось таким до 68-х сут. В начале эксперимента мы наблюдали увеличение численности прокариот и эукариот в варианте с биопрепаратом относительно контроля, что, вероятно, было связано с исходно высоким числом микроорганизмов в БАГС (15). Число бактерий в 1 г субстрата, рассчитанное на основании числа копий гена 16S рPНК, начиная с 30-х сут, оказалось в 3,64,1 раза выше, чем аналогичный показатель для грибов.
Известно, что у грибов и бактерий число копий гена 16S рPНК и ITS варьирует в широких пределах (26). Кроме того, клетки бактерий и грибов имеют разный объем (и, как следствие, биомассу) и неодинаковые метаболические возможности. Поэтому мы сопоставили данные ПЦР-РВ с показателями биомассы. Известно, что средний объем клетки эукариот и прокариот соотносится приблизительно как 2000:1, различие по массе клеток также близко к этому соотношению (30). Следовательно, хотя численность эукариот по данным ПЦР-РВ была меньше, биомасса могла превышать бактериальную 500-кратно. Это указывает на увеличение вклада грибов в разложение соломы, подтверждая мнение многих исследователей о большей биомассе и значительной роли этой таксономической группы в деструкции соломы (31, 32).
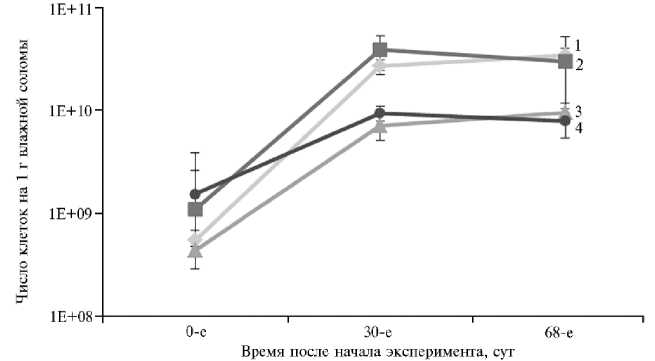
Рис. 1. Динамика микробиоты соломы овса ( Avena sativa L.) при разложении на поверхности почвы в зависимости от присутствия БАГС: 1 — бактерии (контроль), 2 — бактерии (БАГС), 3 — грибы (контроль), 4 — грибы (БАГС) ( n = 3, Ì ±SD). Показатели рассчитывали на основании данных ПЦР-РВ о числе копий гена 16S рPНК и ITS.
По результатам секвенирования для прокариот (по гену 16S рРНК)
было получено в общей сложности 1578759 прочтений, из 830049 которых прошли фильтры качества. В анализе использовали данные 24 образцов со средней глубиной секвенирования 23056 прочтений на образец, их средняя длина составила 253 п.н. Для эукариот (ITS) получили 1592145 прочтений, из которых 678809 прошли фильтры качества. Средняя глубина секвенирования ITS (тоже 24 образца) составила 19394 последовательности на образец, длина полученных прочтений варьировала от 160 до 450 п.н.
Для анализа альфа-разнообразия использовали метод разрежения числа последовательностей до минимальной глубины 11378 последовательностей на образец для прокариот и 7271 последовательность — для эукариот.
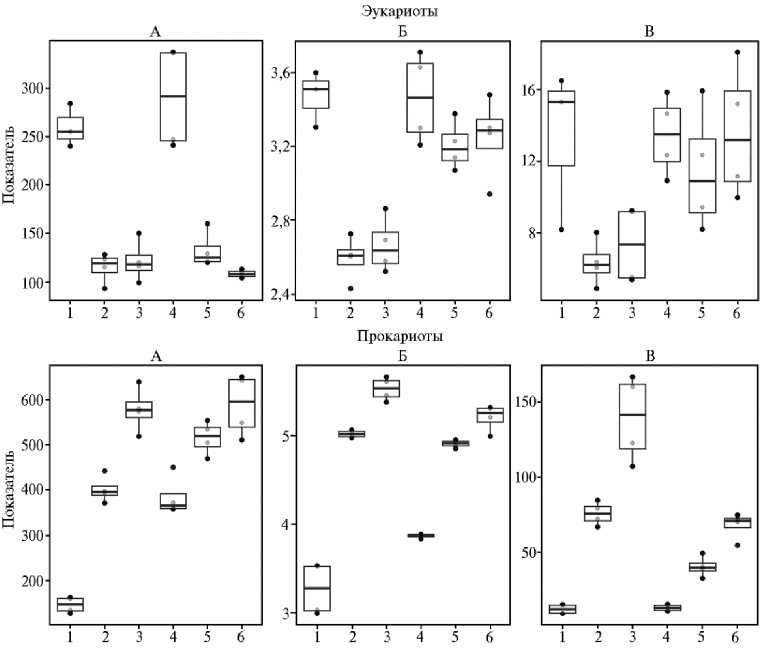
Рис. 2. Индексы альфа-разнообразия — число ASVs (amplicon sequence variants, А) , индекс Шеннона (Б) , обратный индекс Симпсона (В) для эукариот и прокариот в соломе овса ( Avena sativa L.) в контроле и при ее обработке БАГС: 1 — солома + N мин. (0-е сут), 2 — солома + N мин. (30-е сут), 3 — солома + N мин. (68-е сут) (контроль); 4 — солома + N мин. + БАГС (0-е сут), 5 — солома + N мин. + БАГС (30-е сут), 6 — солома + N мин. + БАГС (68-е сут) (опыт). Границы бокса с усами — первый и третий квартиль, приведены медианы, максимальные и минимальные значения по выборке (без выбросов).
Достоверность различий, выявленных методом дисперсионного анализа с попарным тестом Тьюки (p-value от 0,05 до 0,0001), показана на рисунке в дополнительных материалах (см. на сайте .
Наблюдаемая динамика видового обилия и биоразнообразия по индексу Шеннона для эукариот и прокариот была противоположной (рис. 2). К 30-м сут число ASVs у эукариот по сравнению с исходными значениями снижалось в контроле (спонтанная микрофлора) в 2 раза (со 171 до 78-88), при внесении БАГС — чуть меньше (со 171 до 101-96), далее оставаясь без изменений до конца опыта. Снижение биоразнообразия на ранней стадии разложения растительных остатков по этим показателям отмечали и другие исследователи (33-35). Напротив, число ASVs бактерий и их биоразнообразие по индексу Шеннона увеличивались к 30-м сут и продолжали нарастать к 68-м сут в обоих вариантах по сравнению с началом опыта. Подобные изменения характерны для более поздних стадий разложения соломы, когда преимущество получают олиготрофные микроорганизмы (33-35). Следовательно, результаты анализа альфа-разнообразия могут служить косвенным свидетельством того, что разложение соломы осуществляют преимущественно грибы, а бактерии развиваются на продуктах трансформации соломы. Поступление с БАГС дополнительного консорциума микроорганизмов увеличило число ASVs в исходной смеси.
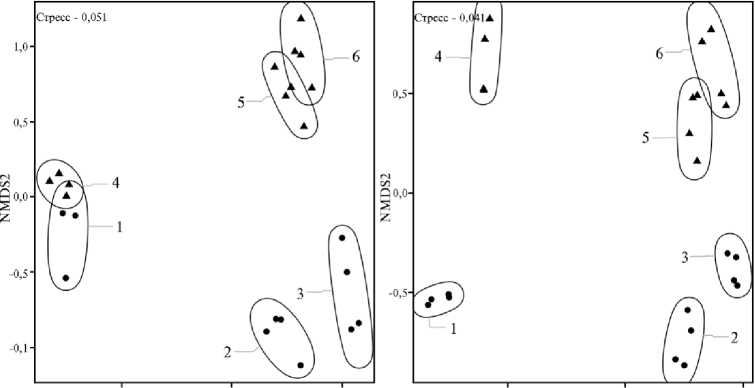
Анализ бета-разнообразия (рис. 3) показал, что при разложении соломы наибольшие изменения как эукариотических, так и бактериальных сообществ происходили в течение первых 30 сут как в опыте, так и в контроле. Отметим, что препарат БАГС при внесении сразу существенно повлиял на бактериальные сообщества.
Л Б
NMDS1 ° ' ' NMDS1
Рис. 3. Бета-разнообразие микробных сообществ эукариот (А) и прокариот (Б) в соломе овса ( Avena sativa L.) в контроле и при ее обработке БАГС: кружки — контроль, треугольники — обработка БАГС; 1 — солома + N мин. (0-е сут), 2 — солома + N мин. (30-е сут), 3 — солома + N мин. (68-е сут); 4 — солома + N мин. + БАГС (0-е сут), 5 — солома + N мин. + БАГС (30-е сут), 6 — солома + N мин. + БАГС (68-е сут); nonmetric multidimensional scaling (NMDS). Различия между любыми очерченными областями статистически значимы при р < 0,001.
2. Состав эукариотического микробиома (%) при разложении соломы овса ( Avena sativa L.) в контроле и при ее обработке БАГС
|
Царство |
Таксономическая группа |
Контроль |
БАГС |
||||
|
0 сут |
30 сут |
68 сут |
0 сут |
30 сут |
68 сут |
||
|
Грибы |
Отдел Ascomycota |
37,8 |
40,2 |
52,2 |
33,6 |
37,7 |
64,0 |
|
Отдел Basidiomycota |
58,3 |
40,1 |
35,1 |
62,7 |
23,0 |
14,9 |
|
|
Животные |
Тип Nematoda |
0 |
17,9 |
4,9 |
0 |
13,9 |
2,0 |
|
Растения |
Отдел Anthophyta |
3,8 |
0,3 |
0,4 |
3,4 |
0,3 |
0,8 |
|
Протисты |
Клада Ochrophytà |
0 |
0,9 |
3,9 |
0,1 |
21,4 |
13,1 |
Кроме грибов при таксономической аннотации эукариот были обнаружены другие их представители — растения, животные (нематоды) и протисты (одноклеточные, не входящие в три предыдущих царства) (табл. 2). Из растений в соломе, кроме овса, обнаружили кострец, осоку, мышиный горошек, клевер луговой. По мере разложения соломы доля растений 88
снижалась. К 30-м сут возрастала относительная представленность свобод-ноживущих нематод-бактериофагов рода Acrobeloides , обильно заселяющих почву и подстилку (36). Увеличение числа нематод при no-till отмечалось и в других сообщениях (37). Одним из факторов 3-7-кратного снижения доли нематод к 68-м сут может быть рост обилия хищных грибов рода Arthrobotrys (сем. Orbiliaceae ), которые питаются нематодами. Протисты были представлены охрофитовыми (бледно-желтыми) водорослями, основной вклад в эукариотический микробиом они вносили в варианте с БАГС.
Основную массу эукариот составляли грибы, при этом в исходных субстратах преобладали базидиомицеты (см. табл. 2). Через 30 сут их доля снизилась за счет элиминации в обоих вариантах базидиомицетовых дрожжей (сем. Bulleribasidiaceae , Sporidiobolaceae ), доля которых от грибного микробиома составляла в исходных образцах 21-22 %. К 68-м сут существенно снизилась доля ксерофильных базидиомицетов рода Wallemia (с 26-36 до 0,2-1,2 %). К концу эксперимента в соломе численно преобладали аско-мицеты, их соотношение с базидиомицетами соответственно для контроля и биопрепарата с 0,65 и 0,54 в начале опыта выросло до 1,49 и 4,30. Аналогичные данные о преобладании аскомицетов на ранней стадии разложения остатков кукурузы (в течение 2 мес) были получены в двухлетнем опыте (32), тогда как к концу эксперимента в субстрате преобладали базидио-мицеты и зигомицеты (32)
Мы выявили подавляющее действие БАГС на базидиомицеты: на 68-е сут их доля от суммарного эукариотического микробиома составила 14,9 % (см. табл. 2). В контроле был отмечен значительный рост Coprinopsis radiata (навозник радиальный), на 30-е сут его доля составляла 36,1 % от суммы эукариот и 90 % — от базидиомицетов. БАГС снижал развитие C. radiata по сравнению с контролем: на 30-е сут — в 2 раза, на 68-е сут — в 11 раз. Таким образом, в варианте с биопрепаратом аскомицеты принимали более активное участие в разложении соломы, чем базидиомицеты. Это могут быть, например Sordariomycetes , являющиеся копиотрофами: их доля в варианте с БАГС на 68-е сут возрастала до 44,8 % от всех грибов.
Грибы, обладающие мощной ферментативной системой, способной разлагать растительные ткани, заслуживают специального внимания, так как многие из них могут вызывать болезни растений (38-40). Суммарная доля родов грибов, включающих фитопатогенные виды ( Alternaria , Aspergillus , Bipolaris , Fusarium , Penicillium , Waitea ), в варианте с БАГС оказалась довольно значительной — до 20 %. Однако не все представители перечисленных родов фитопатогены, поэтому их присутствие в соломе при разложении нельзя расценивать однозначно негативно. К тому же даже фитопатогенные виды могут вести сапротрофный образ жизни (41).
Доминирующими таксонами бактерий (91-98 % микробиома) были Gammaproteobacteria , Alphaproteobacteria , Bacteroidota , Actinobacteria , Bacillota , Verrucomicrobia , Planctomycetota. Прокариотический микробиом мульчи характеризовался отсутствием архей и минорными долями ацидобактерий, в отличие от соломы, разлагавшейся в почве (42). В бактериальном сообществе при деструкции соломы преобладали грамотрицательные бактерии, требующие богатого органического субстрата, которые составляли до 80 % от всего микробиома. По способности утилизировать органический углерод почвы микроорганизмы подразделяют на r-стратегов (копиотрофы) и K-стратегов (олиготрофы) (33-35). Условными r-стратегами считают Actinobacteria, Betaproteobacteria, Bacteroidetes , Firmicutes и Gemmatimonadetes, к оли-готрофам относят Alpha - и Deltaproteobacteria , Planctomycetes , Chloroflexi и
Acidobacteria (33, 43-45). В контрольной соломе во все сроки отбора проб преобладали r-стратеги, что соответствует ранней стадии деструкции. Для варианта с БАГС было характерно равное соотношение K- и r-стратегов, за исключением преобладания r-стратегов на 30-е сут. Причина, скорее всего, в том, что с функциональной точки зрения в бактериальном сообществе БАГС K-стратеги преобладали над r-стратегами (превышение в 2,1 раза).
3. Таксономический состав прокариотического микробиома (% от суммарного микробиома) в соломе овса ( Avena sativa L.) в контроле и при ее обработке БАГС
|
Солома + N мин |
Солома + N мин + БАГC |
|||||||
|
Филум |
Семейство |
“1 |
1 |
|||||
|
n 0 сут 1 |
30 сут |
68 сут |
0 сут |
1 30 сут |
68 сут |
|||
|
Actinobacteriota |
Microbacteriaceae |
↓ 13,28 |
↓ 2,68 |
↓ 2,66 |
9,44 |
↓ 2,27 |
↓ 2,37 |
|
|
Streptosporangiaceae |
0 |
↑ 3,99 |
↑ 3,28 |
0,05 |
↑ 4,83 |
↑ 3,62 |
||
|
Solirubrobacteraceae |
0 |
↑ 1,65 |
↑ 1,69 |
0,01 |
↑ 4,34 |
↑ 2,92 |
||
|
Bacillota |
Bacillaceae |
0 |
0,24 |
0,61 |
0,15 |
↑ 2,17 |
↑ 2,14 |
|
|
Paenibacillaceae |
0,30 |
↑ 1,70 |
↑ 1,89 |
0,17 |
↑ 0,82 |
↑ 0,70 |
||
|
Staphylococcaceae |
8,68 |
↓ 0,03 |
↓ 0,08 |
0,25 |
0,09 |
0 |
||
|
Bacteroidota |
Chitinophagaceae |
0 |
↑ 5,47 |
↑ 6,81 |
0,54 |
↑ 6,90 |
↑ 4,95 |
|
|
Hymenobacteraceae |
4,57 |
↓ 0 |
↓ 0 |
4,04 |
↓ 0 |
↓ 0 |
||
|
Microscillaceae |
0 |
0,17 |
↑ 1,06 |
0,01 |
↑ 1,68 |
↑ 4,11 |
||
|
Sphingobacteriaceae |
2,82 |
↑ 4,78 |
3,22 |
5,69 |
↓ 1,74 |
↓ 0,61 |
||
|
Myxococcota |
Polyangiaceae |
0 |
0,04 |
↑ 1,64 |
0 |
0,05 |
↑ 2,57 |
|
|
Planctomycetota |
Rubinisphaeraceae |
0 |
↑ 1,89 |
0,76 |
0 |
0,82 |
0,32 |
|
|
Alphaproteobacteria |
Caulobacteraceae |
0,03 |
↑ 3,35 |
↑ 2,36 |
0,01 |
↑ 2,66 |
↑ 1,44 |
|
|
Beijerinckiaceae |
1,67 |
↓ 0,57 |
0,18 |
0,46 |
0,49 |
0,24 |
||
|
Devosiaceae |
0,01 |
↑ 2,58 |
↑ 2,6 |
0,04 |
↑ 5,1 |
↑ 3,61 |
||
|
Rhizobiaceae |
2,21 |
↑ 6,38 |
1,88 |
2,09 |
↑ 5,2 |
↑ 4,07 |
||
|
Sphingomonadaceae |
25,68 |
↓ 3,43 |
↓ 1,72 |
25,35 |
↓ 2,64 |
↓ 2,00 |
||
|
Gammaproteobacteria |
Alcaligenaceae |
0 |
0,87 |
↑ 1,17 |
0 |
↑ 1,04 |
0,40 |
|
|
Burkholderiaceae |
0 |
0,12 |
0,37 |
0,11 |
↑ 1,71 |
↑ 1,61 |
||
|
Comamonadaceae |
0,8 |
1,07 |
↑ 2,56 |
0,53 |
↑ 3,41 |
↑ 4,37 |
||
|
Enterobacteriaceae |
0,65 |
0,95 |
0,08 |
0,09 |
0,28 |
0,15 |
||
|
Erwiniaceae |
4,44 |
↓ 0,36 |
↓ 0,33 |
2,79 |
↓ 0,52 |
↓ 0,26 |
||
|
Cellvibrionaceae |
0 |
0 |
0 |
0 |
0,35 |
↑ 1,77 |
||
|
Pseudomonadaceae |
15,79 |
11,34 |
↓ 5,79 |
11,13 |
↓ 3,60 |
↓ 1,95 |
||
|
Steroidobacteraceae |
0 |
↑ 1,19 |
↑ 3,36 |
0,12 |
↑ 1,39 |
↑ 3,50 |
||
|
Xanthomonadaceae |
1,33 |
↑ 6,15 |
↑ 3,65 |
1,16 |
↑ 13,33 |
↑ 8,01 |
||
|
Verrucomicrobiota |
Rubritaleaceae |
0 |
↑ 2,81 |
↑ 1,71 |
0 |
↑ 2,63 |
↑ 0,97 |
|
|
Verrucomicrobiaceae |
0 |
0,37 |
0,91 |
0 |
0,22 |
0,14 |
||
|
Remaining taxa (2477 ASVs) |
6,1 |
↑ 23,38 |
↑ 31,86 |
21,45 |
19,64 |
25,1 |
||
|
Примечание. Стрелками отмечено |
повышение |
( ↑ ) или |
снижения ( ↓ ) |
представленности |
семейства по |
|||
|
мере деструкции соломы (по сравнению |
с 0 сут). |
|||||||
Таксономический состав прокариот, как и эукариот, значительно изменялся во времени: 58,3-58,7 % исходного микробиома прокариот исчезла, или их доля снизилась к 68-м сут (табл. 3).
Доля семейств Microbacteriaceae , Hymenobacteraceae , Beijerinckiaceae , Sphingomonadaceae и Erwiniaceae , значительно представленных в сообществе соломы в начале эксперимента, снизилась в 4-15 раз к 68-м сут. Доля Streptosporangiaceae , Solirubrobacteraceae , Chitinophagaceae , Microscillaceae , Poly-angiaceae , Caulobacteraceae , Devosiaceae , Comamonadaceae , Steroidobacteraceae , Xanthomonadaceae , Rubritaleaceae , напротив, увеличивалась со временем. По известным данным анализа таксономического состава БАГС, основные компоненты бактериального сообщества препарата относились к представителям фил Pseudomonadota , Planctomycetota и Bacteroidota , а грибного — к представителям классов Sordariomycetes , Mucoromycetes и Leotiomycetes (15). Под влиянием БАГС доля семейств Cellvibrionaceae , Xanthomonadaceae , Soli-rubrobacteraceae увеличилась, а на уровне фил возросла представленность Bacteroidota по сравнению с Bacillota ; в целом олиготрофность бактериального сообщества повышалась.
Наибольшие изменения в составе микробиомов происходили в течение первых 30 сут. В процессе разложения рисовой соломы (45) основной причиной смены бактериальных сообществ было более быстрое исчерпание наиболее доступных органических субстратов, что мы наблюдали и в нашем эксперименте при внесении биопрепарата. Поэтому меньшие различия микробных сообществ с 30-х по 68-е сут при внесении биопрепарата могут быть связаны с тем, что в варианте с БАГС первая стадия разложения соломы заканчивалась быстрее, возможно, к 30-м сут. Стоит учесть и преобладание олиготрофной микрофлоры в биопрепарате (15). Причиной может быть то, что численность как бактерий, так и грибов при внесении биопрепарата существенно не изменялась. Ряд исследователей показали, что со скоростью разложения растительных остатков коррелирует численность, а не разнообразие микробиоты (32, 34, 35). Вероятно, видовое богатство и разнообразие микроорганизмов не относятся к существенным факторам биотрансформации из-за функциональной избыточности микробных сообществ при разложении растительных остатков, когда многие микроорганизмы со сходными функциями занимают одну и ту же нишу (35). Кроме того, следует учесть небольшую длительность эксперимента — около 2 мес, в течение которых до 70 % массы соломы еще не разложилось. Учитывая положительную тенденцию к увеличению скорости разложения соломы и принимая во внимание потенциал БАГС в деградации ксенобиотиков (14), следует провести более длительные эксперименты, возможно с увеличением количества добавленного минерального азота. Еще одной задачей остается установление роли протистов в процессах деструкции соломы. По нашим данным, их относительная представленность в варианте с БАГС существенно (в 4-10 раз) возросла.
Таким образом, впервые проведенное глубокое секвенирование ампликонных библиотек гена 16S рРНК и ITS микробиомов соломы овса при разложении на поверхности почвы (мульча) показало значительное изменение сукцессии и состава прокариотической и эукариотической компоненты под влиянием биопрепарата БАГС. Выявлено, что около 60 % исходных про- и эукариотического микробиомов не принимали значимого участия в процессе деструкции и были заменены другими микроорганизмами. Биопрепарат БАГС, имея сложную таксономическую структуру со значительной долей некультивируемых, но функционально важных участников, наиболее существенно повлиял на состав и динамику эукариотического микробиома. Можно отметить быстрое подавление базидиомицетов в присутствии БАГС, например уменьшение доли Coprinopsis radiata (навозник радиальный) на 30-е сут в 2 раза, а на 68-е сут — в 11 раз по сравнению со спонтанным микробиомом в контроле. Однако данные анализа состава микробиома методом ПЦР в реальном времени (ПЦР-РВ) и оценки альфа-разнообразия дают основания полагать, что в нашем эксперименте именно грибы играли основную роль в разложении соломы. В присутствии БАГС такими грибами могут быть аскомицеты Sordariomycetes , проявляющие копиотрофные свойства. Показано, что существенные различия по таксономическому составу микробных сообществ контрольного (без БАГС) и опытного (с добавлением БАГС) вариантов практически не влияли на эффективность разложения соломы. В условиях краткосрочного эксперимента в присутствии минерального азота биопрепарат БАГС практически не ускорил деструкцию соломы, несмотря на повышение активности микроорганизмов на 30-е сут (увеличение продукции СО 2 на 44 %, снижение содержания в соломе водорастворимых органических соединений и нитратного азота в 1,6 и 1,8 раза).


