Динамика проницаемости кишечника у онкологических больных в периоперационном периоде
Автор: Карпенко А.Ю., Цветков Д.С., Киселевский М.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 (66), 2014 года.
Бесплатный доступ
Слизистая оболочка кишечника является защитным барьером организма, препятствующим проникновению в системный кровоток бактериальных агентов и их токсинов, вызывающих развитие воспалительной реакции. В работе оценена динамика кишечной проницаемости у онкологических и кардиохирургических больных в периоперационном периоде с помощью метода неметаболизируемых сахаров (лактулоза-маннитол). Выявлено, что уровень экскреции лактулозы и маннитола повышен у онкологических больных с развившимися послеоперационными осложнениями как до, так и после операции, что свидетельствует о повышенной кишечной проницаемости у данной группы пациентов. Можно предположить, что проникающий, вследствие повышенной кишечной проницаемости, в кровь бактериальный липополисахарид индуцирует ответ эффекторов врожденного иммунитета, на фоне уже активированной иммунной системы приводит к развитию системной воспалительной реакции. Поэтому оценка трансинтестинальной проницаемости может рассматриваться в качестве прогностического фактора неблагоприятного течения раннего постоперационного периода у онкологических больных.
Проницаемость кишечника, онкологические больные, послеоперационные осложнения
Короткий адрес: https://sciup.org/14056476
IDR: 14056476 | УДК: 616-006:616.33-006.6-089:612.017
Текст научной статьи Динамика проницаемости кишечника у онкологических больных в периоперационном периоде
У онкологических больных в периоперационном периоде часто наблюдается увеличение содержания в крови бактериального эндотоксина – липополисахарида (ЛПС). Энтеротоксемия может быть обусловлена не только поступлением бактерий и их токсинов из первичного очага воспаления, но и усилением их транслокации через слизистые оболочки. Слизистая оболочка кишечника формирует эффективный барьер для микроорганизмов и токсинов [12]. Нарушение этого защитного механизма в случае увеличения кишечной проницаемости может привести к чрезмерной транслокации кишечных бактерий и/или их токсинов в окружающие ткани и отдаленные органы [14]. Транзиторная бактериемия встречается довольно часто и сопровождает не только инвазивные, но и многие неинвазивные манипуляции и процедуры. Экспериментально было показано, что трансинтестинальное перемещение бактерий и токсинов наблюдается у пациентов с ожогами, шоком, обструкцией кишечника и после расширенных операций [7, 10, 13, 15, 17].
Следовательно, стрессовое воздействие на организм пациента во время операционного вмешательства может приводить к изменению барьерной функции слизистых оболочек, прежде всего кишечника, и вызывать поступление в кровь бактерий и/ или их токсинов, что, в свою очередь, инициирует каскад воспаления вследствие активации эффекторов врожденного иммунитета. Изучение механизмов такой инверсии иммунных реакций организма является в настоящее время одной из важнейших задач биомедицинских исследований, решение которой позволит понять патогенез развития послеоперационных гнойно-септических осложнений, а также выявить прогностические маркеры и разработать меры профилактики. Оценка целостности кишечного барьера является эффективным методом для диагностики и мониторинга степени повреждения слизистой оболочки кишечника. С этой целью широко используется измерение уровня экскреции с мочой неметаболизируемых сахаров, вводимых перорально [1, 11, 16].
Целью исследования являлось изучение изменения кишечной проницаемости у онкологических больных в периоперационном периоде.
Материал и методы
Кишечную проницаемость оценивали с помощью определения экскреции лактулозы и манни-тола. Для этого больным перорально давали 30 мл 1,5 % раствора маннитола (4,5 г маннитола) и 30 мл препарата «Дюфалак» (20 г лактулозы), после чего в течение 6 ч собирали мочу, измеряли общий объем диуреза и отбирали пробу для дальнейшего исследования. Полученные пробы мочи хранили при –70ºС.
У онкологических пациентов пробы мочи собирали за сутки до операции, на 1, 2 и 5-е сут после операции с целью оценки динамики трансинтестинальной проницаемости. У кардиохирургических больных мочу собирали накануне и на 1-е сут после операции для сравнения исходных показателей кишечной проницаемости и влияния хирургического вмешательства.
Определение концентрации лактулозы проводили по методу Селиванова [12], маннитола – по методу Corcoran и Page [9]. Высчитывали процент экскретированных с мочой аналитов по следующей формуле:
Cl = [D × k × V/m] × 100 %, где D – оптическая плотность; k – коэффициент, полученный с помощью калибровочной кривой, равный 5,7337 для лактулозы и 0,586 для манни-тола; V – объем диуреза, мл; m – масса аналита, мг (20 000 мг лактулозы, 4 500 мг маннитола).
Статистическую обработку полученных результатов проводили с использованием критериев непараметрической статистики пакета Statistica 10. Для межгруппового сравнения применяли критерий Манна – Уитни (р<0,05), для внутригруппового – Вилкоксона (р<0,05). В качестве описательной статистики использовали медиану и размах квартилей (25 ÷75 %).
Результаты исследования
Онкологические больные ретроспективно были разделены на 2 подгруппы: 1) с развившимися послеоперационными осложнениями (у 8 из 24 пациентов возникли следующие послеоперационные осложнения: острый панкреатит (n=6), пневмония (n=2), сепсис (n=1)); 2) без осложнений (n=16).
На начальном этапе проводилось сравнение показателей трансинтестинальной проницаемости в обеих группах до и через 1 сут после операции. При исследовании уровня выведения лактулозы оказалось, что на дооперационном этапе уровень экскреции данного сахара у онкологических больных с осложнениями был значимо выше, у кардиохирургических пациентов и онкологических больных без осложнений. После операции этот показатель значимо возрастал у кардиохирургических пациентов и у онкологических больных без осложнений. В группе онкологических больных с осложнениями исследуемый параметр имел недостоверную тенденцию к увеличению (p=0,06), однако существенно (p<0,05) превышал аналогичные показатели у онкологических больных без осложнений и кардиохирургических пациентов. Процент выведения лактулозы в группе онкологических больных без осложнений значимо не отличался от
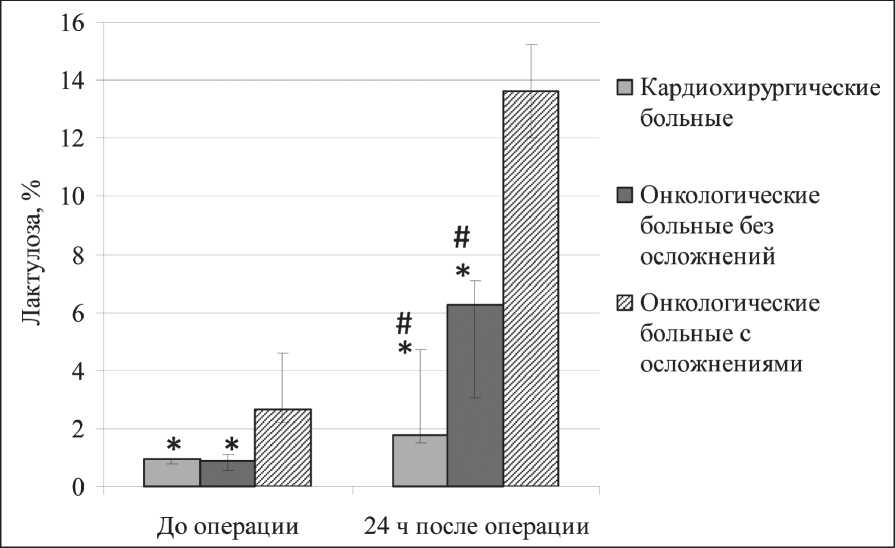
Рис. 1. Выведение лактулозы накануне и через 1 сут после операции у кардиохирургических больных, онкологических пациентов без послеоперационных осложнений и с осложнениями. Данные представлены в виде медианы и размаха квартилей; * – значимое межгрупповое отличие от показателей онкологических больных с осложнениями по критерию Манна – Уитни (p<0,05); # – значимое внутригрупповое отличие от показателей до операции по критерию Вилкоксона (p<0,05)
такового у кардиохирургических пациентов как до, так и после операции (рис. 1).
Процент выведения маннитола в группе онкологических больных с послеоперационными осложнениями исходно также значимо превышал показатели кардиохирургических больных и онкологических пациентов без осложнений. Экскреция маннитола у онкологических больных с послеоперационными осложнениями значимо увеличивалась через 1 сут после операции. Этот показатель значимо не отличался у кардиохирургических больных и онкологических пациентов без осложнений до и после операции; хирургическое вмешательство также не приводило к достоверному изменению данного параметра в указанных группах (рис. 2).
Таким образом, результаты исследования согласуются с имеющимися литературными данными о повышении трансинтестинальной проницаемости в ответ на хирургическое вмешательство [7]. Рассматриваемое явление наблюдалось не только в группе онкологических больных, у которых в ходе операции нарушалась целостность желудочно-кишечного тракта, но и во время кардиохирургических вмешательств, не оказывающих непосредственного влияния на состояние кишечной стенки.
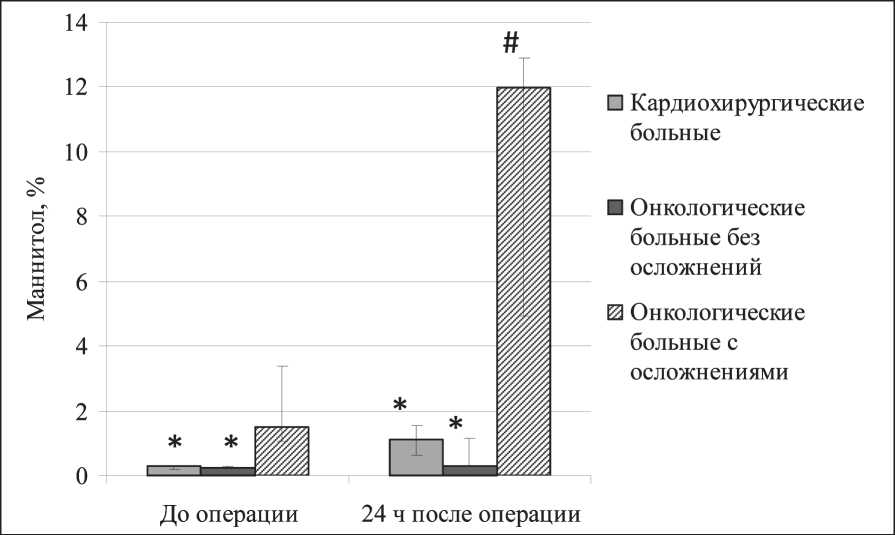
Рис. 2. Выведение маннитола накануне операции и на 1-е сут после операции у кардиохирургических больных и онкологических пациентов без послеоперационных осложнений и с таковыми. Данные представлены в виде медианы и размаха квартилей; * – значимое межгрупповое отличие от показателей онкологических больных с осложнениями по критерию Манна – Уитни (p<0,05); # – значимое внутригрупповое отличие от показателей до операции по критерию Вилкоксона (p<0,05)
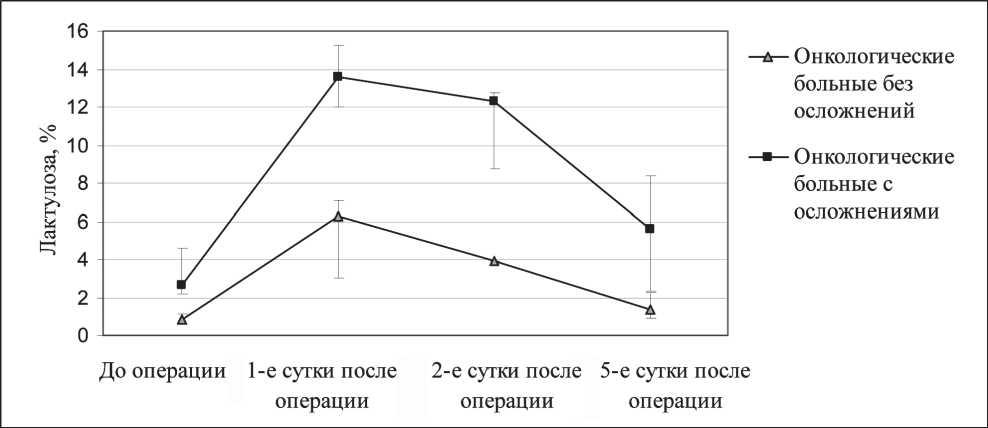
Рис. 3. Изменение уровня лактулозы, экскретированной с мочой в периоперационном периоде, у пациентов без послеоперационных осложнений и с таковыми. Данные представлены в виде медианы и размаха квартилей; * – значимое отличие между группами по критерию Манна – Уитни
Показатели кишечной проницаемости в группе онкологических больных без осложнений не отличались от таковых у кардиохирургических пациентов как до, так и после операции. Это позволяет предположить, что локализация опухоли в органах желудочно-кишечного тракта сама по себе не влияет на трансинтестинальную проницаемость. Однако исследуемые параметры были повышены в группе онкологических больных с послеоперационными осложнениями, что наблюдалось уже на дооперационном этапе.
У онкологических больных исследовалась динамика экскреции маннитола и лактулозы в раннем послеоперационном периоде. При изучении уровня выведения лактулозы было установлено, что уровень ее экскреции в группе пациентов с осложнениями остается повышенным в течение 5 сут после операции, в то время как у больных без осложнений этот параметр на 5-е сут послеоперационного периода не отличается от исходных значений (рис. 3). Значения экскреции маннитола в группе с осложнениями были значимо выше, чем у пациентов без осложнений, только до и через 1 сут после операции, однако в последующем (2–5-е сут после операции) значимых отличий не выявлено (рис. 4). Такая динамика показателей свидетельствует о повышенной проницаемости кишечной стенки у пациентов с послеоперационными ослож-
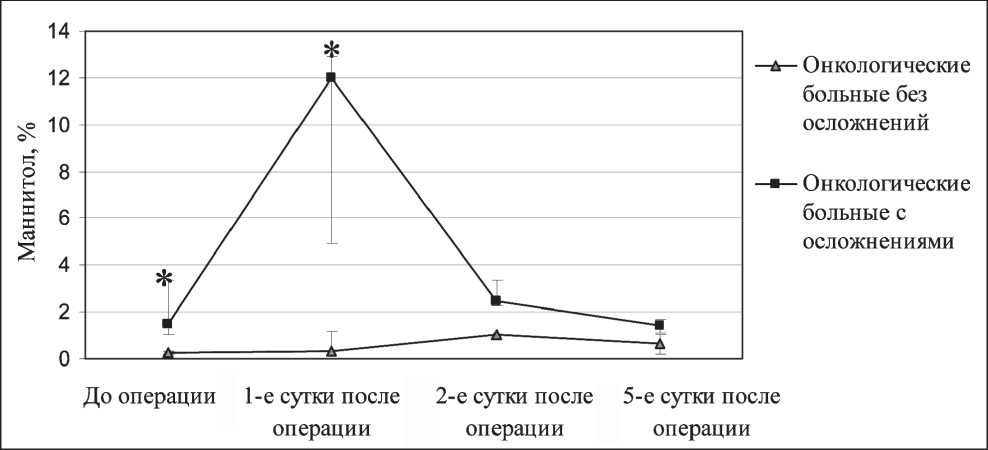
Рис. 4. Изменение уровня лактулозы, экскретированной с мочой в периоперационном периоде, у пациентов без осложнений и с таковыми. Данные представлены в виде медианы и размаха квартилей; * – значимое отличие между группами по критерию Манна – Уитни
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2014. № 6
нениями, что наблюдается уже на дооперационном этапе. В связи с этим трансинтестинальная проницаемость может рассматриваться как прогностический фактор развития послеоперационных гнойно-септических осложнений.
Обсуждение
Измерение экскреции с мочой неметаболизи-руемых сахаров, введенных перорально, широко используется для исследования кишечной проницаемости как при различных патологических процессах, так и в здоровом организме. Метод двух сахаров основан на том, что небольшие молекулы (маннитол, рамноза) проходят через слизистую оболочку кишечника трансцеллюлярным путем, а большие молекулы (лактулоза, целлобиоза) – па-рацеллюлярным путем, через плотные контакты. Таким образом, возрастание уровня экскреции лактулозы свидетельствует о повышении проницаемости плотных контактов.
Межклеточные плотные контакты представляют собой комплекс из нескольких белков, формирование которого регулируется множеством факторов. Имеются данные об изменении числа плотных контактов в ответ на действие интерферона γ, фактора некроза опухоли α, интерлейкинов 1, 4, 6, 10, различных факторов роста. Механизмы такой регуляции связывают с влиянием вышеперечисленных цитокинов на реорганизацию актинового цитоскелета, что ведет к изменению структуры плотных контактов [8].
Известно, что для онкологических больных характерно повышенное содержание в крови различных цитокинов [3, 5], влияющих на систему межклеточных контактов и, соответственно, на проницаемость кишечника. Это, наряду с последующим стрессовым воздействием расширенного хирургического вмешательства, может стать причиной транслокации бактерий и/или их токсинов через кишечную стенку в системный кровоток, что может привести к развитию системной воспалительной реакции в раннем послеоперационном периоде.
Результаты настоящей работы свидетельствуют о повышенной кишечной проницаемости у онкологических больных с послеоперационными осложнениями в сравнении с кардиохирургическими пациентами и группой онкологических больных без осложнений. Это согласуется с данными других авторов о повышенном уровне ЛПС и некоторых цитокинов у онкологических больных с сепсисом [2, 4]. Можно предположить, что проникающий вследствие повышенной кишечной проницаемости в кровь ЛПС, посредством толлподобных рецепторов индуцирует ответ эффекторов врожденного иммунитета [6], что на фоне уже активированной иммунной системы приводит к развитию системной воспалительной реакции. Поэтому оценка трансинтестинальной проницаемости может рассматриваться в качестве прогностического фактора неблагоприятного течения раннего постоперационного периода у онкологических больных.
Выводы
В работе показано, что уровень экскреции лактулозы в группе онкологических больных с послеоперационными осложнениями выше, чем у пациентов без осложнений до операции, на 1-е и 5-e сут после операции. Уровень экскреции маннитола у онкологических пациентов с послеоперационными осложнениями выше, чем таковой у больных без осложнений, до операции и на 1-е сут после операции. Уровень экскреции лактулозы и маннитола у онкологических больных с послеоперационными осложнениями превышает показатели кардиохирургических пациентов как до операции, так и на 1-е сут после. Показатели трансинтестинальной проницаемости онкологических больных не отличаются от таковых в группе кардиохирургических пациентов до операции и через 24 ч после нее.


