Динамика содержания ИЛ-1 и ИЛ-10 в плазме крови у экспериментальных животных при моделировании раневого процесса в условиях низкогорья и в период деадаптации к высокогорью
Автор: Ниязов Батырхан Сабитович, Мамакеев Ж.Б., Сабитов А.А., Маманов Н.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 11 т.6, 2020 года.
Бесплатный доступ
В статье представлена динамика содержания ИЛ-1β и ИЛ-10 в плазме крови у экспериментальных животных при моделировании раневого процесса в условиях низкогорья и в период деадаптации к высокогорью. Животные были разделены на 3 серии: I-я серия - контрольная (постоянно обитающие в условиях г. Бишкек); II-я серия - опытная, после 3-х дневного пребывания на экспериментальной высокогорной базе КГМА им. И. К. Ахунбаева в составе ЦНИЛ (перемещенные в условия г. Бишкек с последующим моделированием и наблюдением за течением раневого процесса); III-я серия - опытная, после 30-ти дневного пребывания на экспериментальной высокогорной базы КГМА им. И. К. Ахунбаева в составе ЦНИЛ (перемещенные в условия г. Бишкек с последующим моделированием и наблюдением за течением раневого процесса). Анализ полученных данных показывает, что при асептическом воспалении наблюдалась противоположная динамика выработки одних из ключевых интерлейкинов, с ИЛ-1β с максимальной концентрацией через 12 часов от начала асептического воспаления. Выявленные изменения в содержании цитокинов при экспериментальном асептическом воспалении обусловили своевременную смену и адекватную продолжительность клеточных реакций. При гнойном воспалении динамика секреции цитокинов была однонаправленной, что привело к затягиванию во времени всех клеточных фаз воспалительного процесса. В период деадаптации после длительного пребывания в условиях высокогорья отмечается низкая секреция ИЛ-1 и ИЛ-10, связанная истощением защитно-приспособительных механизмов.
Высокогорье, деадаптация, раневой процесс
Короткий адрес: https://sciup.org/14117667
IDR: 14117667 | УДК: 616-002.154 | DOI: 10.33619/2414-2948/60/27
Текст научной статьи Динамика содержания ИЛ-1 и ИЛ-10 в плазме крови у экспериментальных животных при моделировании раневого процесса в условиях низкогорья и в период деадаптации к высокогорью
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616-002.154
Несмотря на многообразие лекарственных препаратов и методов лечения, гнойновоспалительные заболевания мягких тканей до сих пор остаются актуальной проблемой в современной хирургии [1–2]. На сегодняшний день, особенно для амбулаторного звена, основным методом является лечение ран под повязкой [3–4]. На фоне стремительного снижения эффективности препаратов системной антибактериальной терапии, «золотым стандартом» лечения гнойных ран мягких тканей стали многокомпонентные мази на полиэтиленгликолевой основе [5]. Достоинствами этих мазей являются: высокая осмотическая активность, избирательная антимикробная направленность в отношении как аэробных, так и анаэробных возбудителей хирургической инфекции, способность стимулировать клеточные и гуморальные факторы [6].
Имеется большой объем исследований о влиянии условий высокогорья на организм экспериментальных животных и человека [7–11]. Исследования особенностей процесса деадаптации не столь многочисленны как вопросы адаптации, но они есть, и касаются главным образом физиологического состояния человека и животных после пребывания в условиях высокогорья и Крайнего Севера [10–12]. Научных же работ по изучению течения и заживления раневых процессов после спуска с гор в долину в доступной литературе нам не встретилось, это и послужило предпосылкой к постановке данного исследования.
Цель исследования — проследить динамику содержания ил-1β и ил-10 в плазме крови у экспериментальных животных при моделирование раненого процесса в условиях низкогорья и в период деадаптации к высокогорью.
Материал и методы исследования
С целью выполнения поставленных целей и задач исследования соответственно плану были проведены ряд экспериментов и лабораторных исследований на базе Проблемной научно-исследовательской лаборатории клинической и экспериментальной хирургии Национального хирургического центра Министерства здравоохранения Кыргызской Республики и экспериментальной высокогорной базы КГМА им. И. К. Ахунбаева в составе Центральной научно-исследовательской лаборатории на перевале Туя-Ашуу.
Материалом исследования для эксперимента послужили 150 беспородных половозрелых разнополых кроликов весом 3,5–4,0 кг. Все животные прошли обязательную вакцинацию, дегельминтизацию и выдерживания в карантине сроком 21 день.
Дизайн исследования, основные правила содержания и ухода были согласованны с Комитетом по Биоэтике КГМА им. И. К. Ахунбаева. Лабораторные животные содержались в равных условиях вивария, одинаковом уходе руководствуясь базисными нормативными документами: «Санитарные правила по устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)» и в соответствии с нормативами ГОСТ «Содержание экспериментальных животных в питомниках НИИ» 1978 г. Кормление осуществлялось по нормам, установленным приказом Минздрава СССР №1179 от 10.10.1983 г. «Об утверждении нормативов затрат кормов для лабораторных животных в учреждениях здравоохранения», со свободным доступом к воде.
Опыты выполнялись в соответствии с правилами лабораторной практики (GLP) (приказ №708 от 23 августа 2010 г. «Об утверждении правил лабораторной практики»); правилами гуманного обращения с животными, регламентированных «Правилами проведения работ с использованием экспериментальных животных», утвержденных Приказом МЗ СССР №742 от 13.11.84 г. «Об утверждении правил проведения работ с использованием экспериментальных животных»; на основании положений изложенных в Хельсинской декларации Всемирной медицинской ассоциации норм асептики и антисептики 1964 г., дополненной в 1975, 1983, 1989 гг. и с учетом требований Европейской конвенции о защите позвоночных животных, используемых для экспериментов или иных научных целей (Страсбург, 18 марта 1986 г.).
Все оперативные вмешательства проводились под общим наркозом с соблюдением правил асептики и антисептики. С целью введения лабораторных животных в медикаментозный сон использовался Кетамин в/в, из расчета 7 мг/кг веса.
У экспериментальных животных раневой процесс вызывался по методике описанным ниже.
Животные были разделены на 3 серии:
I серия — контрольная серия, кролики (50 особей), постоянно обитающие в условиях г. Бишкек;
II серия — опытная серия, кролики (50 особей), после 3-х дневного пребывания на экспериментальной высокогорной базы КГМА им. И. К. Ахунбаева в составе ЦНИЛ, перемещенные в условия г. Бишкек с последующим моделированием и наблюдением за течением раневого процесса;
III серия — опытная серия, кролики (50 особей), после 30-ти дневного пребывания на экспериментальной высокогорной базы КГМА им. И. К. Ахунбаева в составе ЦНИЛ, перемещенные в условия г. Бишкек с последующим моделированием и наблюдением за течением раневого процесса.
В каждой серии животные были разделены на 2 группы.
-
1 группа — животные, с экспериментальной моделью асептического воспаления (25 особей);
-
2 группа — животные, с экспериментальной моделью микробного воспаления (25 особей).
Методика моделирования раны
После введения животных в медикаментозный сон, животных фиксировали в положении на животе.
Асептическое воспаление моделировали путем подкожного введения в межлопаточную область 0,3 мл скипидара на вазелиновом масле. Перед этим у животных в межлопаточной области выстригали шерсть и подкожно вводили 0,5 мл воздуха. Подкожное введение скипидара приводило к развитию асептического воспаления. Так, через 1 сут от начала введения скипидара у крыс клинически развивалась картина острого воспаления с явлениями гиперемии. Очаг воспаления визуально без особенностей. В области введения скипидара отмечался выраженный отек ткани, при пальпации резко болезненный. При вскрытии обнаруживался ожог мягких тканей с элементами некроза, очаг ограничен, ярко выраженный сосудистый рисунок.
Острое гнойное воспаление моделировали по следующей методике: после предварительной подготовки операционного поля, по трафарету диаметром 50 мм, выполненному из листа рентгеновской пленки, на область планируемого разреза 1% спиртовым раствором бриллиантового зеленого наносились контуры стандартной обширной раны округлой формы в межлопаточной области. По намеченному контуру рассекалась кожа, поверхностная фасция. На дне раны надсекали мышцы скальпелем. Образовавшийся кожный лоскут стандартного размера переворачивали шерстью вниз к поверхности раневого дефекта с последующим подшиванием к свободному кожному краю и подлежащим тканям по всему периметру непрерывным швом капроновой нитью №4. Через 48 часов удаляли лоскут, после удаления лоскута наблюдалась инфицированная рана с классическими признаками воспаления.
Все исследования проводились на 3-й, 7-й, 15-й, 20-й и 30-й день исследования. У животных всех серий определяли уровень ключевых цитокинов: провоспалительного ИЛ-1 В , противовоспалительного ИЛ-10 через 12 ч, 1, 2, 3, 5 сут от начала воспалительного процесса. У лабораторных животных в положенные сроки осуществлялся забор крови в пробирки с активатором свертывания крови. Пробирки с кровью центрифугировались при 3000 оборотов в течение 10–15 мин с целью получения слоя плазмы. Концентрацию цитокинов в плазме крови определяли с помощью иммуноферментного анализа.
Для определения цитокинов у крыс использовались тест-наборы австрийского производства Rat IL-1 В ELISA BMS630 и Rat IL-10 ELISA BMS629 (Bender MedSystcms, Vienna, Austria).
Для исследования концентрации цитокинов применялись луночные планшеты с фиксированными антителами (поликлональными — для ИЛ-1β, моноклональными — для ИЛ-10). Перед началом исследования планшеты промывались специальным раствором. В лунки добавлялись образцы и стандартный растворитель по рекомендуемой производителем схеме, далее в течение 2 ч осуществлялась инкубация содержимого лунок с биотин-конъюгатом. После последующего промывания планшетов от биотин-конъюгата в них добавлялся стрептовидин-HRP с дальнейшей инкубацией в течение 1 ч, после чего луночные планшеты также промывались. Затем осуществлялась 10-минутная инкубация содержимого лунок с раствором субстрата (тетраметилбеизидина), в результате чего происходило окрашивание, 45 степень интенсивности которого свидетельствовала об уровне исследуемых цитокинов в плазме крови. Концентрация интерлейкинов измерялась в пг/мл, включая в себя оценку и контроль за течением раневого процесса на основании местных клинических данных, показатели лейкоцитарной формулы по общепринятой методике, микробиологическое исследование, определение цитокинов плазмы крови в динамике раневого процесса.
Для статистической обработки полученных данных использовалась пакет компьютерной программы IBM SPSS 23.0. Проверку нормальности распределения количественных признаков проводили с использованием критерия Колмогорова - Смирнова. Для оценки статистической значимости различий при сравнении по количественному признаку — параметрические и непараметрические методы (ANOVA, критерий Краскаля-Уоллеса), в качестве апостериорного критерия выбран критерий Тьюки. Выборочные параметры проводимые далее обозначены следующим образом: М — среднее, s (δ) — стандартное отклонение (квадратическое отклонение), n — объем анализируемой группы. Статистически достоверным критическим значением уровня значимости считался р˂0,05.
Результаты и обсуждение
Через 12 часов после введения в межлопаточную область 0,3 мл скипидара, у экспериментальных животных контрольной серии (АВ-Н), содержание ИЛ-1β в плазме крови животных составляло 1,7±0,4 пг/мл. Затем происходило закономерное падение уровня ИЛ-1β, содержание которого через 1 сут составляло 1,2±0,2 пг/мл, через 3 сут — 08±0,2 пг/мл. Начиная с 4 сут ИЛ-1β в плазме крови не определялся.
Содержание ИЛ-10 в плазме крови у животных этой серии (АВ-Н) через 1 сутки снижалось относительно фоновых показателей до 10,3±0,6 пг/мл, затем уровень ИЛ-10 медленно повышался, на 3 сутки — 13,1±1,4 пг/мл.
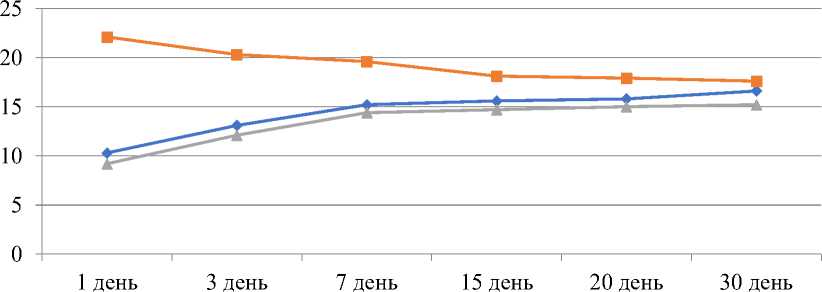
—♦— АВ-Н
—■—АВ-Д3
—A—АВ-Д30
Рисунок 1. Количественные показатели интерлейкина-10 в экспериментальным асептическим воспалением.
плазме крови кроликов с
На 7 сутки — 15,2±1,7 пг/мл; 15 сутки — 15,6±1,6 пг/мл; 20 сутки — 15,8±3,2 пг/мл; 30 сутки — 16,6±3,1 пг/мл (Рисунок 1).
Через 12 ч от начала воспаления, вызванного введением скипидара, в группе животных, после 3-дневного пребывания в условиях высокогорья, концентрация ИЛ-1β в плазме крови животных составляла 5,9±0,2 пг/мл, максимум регистрировался на срок 1 сут — 10,1±0,3 пг/мл, затем уровень ИЛ-1β снижался, но оставался достаточно высоким: на 3 сут — 5,7±0,2 пг/мл, 7 сутки – 3,2±1,5 пг/мл (р<0,05) (табл.1).
|
Таблица 1 СРАВНИТЕЛЬНАЯ ОЦЕНКА ПОКАЗАТЕЛЯ ИЛ-1β В ГРУППАХ АСЕПТИЧЕСКОГО ВОСПАЛЕНИЯ (%) |
|
|
Дни исследования |
АВ-Н АВ-Д3 АВ-Д30 |
|
12 часов 1 сутки 3 сутки |
1,7 ±0,4 5,9±0,2* 1,5±0,3* 1,2 ±0,3 10,1±0,3* 1,4±0,1* 0,8 ± 0,1 5,7±0,2* 0,9±0,4* |
Примечание: * — р<0,05.
Подъем концентрации ИЛ-10 в плазме крови у этих же экспериментальных животных, регистрировался через 1 сутки наблюдалось небольшое падение уровня ИЛ-10 до 22,1±2,1 пг/мл. На сроки 3 и 7 сутки имелось снижение содержания ИЛ-10, 3 сутки — 20,3±3,6 пг/мл, 7 сутки — 19,6±2,7 пг/мл, 15 сутки — 18,1±1,3 пг/мл, 20 сутки — 17,9±2,7 пг/мл и на 30-е сутки — 17,6 ±1,2 пг/мл.
У животных после длительного пребывания в условиях высокогорья, регистрировался подъем ИЛ-1β в плазме крови животных после начала моделирования асептического воспаления через 12 часов равное 1,5±0,3 пг/мл, в сроке 1 сутки — 1,4±0,1 пг/мл, затем уровень ИЛ-1β снижался, на 3 сутки равен был — 0,9±0,4 пг/мл.
Уровень ИЛ-10, представленный на Рисунке 1, характеризовался не высокими значениями на 3 и 7 сутки, равные — 12,1±1,2 пг/мл и 14,4±2,1 пг/мл, на 15 сутки равен был — 14,7±1,1 пг/мл, 20 сутки — 15,0±2,2 пг/мл и на 30-е сутки — 15,2±1,2 пг/мл (р<0,05).
У животных, которым моделировали острое гнойное воспаление мягких тканей, в условиях города Бишкек, регистрировался подъем уровня ИЛ-1β в плазме крови через 12 часов от начала воспаления, который продолжался и достигал максимума на сроке 3 суток (12 часов — 5,6±0,9 пг/мл; 1 сутки — 11,9±1,9 пг/мл; 3 сутки — 28,9±1,7 пг/мл). Затем уровень ИЛ-1β равномерно снижался к 7 суткам после начала воспаления — 11,3±0,3 пг/мл; 15 сутки — 0,7±0,1 пг/мл) (Таблица 2).
Таблица 2.
СРАВНИТЕЛЬНАЯ ОЦЕНКА ПОКАЗАТЕЛЯ ИЛ-1β
В ГРУППАХ ГНОЙНОГО ВОСПАЛЕНИЯ (%)
|
Дни исследования |
ГВ-Н |
ГВ-Д3 |
ГВ-Д30 |
|
12 часов |
5,6±0,9 |
7,6±0,7* |
4,3±0,3* |
|
1 сутки |
11,9 ±1,9 |
14,1±2,1* |
9,9±0,1* |
|
3 сутки |
28,9±1,7 |
31,1±2,5* |
11,3±0,4* |
|
7 сутки |
11,3±0,3 |
12,1±0,7* |
9,6±0,2* |
|
15 сутки |
0,7±0,1 |
1,2±0,3* |
0,6±0,1* |
Примечание: * — р<0,05
Через 12 ч после начала гнойного воспаления, концентрация ИЛ-10 падала, до 5,1±1,0 пг/мл. Затем регистрировался рост уровня ИЛ-10 в плазме крови: 1 сутки — 17,2±3,9 пг/мл, 3 сутки — 36,1±2,1 пг/мл. Далее происходило снижение концентрации ИЛ-10, которая составляла на 7 сутки 22,2±3,1 пг/мл, на 15 сутки — 18,1±1,7 пг/мл, на 20 сутки — 17,2±2,1 пг/мл, на 30 сутки — 17,0±1,8 пг/мл (Рисунок 2).
Через 12 ч от начала гнойного воспаления, в группе животных, после 3-дневного пребывания в условиях высокогорья, концентрация ИЛ-1β в плазме крови животных составляла 7,6±0,7 пг/мл, максимум регистрировался на срок 3 сут, на 1 сут равен был — 14,1±2,1 пг/мл, на 3 сут — 31,1±2,5 пг/мл, затем уровень ИЛ-1β снижался, но оставался достаточно высоким:7 сут — 12,1±0,7 пг/мл (р<0,05) (Таблица 2).
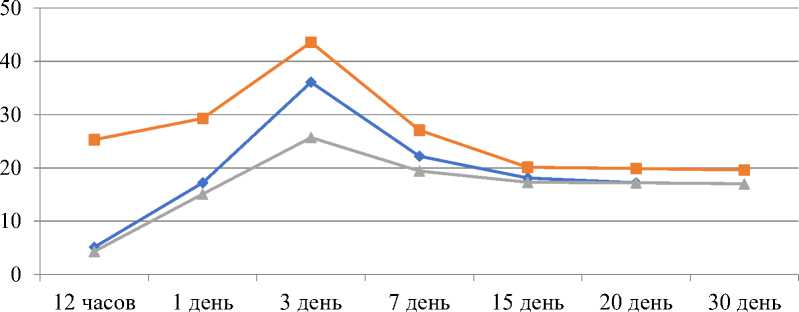
—♦—ГВ-Н
—■—ГВ-Д3
-4-ГВ-Д30
Рисунок 2. Количественные показатели интерлейкина 10 в плазме крови кроликов с экспериментальным острым гнойным воспалением мягких тканей.
Подъем концентрации ИЛ-10 в плазме крови у этих же экспериментальных животных, на 12 ч равное 25,3±0,9 пг/мл. Через 1 сут наблюдалось небольшое падение уровня ИЛ-10 до 29,3±2,7 пг/мл. На сроки 3 и 7 сутки имелось повышение содержания ИЛ-10, так на 3 сутки — 43,6±1,7 пг/мл, 7 сутки — 27,1±2,9 пг/мл, 15 сутки — 20,1±2,1 пг/мл, 20 сутки — 19,9±1,9 пг/мл и на 30-е сутки — 19,6±1,6 пг/мл.
У животных после длительного пребывания в условиях высокогорья, регистрировался подъем ИЛ-1β в плазме крови животных после начала моделирования острого гнойного воспаления мягких тканей через 12 ч равное 4,3±0,3 пг/мл, в сроке 1 сутки — 9,9±0,1 пг/мл, затем уровень ИЛ-1β повышался и на 3 сутки равен был — 11,3±0,4 пг/мл. В последующие дни отмечалось снижение данного показателя — равное 9,6±0,2 и 0,6±0,1 пг/мл. на 7 и 15 дни исследования.
Уровень ИЛ-10 характеризовался не высокими значениями на 3 и 7 сутки, равные 25,7±1,2 пг/мл и 19,4±1,7 пг/мл, на 15 сутки равен был 17,3±1,7 пг/мл, 20 сутки — 17,2±1,2 пг/мл и на 30-е сутки — 17,0±0,3 пг/мл (р<0,05).
Заключение
Таким образом, при асептическом воспалении наблюдалась противоположная динамика выработки одних из ключевых интерлейкинов, с ИЛ-1β с максимальной концентрацией через 12 часов от начала асептического воспаления. Выявленные изменения в содержании цитокинов при экспериментальном асептическом воспалении обусловили своевременную смену и адекватную продолжительность клеточных реакций. При гнойном воспалении динамика секреции цитокинов была однонаправленной, что привело к затягиванию во времени всех клеточных фаз воспалительного процесса.
В период деадаптации после длительного пребывания в условиях высокогорья, отмечается низкая секреция ИЛ-1 и 10, связанное с после истощением защитноприспособительных механизмов.
Список литературы Динамика содержания ИЛ-1 и ИЛ-10 в плазме крови у экспериментальных животных при моделировании раневого процесса в условиях низкогорья и в период деадаптации к высокогорью
- Блатун Л. А. Местное медикаментозное лечение ран. Проблемы и новые возможности их решения // Хирургия. Приложение к журналу Consilium Medicum. 2007. №1. С. 9-15.
- Hsiao G. H., Chang C. H., Hsiao C. W., Fanchiang J. H., Jee S. H. Necrotizing soft tissue infections: surgical or conservative treatment? // Dermatologic surgery. 1998. V. 24. №2. P. 243-248. DOI: 10.1111/j.1524-4725.1998.tb04143.x
- Плотников Ф. В. Комплексное лечение пациентов с гнойными ранами в зависимости от способности микроорганизмов-возбудителей формировать биопленку // Новости хирургии. 2014. Т. 22. №5. С. 575-581. DOI: 10.18484/2305-0047.2014.5.575
- Войновский Е. А. Система лечения ожоговых ран в собственной жидкой среде. М., 2015. 271 с.
- Абаев Ю. К. Хирургическая повязка. Минск. 2005. С. 150-151.
- Можаев Д. А. Результаты пострегистрационного клинического применения мази Офломелид при лечении больных с трофическими язвами венозной этиологии. Самара, 2013. С. 14.
- Березкин М. В. Проблемы ритмов в естествознании: Материалы второго междунар. симп. (1-3 марта 2004 г., Москва). М., 2004. С. 56-57.
- Миррахимов М. М. Высокогорная адаптация. Фрунзе, 1984. С. 3-20.
- Allen D. B., Maguire J. J., Mahdavian M., Wicke C., Marcocci L., Scheuenstuhl H.,.. Hunt T. K. Wound hypoxia and acidosis limit neutrophil bacterial killing mechanisms // Archives of surgery. 1997. V. 132. №9. P. 991-996.
- DOI: 10.1001/archsurg.1997.01430330057009
- Казначеев В. П., Трофимов А. В. ХРОНОЭКОЛОГИЯ: НОВЫЕ АСПЕКТЫ ПРОБЛЕМЫ АДАПТАЦИИ // Эколого-физиологические проблемы адаптации: XI Междунар. симпозиум. 2003. С. 220-221.
- Айдаралиев А. А. Физиологические механизмы адаптации и пути повышения резистентности организма к гипоксии. Фрунзе: Илим, 1978. 90 с.
- Mendez-Eastman S. Use of hyperbaric oxygen and negative pressure therapy in the multidisciplinary care of a patient with nonhealing wounds // Journal of WOCN. 1999. V. 26. №2. P. 67-76.
- DOI: 10.1016/S1071-5754(99)90017-7


