Динамика состояния популяции непарного шелкопряда в ходе вспышки массового размножения в Московской области в 2021–2024 гг.
Автор: Некляев С.Э., Гниненко Ю.И., Лукашевич Р.В., Сергеева Ю.А.
Журнал: Лесохозяйственная информация @forestry-information
Рубрика: Чтения памяти андрея игнатьевича ильинского
Статья в выпуске: 2, 2025 года.
Бесплатный доступ
Описаны результаты изучения особенностей реализации вспышки массового размножения непарного шелкопряда в Московской обл. в 2021– 2024 гг. Установлена фенология развития непарного шелкопряда по фазам вспышки. Определено влияние климатических и биологических факторов на структуру популяции. Показаны особенности воздействия энтомофагов на разных стадиях развития насекомого. Выявлены закономерности развития внутрипопуляционной бакуловирусной инфекции в ходе вспышки.
Непарный шелкопряд, Lymantria dispar, биологическая защита леса, вспышка массового размножения, лиственные породы
Короткий адрес: https://sciup.org/143184421
IDR: 143184421 | УДК: 630.4 | DOI: 10.24419/LHI.2304-3083.2025.2.10
Текст научной статьи Динамика состояния популяции непарного шелкопряда в ходе вспышки массового размножения в Московской области в 2021–2024 гг.
Непарный шелкопряд Lymantria dispar Linnаеus, 1758 (Lepidoptera, Erebidae) является хорошо известным вредителем лиственных лесов европейской части России [1–4], очаги которого регулярно действуют и в Московской обл. [3, 5]. Он отнесён к числу опасных широко распространённых лесных насекомых-вредителей с середины XIX в. [6]. Первая в ХXI в. вспышка массового размножения непарного шелкопряда стала формироваться в лесах Московской обл. в 2019–2020 гг., сначала очаги были обнаружены в её юго-восточной части в 2021 г. [7].
Вспышки непарного шелкопряда в Московской обл. действуют с периодичностью 65 лет (1892–1896 гг.; 1957–1959 гг.; 2021–2024 гг.), в межвспышечный период может происходить увеличение его численности, но крупные очаги не формируются [7].
Предыдущая вспышка 1957–1959 гг. привела к формированию очагов на площади порядка 219 тыс. га [4, 8, 9]. В межвспышечный период (до 2021 г.) наблюдался регулярный подъём численности вредителя – в среднем один раз в 12 лет, но крупных очагов отмечено не было [5, 10–15].
Цель исследования – изучить особенности развития вспышки массового размножения непарного шелкопряда в Московской обл. в 2021–2024 гг. и определить эффективность принятых мер защиты.
Объект и методы исследований
Объект исследования – очаги массового размножения непарного шелкопряда на территории Подмосковной Мещеры в Егорьевском, Шатурском и Луховицком лесничествах. Лесистость территории составляет 51,2%. В районе исследования преобладают сосняки черничный, брусничный, лишайниковый и долгомошный. Лесные участки, подвергавшиеся торфодобыче, представлены производными берёзовыми и осиновыми типами леса, имеются участки дубовых, липовых и сероольховых насаждений. Обследованная территория примыкает к двум районам бывших торфоразработок Госземзапаса общей площадью 37 312 га, а также к 18-ти региональным особо охраняемым природным территориям общей площадью 38 164,2 га.
В ходе обследования использовали известные методики сбора, коллекционирования и идентификации насекомых [16–18]. Их видовую принадлежность устанавливали по морфологическому строению с использованием определителей [19, 20].
Анатомическое строение насекомых исследовали методом прямого микроскопирования (ГОСТ ISO 16000-21–2016) с применением оптического микроскопа MICROS MC300 (объективы 4-100х, окуляры 10x,15х) (Австрия) и бинокулярного стереоскопического МБС-9 (увеличение 3,33–100-кратное) (Россия) [16–18].
Для оценки динамики численности непарного шелкопряда в зоне распространения его очагов закладывали учётные площадки (по 10 деревьев), расположенные через равный интервал (2–5 м) при движении по непровешенной ходовой линии [21–24]. Так как границы очагов изменялись по годам, то количество учётных площадок было разным: в 2021 г. – 227 шт.; в 2022 г. – 430; в 2023 и в 2024 гг. – по 289 шт. Всего было заложено 1 235 учётных площадок. Модельные деревья отбирали на выделе по средним таксационным показателям.
Для определения динамики популяции нами проводилось по 3 учёта ежегодно. Учёт яиц непарного шелкопряда до зимовки осуществлялся во второй декаде сентября, а после зимовки – в первой–третьей декаде апреля: в период от схода снега до пробуждения почек берёзы. Учёт отрождения гусениц выполняли в первой–второй декадах мая в зависимости от фактических погодных условий и фенологических признаков. После проведения мер борьбы количество гусениц учитывали в первой половине июня. Учёты и определение заражённости паразитическими насекомыми и болезнями осуществляли по общепринятым методикам [14, 21, 22, 24, 25]. Степень объедания крон определялась визуально.
Для анализа яйцекладок проводили подсчёт яиц в кладке и взвешивание яйцекладок на весах САРТОГОСМ СЕ224-С (Россия). Затем определяли количество яиц, приходящееся на одно дерево. Собранные яйца анализировали на поражённость энтомофагами и болезнями, устанавливали долю неоплодотворенных яиц [25].
Яйца очищали от «пушка» и подсчитывали. Для очистки кусочком поролона или марли растирали кладку на хлопчатобумажной ткани. Очищенные яйца из 15 кладок с каждой учётной площадки смешивали; затем отбирали из них в случайном порядке 1 000 шт. и разделяли на следующие группы: 1) пустые по неизвестным причинам; 2) пустые, из которых вышли яйцееды (прозрачная скорлупа с небольшим зубчатым отверстием и комочками тёмной массы внутри); 3) неоплодотворённые (розовые или желтоватые); 4) со светлой личинкой яйцееда, которую видно сквозь оболочку яйца; 5) с покрытой волосками гусеницей непарного шелкопряда, которую видно через оболочку. С каждой пробной площади в случайном порядке отбирали по 50 кладок, взвешивали по одной и определяли среднюю массу кладки [25–27].
В ходе обследования устанавливали жизнеспособность яиц с помощью микроскопа бинокулярного стереоскопического МБС-9.
Сбор и анализ куколок непарного шелкопряда выполняли в конце июня и начале июля для получения информации о состоянии популяции. Учёт куколок проводили на 4–5 модельных ветвях, отбираемых из нижней и средней частей кроны в соотношении 1:1,5, на 10 модельных деревьях. Ветви срезали при помощи сучкореза, укреплённого на длинном шесте.
На модельных ветвях подсчитывали отдельно живых гусениц, трупы гусениц, куколок и их шкурки, оставшиеся после вылета бабочек. Куколок складывали в коробки (банки).
В ходе обследования собирали по 100 куколок с каждой учётной площадки с целью дальнейшего анализа. Для определения средней массы куколок из образцов, собранных на учётных площадках, в случайном порядке отбирали 50 здоровых куколок каждого пола и по одной взвешивали на весах САРТОГОСМ СЕ224-С (Россия) [14, 21, 22, 24, 26, 27].
Половой индекс устанавливали по куколкам и вылетевшим из них бабочкам как отношение количества самок к количеству самцов. Проводился учёт отродившихся самцов и самок непарного шелкопряда, а также повреждённых куколок (в результате заражения паразитами и погибших в результате болезней) [14, 21, 22, 24, 26, 27]. Поражённость куколок болезнями устанавливали на основе методик лаборатории биологических методов защиты леса ВНИИЛМ.
В каждой выборке с учётной площадки определяли количество энтомофагов на стадии личинки, коконов и имаго. Личинки и коконы помещали в чашки Петри для отрождения [26, 27].
Учёт гусениц проводили методом парных деревьев одной и той же породы, одинаковых по размерам и сходных по развитию кроны. Для подсчёта гусениц осуществляли спуск 3 модельных ветвей на полог или расчищенную площадку. Разница в количестве гусениц на модельных ветвях до и после обработки принималась за количество погибших особей вредителя [21–24, 26, 27].
Статистическую обработку проводили в пакетах Excel-2016, Statistica-8.0.
Результаты и обсуждение
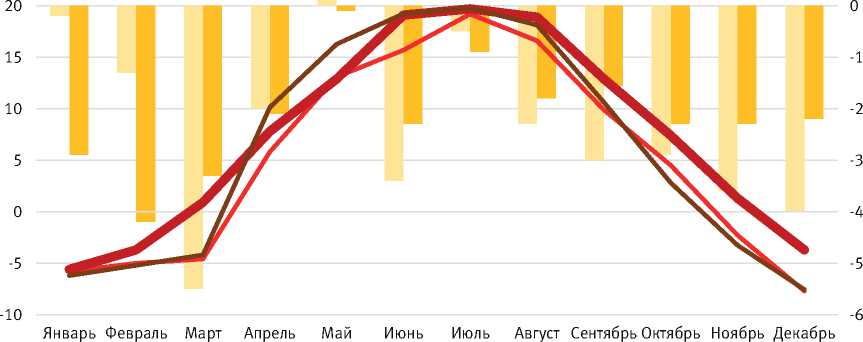
В ходе предыдущих исследований установлено, что на развитие непарного шелкопряда значительное влияние оказывают погодные условия. При сравнении погодных условий вспышек 2021–2024 гг. и 1957–1959 гг. можно отметить, что температурный фон вспышки 2021–2024 гг. был выше на 1,7 °С по сравнению с предыдущей вспышкой, что создало более благоприятные условия для развития вредителя. А на стадиях гусеницы и куколки отмечается увеличение количества осадков на 20,1 мм. При этом в период лёта среднее количество осадков было меньше на 31,7% по сравнению с вспышкой 1957–1959 гг., что способствовало созданию наиболее благоприятных условий.
В ходе реализации вспышки 2021–2024 гг. различия по температуре и количеству осадков наблюдались по отношению к средним многолетним значениям. В период развития гусениц I–II и IV возрастов превышение среднемноголетних значений по температуре достигало 2 °С, а в период окукливания – 3,4 °С, что объясняет не только растянутый выход гусениц, но и их неравномерное развитие внутри границ очага. Необходимо отметить, что такое отклонение температур в период окукливания создавало благоприятные условия для куколочных паразитоидов (рис. 1).
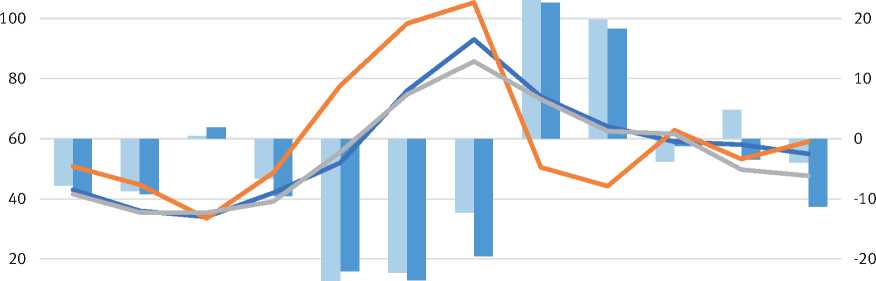
Во время вспышки 2021–2024 гг. в период окукливания наблюдалось увеличение количества осадков по отношению к предыдущей вспышке и к средним многолетним значениям на 37,5%, что обеспечило условия, способствующие развитию болезней внутри популяции. При этом в период лёта наблюдался дефицит осадков (меньше на 35,4%) по отношению как к предыдущей вспышке, так и к среднемноголетним значениям, что позволило бабочкам успешно отложить яйца (рис. 2).
Анализ кормового предпочтения непарного шелкопряда показал, что наиболее короткий цикл развития гусеницы проходят на иве козьей
( Salix caprea L.), на этой же породе отмечалась и наибольшая доля здоровых особей. Кроме того, основной кормовой породой были берёзы повислая ( Betula pendula Roth.) и пушистая ( Betula pubescens L. ( B. Alba Ehrh) – 93% общей площади объедания. На границах с населёнными пунктами и в поймах рек гусеницы также проходили питание на дубе черешчатом ( Quercus robur L.) и яблоне ( Malus spp L.).
Наиболее наглядно ход вспышки иллюстрирует динамика площади очагов. Первые участки с подъёмом численности регистрировались в лесных насаждениях, примыкающих к сельскохозяйственным угодьям и местам бывших торфоразработок. Пик вспышки пришелся на 2022 г., когда очаги охватили более 124 тыс. га леса. В 2023 г. произошел перелом: по результатам осенних учётов площадь очагов сократилась в 2 раза (рис. 3).
Распределение среднего количества кладок и среднего количества яиц на дерево по годам показывает, что в 2022 г. была основная фаза вспышки, так как уже на следующий год эти показатели снизились вдвое. Вместе с тем запас вредителя в насаждениях был настолько высок, что весной 2024 г. среднее количество кладок и яиц на дерево почти не уменьшилось, что объясняется
25 1
Отклонение по T к (1957–1959)
T среднее 1957–1959
T среднее за 100 лет
Отклонение по T к (за 100 лет)
T среднее 2019–2024
Рис. 1. Отклонение средних месячных температур (Т к) во время вспышки 2021–2024 гг. от средних месячных температур во время вспышки 1957–1959 гг. и средних многолетних за 100 лет g 120 30
0 -30
Январь Февраль Март Апрель Май Июнь Июль Август Сентябрь Октябрь Ноябрь Декабрь
^м Отклонение по М к (1957–1959) ^M Отклонение по М к (за 100 лет)
^^^^^M М среднее 1957–1959 ^^^^^M М среднее 2019–2024
^^^^^M М среднее за 100 лет
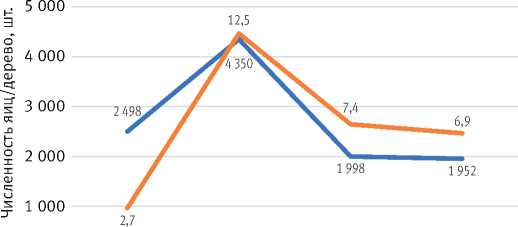
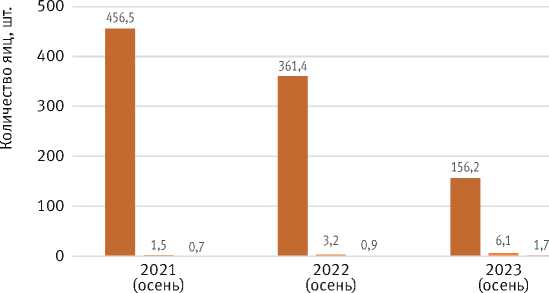
Рис. 2. Отклонение средних месячных сумм осадков (М к) во время вспышки 2021–2024 гг. от средних месячных сумм осадков во время вспышки 1957–1959 гг. и средних многолетних за 100 лет как миграцией очагов, так и благоприятными условиями развития. В среднем по лесничествам осенью 2022 г. отмечалось 12,5 кладок на дерево со средним количеством яиц 4 350 шт., а осенью 2024 г. – уже 6,9 кладок на дерево со средним количеством яиц 1 952 (рис. 4).
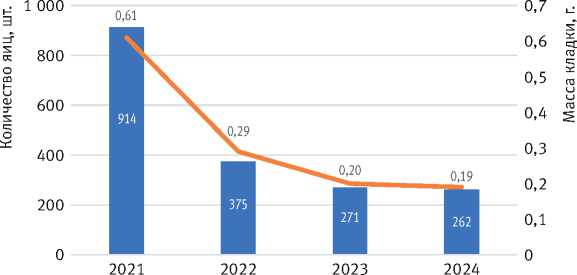
При анализе кладки можно отметить, что с 2022 г. её масса уменьшается с 0,29 г до 0,19 г в 2024 г., что свидетельствует о начале этапа депрессии. Изменение массы кладки коррелирует с количеством яиц в ней. Так, в фазе собственно вспышки в кладке в среднем содержалось порядка 914 яиц, а к началу фазы депрессии в 2023 г. число яиц снизилось на 71,3% (рис. 5).
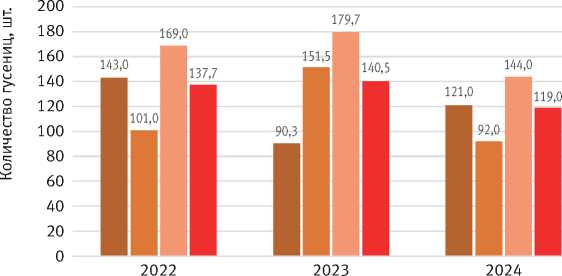
Анализ жизнеспособности яиц в кладке показал, что выживаемость гусениц в период зимовки составляла 97% на фазе максимума вспышки и лишь немного снизилась перед началом депрессии – до 93%. При этом заметен рост количества неоплодотворённых и повреждённых яиц в 3,5 раза, но в целом гибель яиц в результате зимовки не влияла на состояние популяции. Это также указывает на почти полное отсутствие яйцеедов (рис. 6).
Для отслеживания динамики запаса вредителя был проведён контроль отрождения гусениц
03 140 000
124 164,6
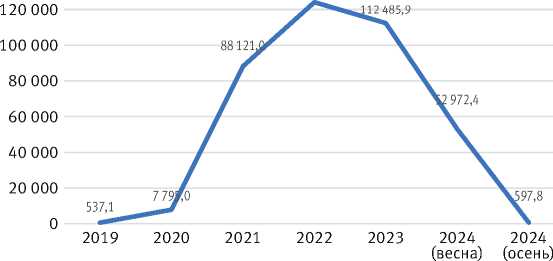
Рис. 3. Изменение площади очагов непарного шелкопряда в Московской обл. в 2019–2024 гг.
2021 2022 2023 2024
Количество кладок/дерево, шт.
^^^^^^ Средняя численность яиц на дерево, шт.
^^^^^ж Среднее количество кладок на дерево, шт.
Рис. 4. Изменение среднего количества кладок на дерево и среднего числа яиц на дерево по годам вспышки
Среднее количество яиц в 1 кладке, шт.
Средняя масса кладки, г
Рис. 5. Изменение средней массы и среднего количества яиц
в кладке по годам вспышки
Всего
Неоплодотворенных
Поврежденных
Рис. 6. Среднее количество яиц в кладке по отношению к неоплодотворённым и повреждённым яйцам в кладке, шт.
Егорьевское Луховицкое
Шатурское Среднее
Рис. 7. Отрождение гусениц в кладках по лесничествам
по лесничествам. В среднем по лесничествам весной 2022 г. количество отродившихся гусениц составило 138, в 2023 г. – 141, в 2024 г. – 119 гусениц. Однако средние значения не отражают пространственного размещения очагов. Анализ показывает, что вспышка начала развиваться в лиственных насаждениях Егорьевского и Шатурского лесничеств, а затем охватила Луховицкое лесничество, продвигаясь на юг (рис. 7).
С 2022 по 2024 г. повреждённые насаждения были обработаны бактериальными препаратами на основе Bacillus thuringiensis, var. kurstaki с титром не менее 10 млрд спор/г.
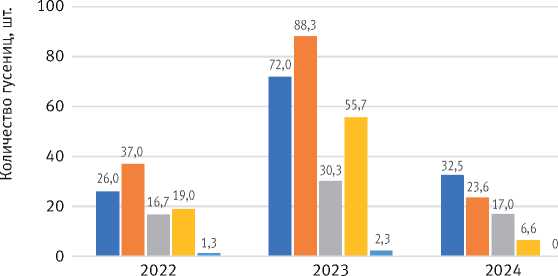
По данным учётов на модельных ветвях, в 2022–2023 гг. в период развития гусениц от I к III возрасту количество особей увеличивалось на 42,3 и 22,6% соответственно, что указывает на высокую степень миграции гусениц в период питания. К 2024 г. количество гусениц III возраста на модельных ветвях снизилось на 28,4% относительно количества гусениц I возраста, что иллюстрирует гибель гусениц от энтомофагов (рис. 8). Основным энтомофагом, паразитировавшим на гусеницах, являлись наездники рода Apanteles (сем. Braconidae). В 2022 г. паразитирование выявлялось единично, а в 2023 г. оно стало массовым, в том числе больных гусениц (рис. 9).
Средняя масса куколки самцов в период максимума увеличивалась на 48,3%, а в период депрессии – всего на 39,5%. При этом масса самок снижалась относительно равномерно: в 2023 г. уменьшение составило 21,7%, а в 2024 г. по отношению к 2023 г. – только 10,5% (рис. 10).
В фазе роста численности вредителя самки превалировали над самцами, их соотношение достигало 0,68, в то время как на фазах максимума и разреживания их отношение оставалось паритетным – 0,5. На фазе депрессии и восстановления половой индекс снизился до 0,38, что свидетельствует о разлёте самцов в поиске самок (рис. 11).
Динамика паразитирования показывает, как происходил рост численности энтомофагов по фазам вспышки. Если в 2021 г. на долю повреждённых и паразитированных куколок приходилось только 13,6%, то к 2024 г. доля таких куколок составила 93,6% (рис. 12).
На протяжении всего периода наблюдений из куколок осуществлялось массовое выведение тахины Agria affinis (Fallen, 1817) (Diptera) (рис. 13). На момент выхода бабочек значительная часть выявленных энтомофагов находилась в стадии личинки или пупария (рис. 14).
Кроме того, в ходе исследований в пробах 2022 и 2023 г. единично был выявлен куколоч-ный паразитоид – наездник Aleiodes indiscretus (Reardon, 1970) (Hymenoptera) (рис. 15).
Анализ внутрипопуляционного инфекционного фона показал, что на третий год вспышки наблюдалось сокращение кормовой базы

АБ

С
Рис. 9. А) Лето 2022 г. – паразитирование на единичных гусеницах. Б) Июнь 2023 г. – массовое паразитирование.
C) Июнь–июль 2023 г. – паразитирование на больных гусеницах
I возраста III возраста
Здоровых III возраста Больных III возраста
Погибших III возраста
Рис. 8. Изменение количества гусениц I и III возрастов на модельных ветвях в период вспышки по физиологическому состоянию после обработки
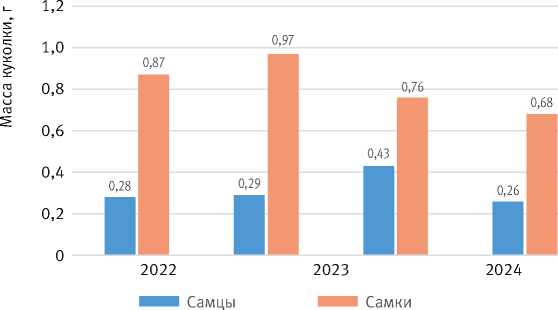
Рис. 10. Изменение массы куколок по годам вспышки
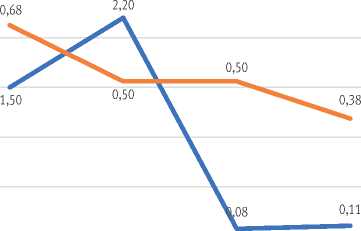
Рост численности
Максимум Разреживание Депрессия и восстановление
0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
Половой индекс
Коэффициент размножения
Половой индекс
Рис. 11. Изменение параметров популяции непарного шелкопряда по фазам вспышки: 1 – рост численности; 2 – максимум (собственно вспышка); 3 – разреживание; 4 – депрессия и восстановление
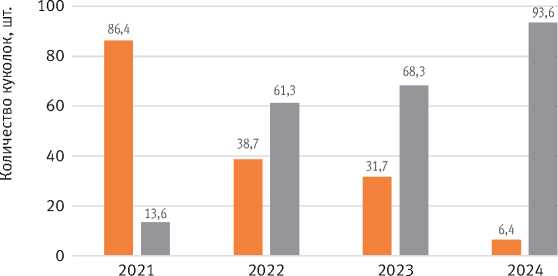
Количество здоровых куколок
Поврежденные и паразитированные куколки
Рис. 12. Соотношение здоровых и паразитированных куколок по годам вспышки

АБВ
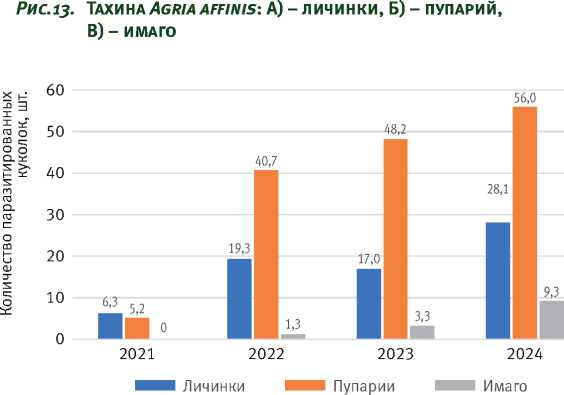
Рис. 14. Распределение тахин по фазам развития на момент отрождения бабочек непарного шелкопряда в пробах по годам вспышки
непарного шелкопряда из-за высокой плотности популяции и конкуренции за кормовую базу, а также переход на питание хвойными растениями, что привело к дистрофии части гусениц (рис. 16).
В ходе исследований установлено, что к 2023 г. внутри популяции непарного шелкопряда

Рис. 15. Наездник Aleiodes indiscretus (Reardon, 1970)

Рис. 16. Дистрофия развития гусениц непарного шелкопряда
активизировалась бакуловирусная инфекция, в результате развития которой погибло в среднем до 35–45% гусениц (рис. 17).

Рис. 17. Погибшие гусеницы в результате развития бакуловирусной инфекции
Выводы
Динамика вспышек массового размножения непарного шелкопряда в 1957–1959 гг. и 2021– 2024 гг. схожа, что подтверждает их цикличность.
В ходе наблюдений за текущей вспышкой массового размножения удалось уточнить фенологию развития непарного шелкопряда. Наблюдается растянутый выход гусениц и такой же растянутый лёт бабочек. Начало отрождения гусениц происходит в последние недели апреля и протекает вплоть до второй половины мая. Гусеницы поднимаются в кроны крайне неравномерно, поэтому в насаждении могут одновременно присутствовать гусеницы I–III возрастов.
В результате исследования установлено, что энтомофаги начинают оказывать значительное влияние на популяцию непарного шелкопряда на третий год вспышки и наибольшее влияние среди энтомофагов на популяцию непарного шелкопряда оказывают мухи-тахи-ны Agria affinis , наездники Aleiodes indiscretus , Apanteles sp.
Применение бактериальных пестицидов не только вызвало формирование искусственной бактериальной эпизоотии в популяциях вредителя, но и сопровождалось ростом паразитирования вредителя энтомофагами и стимулировало распространение внутрипопуляционной бакуло-вирусной инфекции.


