Динамика типа взаимодействия молочнокислых микроорганизмов в парных консорциумах при направленной ферментации овощного сырья
Автор: Кондратенко Владимир Владимирович, Посокина Наталья Евгеньевна, Семенова Жанна Александровна
Журнал: Овощи России @vegetables
Рубрика: Агрохимия
Статья в выпуске: 6 (50), 2019 года.
Бесплатный доступ
Актуальность. Капуста белокочанная ферментируется чаще всего с добавлением различных овощей. При ферментации остаются не только первоначальные питательные вещества, такие как витамин С, аминокислоты, пищевые волокна и др., но также развиваются функциональные микроорганизмы, такие как молочнокислые бактерии. Ферментация оказывает важное влияние на качество и вкус капусты, поэтому важно изучить процесс ферментации, микробное разнообразие и изменение питательных веществ и химических элементов в процессе ферментации. Leuconostoc mesenteroides считается доминирующим видом на ранней гетероферментативной стадии ферментации. Однако имеется мало информации о разнообразии видов и штаммов Leuconostoc, участвующих в ферментации квашеной капусты. Исследования, в которых использовали традиционные биохимические методы изучения ферментации квашеной капусты, показали, что в процессе ферментации задействованы четыре основных вида молочнокислых бактерий: Leuconostoc mesenteroides, Lactobacillus plantarum, Pediococcus pentosaceus и Lactobacillus brevis...
Тип взаимодействия, направленное ферментирование, штаммы молочнокислых микроорганизмов, консорциум, модельная среда
Короткий адрес: https://sciup.org/140245825
IDR: 140245825 | УДК: 635.1/.8:631.563.6 | DOI: 10.18619/2072-9146-2019-6-96-100
Текст научной статьи Динамика типа взаимодействия молочнокислых микроорганизмов в парных консорциумах при направленной ферментации овощного сырья
(ВНИИТеК – филиал ФГБНУ «ФНЦ пищевых систем им. В.М. Горбатова» РАН)
Капуста является одним из самых популярных ферментированных продуктов. Она обычно ферментируется с добавлением различных овощей. При фермента- ции остаются не только первоначальные питательные вещества, такие как витамин С, аминокислоты, пищевые волокна и др., но также развиваются функциональные микроорганизмы, такие как молочнокислые бактерии. Ферментация оказывает важное влияние на качество и вкус капусты, поэтому очень важно изучить процесс ферментации, микробное разнообразие и изменение питательных веществ и химических элементов в процессе ферментации [1]. Процессы ферментации пищевых продуктов часто приводят к глубоким изменениям вкуса по сравнению с исходными ингредиентами. Однако ферментированные продукты обычно представляют собой очень сложные экосистемы с активными ферментными системами из ингредиентов, взаимодействующих с метаболической активностью ферментационных организмов. Такие факторы, как добавленная соль, размеры частиц, температура и уровень кислорода также оказывают важное влияние на процесс ферментации. Очень важна роль молочнокислых бактерий в изменении соединений, которые помогают определить характер ферментированных продуктов [2].
Исследования, в которых использовали традиционные биохимические методы изучения ферментации квашеной капусты, показали, что в процессе ферментации задействованы четыре основных вида молочнокислых бактерий: Leuconostoc mesenteroides, Lactobacillus plantarum, Pediococcus pentosaceus и Lactobacillus brevis .
L. mesenteroides является, пожалуй, наиболее преобладающим видом молочнокислых бактерий, найденных во фруктах и овощах, которые отвечают за инициирование ферментации капусты и других овощей. Осознавая практическое значение L. mesenteroides в ферментации, была определена целая геномная последовательность L. mesenteroides ATCC 8293. L. mesenteroides представляет собой упрощенную, но уникальную модель с интересными характеристиками. Представленные данные оценивают L. mesenteroides как предмет для изучения гетеро-ферментативного метаболизма молочнокислых бактерий [3].
L. mesenteroides считается доминирующим видом на ранней гетероферментативной стадии ферментации. Однако имеется мало информации о разнообразии видов и штаммов Leuconostoc , участвующих в ферментации квашеной капусты. В опыте, проведенном авторами [4], установлено, что конечный рН ферментации капустного сока составлял 3,6, а основными конечными продуктами ферментации были молочная кислота, уксусная кислота и маннит. Показано, что малолактическая активность молочнокислых бактерий может оказать существенное влияние на химические свойства ферментированной капусты, поэтому важно определить, какие виды Leuconostoc преобладают в ферментации и как они взаимодействуют.
Штамм L. mesenteroides LMG 795 4 и штамм Lactobacillus plantarum L4 применяли для контролируемой ферментации кочанов капусты. Наблюдали за параметрами контролируемой и спонтанной ферментации, включая антимикробный эффект рассола капусты, полученного в конце обеих ферментаций. Начальные культуры, применяемые для ферментации кочанов капусты, позволили снизить концентрацию NaCl с 4,0% до 2,5%, значительно ускорить процесс ферментации на 14 дней и улучшить качество продукта. Полученные кочаны квашеной капусты считаются пробиотическим продуктом, поскольку количество жизнеспособных пробиотических клеток в конечном продукте было выше, чем 106 колониеобразующих единиц (КОЕ) на грамм продукта. Результаты этого исследования показали, что применение L. mesenteroides LMG 7954 вместе с Lb. plantarum L4 , положительно повлияло на ферментацию, улучшив качество конечного продукта с добавленными пробиотическими свойствами, значительно сократив время ферментации и предлагая возможность низких солевых ферментаций [5].
Leuconostoс mesenteroides является преобладающим микроорганизмом на ранних стадиях ферментации капусты и оказывает большое влияние на вкус и качество продукта ферментации, поэтому важной задачей являлось изучение характеристик генома L. mesenretoides , а также разнообразие геномов молочнокислых бактерий ( Lactobacillus gasseri, L. casei, L. bulgaricus, and L. brevis, L.
mesenteroides, Oenococcus oeni, Lactococcus cremoris, P. pentosaceus, Streptococcus thermophilus, Brevibacterium linens ) и формирование их в 1 геном консорциум. Данные показали, что бактериофаги могут играть важную роль в естественной смене молочнокислых бактерий [6]. Исследование последовательности бактериофага Leuconostoc mesenteroides Φ 1-A4 , выделенного в процессе промышленной ферментации овощей, представляет собой первую полную геномную и молекулярную характеристику фага Leuconostoc , и результаты исследования могут положить начало развитию технологии управления фагами. Ферментация овощей зависит от правильной последовательности различных молочнокислых бактерий. Инициирует ферментацию L. mesenteroides . По мере протекания процесса ферментации, L. mesenteroides отмирает, а завершает ферментацию другие молочнокислые бактерии. Фаг Ф1-А4, поражающий L. mesenteroides , имеет существенное влияние на развитие вкуса квашенной капусты. В связи с чем нужно отметить, что правильное чередование молочнокислых микроорганизмов непосредственно определяет качество и безопасность готовой ферментированной продукции [7].
На процесс ферментации квашеной капусты могут влиять технологические, микробиологические и сырьевые факторы: хлорид натрия, углеводы, температура, стартерные культуры. Бактериофаги в ферментации квашеной капусты не вызывают особых проблем, так как их распространение внутри ферментера очень ограничено. Молочная кислота, полученная в процессе ферментации капусты, обычно состоит из двух изомеров L-(+) и D-(-) формах. Большая потребность существует в продуктах, содержащих преимущественно L-(+) – молочной кислоты, а исследование гетероферментативных лактобацилл в ферментации квашеной капусты привело к выделению штаммов, характеризующихся исключительно образованием именно этой кислоты. Такая квашеная капуста производится с помощью применения стартерной культуры Lb. Sakei , которая способна даже подавлять штаммы, инициирующие брожение – L. mesenteroides . В связи с чем, можно сделать вывод, что молочнокислые бактерии, участвующие в ферментации квашеной капусты улучшают свойства квашеной капусты и помогают укреплению здоровья человека [8].
Учитывая важность проведения двухстадийной ферментации овощного сырья, с тем, чтобы на первом этапе создать оптимальные условия для развития «основного» пула молочнокислых микроорганизмов, актуальным становится проведения комплекса исследований, направленных на воспроизведения «природоподобного» процесса, в котором на первом этапе основную роль играют бактерии рода Leuconostoc mesenteroides, на втором – монокультуры молочнокислых микроорганизмов и их консорциумы.
Цели и задачи – исследовать динамику типа взаимодействия молочнокислых микроорганизмов в парных консорциумах на модельных средах, прошедших предварительную обработку культурой вида Leuconostoc mesenteroides , на основном этапе ступенчатого ферментирования капусты белокочанной сорта Парус.
Материалы и методы
В качестве объектов исследований были взяты:
– штаммы микроорганизмов рода Leuconostoc mesen-teroides, Lactobacillus brevis, Lactobacillus casei и Lactobacillus plantarum , предоставленные ФГУП ГосНИИгенетика;
– стерилизованная модифицированная модельная среда на основе капусты белокочанной сорта Парус.
Модельную среду готовили последовательными операциями, включающими мойку сырья проточной водой, шинкование на полоски толщиной не более 8 мм, гомогенизацию на измельчителе растительного сырья до получения однородной кашицеобразной массы. В полученную массу вносили NaCl в количестве 1,5% от массы среды, перемешивая до полного растворения. Среду фасовали в стеклянные банки объёмом 0,1 дм3 с винтовым типом укупорки, герметично укупоривали и стерилизовали при избыточном давлении 1 бар в течение 20 мин с последующим охлаждением до комнатной температуры, затем в стерильных условиях добавляли аскорбиновую кислоту в количестве 35 мг на 100 г среды, перемешивали до полного растворения и вторично укупоривали также в стерильных условиях.
Процесс ферментации осуществляли в два последовательных этапа. На первом (предварительном) этапе модельную среду инокулировали суспензией L.
mesenteroides с концентрацией микроорганизмов 104 КОЕ/г в количестве 1,76% от массы среды и инкубировали в чашках Петри при температуре 23...25°С в течение 72 ч. На втором (основном) этапе в подготовленные среды вносили инокулят монокультур (штаммы L. brevis, L. casei и L. plantarum ) и консорциумов ( «L. brevis + L. casei», «L. brevis + L. plantarum» и «L. plantarum + L. casei» ) молочнокислых микроорганизмов с общей концентрацией 104 КОЕ/г в количестве 2% от массы среды. Основной этап ферментации проводили при температуре 25°С в течение 32 суток. Отбор проб на основной стадии ферментации проводили как в контрольном варианте с L. mesenteroides через 0, 1, 2, 3, 7 и 10 суток, так и в вариантах с культурами Lactobacillus и их консорциумами через 0, 3, 7, 8, 9, 14, 18, 23 и 32 суток, отсчитывая с момента начала первой стадии ферментирования. В силу объективного присутствия в начальный период основного этапа ферментации некоторой остаточной концентрации практически неактивных клеток микроорганизмов L. mesenteroides , общий микробиологический состав сред после внесения монокультур лактобацилл рассматривали как псевдоконсорциумы, в отличие от истинных консорциумов, образуемых при внесении одновременно двух монокультур лактобацилл.
Определение скорости культивирования микроорганизмов проводили путём контроля концентрации микроорганизмов в модельной среде в процессе культивирования в точках отбора проб на протяжении всего процесса ферментации путем посева в агаризованную питательную среду разведений отобранного образца. Посевы инкубировали при температуре 30°С в течение 72/120 часов с последующим подсчётом общего количества всех видимых колоний.
Для уменьшения статистической погрешности каждый эксперимент проводили в трёхкратной повторности с отбраковкой статистически недостоверных данных.
Граничные условия применимости критериев оценки потенциала трансформации некрахмальных биополимеров углеводной природы растительного сырья определяли с использованием частной функции желательности Харрингтона по [9].
Отбор проб при исследовании первого этапа ферментации с культурой L. mesenteroides проводили на 0-3-4-56-7 сутки. Отбор проб при исследовании второй стадии ферментации с культурами Lactobacillus и их консорциумами проводили для каждой культуры и консорциума по истечении 0, 3, 7, 8, 9, 14, 18, 23 и 32 суток ферментирования, отсчитывая с момента инокуляции.
Для предотвращения контаминации исследуемых образцов сторонней микрофлорой, отбор проб проводили в боксе стерильными инструментами. Образцы отбирали в одноразовые чашки Петри по 1 г для микробиологических исследований.
Концентрацию молочнокислых микроорганизмов определяли по [10,11]. Определение проводили путем посева в агаризованную питательную среду разведений отобранных проб, инкубирования посевов при температуре 30°С в течение 72/120 часов и подсчёта всех видимых колоний.
Математическую обработку и моделирование проводили с использованием табличного процессора Microsoft Excel 2010 (Microsoft Corporation) с установленными надстройками «Анализ данных», «Поиск решения» и «Подбор параметра», а также специализированного программного обеспечения – TableCurve 2D v.5.01 (SYSTAT Software Inc.) и Wolfram Mathematica v.10.4 (Wolfram Research Inc.)
Обработку экспериментальных данных проводили по следующему алгоритму:
-
а) отсеивали статистически ненадёжные экспериментальные данные в повторностях по существующим методикам;
-
б) массив данных, представляющих динамику исследуемого или промежуточного показателя, аппроксимировали двухфакторными функциями вида y=f(x) при следующих граничных условиях:
-
– квадрат коэффициента корреляции должен быть не менее 0,96;
– вид аппроксимирующей функции должен подчиняться логике процесса (также и при экстраполяции);
– коэффициенты и константа должны быть значимы по критерию Стьюдента при α ≤ 0,05;
– вся функция в целом должна быть адекватна по критерию Фишера при α ≤ 0,05.
Результаты
Анализ данных показал, что функциональные зависимости, наиболее адекватно аппроксимирующие экспериментальные данные, имеют вид:
– для монокультуры L. mesenteroides :
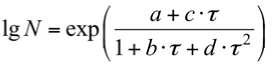
где N – концентрация микроорганизмов, КОЕ/г τ– продолжительность ферментации, ч a – константа b, c, d и f – коэффициенты
– для псевдоконсорциума L. mesenteroides \ L. brevis :
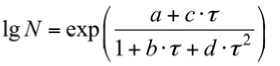
– для псевдоконсорциума L. mesenteroides \ L. casei :
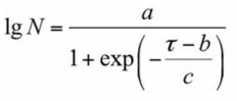
– для псевдоконсорциума L. mesenteroides \ L. plantarum :
lg N = exp
я + ст + /т2X + bT + dr2 + /-т3
В силу неоднозначности полученных зависимостей исследовали динамику темпа нарастания концентрации микроорганизмов как в псевдоконсорциумах, так и в консорциумах.
Темпы нарастания концентрации микроорганизмов вида υ=f_v (τ) определяли дифференцированием функций (2) – (4) по их аргументу:
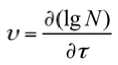
где υ – темп нарастания концентрации микроорганизмов, [lg (КОЕ/г)]/ч.
Для удобства графического представления логики дальнейших рассуждений, функции темпов были преобразованы следующим образом:
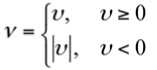
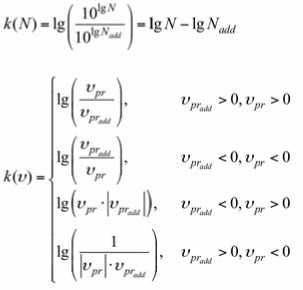
При выраженной lg N, значения темпа нарастания концентрации микроорганизмов для разных моментов времени будут логически неэквивалентны друг другу даже в случае их численного равенства. Поэтому дальнейшие расчёты выполняли приведёнными значениями темпа:
i/ = —-IO8P IgN
Аддитивные значения концентрации и приведённого темпа нарастания микроорганизмов в консорциумах рассчитывали, соответственно, как
и
РГ«М Д -r
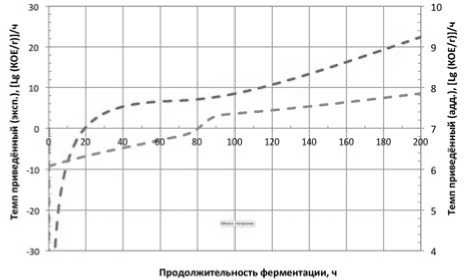
Рис.1. Экспериментальная и аддитивная функции изменения приведённых темпов убывания концентрации микроорганизмов консорциума L. mesenteroides \ L. brevis + L. casei Красная линия – консорциум; серая – аддитивная кривая Fig.1. Experimental and additive change functions the reduced rate of decrease in the concentration of microorganisms consortium L. mesenteroides \ L. brevis + L. casei
The red line is the consortium; gray – additive curve
На рисунках 1-3 приведены экспериментальные и аддитивные зависимости темпов нарастания концентраций консорциумов от продолжительности культивирования.
Анализ данных, приведённых на рисунке 1, показывает не просто отсутствие фазы нарастания микробиальной биомассы, но и прогрессирующее нарастание темпа убывания концентрации, превышающего аддитивное значение уже после 10 часов культивирования, что говорит о том, что культуры L. brevis и L. casei в условиях основного
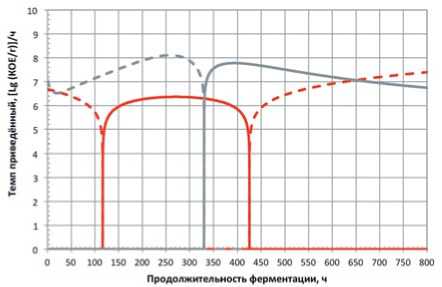
Рис. 2. Экспериментальная и аддитивная функции изменения приведённых темпов убывания концентрации микроорганизмов консорциума L. mesenteroides \ L. brevis + L. plantarum Красные линии – консорциум; серые – аддитивные кривые; сплошные – темпы нарастания; штриховые – темпы убывания
Fig.2. Experimental and additive change functionsthe reduced rate of decrease in the concentration of microorganisms consortium L. mesenteroides \ L. brevis + L. plantarum
Red lines – consortium; gray – additive curves; solid – growth rates; dashed – the rate of decrease
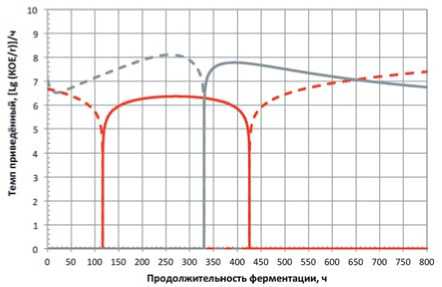
Рис. 3. Экспериментальная и аддитивная функции изменения приведённых темпов убывания концентрации микроорганизмов консорциума L. mesenteroides \ L. casei+ L. plantarum Красные линии – консорциум; серые – аддитивные кривые; сплошные – темпы нарастания; штриховые – темпы убывания
Fig. 3. Experimental and additive change functions the reduced rate of decrease in the concentration of microorganisms consortium L. mesenteroides \ L. casei+ L. plantarum
Red lines – consortium; gray – additive curves; solid – growth rates; dashed – the rate of decrease этапа ферментирования не просто испытывают стресс, но и оказывают негативное влияние друг на друга в консорциуме.
В силу значительной разобщённости, адекватная интерпретация информации, представленной на рисунках 2 и 3, затруднена. В этой связи для полновесной оценки динамики развития консорциумов на основном этапе ферментирования исследовали показатели сравнения как для концентрации микроорганизмов, так и для темпов её нарастания и убывания.
Показатели сравнения для данных показателей рассчитывали, соответственно, как
На рисунках 4-6 представлены показатели сравнения по приведённому темпу и концентрации микроорганизмов для исследованных консорциумов.
Анализ данных, представленных на рисунке 4, показывает слабый синергизм по концентрации микроорганизмов с 25 по 120 часы культивирования, что указывает на некоторое благотворное влияние соседствующих культур
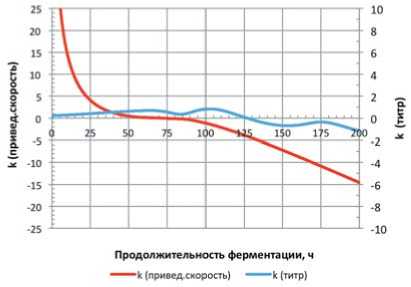
Рис. 4. Динамики показателей сравнения для консорциума L. mesenteroides \ L. brevis + L. casei k (привед. скорость) – показатель сравнения по приведённому темпу; k (титр) – показатель сравнения по концентрации микроорганизмов Fig. 4. Dynamics of comparison indicators for the consortium L. mesenteroides \ L. brevis + L. casei k (speed) – the indicator of comparison by the given rate; k (titer) – comparison indicator for the concentration of microorganisms
^^к (приведсиорость) к (титр)
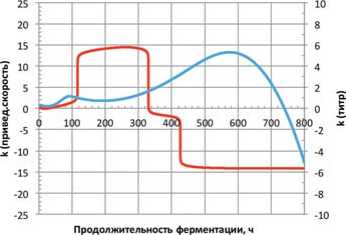
Рис. 5. Динамики показателей сравнения для консорциума L. mesenteroides \ L. brevis + L. plantarum k (привед. скорость) – показатель сравнения по приведённому темпу; k (титр) – показатель сравнения по концентрации микроорганизмов
Fig. 5. Dynamics of comparison indicators for the consortium L. mesenteroides \ L. brevis + L. plantarum k (reduced speed) is a comparison indicator for the reduced rate; k (titer) – a comparison indicator for the concentration of microorganisms
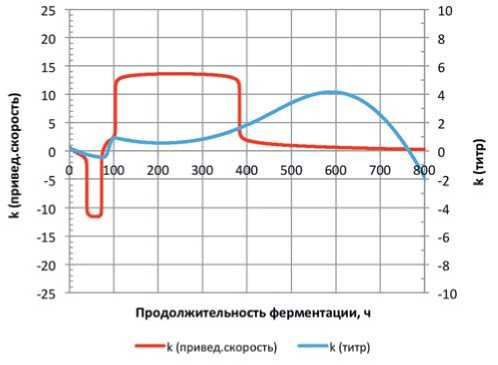
Рис. 6. Динамики показателей сравнения для консорциума L. mesenteroides + L. casei + L. plantarum k (привед. скорость) – показатель сравнения по приведённому темпу; k (титр) – показатель сравнения по концентрации микроорганизмов Fig.6. Dynamics of comparison indicators for the consortium L. mesenteroides + L. casei + L. plantarum k (reduced speed) is a comparison indicator for the reduced rate;
k (titer) – a comparison indicator for the concentration of microorganisms
друг на друга в части сосуществования, несколько замедляя темп отмирания, но по истечении 100 часов культивирования подобный синергизм сходит на нет.
Анализ результатов, представленных на рисунках 5 и 6, показывает выраженный синергизм взаимодействия культур в консорциуме в отношении концентрации микроорганизмов практически в течение всего основного этапа ферментирования. Однако в отношении показателя сравнения по приведённому темпу в случае с консорциумом « L. mesenteroides \ L. brevis + L. plantarum » отмечен переход в фазу антагонизма по прошествии чуть более 330 часов с начала процесса, что, вероятно указывает на проявление некоторого депрессирующе-го фактора.
По сумме критериев консорциум « L. mesenteroides + L. casei + L. plantarum » демонстрирует наиболее выраженное преимущество по сравнению с культивированием соответствующих монокультур в формате псевдоконсорциумов. Тем не менее, консорциум « L. mesen-teroides \ L. brevis + L. plantarum » также демонстрирует преимущество, однако динамика показателя сравнения по темпу нарастания концентрации микроорганизмов указывает на необходимость проведения дополнительных исследований.
Выводы
-
1. Установлено, что по сумме критериев консорциум « L. mesenteroides \ L. casei + L. plantarum » демонстрирует наиболее выраженное преимущество по сравнению с культивированием соответствующих монокультур в формате псевдоконсорциумов.
-
2. Установлено, что, несмотря на выраженный синергизм при культивировании консорциума « L. mesen-teroides \ L. brevis + L. plantarum », динамика показателя сравнения по темпу нарастания концентрации микроорганизмов указывает на необходимость проведения дополнительных исследований.
Об авторах: About the authors:
Кондратенко Владимир Владимирович – зам. директора по науке, к.т.н. Vladimir V. Kondratenko – Deputy Director for Science, Посокина Наталья Евгеньевна – зав. лабораторией Candidate of Technical Sciences (Ph.D.)
технологии консервирования, к.т.н. Nataliya E. Posokina – Head of the laboratory,
Jeanne A. Semenova – Researcher
-
• Литература / References
-
1. Zhang Yu-Long; Hu Ping; Zhan Jian-Long. Research of fermented sauerkraut and its advancement. Journal of Food Safety and Quality. 2014;5(12):3998-4003.
-
2. McFeeters R. F. Fermentation Microorganisms and Flavor Changes in Fermented Foods. Journal of food science . 2004;69(1):35-37.
-
3. Plengvidhya, Vethachai. Microbial ecology of sauerkraut fermentation and genome analysis of lactic acid bacterium Leuconostoc mesenteroides ATCC 8293. Food Science. 2004.
-
4. Ji Young Jung, Seung Hyeon Lee, Se Hee Lee and Che Ok Jeon. Complete Genome Sequence of Leuconostoc mesenteroides subsp. mesenteroides Strain J18, isolated from kimchi. Journal of Bacteriology. 2012;194(3):730–731.
-
5. B. Wiander Hannu J.T. Korhonen. Preliminary studies on using LAB strains isolated from spontaneous sauerkraut fermentation in combination with mineral salt, herbs and spices in sauerkraut and sauerkraut juice fermentations. Agricultural and Food Science. 2011;20:176–182.
-
6. Dimic G.R. Characteristics of the Leuconostoc mesenteroides strains from fresh vegetables. Original scientific paper . 2006. P.3-11.
-
7. F. Breidt, K.A. Crowley, H.P. Fleming. Isolation and characterization of nisin-
resistant Leuconostoc mesenteroides for use in cabbage fermentations. Applied and Environmental Microbiology. 1993. P.3778-3783.
-
-
8. L.J. Harris, H.P. Fleming, T.R. Klaenhammer. Novel paired starter culture system for sauerkraut, consisting of a nisin-resistant Leuconostoc mesenteroides strain and a nisin-producing Lactococcus lactis strain. Appl. Environ. Microbiol .1992;58 (5):1484-1489.
-
9. Harrington E.C. The Desirability Function. Industrial Quality Control . 1965;21:494-498.
-
10. ГОСТ 10444.11-2013 (ISO 15214:1998) Микробиология пищевых продуктов и кормов для животных. Методы выявления и подсчета количества мезофильных молочнокислых микроорганизмов. М.: Стандартинформ, 2014. 23 с. [GOST 10444.11-2013 (ISO 15214:1998) Microbiology of food and animal feed. Methods of detection and counting of mesophilic lactic acid microorganisms. Moscow: STANDARTINFORM, 2014. 23 p.]
-
11. ГОСТ ISO 7218-2015 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям. М.: Стандартинформ, 2015. 70 с. [GOST ISO 7218-2015 Microbiology of food and animal feed. General requirements and recommendations for microbiological studies. Moscow: STANDARTINFORM, 2015. 70 p.]
Список литературы Динамика типа взаимодействия молочнокислых микроорганизмов в парных консорциумах при направленной ферментации овощного сырья
- Zhang Yu-Long; Hu Ping; Zhan Jian-Long. Research of fermented sauerkraut and its advancement. Journal of Food Safety and Quality. 2014;5(12):3998-4003.
- McFeeters R. F. Fermentation Microorganisms and Flavor Changes in Fermented Foods. Journal of food science. 2004;69(1):35-37.
- Plengvidhya, Vethachai. Microbial ecology of sauerkraut fermentation and genome analysis of lactic acid bacterium Leuconostoc mesenteroides ATCC 8293. Food Science. 2004.
- Ji Young Jung, Seung Hyeon Lee, Se Hee Lee and Che Ok Jeon. Complete Genome Sequence of Leuconostoc mesenteroides subsp. mesenteroides Strain J18, isolated from kimchi. Journal of Bacteriology. 2012;194(3):730-731.
- B. Wiander Hannu J.T. Korhonen. Preliminary studies on using LAB strains isolated from spontaneous sauerkraut fermentation in combination with mineral salt, herbs and spices in sauerkraut and sauerkraut juice fermentations. Agricultural and Food Science. 2011;20:176-182.
- Dimic G.R. Characteristics of the Leuconostoc mesenteroides strains from fresh vegetables. Original scientific paper. 2006. P.3-11.
- F. Breidt, K.A. Crowley, H.P. Fleming. Isolation and characterization of nisinresistant Leuconostoc mesenteroides for use in cabbage fermentations. Applied and Environmental Microbiology. 1993. P.3778-3783.
- L.J. Harris, H.P. Fleming, T.R. Klaenhammer. Novel paired starter culture system for sauerkraut, consisting of a nisin-resistant Leuconostoc mesenteroides strain and a nisin-producing Lactococcus lactis strain. Appl. Environ. Microbiol. 1992;58 (5):1484-1489.
- Harrington E.C. The Desirability Function. Industrial Quality Control. 1965;21:494-498.
- ГОСТ 10444.11-2013 (ISO 15214:1998) Микробиология пищевых продуктов и кормов для животных. Методы выявления и подсчета количества мезофильных молочнокислых микроорганизмов. М.: Стандартинформ, 2014. 23 с. [GOST 10444.11-2013 (ISO 15214:1998) Microbiology of food and animal feed. Methods of detection and counting of mesophilic lactic acid microorganisms. Moscow: STANDARTINFORM, 2014. 23 p.]
- ГОСТ ISO 7218-2015 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям. М.: Стандартинформ, 2015. 70 с. [GOST ISO 7218-2015 Microbiology of food and animal feed. General requirements and recommendations for microbiological studies. Moscow: STANDARTINFORM, 2015. 70 p.]


