Динамика уровня маркера острого повреждения почек KIM-1 в моче онкологических больных, получающих химиотерапию с цисплатином
Автор: Сергеева Н.С., Кармакова Т.А., Савчина В.В., Дшкина Т.И., Карпенко Е.Ю., Болотина Л.В., Алентов И.И., Маршутина Н.В., Феденко А.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 т.22, 2023 года.
Бесплатный доступ
Препараты платины - основной компонент большинства схем химиотерапии (ХТ) онкологических больных, однако возможность их применения может быть лимитирована нефротоксичностью. На роль раннего маркера острого повреждения почек (ОПП), индуцированного цисплатином, претендует KIM-1 (kidney injury molecule 1). Цель исследования - оценить динамику содержания KIM-1 в моче (uKIM-1) у пациентов, получающих ХТ, с высоким риском нефротоксического действия на протяжении всего курса противоопухолевого лекарственного лечения. материал и методы. В исследование включено 19 первичных больных солидными злокачественными новообразованиями. Уровень uKIM-1 определяли методом иммуноферментного анализа перед каждым циклом ХТ (режимы, включающие цисплатин или оксалиплатин) и через сутки после введения цитостатиков. Величины uKIM-1 нормировали на концентрацию в моче креатинина (uKIM-1). Состояние почек оценивали по содержанию в крови креатинина (sCr) и скорости клубочковой фильтрации (СКФ). Результаты. До начала лечения лабораторные показатели функционального состояния почек у пациентов находились в пределах нормальных значений. На фоне ХТ только у 1 (5,3 %) больного наблюдалось увеличение sCr более чем на 50 % и снижение СКФ до 68 мл/мин/1,73 м2, что соответствует I стадии ОПП (KDIGO). uKIM-1 до начала лечения превышал верхнюю границу нормы (3,4 нг/мгuCr) у 3 больных (15,8 %; медиана 2,1 нг/мгuCr); к началу 2-го курса ХТ - у 9 больных (47,4 %; медиана 3,2 нг/мгuCr; р=0,0025, критерий Манна-Уитни); к началу 3-го курса - у 12 больных (63,2 %; медиана 4,9 нг/мгuCr; р=0,00007). На фоне ХТ с цисплатином средний уровень uKIM-1 нарастал с каждым последующим циклом, в большинстве случаев - уже через 1 сут после введения цитостатиков. При использовании схем ХТ, не включающих цисплатин, но содержащих оксалиплатин, увеличения uKIM-1 на фоне лечения не наблюдалось. Достижение показателем uKIM-1 порогового уровня 6,0 нг/мгuCr к началу очередного цикла ХТ было ассоциировано с высокой вероятностью дальнейшего его увеличения (RR=18,8; p=0,0051). заключение. Возрастание уровня uKIM-1 после введения цисплатина может расцениваться как проявление субклинического повреждения почек. Увеличение uKIM-1 в начале очередного цикла ХТ в перспективе может быть основанием для усиленных профилактических мероприятий или назначения менее нефротоксичных схем лечения.
Молекула повреждения почек 1 (kim-1), химиотерапия, цисплатин, нефротоксичность
Короткий адрес: https://sciup.org/140302020
IDR: 140302020 | УДК: 616-006-08-06+616.61+615.28 | DOI: 10.21294/1814-4861-2023-22-4-44-54
Текст научной статьи Динамика уровня маркера острого повреждения почек KIM-1 в моче онкологических больных, получающих химиотерапию с цисплатином
Химиотерапия (ХТ) относится к базовым методам лечения онкологических больных. Производные платины (цисплатин, карбоплатин и оксалиплатин) входят во многие современные схемы ХТ и применяются в неоадъювантном, адъювантном и лечебном режимах при различных злокачественных опухолях [1]. Цисплатин (цис-диамминдихлорплатина [II]) – наиболее широко используемый противоопухолевый препарат этого класса [2]. Одним из серьезных дозолимитирующих факторов его применения является нефротоксичность [3].
Развитие нефротоксичности приводит к необходимости уменьшения дозы препарата или полного отказа от его использования, что негативным образом может отразиться на эффективности лечения. Кроме того, дисфункция почек снижает качество жизни больных и ухудшает общий прогноз. Поэтому раннее выявление и своевременная коррекция почечных нарушений у больных, получающих ХТ, важны для обеспечения наилучших результатов противоопухолевого лечения. Все это диктует необходимость пристального контроля почечной функции у больных, которые получают ХТ, включающую препараты платины.
Рутинные показатели нарушения функции почек – снижение скорости клубочковой фильтрации (СКФ), возрастание концентрации креатинина и мочевины в крови, а также протеинурия – выявляются лишь спустя сравнительно большой срок (до 10 дней) после нефротоксического воздействия, т. е. являются поздними индикаторами цисплатин-индуцированной нефротоксичности [4, 5]. Кроме того, существенные изменения этих показателей происходят при значительной степени повреждения почек (снижение функции на 50 % и более). Следовательно, необходимо внедрение в клиническую практику новых маркеров, информативных для раннего и надежного выявления нарушения функции почек в процессе химиотерапии.
При подборе маркеров цисплатин-индуциро-ванной нефротоксичности следует учитывать, что цисплатин аккумулируется в основном в эпителии проксимальных почечных канальцев, что приводит к повреждению и гибели эпителиальных клеток и, как результат, к нарушению функции почек [6]. Одной из молекул, претендующих на роль раннего маркера повреждения почек, является KIM-1 (kidney injury molecule 1) – трансмембранный гликопротеин, который в ткани нормальной почки синтезируется в эпителии проксимальных почечных канальцев в следовых количествах и присутствует в моче в низкой концентрации. Содержание KIM-1 в моче (uKIM-1) увеличивается при остром повреждении почек (ОПП) и хронической почечной недостаточности различной этиологии [7]. Среди потенциальных биологических маркеров ОПП увеличение уровня uKIM-1 расценивают как наиболее ранний показатель повреждения проксимальных отделов нефрона [8–10].
В ряде исследований показано, что у больных, получающих цисплатин-содержащую ХТ, повышение уровня uKIM-1 наблюдается уже в первые дни после введения цитостатика [11–18]. Также выявлена достоверная корреляция между возрастанием концентрации uKIM-1 и развитием у больных ОПП [11, 12, 14, 15, 18]. Однако эти исследования в большинстве своем были ограничены определением уровня uKIM-1 при первом и однократном введении противоопухолевых препаратов. Кроме того, опубликованные результаты отличаются по срокам наблюдения и демонстрируют разную динамику uKIM-1, а оценка авторами клинической значимости этого показателя неоднозначна. Вследствие этого критерии для оценки KIM-1 как маркера цисплатин-опосредованной нефротоксичности пока не разработаны.
Цель исследования – оценить динамику uKIM-1 у онкологических больных, получающих ХТ с высоким риском побочного нефротоксического действия на протяжении всего цикла противоопухолевого лекарственного лечения.
Материал и методы
В исследование включены пациенты, получавшие ХТ в МНИОИ им. П.А. Герцена в 2021–22 гг. Протокол исследования одобрен комитетом по биомедицинской этике МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России (Протокол № 659 от 5 февраля 2021 г.). Критериями включения являлись: возраст старше 18 лет; общее состояние по шкале Карновского более 70 %; первая линия лекарственного противоопухолевого лечения.
Согласно утвержденным клиническим рекомендациям для каждого вида опухоли, 16 больных получали ХТ, содержащую цисплатин (схема TPF – 5 больных, TP – 6, TP + цетуксимаб – 2, EP – 1, TIP/TF – 1, АР – 1); у 3 больных схема терапии включала оксалиплатин (FLOT – 2, FOLFOX – 1). Разовая доза цисплатина у большинства пациентов составляла 75 мг/м2 и варьировала от 70 мг/м2 (режим EP) до 120 мг/м2 (режим АР). Дополнительно все больные получали профилактическую терапию: гидратацию (внутривенные инфузии 5 % раствора глюкозы и 0,9 % раствора хлорида натрия за 12–24 ч до введения цисплатина), дексаметазон и филграстим по показаниям. Все участники были проинформированы о протоколе исследования и заполнили форму информированного согласия. Протокол исследования был одобрен этическим комитетом МНИОИ им. П.А. Герцена.
Образцы утренней мочи для определения уровня uKIM-1 получали в день начала каждого цикла ХТ (до введения цитостатиков) и на следующий день, т.е. через 1 сут после введения. Содержание uKIM-1 (нг/мл) определяли иммуноферментным методом с использованием тест-системы EnzoLife Sciences KIM-1 ELISA (США). Преаналитическая подготовка мочи включала ее центрифугирование при 3000 g в течение 15 мин. Измерение оптической плотности в пробах проводили на иммунологическом анализаторе Multiscan EX (Thermo Electron, Instrument Co., LTD, Китай). Линейный участок калибровочной кривой соответствовал диапазону концентраций uKIM-1 от 1,279 х 10-3нг/мл до 0,5 нг/мл. Если измеренный уровень uKIM-1 превосходил 0,5 нг/мл, мочу разводили специальным буфером и анализ повторяли. Концентрацию uKIM-1 нормировали на концентрацию в моче креатинина (uCr). Содержание uCr (мг/мл) определяли на биохимическом автоматическом анализаторе AU680 (Beckman Coulter,Inc, США). Если анализ не проводили в течение суток после получения образца биологического материала, то мочу аликвотировали и замораживали при 80 °С. Срок хранения образцов не превышал 3 мес.
Величины uKIM-1, нормированного на креатинин мочи, характерные для нормы, установлены нами ранее при исследовании мочи 56 здоровых лиц [19]: интервал вариации показателя составил 0,1–3,4 нг/мгuCr, медиана и величины 1 и 3-го квартилей – 0,8 (0,5; 1,2) нг/мгuCr. При оценке изменения величин показателя у индивидуальных больных в динамике, принимая во внимание аналитическую точность используемых методов и воспроизводимость результатов анализа, значимым считали увеличение или снижение уровня uKIM-1 не менее чем на 0,5 нг/мгuCr.
Перед каждым циклом ХТ больным выполняли общепринятый комплекс исследований крови и мочи, в том числе биохимический анализ крови с определением концентрации креатинина (sCr, мкмоль/л) и мочевины (ммоль/л). В ходе анализа результатов учитывали данные рутинных клинических лабораторных исследований через 2–3 мес после окончания курсов ХТ. При оценке уровня sCr использовали следующие референсные значения: 58,0–96,0 мкмоль/л для женщин и 72,0–127,0 мкмоль/л для мужчин. Скорость клубочковой фильтрации (СКФ, мл/мин/1,73 м2) рассчитывали по формуле CKD-EPI [20] с использованием online-калькулятора [21]. Признаком поражения почек, согласно рекомендациям KDIGO (Kidney Disease: Improving Global Outcomes), считали увеличение концентрации sCr более чем на 26,5 мкмоль/л либо на 50 % и более по сравнению с исходным уровнем показателя [22].
Для характеристики распределения показателей в группах использовали базовые статистические характеристики. Отличия между группами оценивали с применением непараметрических инструментов анализа: U-критерия Манна–Уитни, χ 2-критерия Пирсона или точного критерия Фишера. Сравнение парных показателей в зависимых группах наблюдений проводили с использованием критерия Вилкоксона для связанных выборок. Статистические расчеты выполняли при помощи программы Statistica 10 (StatSoft. Inc., США).
Результаты
До начала лечения лабораторные показатели функционального состояния почек (sCr и СКФ) у пациентов находились в пределах референсных значений, соответствующих возрасту и полу, что свидетельствует об отсутствии явных признаков нарушения почечной функции. Достоверных различий по трем показателям (sCr, СКФ и uKIM-1) в подгруппах больных, которым запланированы схемы ХТ с цисплатином и без него, не установлено (табл. 1).
На протяжении всего времени наблюдения на фоне ХТ и после завершения комбинированного лечения абсолютные значения sCr у всех пациентов претерпевали определенные колебания, которые у половины больных (n=10; 52,6 %) не превышали 10 % от исходного уровня, не выходили за пределы референсных значений и сохранялись в этих пределах через 2–3 мес после химиотерапии (табл. 2). У 6 (31,6 %) больных наблюдались снижение уровня sCr более чем на 10 % после первого введения цитостатиков и постепенное восстановление значений показателя после завершения лечения (табл. 2). У 2 (10,5 %) пациентов после первого цикла ХТ отмечено умеренное повышение уровня sCr (на 23–26 %), далее – снижение показателя к началу
Таблица 1/Table 1
Показатели функционального состояния почек и уровень uKIM-1 у больных до начала химиотерапии
Parameters of renal function and uKIM-1 levels in patients before chemotherapy
|
sCr, мкмоль/л/ |
СКФ, мл/мин/1,73 м2/ |
uKIM-1, нг/мг / |
|
|
Планируемые схемы химиотерапии (число больных)/ |
sCr mcmol/L |
eGFR ml/min/173 m2 |
uKIM-1, ng/mg |
|
Planned chemotherapy regimens (number of patients) |
ME (Q1; Q3); Мин – Макс/ME (Q1; |
Q3); Min – Max |
|
|
Содержащие цисплатин (n=16)/ Cisplatin-based (n=16) |
92 (81; 99) 52–109 |
81 (72; 94) 61–137 |
2,6 (2,0; 3,4) 0,2–6,8 |
|
Не содержащие цисплатин (n=3)/ |
74 (68; 75) |
100 (97; 103) |
2,0 (0,6; 4,1) |
|
Do not include cisplatin (n=3) |
61–89 |
93–105 |
0,4–12,9 |
|
Всего (n=19)/Total (n=19) |
88 (74; 98) 52–109 |
82 (73; 100) 61–137 |
2,3 (1,8; 3,9) 0,2–12,9 |
Примечание: sCr – уровень креатинина в сыворотке крови; СКФ – скорость клубочковой фильтрации (по формуле CKD-EPI); МЕ – медиана; Q1 и Q3 – 1 и 3-й квартили соответственно; Мин – Макс – интервал вариаций показателей.
Note: sCr – serum creatinine level; eGFR – estimated glomerular filtration rate calculated by the CKD-EPI equation; ME – median; Q1 and Q3 – the 1st and the 3rd quartiles, respectively; Min – Max – interval of variations.
Таблица 2/Table 2
Динамика уровня креатинина крови (sCr) у больных на фоне химиотерапии
Changes in blood creatinine (sCr) levels in patients undergoing chemotherapy
Уровень uKIM-1 до начала лечения у значительной части пациентов был повышенным: медиана значений uKIM-1 составила 2,1 (1,4; 3,2) нг/мг , uCr что почти в 3 раза превышало медиану показателя у здоровых лиц (0,8 нг/мгuCr). У 3 из 19 больных (15,8 %) uKIM-1 превышал верхнюю границу нормы – 3,4 нг/мгuCr. Относительное количество случаев, в которых uKIM-1 превышал пороговый уровень 3,4 нг/мгuCr, увеличивалось с каждым циклом. К началу 2-го цикла ХТ количество случаев с повышенным относительно нормы uKIM-1 возросло до 9 (47,4 %) и медиана показателя составила 3,2 (2,1; 5,2) нг/мгuCr. К началу 3-го цикла uKIM-1 превышал верхнюю границу нормы у 12 больных (63,2 %), а медиана возросла до 4,9 (1,9; 6,5) нг/мгuCr, превышая исходную величину в 2,3 раза (рис. 1). Отличия uKIM-1 от исходного уровня в общей группе больных статистически значимы.
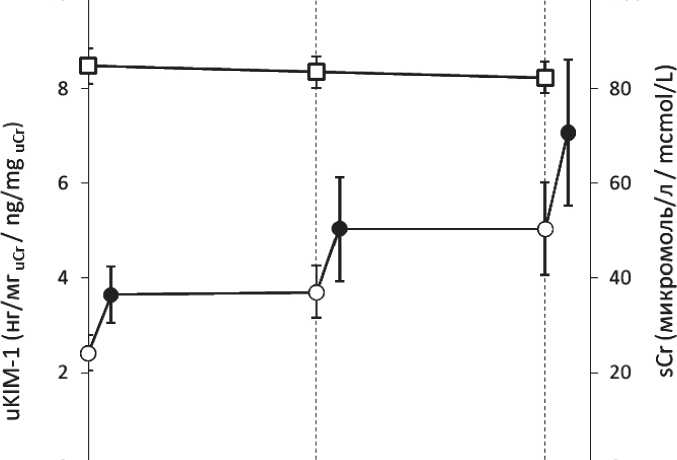
Динамика изменения uKIM-1 для всей обследованной группы больных представлена на рис. 2. В большинстве наблюдений уровень uKIM-1 возрастал уже через 1 сут после введения цитостатиков, по сравнению с показателем до начала курса, и еще несколько увеличивался в промежутке времени до начала следующего цикла. Средний уровень sCr при этом сохранялся в пределах нормальных значений на всем протяжении ХТ (рис. 2). Практически не изменялись в процессе ХТ и средние уровни мочевины и СКФ (данные не представлены). Т. е. у подавляющего большинства больных на фоне 3 циклов ХТ не наблюдалось значимых изменений рутинно исследуемых лабораторных показателей, отражающих функциональное состояние почек.
Динамика uKIM-1 у больных, получающих схемы ХТ, содержащие и не содержащие цисплатин, различалась. Как видно из данных, представленных на рис. 3, при наличии цисплатина в схеме ХТ происходит постоянное увеличение uKIM-1, которое регистрируется уже через 1 сут после введения цитостатиков и далее незначительно возрастает к следующему циклу (рис. 3, кривая А). Средний уровень uKIM-1 в данной группе случаев за 3 цикла ХТ увеличился более чем втрое. При использовании схем ХТ, не включающих цисплатин, увеличения уровня uKIM-1 на фоне лечения не наблюдалось (рис. 3, кривая Б).
Анализ индивидуальных данных показал, что пациенты, получавшие цисплатин-содержащую ХТ, отличаются по частоте эпизодов повышения уровня uKIM-1 после введения цитостатиков, степени этого повышения, характеру изменения
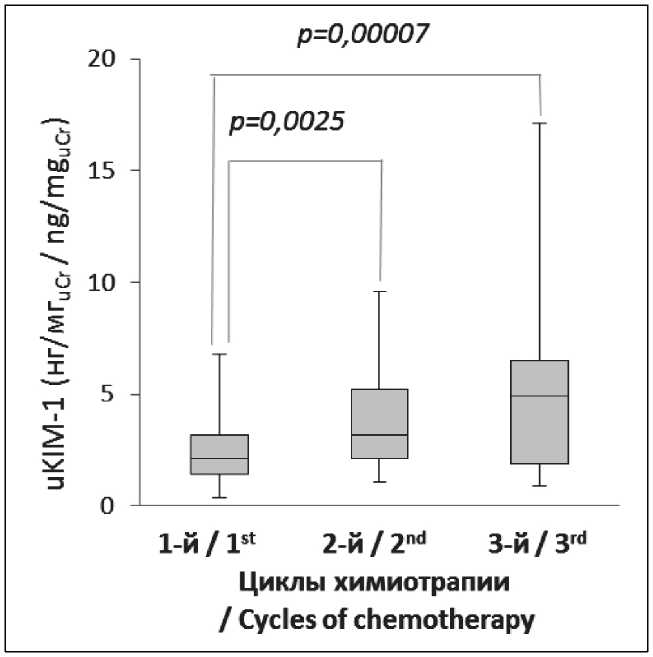
Рис. 1. Уровни uKIM-1 перед курсами химиотерапии в общей группе больных. На диаграмме представлены медианы со значениями Q1 и Q3 (боксы), минимальное и максимальное значения показателя (усы);
р – уровень значимости отличий (U-критерий Манна–Уитни) Fig. 1. uKIM-1 levels before chemotherapy in the entire group of patients.
The diagram represents medians with Q1 and Q3 quartiles (boxes), the minimum and maximum values (whiskers); р-values were determined using Mann–Whitney U-test
10 1 ■ ■ г 100
О Ч-------------------------------------11-------L о
1-й/Ist 2-й /2nd 3-й/3rd
Циклы химиотерапии / Cycles of chemotherapy
Рис. 2. Уровни креатинина крови (sCr; квадраты) и uKIM-1 (кружки) в процессе химиотерапии в общей группе больных (n=19); светлые символы – до введения цитостатиков; черные символы – через 1 сут после введения цитостатиков; данные представлены в виде средних и величин стандартной ошибки среднего [ ± SE]
Fig. 2. Blood creatinine levels (sCr; squares) and uKIM-1 levels (circles) during chemotherapy in the entire group of patients (n=19); light symbols: before the administration of cytostatics; black symbols: one day after the administration of cytostatics; data are presented as means and standard error of the mean [ ± SE]
показателя между циклами ХТ и, как следствие, по общей динамике уровня uKIM-1 на фоне ХТ. Увеличение уровня uKIM-1 (на 0,6 нг/мгuCr и более) после первого введения цитостатиков выявлено у 10 (62,5 %) больных, после второго введения – у 11 (68,8 %), после третьего – у 12 (75,0 %) больных (рис. 4). В остальных случаях показатель возрастал незначительно или снижался. Обращало на себя внимание возрастание частоты эпизодов значительного (>10 нг/мгuCr) увеличения уровня uKIM-1 через сутки после начала очередного цикла лекарственного лечения с увеличением количества циклов (рис. 4), что может быть отражением нарастания степени поражения почечной паренхимы и субклинического повреждения почек.
В соответствии с критериями KDIGO одним из достаточных критериев ОПП является возрастание sCr более чем в 1,5 раза по сравнению с исходным уровнем. Этому критерию соответствует случай, указанный в строке 4 табл. 2, который мы проанализировали более детально.
Больной К., 60 лет, с диагнозом: Рак носоглотки III cтадии, сT4N3M0 на первом этапе лечения получил 3 цикла цисплатин-содержащей ХТ по схеме ТР (доцетаксел 60–75 мг/м2 + цисплатин 75 мг/м2 с интервалом 3 нед). Уже после первого цикла ХТ у него зарегистрировано возрастание sCr с 67 до 103 мкмоль/л (в 1,54 раза), которое сохранялось и через 12 нед после завершения лечения (рис. 5). Формально sCr не превысил верхнюю границу нормы, но приблизился к ней. В то же время наблю-
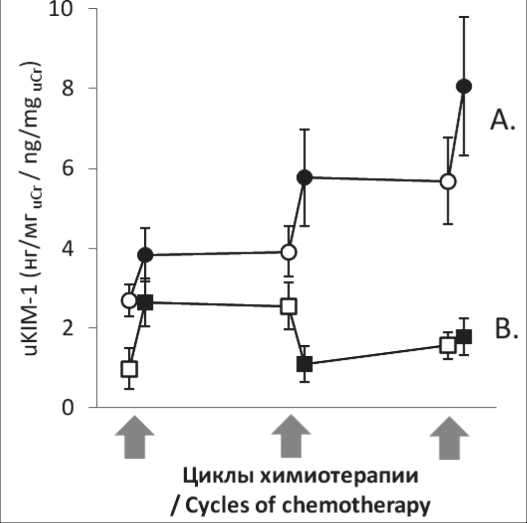
Рис. 3. Изменение уровня uKIM-1 у больных в динамике в зависимости от вида химиотерапии (ХТ). Кривая
А (кружки) – больные (n=16), получающие цисплатин-содержащую ХТ (схемы TPF, TP, EP, AP, TIP); кривая В (квадраты) – больные (n=3), получающие ХТ по схемам, не содержащим цисплатин (FOLFOX, FLOT); светлые символы – до введения цитостатиков; черные символы – через 1 сут после введения цитостатиков; стрелками обозначены циклы ХТ; данные представлены в виде средних и стандартной ошибки среднего ( ± SE)
Fig. 3. Changes in the uKIM-1 levels depending on the type of hemotherapy (CT). Curve A (circles) – patients (n=16) receiving cisplatin-containing chemotherapy (TPF, TP, EP, AP, TIP regimens). Curve B (squares) – patients (n=3) receiving chemotherapy regimens without cisplatin (FOLFOX, FLOT).
Light symbols: before administration of cytostatics; black symbols: one day after administration of the cytostatic drugs; arrows indicate CT cycles; data are presented as means and standard error of the mean
( ± SE)
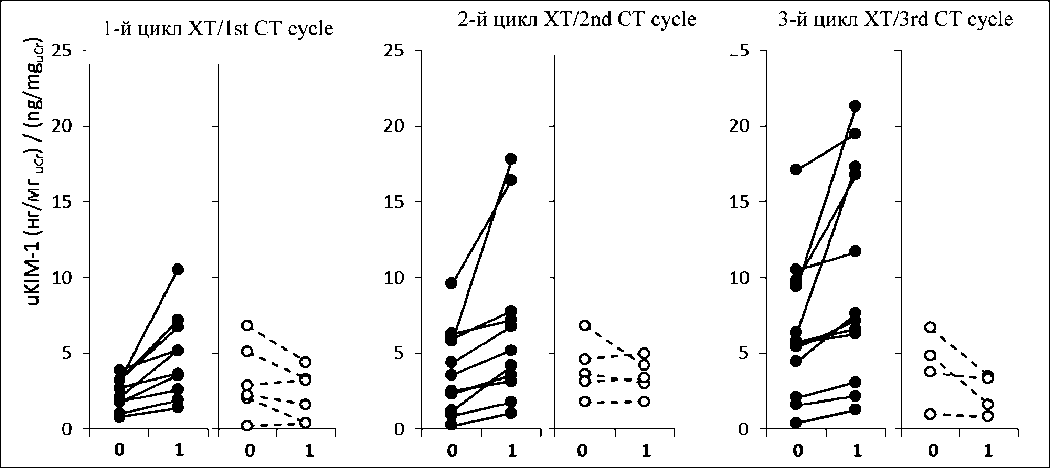
Рис. 4. Уровень uKIM-1 до (0) и через 1 сут (1) после введения цитостатиков у больных, получавших цисплатин-содержащую химиотерапию (ХТ). На диаграмме для каждого цикла ХТ отдельно представлены индивидуальные случаи, в которых у пациентов через 1 сут зарегистрировано увеличение uKIM-1 более чем на 0,5 нг/мгuCr (темные символы), и случаи, в которых показатель возрос менее чем на 0,5 нг/мгuCr, либо наблюдалось его снижение (светлые символы)
Fig. 4. uKIM-1 levels before (0) and one day after (1) administration of cytostatics in patients undergoing cisplatin-based chemotherapy (CT). The diagrams for each CT cycle separately show individual cases when uKIM-1 increased by more than 0.5 ng/mguCr (dark symbols) and cases when uKIM-1 increased by less than 0.5 ng/mguCr or decreased (light symbols)
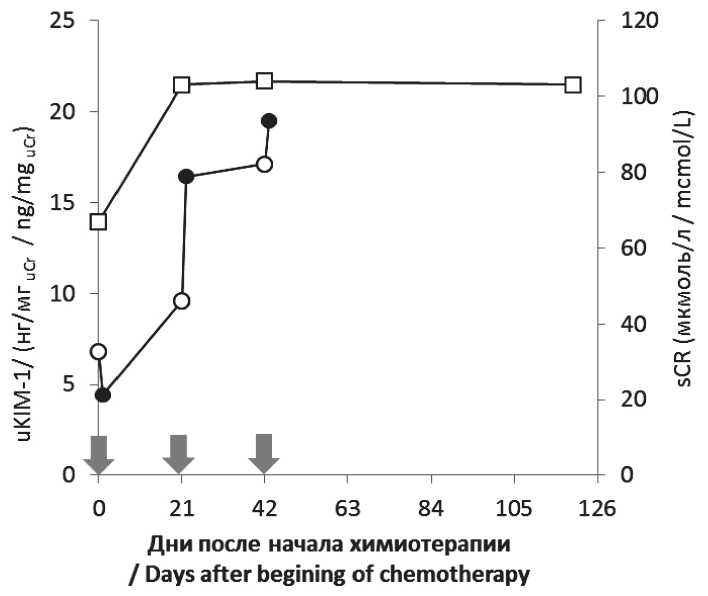
Рис. 5. Уровни креатинина крови (квадраты) и uKIM-1 (кружки) в процессе химиотерапии (схема TPF) у больного К.; светлые символы – до введения цисплатина; черные символы – через 1 сут после введения цисплатина; стрелками обозначены циклы химиотерапии
Fig. 5. Blood creatinine levels (squares) and uKIM-1 levels (circles) during chemotherapy (TPF scheme) in patient K.; light symbols: before administration of cisplatin; black symbols: one day after administration of cisplatin; arrows indicate the chemotherapy cycles
далось снижение СКФ с 99 до 68 мл/мин/1,73 м2, т.е. приближение показателя к нижней границе нормы. В отличие от других пациентов у данного больного к началу 3-го цикла также отмечено нарастание концентрации мочевины в крови (от исходного 4,1 ммоль/л до 10,0 ммоль/л). Как было отмечено выше, по критериям KDIGO данный случай можно расценить как нераспознанную I стадию ОПП. Следует отметить, что исходно у этого пациента uKIM-1 вдвое превышал верхнюю границу нормы (6,8 нг/мгuCr), а в процессе 3 циклов ХТ возрос еще втрое – до 19,5 нг/мгuCr (рис. 5).
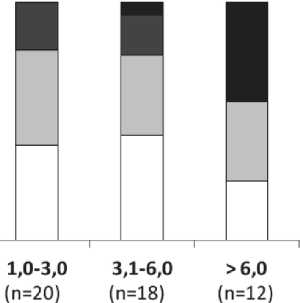
Анализ факторов, которые могут предсказать неблагоприятную динамику уровня uKIM-1 у больных на фоне ХТ и, как следствие, риск развития ОПП, показал следующее. Вероятность повышения uKIM-1 через сутки после введения цитостатиков в обследованной нами группе больных возрастала с увеличением значений показателя непосредственно перед очередным циклом лечения. Так, в случаях, когда до введения цитостатиков uKIM-1 не превышал 3,0 нг/мгuCr, значительного увеличения показателя после введения цитостатиков не наблюдалось (рис. 6), а когда uKIM-1 до введения цитостатиков варьировал в интервале от 3,1 до 6,0 нг/мгuCr зарегистрирован только 1 (5,6 %) такой эпизод. В группе наблюдений, когда уровень uKIM-1 до начала очередного цикла превышал 6,0 нг/мгuCr, значительное увеличение показателя (более чем на 6,0 нг/мгuCr) выявлено в 41,7 % случаев (рис. 6).
ш 100% q
I 3 80% -
§ ^ 60% - т t 40% -
2 2 20%
5 о% -

Повышение уровня uKIM-1 (нг/мгиСг) /uKIM-1 level increase (ng/mg„Cl)
■ >6,0
■ 3,1-6,0
■ 0,6-3,0
□ Нет / No uKIM-1 до введения цитостатиков (нг/мгиСг) I uKIM-1 before cytostatic drugs administration
Рис. 6. Изменение уровня uKIM-1 через 1 сут после введения цитостатиков в зависимости от значений показателя до начала очередного цикла химиотерапии (общий пул наблюдений по трем циклам лечения). По оси Х – интервалы вариации uKIM-1 (нг/мгuCr) и количество соответствующих случаев (n). Высота столбиков соответствует доле случаев (%), в которых уровень uKIM-1 не увеличивался, возрастал не более чем на 3,0 нг/мгuCr, на величину от 3,1 до 6,0 нг/мгuCrи более чем на 6,0 нг/мгuCr
Fig. 6. Changes in uKIM-1 levels one day after administration of the cytostatic drugs, depending on the value before the next injection (total pool of observations for three cycles of the treatment). X axis: the intervals of variation of uKIM-1 (ng/mguCr) and the number of corresponding cases (n). The height of the columns corresponds to the proportion of cases (%) in which the level of uKIM-1 did not increase, or increased by no more than 3.0 ng/mguCr, or increased by 3.1–6.0 ng/mguCr, or by more than 6.0 ng/mguCr
Коэффициенты ранговой корреляции по Спирмену между значениями uKIM-1 до введения цитостатиков и через сутки после начала ХТ составили 0,738 – для всей совокупности наблюдений, 0,245 – для случаев ХТ без цисплатина и 0,778 – при цисплатин-содержащей ХТ. Следовательно, исходно повышенный uKIM-1 указывает на высокую вероятность его роста в ранние сроки после введения цисплатина.
Частота эпизодов экстремального нарастания уровня uKIM-1 через сутки после введения цитостатических агентов при значениях показателя накануне лечения ниже или выше 6,0 нг/мгuCr значимо отличалась (1/45 vs 5/12 случаев; р<0,001, χ2-критерий Пирсона). Относительный риск (relative risk, RR) возникновения подобного эпизода в случаях, когда uKIM-1 у пациентов превышал 6,0 нг/мг , составил 18,8 (95 % ДИ 2,4–145,7; uCr p=0,0051). Таким образом, уровень uKIM-1 свыше 6,0 нг/мгuCr перед началом цикла ХТ с использованием цисплатина можно рассматривать как фактор высокого риска прогрессирующего повреждения почек после введения очередной дозы цитостатика.
Обсуждение
В нашем исследовании впервые представлены данные об изменении уровня uKIM-1, нормализованного на креатинин мочи (uKIM-1), на протяжении 3 последовательных циклов цисплатин-содержащей ХТ в сопоставлении с динамикой sCr. Полученные результаты в целом со- гласуются с данными литературы о том, что увеличение уровня uKIM-1 после введения цисплатина ассоциировано с признаками нарушения почечной функции у больных, получающих ХТ.
Цисплатин, как и другие соединения платины, преимущественно выводится из организма почками. По данным литературы, концентрация цисплатина в почечной паренхиме примерно в 5 раз превышает его уровень в крови [24]. Клетки эпителия проксимальных почечных канальцев экспрессируют мембранные транспортеры, способные захватывать цисплатин, что определяет их как основную тканевую нишу аккумуляции препарата [6]. Комбинированный механизм цисплатин-опосредованного повреждения ткани почек включает индукцию окислительного стресса, некроза и апоптоза в клетках проксимальных канальцев, токсическое воздействие на микрососудистое русло с последующим развитием ишемии, а также провокацию местной воспалительной реакции [6]. Следствием поражения почечного эпителия является развитие различного рода тубулопатий и тубулоинтерстициальных нефропатий [25].
Наблюдаемая в нашем исследовании динамика показателей соответствует описанной в литературе взаимосвязи между развитием цисплатин-индуцированного ОПП и повышением уровня KIM-1 в моче [23], а также согласуется с данными A. Maeda et al. [13], которые наблюдали нарастание уровня uKIM-1 у больных после введения цисплатины в отличие от пациентов, получавших другие противоопухолевые препараты.
Противоопухолевая ХТ является курсовым лечением, однако, как было отмечено выше, в большинстве опубликованных к настоящему времени исследований представлены данные об изменении уровня uKIM-1 до и после однократного введения цисплатина. Как показало наше исследование, такой подход, скорее всего, является недостаточно информативным для оценки потенциальной нефротоксичности лечения. По нашим данным, вариации уровня uKIM-1 в течение суток после первого введения противоопухолевых препаратов не отражают его дальнейшей динамики. Степень возрастания uKIM-1 увеличивается с каждым последующим введением цитостатических агентов как через 1 сут после очередной терапевтической процедуры, так и на протяжении всего лечения. Сходная тенденция описана B. George et al. [16] у больных, получавших цисплатин-содержащую терапию, при сравнении изменения уровня uKIM-1 на 3-и и 10-е сут после первого введения
Список литературы Динамика уровня маркера острого повреждения почек KIM-1 в моче онкологических больных, получающих химиотерапию с цисплатином
- Противоопухолевая лекарственная терапия. Национальное руководство. Под ред. В.А. Горбуновой, М.Б. Стениной. М., 2022. 708 с. [Anticancer drug therapy. National Guideline. Eds. V.A. Gorbunova, M.B. Stenina. Moscow, 2022. 708 p. (in Russian)].
- Romani A.M.P. Cisplatin in cancer treatment. Biochem Pharmacol. 2022; 206: 1–11. doi: 10.1016/j.bcp.2022.115323.
- Поддубная И.В., Орёл Н.Ф. Побочные реакции и осложнения лекарственной терапии. Руководство по химиотерапии опухолевых заболеваний (под ред. Н.И. Переводчиковой и В.А. Горбуновой). М., 2017. [Poddubnaya I.V., Oryol N.F. Adverse reactions and complications of anticancer drug therapy. In: Guidelines for the chemotherapy of neoplastic diseases. Eds. N.I. Perevodchikova, V.A. Gorbunova. Moscow, 2017. (in Russian)].
- Осипова Т.В., Бухман В.М. Биомаркеры лекарственной нефро-токсичности. Российский биотерапевтический журнал. 2015; 14(3): 3–18. [Osipova T.V., Bukhman V.M. Biomarkers of drug nephrotoxicity. Russian Journal of Biotherapy. 2015; 14(3): 3–18. (in Russian)]. doi: 10.17650/1726-9784-2015-14-3-3-18.
- Ostermann M., Zarbock A., Goldstein S., Kashani K., Macedo E., Murugan R., Bell M., Forni L., Guzzi L., Joannidis M., Kane-Gill S.L., Legrand M., Mehta R., Murray P.T., Pickkers P., Plebani M., Prowle J., Ricci Z., Rimmelé T., Rosner M., Shaw A.D., Kellum J.A., Ronco C. Recommendations on acute kidney injury biomarkers from the Acute Disease Quality Initiative Consensus Conference: A consensus statement. JAMA Netw Open. 2020; 3(10): 1–17. doi: 10.1001/jamanetworkopen.2020.19209.
- McSweeney K.R., Gadanec L.K., Qaradakhi T., Ali B.A., Zulli A., Apostolopoulos V. Mechanisms of cisplatin-induced acute kidney injury: Pathological mechanisms, pharmacological interventions, and genetic mitigations. Cancers (Basel). 2021; 13(7): 1–42. doi: 10.3390/cancers13071572.
- Кармакова Т.А., Сергеева Н.С., Канукоев К.Ю., Алексеев Б.Я., Каприн А.Д. Молекула повреждения почек 1 (KIM-1): многофункциональный гликопротеин и биологический маркер. Современные технологии в медицине. 2021; 13(3): 64–80. [Karmakova Т.А., Sergeeva N.S., Kanukoev К.Yu., Alekseev B.Yu., Kaprin А.D. Kidney Injury Molecule 1 (KIM-1): a Multifunctional Glycoprotein and Biological Marker (Review). Modern Technologies in Medicine. 2021; 13(3): 64–80. (in Russian)]. doi:10.17691/stm2021.13.3.08.
- Bonventre J.V. Kidney injury molecule-1 (KIM-1): a specific and sensitive biomarker of kidney injury. Scand J Clin Lab Invest Suppl. 2008; 241: 78–83. doi: 10.1080/00365510802145059.
- Kashani K., Cheungpasitporn W., Ronco C. Biomarkers of acute kidney injury: the pathway from discovery to clinical adoption. Clin Chem Lab Med. 2017; 55(8): 1074–89. doi: 10.1515/cclm-2016-0973.
- Geng J., Qiu Y., Qin Z., Su B. The value of kidney injury molecule 1 in predicting acute kidney injury in adult patients: A systematic review and Bayesian meta-analysis. J Transl Med. 2021; 19(1): 1–13. doi: 10.1186/s12967-021-02776-8.
- Shinke H., Masuda S., Togashi Y., Ikemi Y., Ozawa A., Sato T., Kim Y.H., Mishima M., Ichimura T., Bonventre J.V., Matsubara K. Urinary kidney injury molecule-1 and monocyte chemotactic protein-1 are noninvasive biomarkers of cisplatin-induced nephrotoxicity in lung cancer patients. Cancer Chemother Pharmacol. 2015; 76(5): 989–96. doi: 10.1007/s00280-015-2880-y.
- Tekce B.K., Uyeturk U., Tekce H., Uyeturk U., Aktas G., Akkaya A. Does the kidney injury molecule-1 predict cisplatin-induced kidney injury in early stage? Ann Clin Biochem. 2015; 52(Pt 1): 88–94. doi: 10.1177/0004563214528312.
- Maeda A., Ando H., Ura T., Muro K., Aoki M., Saito K., Kondo E., Takahashi S., Ito Y., Mizuno Y., Fujimura A. Differences in urinary renal failure biomarkers in cancer patients initially treated with cisplatin. Anticancer Res. 2017; 37(9): 5235–9. doi: 10.21873/anticanres.11947.
- Abdelsalam M., Elmorsy E., Abdelwahab H., Algohary O., Naguib M., El Wahab A.A., Eldeeb A., Eltoraby E., Abdelsalam A., Sabry A., El-Metwally M., Akl M., Anber N., El Sayed Zaki M., Almutairi F., Mansour T. Urinary biomarkers for early detection of platinum based drugs induced nephrotoxicity. BMC Nephrol. 2018; 19(1): 219. doi: 10.1186/s12882-018-1022-2.
- Ghadrdan E., Ebrahimpour S., Sadighi S., Chaibakhsh S., Jahangard-Rafsanjani Z. Evaluation of urinary neutrophil gelatinase-associated lipocalin and urinary kidney injury molecule-1 as biomarkers of renal function in cancer patients treated with cisplatin. J Oncol Pharm Pract. 2020; 26(7): 1643–9. doi: 10.1177/1078155220901756.
- George B., Wen X., Mercke N., Gomez M., O'Bryant C., Bowles D.W., Hu Y., Hogan S.L., Joy M.S., Aleksunes L.M. Time-dependent changes in kidney injury biomarkers in patients receiving multiple cycles of cisplatin chemotherapy. Toxicol Rep. 2020; 7: 571–6. doi: 10.1016/j.toxrep.2020.04.003.
- Ghonaim E., El-Haggar S., Gohar S. Possible protective e-ect of pantoprazole against cisplatin-induced nephrotoxicity in head and neck cancer patients: a randomized controlled trial. Medical Oncology. 2021; 38(9): 108. doi: 10.1007/s12032-021-01558-y.
- Гречухина К.С., Чеботарева Н.В., Жукова Л.Г., Дорофеев А.С., Краснова Т.Н. NGAL и KIM-1 – ранние мочевые биомаркеры нефротоксичности, опосредованной цисплатином: обсервационное исследование. Современная онкология. 2022; 24(1): 119-124. [Grechukhina K.S., Chebotareva N.V., Zhukova L.G., Dorofeev A.S., Krasnova T.N. NGAL and KIM-1 – early urinary biomarkers of nephrotoxicity mediated by cisplatin: Observational study. Modern Oncology. 2022; 24(1): 119–124. (in Russian)]. doi: 10.26442/18151434.2022.1.201285.
- Сергеева Н.С., Канукоев К.Ю., Кармакова Т.А., Алентов И.И., Маршутина Н.В., Каприн А.Д. О нормировании уровня KIM-1 на содержание креатинина в моче у больных почечно-клеточным раком. Клиническая лабораторная диагностика. 2021; 66(9): 517–24. [Sergeeva N.S., Kanukoev K.Y, Karmakova T.A., Alentov I.I., Marshutina N.V., Kaprin A.D. On normalizing of urinary KIM-1 level to urine creatinine in patients with renal cell cancer. Clinic Laboratory Diagnostic. 2021; 66(9): 517–24. (in Russian)]. doi: 10.51620/0869-2084-2021-66-9-517-524
- Levey A.S., Stevens L.A., Schmid C.H., Zhang Y.L., Castro A.F. 3rd, Feldman H.I., Kusek J.W., Eggers P., Van Lente F., Greene T., Coresh J.; CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration). A new equation to estimate glomerular filtration rate. Ann Intern Med. 2009; 150(9): 604–12. doi: 10.7326/0003-4819-150-9-200905050-00006.
- Скорость клубочковой фильтрации. Онлайн калькулятор [Internet]. URL: https://medsoftpro.ru/kalkulyatory/skf.html [cited 2023 Feb 8]. [Glomerular filtration rate. Online calculator. [Internet]. URL: https://medsoftpro.ru/kalkulyatory/skf.html [cited 2023 Feb 8]. (in Russian)].
- Клинические практические рекомендации KDIGO по острому почечному повреждению [Internet]. URL: https://kdigo.org/guidelines/acute-kidney-injury/ [cited 2023 Mar 30]. [Clinical Practice Guidelines for Acute Kidney Disease [Internet]. URL: https://kdigo.org/guidelines/acute-kidney-injury/ [cited 2023 Mar 30]. (in Russian)].
- Tanase D.M., Gosav E.M., Radu S., Costea C.F., Ciocoiu M., Carauleanu A., Lacatusu C.M., Maranduca M.A., Floria M., Rezus C. The predictive role of the biomarker kidney molecule-1 (KIM-1) in acute kidney injury (AKI) cisplatin-induced nephrotoxicity. Int J Mol Sci. 2019; 20(20): 5238. doi: 10.3390/ijms20205238.
- Kuhlmann M.K., Burkhardt G., Köhler H. Insights into potential cellular mechanisms of cisplatin nephrotoxicity and their clinical application. Nephrol Dial Transplant. 1997; 12(12): 2478–80. doi: 10.1093/ndt/12.12.2478.
- Громова Е. Г., Бирюкова Л. С., Джумабаева Б. Т., Курмуков И. А. Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов. Злокачественные опухоли: Практические рекомендации RUSSCO. 2020; 10(3s2): 118–30. [Gromova E.G., Biryukova L. S., Dzhumabaeva B. T., Kurmukov I. A. Practical recommendations for the correction of nephrotoxicity of anticancer drugs. Malignant Tumors: Practical RUSSCO recommendations. (in Russian)]. doi: 10.18027 / 2224-5057-2020-10-3s2-46.
- Miller R.P., Tadagavadi R.K., Ramesh G., Reeves W.B. Mechanisms of cisplatin nephrotoxicity. Toxins (Basel). 2010; 2: 2490–518. doi: 10.3390/toxins2112490.
- Бурнашева Е.В., Шатохин Ю.В., Снежко И.В., Мацуга А.А. Поражение почек при противоопухолевой терапии. Нефрология. 2018; 22(5): 17–24. [Burnasheva E.V., Shatokhin Yu.V., Snezhko I.V., Matsuga A.A. Kidney injury in cancer therapy. Nephrology. 2018; 22(5): 17–24. (in Russian)]. doi: 10.24884/1561-6274-2018-22-5-17-24.
- Bunel V., Tournay Y., Baudoux T., De Prez E., Marchand M., Mekinda Z., Maréchal R., Roumeguère T., Antoine M.H., Nortier J.L. Early detection of acute cisplatin nephrotoxicity: interest of urinary monitoring of proximal tubular biomarkers. Clin Kidney J. 2017; 10(5): 639–47. doi: 10.1093/ckj/sfx007.


