Динамика вирулентности омской популяции Puccinia triticina
Автор: Шаманин П., Гультяева Е.И., Шайдаюк Е.Л., Потоцкая И.В., Пожерукова В.Е.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Сельскохозяйственные науки
Статья в выпуске: 5, 2018 года.
Бесплатный доступ
Проведен анализ вирулентности образцов по-пуляций Puccinia triticina, собранных в Омской об-ласти в 2017 г. Высокой эффективностью харак-теризовались гены Lr19, Lr24, Lr28, Lr29, Lr41, Lr42, Lr45, Lr47, Lr51, Lr53 и Lr65. Варьирование в часто-тах вирулентности отмечено на линиях ТсLr2a, ТсLr9, ТсLr11, ТсLr15, ТсLr16, ТсLr20 и ТсLr26. В ос-новном существенные изменения в омской популя-ции в 2013-2017 гг. затрагивали частоту встре-чаемости клонов, вирулентных к линиям пшеницы с генами устойчивости Lr9 (10-33 %), Lr20 (37-100 %) и Lr26 (0-69 %). Шестьдесят один изученный мо-нопустульный изолят был представлен двена-дцатью фенотипами (расами). Среди них три: THTTR (авирулентность/вирулентность: ТсLr9, 19, 24/ 1, 2a, 2b, 2c, 3a, 3bg, 3ka, 11, 14a, 14b, 15, 16, 17, 18, 20, 26, 30), TGTTR (ТсLr9, 19, 24, 26/ 1, 2a, 2b, 2c, 3a, 3bg, 3ka, 11, 14a, 14b, 15, 16, 17, 18, 20, 30) и TQTTR (ТсLr19, 24, 26/1, 2a, 2b, 2c, 3a, 3bg, 3ka, 9, 11, 14a, 14b, 15, 16, 17, 18, 20, 30), - были наиболее представлены в омской популяции в 2013-2017 гг. Сходство между образцами омской популяции в 2015 и 2016 гг. было выше, чем в 2013 и 2014 гг. Фенотипы TGTTR и TQTTR отмечены во все годы исследования. Не выявлено изменений в феноти-пическом составе патогена на сорте Павлоградка. Незначительные изменения отмечены на сортах Памяти Азиева, Дуэт и Чернява 13 и более суще-ственные - на сорте ОмГАУ 90.
Бурая ржавчина, вирулентность, мягкая пшеница, lr-гены
Короткий адрес: https://sciup.org/140238107
IDR: 140238107 | УДК: 632.911.2
Текст научной статьи Динамика вирулентности омской популяции Puccinia triticina
Введение . Бурая ржавчина – широко распространенное заболевание яровой пшеницы (возбудитель Puccinia triticina ) в Омской области. В последнее десятилетие оно проявляется в умеренной степени, не вызывая эпифитотий [12]. Это обусловлено тем, что развитие бурой ржавчины лимитирует одновременное появление в посевах стеблевой ржавчины, которая характеризуется более высокой вредоносностью [7]. Тем не менее, высокий эволюционный потенциал возбудителя бурой ржавчины предопределяет необходимость постоянного мониторинга данного патогена.
В последние годы в Западной Сибири в районировании возрастает число генетически устойчивых к бурой ржавчине сортов. Широкое их возделывание может привести к резкому изменению состава популяций и появлению рас с новой вирулентностью, как это произошло с сортами, защищенными геном Lr9 на Урале и в Западной Сибири в 2010 г. [6]. Мониторинг вирулентности патогена на перспективных сортах и линиях мягкой пшеницы, изучаемых в селекционных учреждениях и на Государственных сортоучастках (ГСУ), позволяет спрогнозировать данные изменения и своевременно скорректировать селекционные программы.
Мониторинг вирулентности P. triticina в Омской области проводится нами с 2013 г. [3, 8]. Для анализа используется разнообразный инфекционный материал, который собирается с районированных и перспективных сортов и линий пшеницы, изучаемых в ОмГАУ. Для оценки многолетней динамики фенотипического состава и вирулентности омской популяции в качестве источников инфекции используется сходный набор восприимчивых сортов пшеницы, что позволяет оценить многолетнюю динамику патогена и снизить влияние селективного отбора растения-хозяина на результаты анализа вирулентности.
Цель исследования : мониторинг вирулентности P. triticina в Омской области в 2017 г.
Задачи исследования: провести сбор инфекционного материала P. triticina с районированных и перспективных сортов пшеницы и оценить многолетнюю динамику вирулентности патогена в условиях Омской области.
Материал и методы исследования . Листья с урединиопустулами были собраны на опытном поле ОмГАУ с сортов яровой пшеницы Памяти Азиева, ОмГАУ 90, Чернява 13, Павлоградка, Дуэт, для которых анализ вирулентности патогена проводится ежегодно, и с 25 образцов пшеницы, изучаемых в рамках программы Казахстанско-Сибирской сети, а также на Черлакском (Катюша, Алтайская 70, Омская 36) и Павлоградском ГСУ (Памяти Азиева, Омская 36, Павлоградка, ОмГАУ 90, ОмГАУ 100).
Погодные условия 2017 г. были умеренно благоприятными для развития бурой ржавчины в Омской области. Пораженность изученных сортов-источников инфекционного материала составляла 30–100 %. Сборная популяция патогена, включающая урединиоспоры со всех изученных образцов пшеницы, была использована для инокуляции 37 линий Thatcher (ТсLr) с генами Lr1, Lr2a, Lr2b, Lr2c, Lr3a, Lr3bg, Lr3ka, Lr9, Lr10, Lr11, Lr14a, Lr14b, Lr15, Lr16, Lr17, Lr18, Lr19, Lr20, Lr21, Lr24, Lr26, Lr28, Lr29, Lr30, Lr41, Lr42, Lr44, Lr45, Lr47, Lr48, Lr49, Lr51, Lr53, Lr57, Lr64, Lr65, Lr67 и оценки эффективности Lr-генов в фазе проростков. Для анализа вирулентности с сортов Памяти Азиева, Сибаковская юбилейная, Дуэт, ОмГАУ 90, Павлоградка, Чернява 13, Терция было получено по 3–5 монопустульных изолятов P. triticina, а с материала КАСИБ – по 1–2. Для получения монопустульных изолятов и их раз- множения использовали метод лабораторного культивирования гриба на отрезках листьев пшеницы [2].
При этом анализ вирулентности в 2017 г., в отличие от других лет исследований, проводили на интактных растениях, а не на отрезках листьев. Учет проводили на 10–12-й день после заражения по шкале E.B. Mains и H.S. Jackson [11]. Растения с типом реакции 0, 1, 2 относили к устойчивым, с типом 3, 4, Х – к восприимчивым.
Для обозначения фенотипов использовали буквенную североамериканскую номенклатуру [10], основанную на определении вирулентности к группам Tc Lr -линий. В настоящем анализе использована следующая последовательность Тс Lr -линий: 1 – Lr1, Lr2a, Lr2c, Lr3а ; 2 – Lr9, Lr16, Lr24, Lr26 ; 3 – Lr3ka, Lr11, Lr17, Lr30 ; 4 – Lr2b, Lr3bg, Lr14a, Lr14b ; 5 – Lr15, Lr18, Lr19, Lr20 .
Для определения буквенного кода фенотипов, частот вирулентности и индексов внутрипопуляци-онного разнообразия использовали пакет программ Virulence Analysis Tool (VAT) [9]. Индексы межпопуляционных генетических расстояний Fst и Нея (Nei D, Nei genetic distance) определяли в пакете программ GenAlЕx. Многомерная диаграмма родства между образцами омской популяции в 2013–2017 гг. построена по индексу Нея (PCoA parametrs).
Результаты исследования . При инокуляции 37 тестерных Lr -линий сборной омской популяцией P. triticina высокой эффективностью характеризовались гены Lr19, Lr24, Lr28, Lr29, Lr41, Lr42, Lr45, Lr47, Lr51, Lr53, Lr57 и Lr65 (тип реакции 0 и 0;). На линиях Thatcher (Тс) с генами Lr44, Lr57 наблюдали умеренно устойчивый тип реакции 2 – 2++; а на линиях Тс Lr11 и Тс Lr16 – умеренно восприимчивый 2++–3 (Х). В популяционных исследованиях в 2017 г. использован 61 монопустульный изолят. При анализе вирулентности на 20 линиях-дифференциаторах все изученные изоляты характеризовались авиру-лентностью к генам Lr19 и Lr24 . Варьирование в частотах вирулентности отмечено на линиях Тс Lr2a, Тс Lr9, Тс Lr11 , Тс Lr15, Тс Lr16, Тс Lr20 и Тс Lr26 (табл. 1).
Изоляты, вирулентные к линии Тс Lr9, обнаружены на сорте Дуэт, имеющем этот ген, и в единичном количестве на нескольких сортах без данного гена, и все они характеризовались авирулентностью к Lr26 .
Таблица 1
Частоты изолятов, вирулентных к линиям Thatcher в омской популяции Puccinia triticina в 2017 г., %
|
Линия Thatcher c геном Lr |
Частоты вирулентности* |
|
19, 24 |
0 |
|
2a |
90,2 ± 0,04 |
|
2b |
90,2 ± 0,04 |
|
2c |
90,2 ± 0,04 |
|
9 |
14,8 ± 0,04 |
|
11 |
70,5 ± 0,06 |
|
15 |
90,2 ± 0,04 |
|
16 |
75,4 ± 0,05 |
|
20 |
91,8 ± 0,03 |
|
26 |
68,9 ± 0,06 |
|
1,3a,3bg, 3ka, 14a, 14b, 17,18 |
100 |
*Ошибка средней арифметической.
Это указывает на то, что данное сочетание генов может быть эффективным в защите от бурой ржавчины в Западно-Сибирском регионе. Вирулентность к гену Lr26 выявлена как на образцах пшеницы с этим геном (Элемент 22, Тюменочка, ГВК 2127, Лю-тесценс 22-17, Лютесценс 37-17, Лютесценс KS 14/09-2, Лютесценс KS 140/08-3, Лютесценс KS 963), так и без этого гена. Наличие генов Lr9 и Lr26 у данных образцов пшеницы подтверждено нами с использованием ПЦР-маркеров в исследованиях, выполняемых по программе КАСИБ [1]. Изоляты с сорта ОмГАУ 90 характеризовались авирулентностью к генам Lr2a, Lr2b, Lr2c и Lr15 ; с сортов Чернява 13, Дуэт, Катюша, Алтайская 70, Новосибирская 16, Степная 273, Омская 35, Саратовская 29 и линий Лютесценс 857, Лютесценс 2102, Лютесценс KS 963 – к гену Lr16 ; с сортов Катюша, Алтайская 70, Дуэт – к гену Lr20 . Авирулентность к гену Lr16 на сортах Саратовская 29, Омская 35 наблюдалась и в 2016 г. [3].
Образцы омской популяции Р. triticina , как и в предыдущие годы, характеризовались высоким числом аллелей вирулентности (14–17(р)), за исключением изолятов с сорта ОмГАУ 90 (р = 12).
В основном изменения в омской популяции в 2013–2017 гг. затрагивали частоту встречаемости клонов, вирулентных к линиям пшеницы с генами устойчивости Lr9 (10–33 %) , Lr20 (37–100 %) и Lr26 (0–69 %) (рис. 1). Частоты вирулентности к Lr1 , Lr2a, Lr2b, Lr2c, Lr3a, Lr3bg, Lr3ka, Lr14a, Lr15, Lr17, Lr18 и Lr30 оставались стабильно высокими в течение всего периода исследования (88–100 %) [3]. Динамика снижения частот вирулентности к гену Lr16 отмечается с 2016 г. (95–75 %). Различия в частотах вирулентности к линии Тc Lr11 в 2013–2016 гг. (100 %) и в 2017 г. (70 %), вероятно, обусловлены нестабильным типом реакции этой линии при использовании метода отрезков листьев и живых растений.
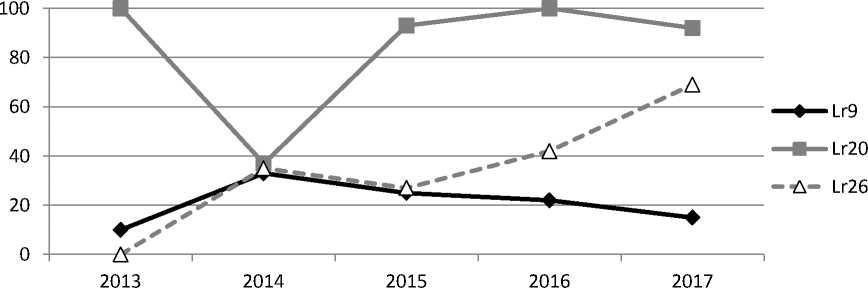
Рис. 1. Частота встречаемости клонов, вирулентных к линиям Thatcher с генами Lr9, Lr20 и Lr26 в омской популяции Puccinia triticina в 2013–2017 гг.
Индекс Нея (N), оценивающий межпопуляционные различия по частотам вирулентности, не выявил радикальных изменений в омской популяции в изучен- ный период времени (N = 0,012 (2017 и 2016 гг.); N = 0,02 (2017 и 2015 гг.); N = 0,036 (2017 и 2014 гг.);
N = 0,035 (2017 и 2013 гг.) (рис. 2).
Principal Coordinates (PCoA)
|
♦ 2014 |
♦ 2017 |
|
♦ 20 ♦ 2013 |
5 ♦ 2016 |
Coord. 1
Рис. 2. Многомерная диаграмма генетических расстояний между омскими популяциями в 2013–2017 гг. (по индексу Нея N)
С использованием 20 линий-дифференциаторов в омской популяции в 2017 г. выявлено 12 фенотипов (рас): THTTR (32,8 %), THPTR (18 %), TCTTR (8,2 %), TGTTR (6,6 %), TBTTR (6,6 %), TQTTR (6,6 %), TLPTQ (4,9 %), MHPKH (4,9 %), MGTKH (4,9 %), ТCTTQ (3,3 %), TRPTR (1,6 %), ТLTTR (1,6 %). Фенотипы TQTTR (авирулентность/вирулентность Тс Lr 19, 24, 26/ 1, 2a, 2b, 2c, 3a, 3bg, 3ka, 9, 11, 14a, 14b, 15, 16, 17, 18, 20, 30) и TGTTR (Тс Lr9 , 19, 24, 26/1, 2a, 2b, 2c, 3a, 3bg, 3ka, 11, 14a, 14b, 15, 16, 17,18, 20, 30) ежегодно встречались в анализе патогена в 2013–2017 гг. (TQTTR: 10 %; 1,7 %; 19,5 %; 11,3 %; 6,6 % и TGTTR: 90 %; 10,8 %; 47,6 %; 25,8 %; 6,6 %). Частота фенотипа TQTTR в 2013 г. составила 10 %, в 2014 г. – 2 %, в 2015 г. – 19 % , в 2016 г. – 11 %, а фенотипа TGTTR – 90 %; 11; 48 и 26 % соответственно. Фенотип THTTR (Тс Lr9 ,19,24 / 1, 2a, 2b, 2c, 3a, 3bg, 3ka, 11, 14a, 14b, 15, 16, 17, 18, 20, 26, 30) отмечается в омской популяции с 2014 г. с частотой 30 % (2014 г.), 46 % (2015 г.) и 31 % (2016 г.). Идентифицированные фенотипы относятся к группе широко представленных и в других азиатских регионах [6].
Индекс Роджерса (R), оценивающий различия между популяциями по фенотипическому составу, для пары популяций 2017 и 2016 гг. составил 0,45; 2017 и 2016 гг. – 0,65; 2017 и 2014 гг. – 0,67; 2017 и 2013 гг. – 0,87. Как и индекс Нея, он указывал на более высокое сходство состава омской популяции P. triticina в 2015–2016 гг.
Анализ популяций P. triticina с использованием одинаковых сортов пшеницы – источников инфекции позволяет более достоверно оценить изменения в структуре популяций патогенов и исключить селективное влияние хозяина на результаты анализа вирулентности патогена. Районированные сорта Памяти Азиева, Дуэт, ОмГАУ 90, Павлоградка, Чернява 13, имеющие разный генетический контроль устойчивости к бурой ржавчине, используются нами в качестве инфекционного источника практически ежегодно. Фенотипический состав изолятов, выявленный на этих сортах в 2013–2017 гг., представлен в таблице 2.
Не выявлено изменений в фенотипическом составе гриба на сорте Павлоградка. Незначительные изменения по вирулентности патогена отмечены на сортах Памяти Азиева, Дуэт и Чернява 13. Определенные изменения в фенотипическом составе отмечены на сорте ОмГАУ 90.
Динамика фенотипического состава P. triticina в Омской области
Таблица 2
|
Сорт пшеницы |
Фенотипы |
||||
|
2013 г. |
2014 г. |
2015 г. |
2016 г. |
2017 г. |
|
|
Павлоградка |
TGTTR |
TQTTQ TGTTQ TGTTR TQTTR |
TGTTR |
TGTTR |
TGTTR |
|
Памяти Азиева |
TGTTR |
THTTR |
THTTR |
TGTTR |
THPTR THTTR |
|
ОмГАУ 90 |
TGTTR |
TGTTQ |
– |
THTTR |
MGTKH MHPKH |
|
Чернява 13 |
TGTTR |
TGTTQ THTTQ |
– |
TGTTR |
TBTTR |
|
Дуэт |
– |
– |
TQTTR |
PQTTH |
TLPTQ TQTTR |
Сорта Павлоградка и ОмГАУ 90 в 2015–2016 гг. характеризовались высокой степенью восприимчивости к бурой ржавчине (50–100S), а в 2017 г. – умеренной (30–45MS).
В целом в результате многолетнего мониторинга не выявлено существенных изменений по вирулентности и фенотипическому составу омской популяции возбудителя бурой ржавчины. Сравнительный анализ структуры популяций в западноазиатских регионах России и Cеверном Казахстане выявил высокое генетическое сходство омской популяции с челябинской и североказахстанской популяциями [4].
Выводы. Проведен мониторинг вирулентности образцов P. triticina, собранных в Омской области с образцов пшеницы в 2017 г. Не выявлено существенных изменений по вирулентности и фенотипическому составу омской популяции в 2017–2015 гг. по сравнению с 2013–2014 гг.
Высокоэффективные гены Lr24, Lr28, Lr29, Lr41, Lr42, Lr45, Lr47, Lr51, Lr53 и Lr65 могут представлять потенциал для селекции на устойчивость к бурой ржавчине в Западной Сибири. Ген Lr19, частично утративший эффективность в ряде регионах РФ, может быть рекомендован для пирамидирования с данными эффективными Lr -генами и с геном Lr9, утратившими эффективность в Западно-Сибирском регионе.
Список литературы Динамика вирулентности омской популяции Puccinia triticina
- Белан И.А. и др. Иммунологическая оценка материала «КАСИБ» в условиях южной лесостепи Западной Сибири//Вестн. Алтайского гос. аграр. ун-та. -2012. -№ 10 (96). -С. 39-43.
- Гультяева Е.И., Солодухина О.В. Ржавчинные болезни зерновых культур//Изучение генетических ресурсов зерновых культур по устойчивости к вредным организмам. -М.: Изд-во РАСХН, 2008. -С. 5-11.
- Гультяева Е.И. и др. Фенотипический состав Puccinia triticina на образцах мягкой пшеницы в Омской области в 2016 г.//Вестн. Новосиб. гос. аграр. ун-та. -2017. -№ 2 (43). -С. 16-23.
- Гультяева Е.И. и др. Структура популяций листовых патогенов яровой пшеницы в западно-азиатских регионах России и Cеверном Казахстане в 2017 г.//Вавиловсикй журнал генетики и селекции. -2018. -№ 22 (3). -С. 363-369.
- Рекомендации по возделыванию сортов сельскохозяйственных культур и результаты сортоиспытания в Омской области за 2016 г. -Омск: Технология, 2016. -С. 6-7.
- Тюнин В.А. и др. Характеристика вирулентности популяций Рuccinia triticina и перспективы использования генов Lr24, Lr25, LrSp в селекции яровой мягкой пшеницы на Южном Урале//Вавиловский журнал генетики и селекции. -2017. -№ 21(5). -С. 523-529.
- Чумаков А.Е., Захарова Т.И. Вредоносность болезней сельскохозяйственных культур. -М.: Агропромиздат, 1990. -128 с.
- Шаманин В.П. и др. Мониторинг вирулентности популяций гриба Puccinia triticina на опытном поле ОмГАУ//Вестн. Алтайского ГАУ. -2015. -№ 5 (127). -С. 70-75.
- Коsman E. et al. Virulence Analysis Tool (VAT): User Manual, 2008.
- Long D.L., Kolmer J.A. North American system of nomenclature for Puccinia recondita f.sp. tritici//Phytopathology. -1989. -Vol. 79. -рр. 525-529.
- Mains E.B., Jackson H.S. Physiologic specializa-tion in the leaf rust of wheat; Puccinia triticina Erikss.//Phytopathology. -1926. -Vol. 16. -рр. 89-120.
- Shamanin V. et al. Genetic diversity of spring wheat from Kazakhstan and Russia for resistance to stem rust Ug99//Euphytica. -2016. -Vol. 12. -рр. 287-296.


