Динамика заболеваемости раком щитовидной железы населения России: основные факторы риска
Автор: Иванов В.К., Горский А.И., Полькин В.В., Андреев В.Г., Кащеев В.В., Туманов К.А., Иванов С.А., Каприн А.Д.
Рубрика: Научные статьи
Статья в выпуске: 4 т.31, 2022 года.
Бесплатный доступ
Специалисты Международного агентства по изучению рака (Лион, Франция) предоставили текущие данные по заболеваемости раком в 185 странах: число новых случаев в 2020 г. достигло 19,3 млн и 10 млн человек скончались от этой болезни. В течение жизни онкологическое заболевание будет диагностировано у каждого пятого жителя планеты, один из 8 мужчин и одна из 11 женщин умрут от него. Динамика заболеваемости и смертности от них в РФ фиксируется в МНИОИ им. П.А. Герцена - филиале ФГБУ «НМИЦ радиологии» Минздрава России. Проведено сравнение этих показателей в 2010 и 2019 гг. Рост заболеваемости по всем новообразованиям за этот период составил 24%. Однако рост заболеваемости раком щитовидной железы (РЩЖ) доминирует и составляет 58%. Рассмотрены следующие основные факторы риска потенциальной индукции заболеваемости РЩЖ: экологическая ситуация на уровне областей РФ, последствия аварии на Чернобыльской АЭС и эффект скрининга населения с использованием современной диагностической техники. На основе проведённых эпидемиологических исследований численно доказано, что значительное повышение частоты заболеваемости РЩЖ населения РФ может быть обусловлено приведёнными выше основными факторами риска.
Онкозаболеваемость и онкосмертность населения рф, рак щитовидной железы, основные факторы риска, многофакторный эпидемиологический анализ
Короткий адрес: https://sciup.org/170196161
IDR: 170196161 | УДК: 616.441-02:614.876 | DOI: 10.21870/0131-3878-2022-31-4-6-20
Текст научной статьи Динамика заболеваемости раком щитовидной железы населения России: основные факторы риска
В 1965 г. на 18-й сессии Всемирной ассамблеи здравоохранения под патронатом Всемирной организации здравоохранения было создано в г. Лион (Франция) Международное агентство по изучению рака (МАИР). В настоящее время членами МАИР являются 21 государство, в том числе Российская Федерация.
По глобальным статистическим данным GLOBOCAN 2020 Statistics [1], предоставленных МАИР, заболеваемость и смертность по 36 типам рака в 185 странах: число новых случаев рака в 2020 г. увеличилось на 19,3 млн и смертность от рака увеличилась на 10 млн человек. В течение жизни онкологическое заболевание будет диагностировано у каждого пятого жителя планеты; каждый восьмой мужчина и каждая 11 женщина умрут от этого заболевания.
Число людей, выживших спустя пять лет после того, как им поставили диагноз, тоже растёт – их теперь 50,6 млн. На десять наиболее распространённых видов рака приходится 60% новых
Самым смертельным для мужчин признан рак лёгких – на это заболевание приходится 18% всех летальных исходов среди представителей мужского пола. Вторым в списке самых опасных для жизни мужчин онкологических заболеваний стоит рак простаты. Женщины чаще всего умирают от рака молочной железы, рака лёгких и рака прямой кишки.
По оценкам МАИР к 2040 г. число ежегодных новых случаев онкологических заболеваний возрастёт на 47% и достигнет 28,4 млн [1]. Подавляющая часть этой статистики приходится на страны с низким и средним индексом социального и экономического развития. Во многих из этих стран к 2040 г. также значительно возрастут показатели факторов риска, влияющих на заболеваемость, таких как курение, нездоровое питание, ожирение и малоподвижный образ жизни.
«На заболеваемость раком и смертность от него будут влиять изменения структуры населения и условий жизни людей, а также уровень способности систем здравоохранения контролировать ситуацию», – считает специалист Агентства д-р Фредди Брей [1].
Динамика заболеваемости и смертности злокачественными новообразованиями в РФ фиксируется в МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России [2].
Динамика онкозаболеваний в РФ
Таблица 1
|
Локализация, нозологическая форма |
2010 г. |
2019 г. |
Увеличение в 2019 г. к 2010 г. (в %) |
|
Все новообразования |
516 874 |
640 391 |
24% |
|
Кожа (без меланомы) |
64 168 |
83 752 |
31% |
|
Молочная железа |
57 241 |
73 918 |
29% |
|
Трахея, бронхи, лёгкое |
56 985 |
60 113 |
5% |
|
Предстательная железа |
26 268 |
45 763 |
74% |
|
Ободочная кишка |
32 978 |
45 277 |
37% |
|
Желудок |
39 775 |
36 171 |
-9% |
|
Прямая кишка, ректосигмоидное соединение, анус |
25 568 |
31 785 |
24% |
|
Лимфатическая и кроветворная ткань |
24 470 |
31 020 |
27% |
|
Тело матки |
19 784 |
27 151 |
37% |
|
Почка |
18 723 |
24 880 |
33% |
|
Поджелудочная железа |
15 034 |
19 930 |
33% |
|
Шейка матки |
14 719 |
17 503 |
19% |
|
Мочевой пузырь |
13 778 |
17 290 |
25% |
|
Яичники |
13 093 |
14 206 |
9% |
|
Щитовидная железа |
8 879 |
13 987 |
58% |
|
Меланома кожи |
8 416 |
11 961 |
42% |
|
Полость рта |
7 357 |
9 815 |
33% |
|
Печень и внутрипечёночные желчные протоки |
6 464 |
9 324 |
44% |
|
Головной мозг и др. отделы ЦНС |
7 245 |
8 776 |
21% |
|
Пищевод |
7 373 |
8 327 |
13% |
|
Гортань |
6 689 |
6 914 |
3% |
|
Глотка |
4 569 |
5 978 |
31% |
|
Желчный пузырь и внепечёночные желчные протоки |
3 366 |
3 856 |
15% |
|
Губа |
3 356 |
2 162 |
-36% |
|
Соединительная и др. мягкие ткани |
1 769 |
1 887 |
7% |
|
Яичко |
1 479 |
1 540 |
4% |
|
Кости и суставные хрящи |
1 757 |
1 418 |
-19% |
|
Полость носа, среднее ухо, придаточные пазухи |
898 |
994 |
11% |
|
Половой член |
499 |
689 |
38% |
Используя эту базу данных, в табл. 1 приведены данные по отношению онкозаболеваемости в РФ в 2019 и 2010 гг. Как видно из этой таблицы, рост онкозаболеваемости по всем новообразованиям за этот период составил 24%. Однако рост заболеваемости населения раком щитовидной железы (РЩЖ) превосходит рост заболеваний раком других локализаций и составляет 58%.
После аварии на Чернобыльской АЭС в 1986 г. на базе Медицинского радиологического научного центра им. А.Ф. Цыба был создан Национальный радиационно-эпидемиологический регистр (НРЭР), функционирующий в настоящее время по прямому Указу Президента РФ. По данным НРЭР было установлено, что повышение заболеваемости РЩЖ среди детского населения Брянской, Калужской, Тульской и Орловской областей связано с инкорпорированным облучением детей 131I. Эти данные были опубликованы в ведущих отечественных и зарубежных журналах, вошли в итоговые отчёты НКДАР ООН [3-8].
Увеличение частоты заболевания РЩЖ на 58% за последние 10 лет может быть связано со следующими факторами риска: экологической ситуацией в стране; последствиями аварии на Чернобыльской АЭС; эффектами скрининга населения РФ. Рассмотрим последовательно роль и значимость этих факторов.
Роль атмосферных выбросов
Исследована заболеваемость РЩЖ от выброса в атмосферу: монооксида углерода (СО), диоксида азота (NOx), оксида серы (SO 2 ), летучих органических соединений (ЛОС), выбросов твёрдых частицы (ТЧ).
Окись углерода может образовываться при неполном сгорании материалов, содержащих углерод, и является составной частью многих газообразных отходов производства (генераторных, выхлопных, взрывных и пр.). Интоксикация окисью углерода возможна при работе в котельных, литейных цехах, при испытании моторов, в гаражах, автобусах и т.д., в быту при неправильной топке печей или неправильном пользовании газовыми плитами.
Оксиды азота – это группа из семи газов и соединений, состоящая из азота и кислорода, иногда совокупно известных как газы NOx. Двумя наиболее распространёнными и опасными оксидами азота являются оксид азота и диоксид азота. Оксид азота, также называемый веселящим газом, является парниковым газом, который способствует глобальному потеплению.
Оксид азота (NO) выбрасывается в составе выхлопных газов транспортных средств, а также при сжигании угля, нефти, дизельного топлива и природного газа, особенно на электростанциях. Он также выделяется фабриками, сигаретами, газовыми плитами, керосиновыми обогревателями, дровяными котлами.
Самым крупным источником SO 2 в атмосфере является сжигание ископаемого топлива на электростанциях и других промышленных объектах. К более мелким источникам выбросов SO 2 относятся: промышленные процессы, такие как добыча металла из руды; природные источники, такие как вулканы; а также локомотивы, корабли, другие транспортные средства и тяжёлое оборудование, сжигающие топливо с высоким содержанием серы.
Формальдегид, один из наиболее распространённых ЛОС, представляет собой бесцветный газ с едким (резким и горьким) запахом. Формальдегид выделяется от таких строительных материалов как фанера, ДСП и клеи. Формальдегид также можно найти в некоторых портьерах и тканях, в некоторых типах пенопласта.
Выделение ЛОС происходит при сжигании топлива – газа, древесины, керосина, а также при использовании табачных изделий. ЛОС также могут поступать из товаров личной гигиены, таких как духи и лаки для волос; из чистящих средств, жидкостей для химической чистки, красок, лаков, а также из копировальных и печатных машин.
Твёрдые частицы размером менее 2,5 мкм в диаметре можно считать одним из наиболее опасных загрязнителей воздуха для здоровья человека, так как они могут проникнуть в лёгкие, влияя на здоровье дыхательных путей. Источниками ТЧ являются зола, пыль и дым. Эти частицы могут способствовать развитию астмы, сердечных заболеваний и некоторых видов рака.
В статье использованы данные о выбросах загрязняющих веществ в атмосферный воздух по субъектам РФ (Госдоклад Минприроды РФ «О состоянии и об охране окружающей среды Российской Федерации в 2019 году») [9], а также данные по онкозаболеваемости населения субъектов РФ из ежегодных статистических сборников Московского научно-исследовательского онкологического института им. П.А. Герцена [2]. Эти данные представлены на рис. 1-6 для различных регионов России. На рис. 7 представлена постановка задачи многомерной линейной регрессии [10]. В табл. 2 показана нумерация областей РФ на этих рисунках. Результаты проведённого анализа показывают (табл. 3), что выброс твёрдых частиц в атмосферу следует отнести к фактору риска потенциальной индукции заболеваемости РЩЖ.
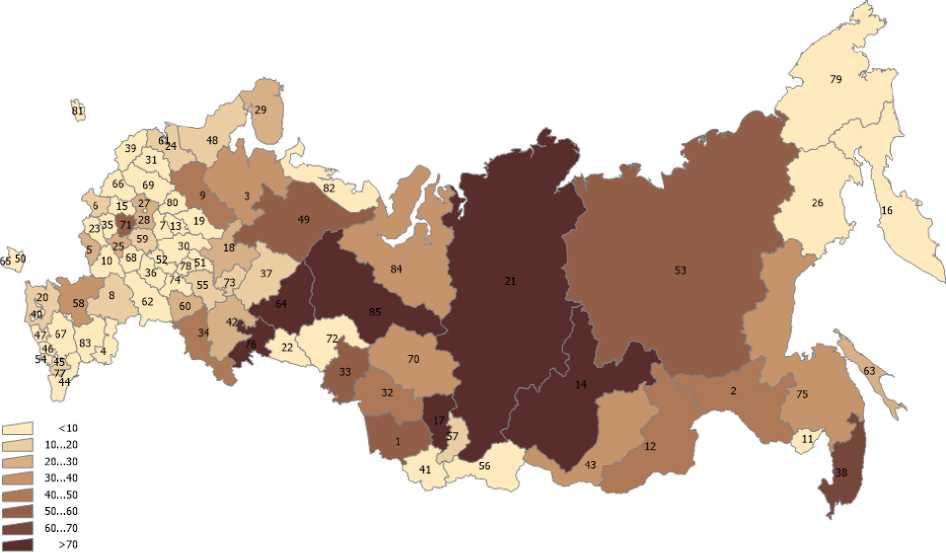
Рис. 1. Распределение средних масс ежегодных выбросов по областям РФ (твёрдые частицы).
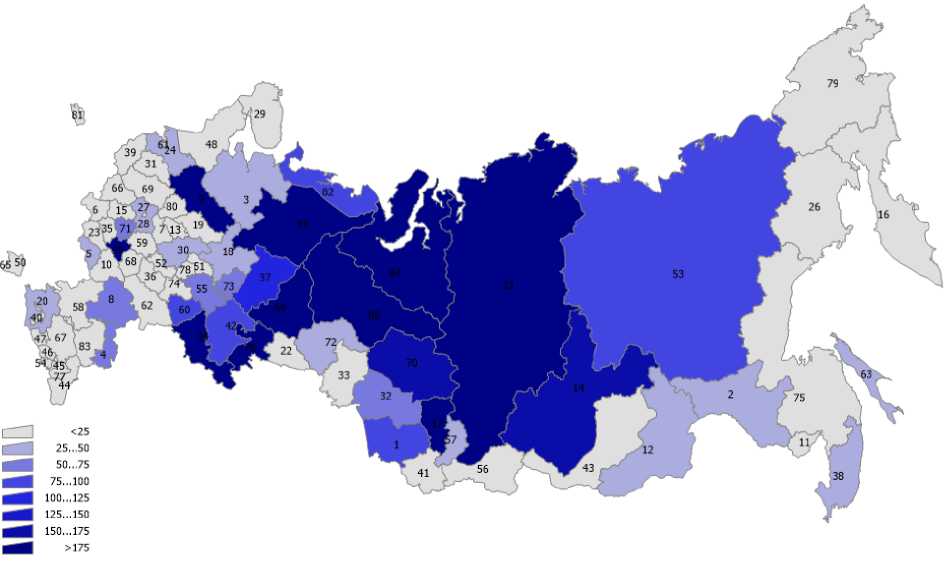
Рис. 2. Распределение средних масс ежегодных выбросов по областям РФ (СО).
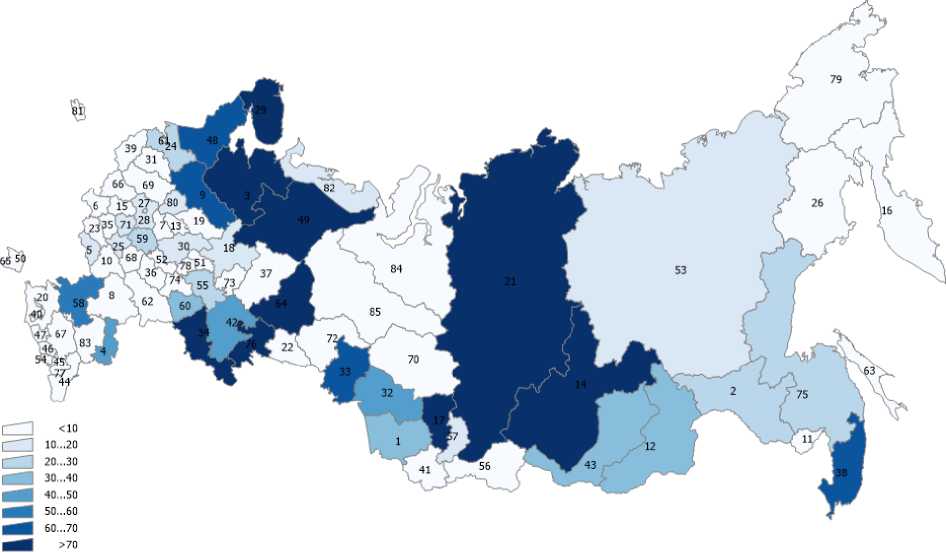
Рис. 3. Распределение средних масс ежегодных выбросов по областям РФ (SO 2 ).
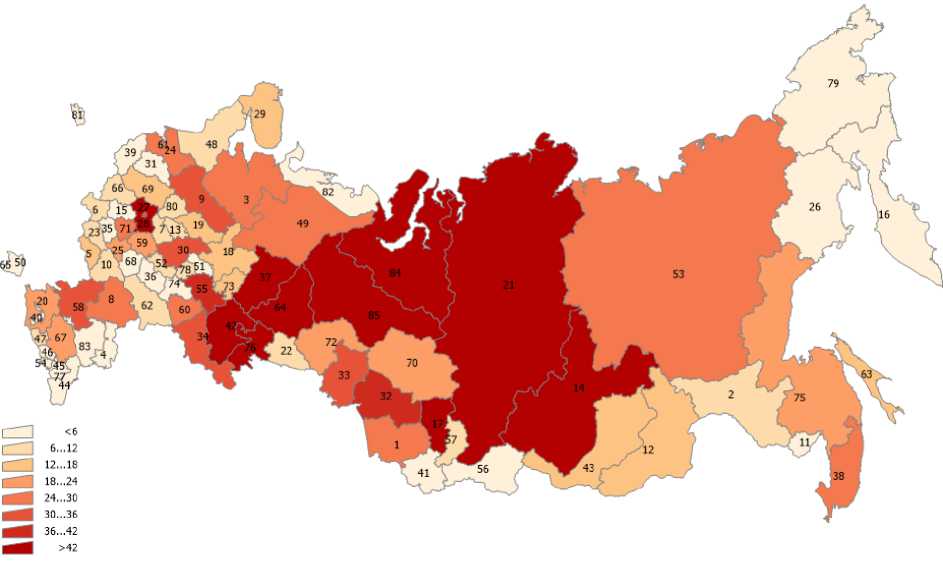
Рис. 4. Распределение средних масс ежегодных выбросов по областям РФ (NOx).
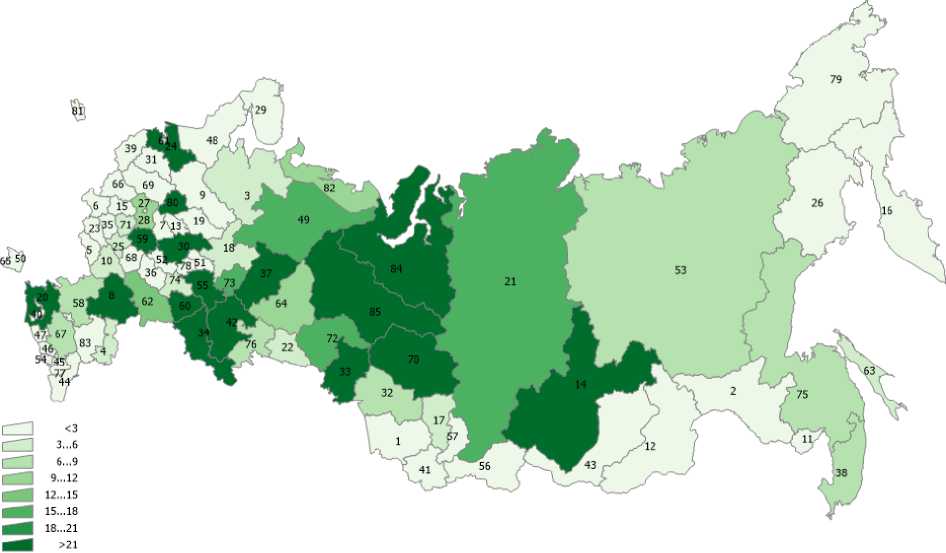
Рис. 5. Распределение средних масс ежегодных выбросов по областям РФ (ЛОС).
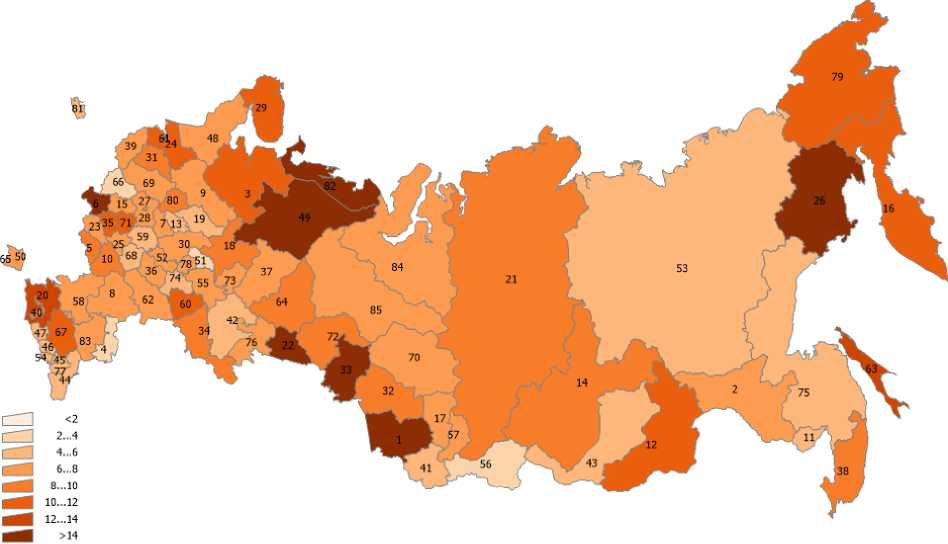
Рис. 6. Грубые показатели заболеваемости раком щитовидной железы по областям России в 2019 г.
Процедура многомерной линейной регрессии для каждого наблюдения будет оценивать линейную форму:
У = b0 + b1X1 t b2X2 t... t bkXk, где У - зависимая переменная; к - число факторов; X - значение независимой переменной для фактора к; Ьк - предиктор, коэффициент чувствительности зависимости переменной У к фактору, коэффициент линейной зависимости заболеваемости от фактора к.
Зависимая переменная в данном анализе - заболеваемость раком щитовидной железы (РЩЖ), предикторы - коэффициенты чувствительности заболеваний к рассмотренному фактору выброса: монооксиду углерода (СО), диоксиду азота (NOX), оксиду серы (SO2), летучим органическим соединениям (ЛОС), выбросам твердых частицы (ТЧ).
Рис. 7. Постановка задачи многомерной линейной регрессии.
Таблица 2
Список субъектов РФ (регионов) с номерами, используемыми на рис. 1-5
|
Название субъекта РФ (региона) |
Номер субъекта РФ (региона) |
Название субъекта РФ (региона) |
Номер субъекта РФ (региона) |
|
Алтайский край |
1 |
Республика Адыгея (Адыгея) |
40 |
|
Амурская область |
2 |
Республика Алтай |
41 |
|
Архангельская область |
3 |
Республика Башкортостан |
42 |
|
Астраханская область |
4 |
Республика Бурятия |
43 |
|
Белгородская область |
5 |
Республика Дагестан |
44 |
|
Брянская область |
6 |
Республика Ингушетия |
45 |
|
Владимирская область |
7 |
Республика Калмыкия |
83 |
|
Волгоградская область |
8 |
Республика Карелия |
48 |
|
Вологодская область |
9 |
Республика Коми |
49 |
|
Воронежская область |
10 |
Республика Крым |
50 |
|
Еврейская автономная область |
11 |
Республика Марий Эл |
51 |
Продолжение таблицы 2
|
Название субъекта РФ (региона) |
Номер субъекта РФ (региона) |
Название субъекта РФ (региона) |
Номер субъекта РФ (региона) |
|
Забайкальский край |
12 |
Республика Мордовия |
52 |
|
Ивановская область |
13 |
Республика Саха (Якутия) |
53 |
|
Иркутская область |
14 |
Республика Северная Осетия – Алания |
54 |
|
Кабардино-Балкарская Республика |
46 |
Республика Татарстан (Татарстан) |
55 |
|
Калининградская область |
81 |
Республика Тыва |
56 |
|
Калужская область |
15 |
Республика Хакасия |
57 |
|
Камчатский край |
16 |
Ростовская область |
58 |
|
Карачаево-Черкесская Республика |
47 |
Рязанская область |
59 |
|
Кемеровская область – Кузбасс |
17 |
Самарская область |
60 |
|
Кировская область |
18 |
Санкт-Петербург – город федерального значения |
61 |
|
Костромская область |
19 |
Саратовская область |
62 |
|
Краснодарский край |
20 |
Сахалинская область |
63 |
|
Красноярский край |
21 |
Свердловская область |
64 |
|
Курганская область |
22 |
Севастополь – город федерального значения |
65 |
|
Курская область |
23 |
Смоленская область |
66 |
|
Ленинградская область |
24 |
Ставропольский край |
67 |
|
Липецкая область |
25 |
Тамбовская область |
68 |
|
Магаданская область |
26 |
Тверская область |
69 |
|
Москва – город федерального значения |
27 |
Томская область |
70 |
|
Московская область |
28 |
Тульская область |
71 |
|
Мурманская область |
29 |
Тюменская область |
72 |
|
Ненецкий автономный округ |
82 |
Удмуртская Республика |
73 |
|
Нижегородская область |
30 |
Ульяновская область |
74 |
|
Новгородская область |
31 |
Хабаровский край |
75 |
|
Новосибирская область |
32 |
Ханты-Мансийский автономный округ – Югра |
85 |
|
Омская область |
33 |
Челябинская область |
76 |
|
Оренбургская область |
34 |
Чеченская Республика |
77 |
|
Орловская область |
35 |
Чувашская Республика – Чувашия |
78 |
|
Пензенская область |
36 |
Чукотский автономный округ |
79 |
|
Пермский край |
37 |
Ямало-Ненецкий автономный округ |
84 |
|
Приморский край |
38 |
Ярославская область |
80 |
|
Псковская область |
39 |
Таблица 3
Параметры регрессионной модели с предиктором «твёрдые частицы» (мужчины)
|
Выброс |
Параметр |
Стандартная ошибка |
t |
p |
-90% |
+90% |
|
Свободный член |
2,476879 |
0,105755 |
23,42102 |
0.000000 |
2,300723 |
2,653035 |
|
Твёрдые частицы |
0,003661 |
0,002119 |
1,72772 |
0,088210 |
0,000131 |
0,007190 |
Последствия Чернобыля и скрининговый эффект
Неблагоприятное влияние радиационного фактора риска на возможное повышение частоты онкологических заболеваний при высоких дозах облучения было доказано в результате проведения крупномасштабных эпидемиологических исследований среди жителей японских городов Хиросима и Нагасаки, подвергшихся в 1945 г. атомной бомбардировке. Результаты этих исследований положены в основу международных принципов радиационной безопасности Научным комитетом ООН по действию атомной радиации (НКДАР ООН), Международной комиссией по радиологической защите (МКРЗ) и МАГАТЭ.
Вместе с тем, крупные радиационные катастрофы последних лет (Три-Майл Айленд, Чернобыль, Фукусима), приведшие к облучению значительных контингентов населения и персонала, ставят в качестве основного приоритета проблему оценки возможных радиационных рисков индукции онкологических заболеваний при средних и малых дозах облучения. Объективное и научно обоснованное решение указанной проблемы в значительной степени влияет на стратегию формирования групп повышенного риска для оказания необходимой и своевременной медицинской помощи органами практического здравоохранения, позволяет широко использовать – при минимизации отдалённых радиологических последствий – современные дорогостоящие медицинские технологии.
После аварии на Чернобыльской АЭС прошло 36 лет, однако результаты постчернобыльских эпидемиологических исследований стали особенно актуальны в последнее время. Это, в первую очередь, связано с важностью и необходимостью использования накопленных знаний и опыта для уменьшения возможных радиологических последствий аварии на АЭС «Фукусима-1» в Японии. Проблема оценки возможных радиологических последствий для населения этой префектуры островного государства остаётся актуальной.
«Опыт Чернобыля» показал, что особое место в оценке радиологических последствий отводится изучению заболеваемости РЩЖ населения наиболее загрязнённых радионуклидами территорий. Многочисленные исследования выявили рост заболеваемости РЩЖ среди лиц из населения загрязнённых территорий в сравнении со спонтанными национальными показателями в Белоруссии, России и Украине [11, 12]. Также было показано, что дети (на момент облучения) могут быть отнесены к группе повышенного радиационного риска по РЩЖ [13].
Вместе с тем, оценка радиационных рисков раковой патологии щитовидной железы в диапазоне малых и средних доз облучения, а также прогноз радиационно-индуцированной заболеваемости РЩЖ в последующие годы в условиях выраженных скрининговых эффектов остаётся непростой задачей.
В исследование были включены люди, подвергшиеся радиационному воздействию в результате аварии на Чернобыльской АЭС в 1986 г. и проживающие на наиболее загрязнённых территориях Брянской, Орловской, Тульской и Калужской областей. Для учёта латентного периода в индукции солидных злокачественных новообразований использовался 5-летний временной лаг, т.е. период наблюдения был выбран с 1.01.1991 по 31.12.2013 гг. Поскольку для членов этой когорты имеется индивидуальная информация об их месте жительства в 1986 г. и возрасте, были получены индивидуализированные оценки доз облучения щитовидной железы от инкорпорированных радионуклидов йода. Общее число людей, включённых в настоящее исследование, составило 327 тыс. человек.
Как было показано в недавнем исследовании, доза облучения щитовидной железы в группе детей и подростков до 18 лет сильно зависит от возраста на момент облучения. Зависимость имеет экспоненциальный вид, и доза облучения щитовидной железы снижается с возрастом при облучении. В то же время доза облучения щитовидной железы для взрослых старше 18 лет не зависит от возраста при облучении. Средняя доза облучения щитовидной железы для детей и подростков в когорте составляет 174 мГр и 36 мГр для взрослых. Максимальные дозы равны 4,48 Гр и 0,66 Гр соответственно.
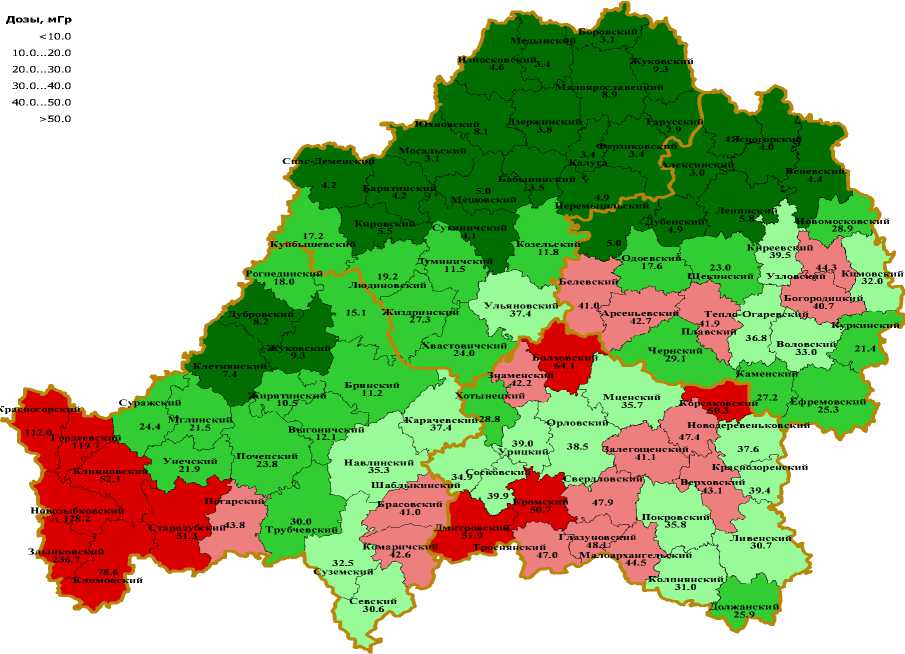
На рис. 8 приведена карта среднерайонных доз облучения щитовидной железы детей и подростков 4-х рассматриваемых областей. Как видно из рисунка, наибольшему облучению подверглись дети и подростки юго-западных районов Брянской области.
Дозы, мГр
<10.0
>50.0
Мосальский
Киро
39.5
23.0
Рогнединский
Дубро
36.8
33.0
39.0
37.6
41.1
35.3
39.9
47.9
41.0
тародубс у48.
47.0
44.5
78.6
30.6
25.9
овский 32.0
Ливенский 30.7
30.0...40.0
Чернский 29.1
40.0...50.0
20.0...30.0
10.0...20.0
фремовский 25.3
Богородицк
40.7
17.2 Куйбышев ачевский28.8 37.4
32.5 Суземск
Почепский
Унечский 23.8
Рис. 8. Карта среднерайонных доз облучения щитовидной железы для детей и подростков (0-17 лет) на момент аварии, проживающих в Брянской, Орловской, Тульской и Калужской областях.
Оценка зависимости заболеваемости РЩЖ от дозы инкорпорированного облучения щитовидной железы радионуклидами йода проводилась с использованием Пуассоновской регрессии. Использовалась модель избыточного относительного риска (Excess Relative Risk, ERR) следующего вида:
I = V[l+0(# (1)
где Л зр - фоновая заболеваемость РЩЖ в когорте, не зависящая от облучения; p (d) - функция, характеризующая зависимость заболеваемости от дозы инкорпорированного облучения щитовидной железы.
Фоновая заболеваемость определялась с использованием внешней контрольной группы:
2 s P = ехр(/?) ■ ;r „s (s,a, t) , (2)
где Arus(s,a,f) - годовые половозрастные показатели заболеваемости РЩЖ населения России; ехр(Р) = ES - эффект скрининга (коэффициент, учитывающий различие спонтанных заболева-емостей в изучаемой и российской популяции в рассматриваемый период времени), в - неизвестная константа.
Как для детей и подростков на момент аварии, так и для взрослого населения, рассматривались линейные модели зависимости заболеваемости РЩЖ от дозы инкорпорированного облучения щитовидной железы:
для детей: p(d) = ERRt Гр ■ d ■ exp[v ■ е + ы ■ ln(a/20)] , (3)
для взрослых: p(d) = ERRt Гр ■ d ■ exp[u ■ (e - 45) + ы ■ ln(a/60)] , (4)
где ERR 1Гр – избыточный относительный риск на единицу дозы 1 Гр; d – индивидуализированная доза инкорпорированного облучения щитовидной железы радионуклидами йода в Гр; e – возраст при облучении; a – достигнутый возраст; υ и ω – неизвестные константы.
Подбор неизвестных констант ERR 1Гр , β , ω и υ осуществлялся с помощью максимизации функции правдоподобия. Так же оценивалась статистическая значимость (p - value) исследуемых параметров. Статистическим тестом для этих целей служит тест отношения правдоподобий. Подбор неизвестных констант, оценки значимости и 95% доверительные интервалы (95% ДИ) проводились с помощью программного пакета R [14]. На рис. 9 графически отражена используемая методология оценки эффекта скрининга и линейной зависимости увеличения частоты РЩЖ от дозы облучения.
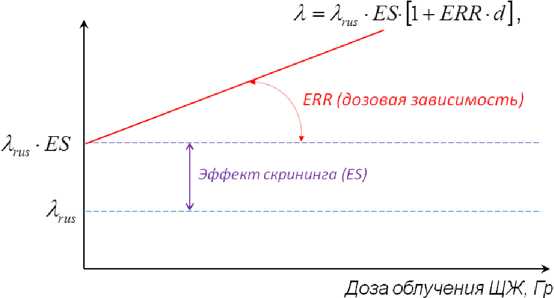
Рис. 9. Модель оценки эффекта скрининга и линейной зависимости увеличения частоты РЩЖ от дозы облучения.
Установлено, что величина избыточного относительного риска (ERR) при дозе облучения щитовидной железы 1 Гр равна 4,73 для детей и подростков на момент аварии на Чернобыльской АЭС. Эффект скрининга равен 12,8 в 1991-1995 гг. и 6,74 в 2006-2013 гг.
Полученные результаты позволяют сделать следующие основные выводы:
-
1. На территориях Брянской, Тульской, Калужской и Орловской областей, в наибольшей степени подвергшихся радиационному загрязнению вследствие аварии на Чернобыльской АЭС, выявлено значительное увеличение частоты заболеваемости РЩЖ среди населения.
-
2. Значимый радиационный риск индукции РЩЖ установлен только для детей и подростков (0-17 лет) на момент аварии. Установлено, что для детей и подростков на момент аварии радиационный риск РЩЖ зависит от возраста на момент облучения и достигнутого возраста.
-
3. Для населения наиболее загрязнённых территорий Брянской, Тульской, Калужской и Орловской областей установлен выраженный скрининговый эффект в процессе регистрации заболеваний РЩЖ (6,74 для детей и подростков 0-17 лет на момент аварии и 1,5 для группы 18 лет и старше). Оценка коэффициента скрининга по периодам наблюдения выявила значимое (p<0,001) 2-кратное снижение эффекта скрининга, начиная с 1996 г., в сравнении с первым периодом (1991-1995 гг.).
Заключение
-
1. За период наблюдения с 2010 по 2019 гг. онкозаболеваемость населения РФ возросла на 24%, при этом заболеваемость раком щитовидной железы – на 58%.
-
2. Рассмотрены три фактора риска возможного повышения частоты заболеваемости раком щитовидной железы: экология, последствия аварии на Чернобыльской АЭС, эффект скрининга.
-
3. Установлено, что приведённые факторы риска индукции заболевания раком щитовидной железы имеют прямое эпидемиологическое доказательство с использованием современных технологий многомерного анализа.
-
4. Полученные данные могут быть использованы при выработке стратегии минимизации последствий для населения при заболеваемости раком щитовидной железы.
Список литературы Динамика заболеваемости раком щитовидной железы населения России: основные факторы риска
- Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram J., Jemal A., Bray F. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality or 36 Cancers in 185 Countries //CA Cancer J. Clin. 2021. V. 71, N 3. P. 209-249. DOI: 10.3322/caac.21660.
- Злокачественные новообразования в России в 2019 году (заболеваемость и смертность) /под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М.: МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2020. 252 с.
- Иванов В.К., Цыб А.Ф. Медицинские радиологические последствия Чернобыля для населения России: оценка радиационных рисков. М.: Медицина, 2002. 392 с.
- Ivanov V.K., Tsyb A.F., Ivanov S.I., Pokrovsky V.I. Medical radiological consequences of the Chernobyl catastrophe in Russia: estimation of radiation risks. St. Petersburg: Nauka, 2004. 388 p.
- Иванов В.К., Кащеев В.В., Чекин С.Ю., Максютов М.А., Туманов К.А., Меняйло А.Н., Власов О.К., Кочергина Е.В., Кащеева П.В., Щукина Н.В., Галкин В.Н., Каприн А.Д., Саенко В.А., Ямасита С. Рак щитовидной железы: уроки Чернобыля и их применение к ситуации в Фукусиме //Радиация и риск. 2016. Т. 25, № 2. С. 5-19.
- Ivanov V.K., Kashcheev V.V., Chekin S.Yu., Maksioutov M.A., Tumanov K.A., Vlasov O.K., Shchukina N.V., Tsyb A.F. Radiation-epidemiological studies of thyroid cancer incidence in Russia after the Chernobyl accident (estimation of radiation risks, 1991-2008 follow-up period) //Radiat. Prot. Dosimetry. 2012. V. 151, N 3. P. 489-499.
- Кащеев В.В., Чекин С.Ю., Максютов М.А., Туманов К.А., Корело А.М., Кочергина Е.В., Власов О.К., Щукина Н.В., Иванов В.К. Оценка радиационных рисков и эффекта скрининга рака щитовидной железы среди населения Брянской и Орловской областей Российской Федерации //Радиация и риск. 2015. Т. 24, № 1. С. 8-22.
- Власов О.К. Радиоэкологическая модель транспорта радионуклидов йода и цезия по пищевым цепочкам после радиационных аварий с выбросом в атмосферу для исследований закономерностей формирования доз внутреннего облучения населения. Часть 4. Исследования закономерностей формирования доз внутреннего облучения населения после аварии на ЧАЭС //Радиация и риск. 2014. Т. 23, № 2. С. 7-27.
- О состоянии и об охране окружающей среды Российской Федерации в 2019 году. Государственный доклад. М.: Минприроды России, 2020. 1000 с.
- Пакет статистических программ «Статистика 10», 2022. [Электронный ресурс]. URL: http://www.statsoft.ru (дата обращения 16.08.2022).
- Cardis E., Kesminiene A., Ivanov V., Malakhova I., Shibata Y., Khrouch V., Drozdovitch V., Maceika E., Zvonova I., Vlasov O., Bouville A., Goulko G., Hoshi M., Abrosimov A., Anoshko J., Astakhova L., Chekin S., Demidchik E., Galanti R., Ito M., Korobova E., Lushnikov E., Maksioutov M., Masyakin V., Nerovnia A., Parshin V., Parshkov E., Piliptsevich N., Pinchera A., Polyakov S., Shabeka N., Suonio E., Tenet V., Tsyb A., Yamashita S., Williams D. Risk of thyroid cancer after exposure to 131I in childhood //J. Natl. Cancer Inst. 2005. V. 97, N 10. P. 724-732.
- Ilyin L.A., Balonov M.I., Buldakov L.A., Bur'yak V.N., Gordeev K.I., Dement'ev S.I., Zhakov I.G., Zubovsky G.A., Kondrusev A.I., Konstantinov Y.O., Linge I.I., Likhtarev I.A., Lyaginskaya A.M., Matyuhin V.A., Pavlovsky O.A., Potapov A.I., Prysyazhnyuk A.E., Ramsaev P.V., Romanenko A.E., Savkin M.N., Starkova N.T., Tron'ko N.D., Tsyb A.F. Radiocontamination patterns and possible health consequences of the accident at the Chernobyl nuclear power station //J. Radiol. Prot. 1990. V. 10, N 1. P. 3-29.
- Ron E., Lubin J.H., Shore R.E., Mabuchi K., Modan B., Pottern L.M., Schneider A.B., Tucker M.A., Boice J.D.Jr. Thyroid cancer after exposure to external radiation: a pooled analysis of seven studies //Radiat Res. 1995. V. 141, N 3. P. 259-277.
- Dalgaard P. Introductory statistics with R. 2nd edition. New York: Springer, 2008.


