Дисперсия реполяризации как предиктор жизнеугрожающих желудочковых аритмий при экспериментальном сахарном диабете малого стажа
Автор: Е.Н. Седякина, А.С. Цветкова, А.В. Дуркина, М.А. Гонотков, Я.Э. Азаров, А.О. Овечкин
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Биологические науки
Статья в выпуске: 4, 2024 года.
Бесплатный доступ
Сахарный диабет (СД) является хорошо известным фактором риска сердечно-сосудистых заболеваний (ССЗ) и сам по себе может вызывать нарушение метаболизма миокарда, окислительный стресс, воспаление, апоптоз кардиомиоцитов, структурное ремоделирование, желудочковую дисфункцию и летальные аритмии. Цель. Поиск модели сахарного диабета, при которой увеличивается частота индуцируемых ишемией/реперфузией миокарда желудочковых аритмий, а также изучение электрофизиологических свойств миокарда желудочков в найденных моделях СД. Материалы и методы. Исследование проведено на 32 крысах с неконтролируемым стрептозото-циновым СД длительностью 4 нед. (малый стаж) и 8 нед. Контрольную группу составили 23 крысы. При эпикардиальном картировании измеряли параметры деполяризации и реполяризации, а также дисперсию реполяризации миокарда желудочков. Ишемию и реперфузию миокарда левого желудочка вызывали перевязкой коронарной артерии с целью провокации желудочковой тахикардии и/или фибрилляции желудочков (ЖТ/ФЖ). Результаты. Продолжительность реполяризации была значительно выше в обеих группах крыс с диабетом по сравнению с контролем, но дисперсия реполяризации отличалась от контроля только в группе с сахарным диабетом продолжительностью 4 нед. В этой же группе реперфузи-онные желудочковые аритмии развивались значимо чаще по сравнению с группой со стажем диабета 8 нед. Выводы. Частота развития реперфузионной ЖТ/ФЖ была выше у крыс с СД длительностью 4 нед., что, возможно, связано с большей дисперсией длительности реполяризации миокарда левого желудочка в этой группе.
Сахарный диабет, реполяризация, желудочковые аритмии, реперфузия
Короткий адрес: https://sciup.org/14132312
IDR: 14132312 | DOI: 10.34014/2227-1848-2024-4-133-143
Текст научной статьи Дисперсия реполяризации как предиктор жизнеугрожающих желудочковых аритмий при экспериментальном сахарном диабете малого стажа
Введение. Сахарный диабет (СД) является хорошо известным фактором риска сердечно-сосудистых заболеваний (ССЗ) и сам по себе может вызывать нарушение метаболизма миокарда, окислительный стресс, воспаление, апоптоз кардиомиоцитов, структурное ремоделирование, желудочковую дисфункцию и летальные аритмии. Эти изменения в совокупности составляют концепцию диабетической кардиомиопатии (ДКМП) [1, 2]. ДКМП является причиной более высокого риска внезапной сердечной смерти у лиц с сердечно-сосудисты1ми заболеваниями по сравнению с лицами без СД [3, 4]. Несмотря на то что желудочковые аритмии при СД, включая желудочковую тахикардию и фибрилляцию желудочков (ЖТ/ФЖ), являются результатом раз-личны1х сердечно-сосудистых патологий, электрическое ремоделирование вследствие ДКМП вносит большой вклад в аритмогенез [5, 6].
Удлинение фазы реполяризации потенциалов действия в желудочковых кардиомиоцитах можно рассматривать как явление, приводящее к развитию либо re-entry либо ранней постдеполяризации в диабетическом сердце [6, 7]. Это происходит в результате сочетания изменений токов K+, Na+ и Ca2+ при диабете [5, 8–10].
Несмотря на имеющиеся успехи в изучении электрического ремоделирования при диабетической кардиомиопатии [9–13] результаты экспериментальных исследований по воспроизведению желудочковых аритмий у животных остаются противоречивыми. Имеются сообщения о безуспешных попытках разработать модель с высоким уровнем аритмического исхода у животных с индуцированным СД [14, 15]. Возможными причинами такой устойчивости к развитию желудочковых аритмий называют диабетическое прекондиционирование миокарда желудочков к влиянию ишемии/ре-перфузии [14] или выраженное повреждение миокарда в экспериментах с продолжительным (более месяца) некорригируемым СД.
Цель исследования. Поиск модели СД, при которой увеличивается частота индуцируемых ишемией/реперфузией миокарда желудочковых аритмий, а также изучение электрофизиологических свойств миокарда желудочков у крыс с разным стажем экспериментального СД.
Материалы и методы. Экспериментальная модель. Эксперименты проведены на 55 крысах-самцах линии «Вистар» (возраст 6– 10 нед.). Исследование выполнено в соответствии с Руководством по уходу и использованию лабораторных животных (8-е издание, National Academies Press (США), 2011 г.) и принципами Директивы 2010/63/EU Европейского парламента о защите животных, используемых в научных целях, и одобрено этическим комитетом Института физиологии Коми научного центра Уральского отделения РАН. У 32 крыс СД индуцировали однократной внутривенной инъекцией стрептозотоцина (60 мг/кг массы тела), растворенного в холодном цитратном буфере (pH 4). Концентрацию глюкозы в венозной плазме измеряли сначала через 24 ч после инъекции, затем один раз в неделю с помощью глюкометра OneTouch (LifeScan, Швейцария). Контрольную группу составили 23 самца того же возраста. Всех животных содержали в стандартных лабораторных клетках и кормили стандартным кормом при постоянном доступе к пище и воде. В дальнейшем крысы с СД были разделены на
2 группы в зависимости от длительности диабета: СД короткий (16 крыс с малым стажем диабета – 4 нед.) и СД длительный (16 крыс с длительностью СД 8 нед.).
Электрофизиология. Запись ЭКГ-отведений от конечностей (КТ-07-3/12, «ИНКАРТ», Санкт-Петербург, Россия) осуществлялась с частотой 1028 Гц, динамическим диапазоном ±310 мВ. Компьютерные измерения длительности комплекса QRS, RR, QT и Tpeak-Tend (от самого раннего Tpeak до самого позднего Tend в отведениях от конечностей) проводились на записанных в цифровом формате ЭКГ.
Запись униполярных электрограмм с поверхности эпикарда проводилась у крыс после анестезии внутримышечной инъекцией тела-зола (15 мг/кг массы тела, Zoetis Manufacturing & Research Spain, S.L., Ctra. de Camprodon, s/n., Finca La Riba, Vall de Bianya, 17813, Же-рона, Испания). Животных интубировали, затем им проводили механическую вентиляцию легких и выполняли срединную торакотомию. Температуру сердца поддерживали на уровне 37–38 °С путем орошения теплым физиологическим раствором и подогрева окружающего воздуха. Униполярные электрограммы регистрировались с поверхности эпикарда правого и левого желудочков с использованием квадратной матрицы из 64 электродов (8×8 отведений, межэлектродное расстояние 0,5 мм) с помощью специально разработанной 128-канальной системы записи (16 бит; полоса пропускания 0,05–1000 Гц; частота 4000 Гц). В каждом эпикардиальном отведении время активации (AT) и время реполяризации (RT) определяли как минимум dV/dt во время комплекса QRS и максимум dV/dt во время зубца T соответственно по отношению к началу комплекса QRS. В качестве продолжительности потенциала действия рассчитывали интервал активации-реполяризации (ARI) – разницу между RT и AT. В анализе использовалась средняя длительность ARI по всем отведениям. За дисперсию реполяризации (DOR), являющуюся предиктором односторонней блокады проведения, принимали разницу между максимальным и минимальным значениями RT. После записи электрограмм в исходном состоянии левую переднюю нисходящую коронарную артерию лигировали для развития ишемии в течение 5 мин, после чего следовал 5-минутный период реперфузии, обеспечиваемый ослаблением лигатуры. Анализировали частоту возникновения эпизодов желудочковой тахикардии и/или фибрилляции желудочков (ЖТ/ФЖ), индуцированных ишемией и/или реперфузией.
Скорость проведения (CV) измеряли с помощью изохронных карт активации при электростимуляции (400 уд./мин, 2 мА, 2 мс) свободных стенок левого и правого желудочков. CV рассчитывали как расстояние, пройденное через матрицу (в продольном направлении (CVL) и в поперечном (CVT)), деленное на разницу между временем активации в месте стимуляции и самым ранним временем активации на противоположной стороне матрицы.
Исследование длительности потенциала действия (ПД) кардиомиоцитов. Выделение кардиомиоцитов проводили у 16 крыс из группы СД малого стажа, 12 крыс из группы СД длительного стажа и 13 контрольных крыс. После электрофизиологического картирования перед изъятием сердца внутрибрюшинно вводился гепарин (5000 МЕ/мл), разведенный в 0,9 % NaCl. Изолированное сердце промывали в течение 10 мин ретроградной перфузией через аорту по системе Лангендорфа аэрированным (95 % O2, 5 % CO2) и модифицированным бескальциевым раствором Тироде следующего состава (мМ): 125 NaCl, 4 KCl, 1,7 NaH2PO4, 25,2 NaHCO3, 0,55 MgCl2, 4,9 пирувата натрия, 20.5 таурина, 11.11 ммоль/л глюкозы и 1 мг/мл бычьего сывороточного альбумина; рН 7,4, 37 °С. Затем перфузию осуществляли раствором Tироде того же состава с добавлением коллагеназы II типа (0,6 мг/мл, Sigma Aldrich, США), протеазы (0,06 мг/мл, Sigma Aldrich, США) и 10 мкМ CaCl2 в течение 30–35 мин для выделения желудочковых кардиомиоцитов. По окончании ферментативной перфузии желудочки разрезали на мелкие кусочки. Клетки отделяли от кусочков фильтрованием через сетку с порами (200 мкм) в растворе Kraft-Brühe, содержащем (мМ): 30 KCl, 50 глутаминовой кислоты,
30 KH2PO4•2H2O, 3 MgSO4•7H2O, 0,5 EGTA, 10 глюкозы, 20 таурина и 20 HEPES; рН 7,2.
Регистрацию записи мембранного потенциала проводили методом patch-clamp в режиме current-clamp при температуре 22–24 °C с помощью Axopatch 200B (Axon Instrument). Желудочковые кардиомиоциты помещали в экспериментальную камеру RC26 (Warner Instrument Corp.). Пипетки изготавливали из боросиликатного стекла (Sutter Instruments) в пуллере HEKA типа PIP 6 (HEKA Electronics).
Для регистрации использовали стандартные растворы: внешний – NaCl 150; KCl 5,4; MgCl2 1,2; HEPES 5; CaCl2 1,8 (pH 7,4, 24 °С, доводили с помощью 5М раствора NaOH); пипеточный – KCl 140; MgCl2 1; EGTA 5; HEPES 10; MgАТФ 4; Na2ГТФ 0,03 (рН 7,2, 24 °С, доводили с помощью 5М раствора KOH).
Статистический анализ. Для статистического анализа использовались IBM SPSS Statistics версии 23.0 и GraphPad Prism 8.0.1 (GraphPad Software, Бостон, Массачусетс, США). Данные представлены в виде медиан и интерквартильных интервалов (IQR). Непараметрические критерии сравнения использовались в связи с отсутствием нормального распределения данных. Тест Крускала – Уоллиса использовался для сравнения контрольной группы, групп короткого и длительного СД. Далее для попарного сравнения использовался U-критерий Манна – Уитни. Частоту реперфузионных аритмий в группах контроля и СД сравнивали, используя точный критерий Фишера. Статистически различия считались значимыми при р<0,05.
Результаты. Как и ожидалось, у крыс с СД уровень глюкозы в плазме венозной крови был выше, чем у контрольных. Так, в контрольной группе показатель гликемии натощак составил 5,7 (IQR 5,3–6,5) ммоль/л против 31,4 (IQR 20,5–33,3) ммоль/л в группе короткого СД и 31,0 (IQR 25,9–33,1) ммоль/л в группе длительного СД (р<0,001 в обоих сравнениях).
На ЭКГ у крыс с сахарным диабетом наблюдалось значимое увеличение интервала RR, длительности QТ и интервала Tpeak-Tend (рис. 1).
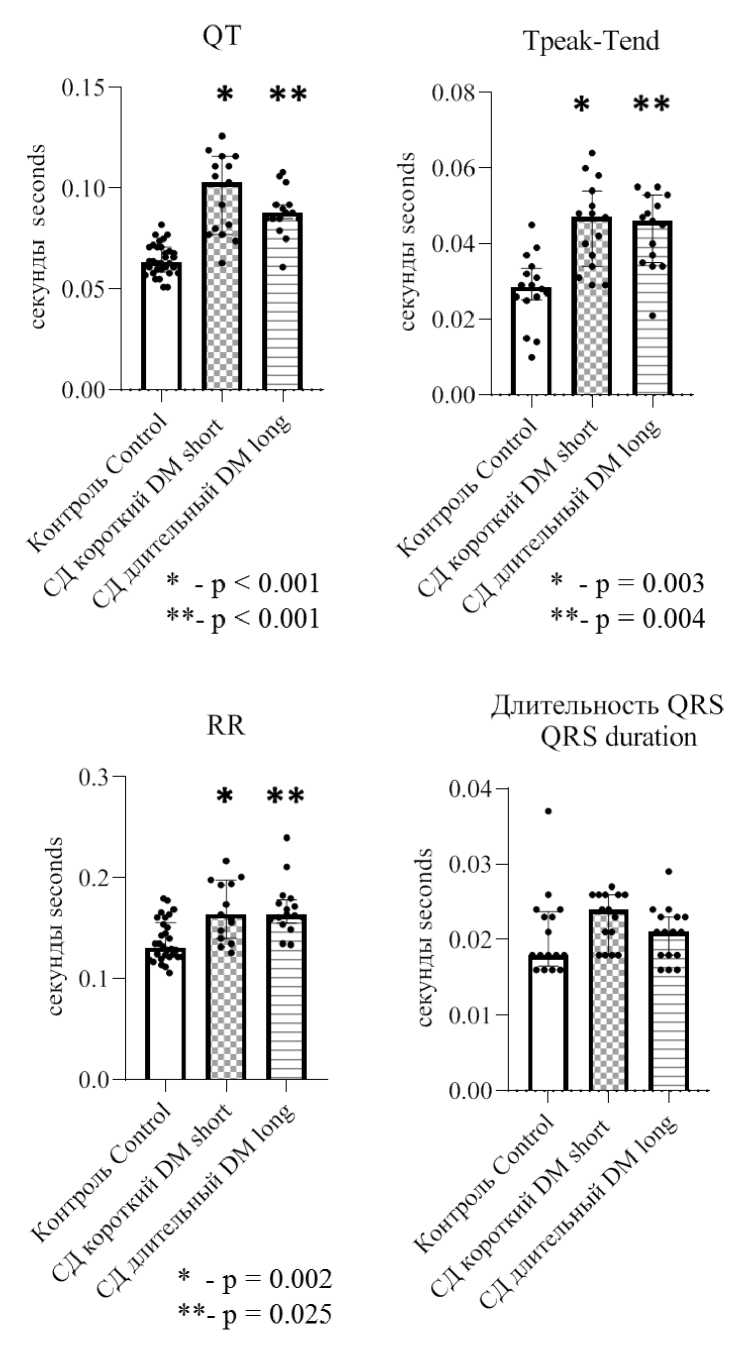
Рис. 1. Сравнение показателей ЭКГ в группах животных (U-критерий Манна – Уитни) Fig. 1. Comparison of ECG parameters in different animal groups (Mann – Whitney U test)
При оценке электрофизиологических параметров верхушки левого желудочка в исходном состоянии (до ишемии/реперфузии) время активации и дисперсия реполяризации значимо отличались от контрольной группы только у животных с коротким стажем СД (рис. 2). Время окончания реполяризации и интервал активации-реполяризации левого желудочка были значимо выше в обеих группах животных с СД по сравнению с контролем (рис. 2).
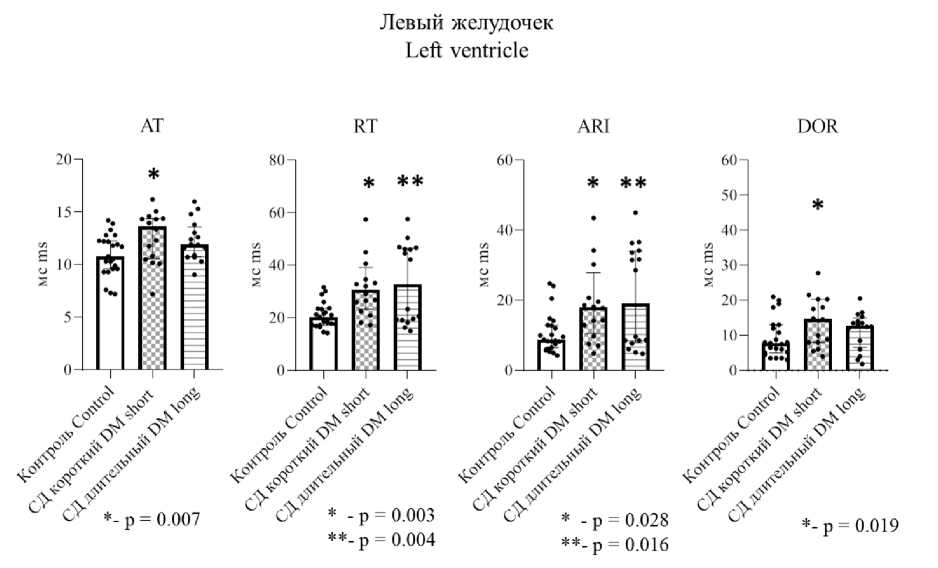
Рис. 2 . Сравнение электрофизиологических параметров верхушки левого желудочка (зона последующей ишемии/реперфузии) в группах животных (U-критерий Манна – Уитни)
Fig. 2. Comparison of electrophysiological parameters of the left ventricular apex (the zone of subsequent ischemia/reperfusion) in different animal groups (Mann – Whitney U test)
У крыс с сахарным диабетом наблюдалось значительное замедление продольной и поперечной скорости проведения как в левом, так и в правом желудочках (рис. 3).
Регистрация потенциалов действия кардиомиоцитов желудочков методом patch- clamp в режиме current-clamp показала увеличение их длительности в обеих группах с сахарным диабетом (рис. 4).
Стоит отметить, что рост продолжительности СД до 8 нед. не привел к дополнительному удлинению ПД (рис. 4).
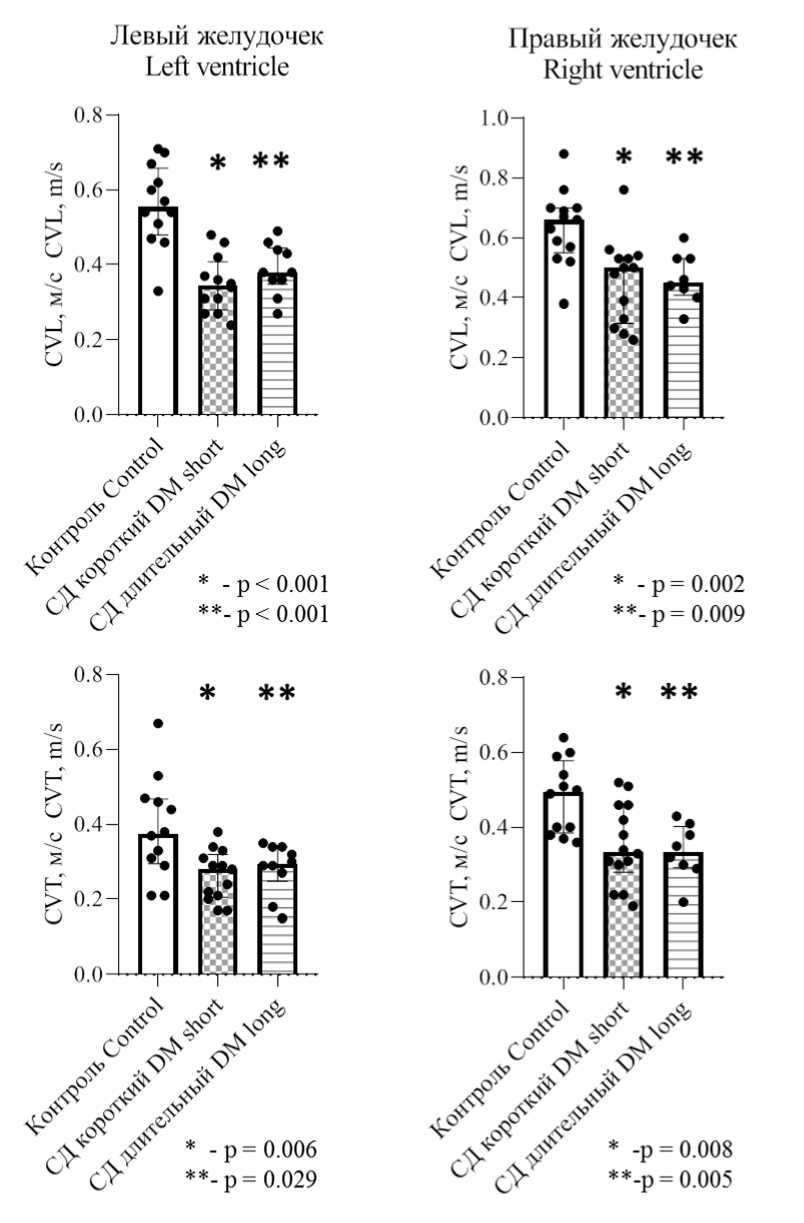
Рис. 3. Сравнение CVL и CVT в левом и правом желудочках в группах животных (U-критерий Манна – Уитни)
Fig. 3. Comparison of CVL и CVT in the left and right ventricles in different animal groups (Mann – Whitney U test)
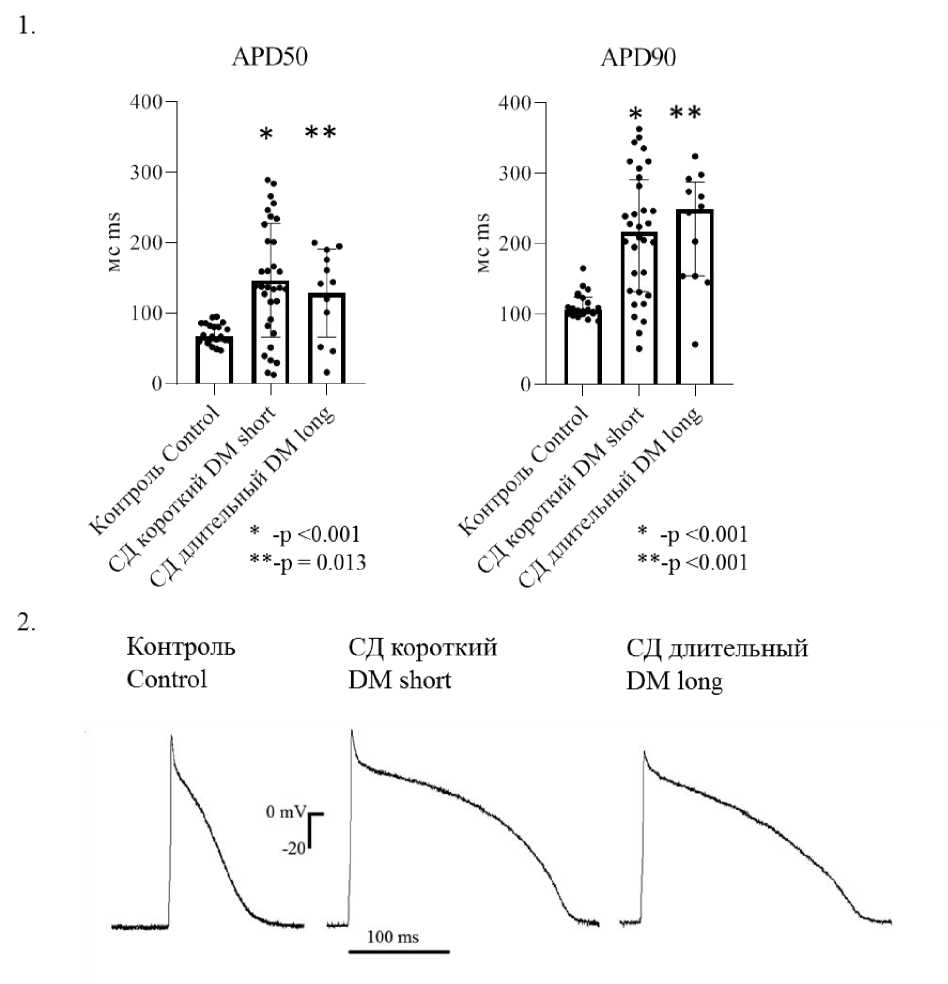
Рис. 4. Сравнение длительности потенциала действия кардиомиоцитов желудочков в группах животных на уровне 50 % и 90 % реполяризации (APD50 и APD90) (U-критерий Манна – Уитни): 1 – длительность ПД кардиомиоцитов желудочков на уровне 50 % и 90 % реполяризации (APD50 и APD90);
2 – репрезентативные записи ПД
Fig. 4. Comparison of the duration of ventricular cardiomyocytes action potential in animal groups at 50 % and 90 % repolarization (APD50 and APD90) (Mann–Whitney U-test): 1 – duration of ventricular cardiomyocyte action potential at 50 % and 90 % repolarization (APD50 and APD90); 2 – representative action potential recordings
Моделирование ишемии/реперфузии левого желудочка привело к появлению реперфузионных ЖТ/ФЖ. В исследуемых группах контроля, СД короткого и длительного стажа частота ЖТ/ФЖ составила 39,1 % (9 из 23),
50,0 % (8 из 16) и 6,3 % (1 из 16) соответственно. Частота ЖТ/ФЖ была значительно выше в группе с коротким стажем СД по сравнению с группой с длительным стажем (p=0,015).
Обсуждение. В нашем исследовании путем вариации длительности индуцированного стрептозотоцином СД у крыс нам удалось получить экспериментальную модель с высокой частотой индуцируемых ишемией/реперфу-зией желудочковых аритмий. У крыс с длительностью заболевания 4 нед. частота ЖТ/ФЖ была выше, чем у крыс с 8-недельным СД.
Электрокардиографическим выражением влияния сахарного диабета на реполяризацию желудочков было удлинение интервалов QT и Tpeak-Tend. Эти параметры ЭКГ и ранее показали себя как предикторы желудочковых аритмий и внезапной смерти при различной патологии сердца [16].
При исследовании изолированных желудочковых кардиомиоцитов крыс методом patchclamp в режиме current-clamp обнаружилось значимое увеличение длительности потенциала действия. Это может быть связано с изменениями ионных токов в кардиомиоцитах, в частности с усилением токов натрия (INa) и кальция (ICaL) [11, 17, 18] и/или ослаблением токов калия (Ito, IKr) [16, 19, 20]. Удлинение продолжительности потенциала действия за счет медленной реполяризации может привести к развитию ранних постдеполяризаций и желудочковых аритмий.
Также наблюдаются признаки замедления активации желудочков у крыс с СД любой продолжительности. Это проявляется снижением скорости проведения и увеличением АТ, что отражает медленное распространение импульса от проводящей системы к картируемой
области. Медленный охват миокарда возбуждением при СД может быть вызван его фиброзом. Конечные продукты гликирования, образующиеся при гипергликемии, действуют на специфический рецептор RAGE, активируют его и вызывают накопление активных форм О2, которые в свою очередь вызывают воспаление как в миокарде, так и в микроциркуля-торном русле. Окислительный стресс и хроническое воспаление миокарда приводят к активации фибробластов, усиленному синтезу коллагена и фиброзу [21, 22].
Дисперсия реполяризации увеличивалась только в группе со стажем СД 4 нед. Повышенная дисперсия реполяризации, предрасполагающая к однонаправленному блоку проведения возбуждения, ранее показана как проар-итмический фактор [23, 24]. Это предполагает высокую вероятность re-entry как механизма, приводящего к развитию желудочковых аритмий у животных с малым стажем экспериментального СД.
Заключение. При экспериментальном СД частота развития реперфузионной желудочковой тахикардии и/или фибрилляции желудочков была выше в группе экспериментального СД длительностью 4 нед., что, возможно, связано с большей дисперсией длительности реполяризации миокарда левого желудочка в этой группе животных. Удлинение длительности реполяризации без роста ее дисперсии или неоднородности не повышает частоту развития желудочковых аритмий при ишемии и реперфузии левого желудочка.
Работа поддержана грантом РНФ (соглашение № 23-25-00455).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Концепция и дизайн исследования: Седякина Е.Н., Цветкова А.С., Азаров Я.Э., Овечкин А.О.
Литературный поиск, участие в исследовании, обработка материала: Седякина Е.Н., Цветкова А. С., Азаров Я. Э., Дуркина А.В., Гонотков М.А., Овечкин А. О.
Статистическая обработка данных: Седякина Е.Н., Цветкова А. С., Азаров Я.Э., Дуркина А.В., Гонотков М.А., Овечкин А. О.
Анализ и интерпретация данных: Седякина Е.Н., Цветкова А. С., Азаров Я.Э., Овечкин А.О.
Написание и редактирование текста: Седякина Е.Н., Овечкин А.О.
Список литературы Дисперсия реполяризации как предиктор жизнеугрожающих желудочковых аритмий при экспериментальном сахарном диабете малого стажа
- Rubler S., Dlugash J., Yuceoglu Y.Z., Kumral T., Branwood A.W., Grishman A. New type of cardiomyopathy associated with diabetic glomerulosclerosis. Am J Cardiol. 1972; 30 (6): 595-602. DOI: 10.1016/0002-9149(72)90595-4
- Bugger H., Abel E.D. Molecular mechanisms of diabetic cardiomyopathy. Diabetologia. 2014; 57 (4): 660-671. DOI: 10.1007/s00125-014-3171-6 EDN: NYILZL
- Zaccardi F., Khan H., Laukkanen J.A. Diabetes mellitus and risk of sudden cardiac death: a systematic review and meta-analysis. Int J Cardiol. 2014; 177 (2): 535-537. DOI: 10.1016/j.ijcard.2014.08.105
- Aune D., Schlesinger S., Norat T., Riboli E. Diabetes mellitus and the risk of sudden cardiac death: A systematic review and meta-analysis of prospective studies. Nutr Metab Cardiovasc Dis. 2018; 28 (6): 543-556. DOI: 10.1016/j.numecd.2018.02.011
- Gallego M., Casis O. Cellular Mechanism Underlying the Misfunction of Cardiac Ionic Channels in Diabetes. Diabetic Cardiomyopathy. Advances in Biochemistry in Health and Disease. 2014; 9: 189-199. DOI: 10.1007/978-1-4614-9317-4_11


