Дистанционная нейтронная терапия в Томске: 40 лет на службе онкологии
Автор: Старцева Ж.А., Грибова О.В., Великая В.В., Сухих Е.С., Лисин В.А., Новиков В.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 1 т.23, 2024 года.
Бесплатный доступ
Цель исследования - оценка эффективности нейтронной терапии (НТ) в лечении радиорезистентных злокачественных опухолей - слюнных желез, рецидивов рака молочной железы (РМЖ). Материал и методы. В исследование включено 130 больных раком слюнных желез, 125 больных с рецидивами РМЖ. Пациенты из групп исследования получали терапию быстрыми нейтронами на циклотроне У-120. Больным из групп сравнения/контроля проводилась терапия редкоионизирующим видом излучения (электронная, дистанционная гамма-терапия).
Нейтронная терапия, рак слюнных желез, комбинированное лечение, лучевая терапия, быстрые нейтроны, рак молочной железы, рецидив
Короткий адрес: https://sciup.org/140303751
IDR: 140303751 | УДК: 615.849.12:616-006(571.16) | DOI: 10.21294/1814-4861-2024-23-1-98-108
Текст научной статьи Дистанционная нейтронная терапия в Томске: 40 лет на службе онкологии
Нейтронная терапия (НТ) как один из методов дистанционной лучевой терапии берет свое начало в ХХ веке. За несколько десятилетий данный вид терапии претерпел немало взлетов и падений. Открытие уникальных особенностей взаимодействия плотноионизирующего излучения с биологической тканью послужило толчком к проведению не только экспериментальных, но и клинических исследований эффективности быстрых нейтронов [1].
Первые попытки использования быстрых нейтронов для лечения злокачественных опухолей были предприняты R. Stone (1938) вскоре после открытия нейтральной частицы. В серии работ, опубликованных в 1940–48 гг., была показана принципиальная возможность деструкции раковой опухоли под воздействием быстрых нейтронов, о чем свидетельствовали 18 больных, переживших пятилетний срок наблюдения. Однако излечение сопровождалось возникновением поздних лучевых повреждений нормальных тканей, вследствие чего автором был сделан вывод о недопустимости применения нейтронного излучения для лечения онкологических больных. Это задержало дальнейшее развитие нового направления клинической радиологии не менее чем на 20 лет [2].
Позже было установлено, что среди радиобиологических преимуществ плотноионизирующего излучения наиболее весомыми являются следующие: сравнительно более высокое значение линейной передачи энергии (ЛПЭ) нейтронной терапии вызывает двунитевые разрывы ДНК, которые репарируются в меньшей степени по сравнению с редкоионизи-рующим излучением; кислородный эффект менее выражен; нивелировка различий в радиочувствительности отдельных стадий клеточного цикла.
Среди основоположников современной нейтронной терапии следует отметить M. Catterall, радиобиологические исследования которой явились толчком для возникновения интереса к применению быстрых нейтронов во всем мире [3, 4]. В различных городах Америки, Германии, Японии были созданы центры нейтронной терапии на базе университетов, где имелись технические циклотроны или нейтронные генераторы. На данный момент нейтронную терапию получили более 30 тысяч пациентов со злокачественными опухолями различных локализаций. Однако медицинской аппаратуры, генерирующей нейтронное излучение и обладающей всеми необходимыми качествами высокоспециализированной радиологической техники, так и не создано [5].
К 2011 г. из сорока мировых центров, где проводилась дистанционная нейтронная терапия, осталось лишь восемь. Причины, с одной стороны, кроются в экономических и технических условиях использования радиотерапевтической аппаратуры. С другой стороны, возросла конкуренция с другими, более современными методиками лучевой терапии (протонная, терапия ионами углерода), что в итоге привело к снижению интереса к использованию быстрых нейтронов. В настоящее время есть данные о работе одного зарубежного центра нейтронной терапии – на базе медицинского центра университета Вашингтона (Сиэттл, США). Циклотрон Scanditronix MC 50 имеет изоцентри-ческий гантри и многолепестковые коллиматоры, которые позволяют проводить конформную терапию нейтронами [6]. В России нейтронная терапия проводилась в трех центрах: НИИ онкологии г. Томска, МРНЦ г. Обнинска и Уральском центре нейтронной терапии в г. Снежинске [7–24].
В течение 40 лет и по настоящее время исследования по НТ продолжаются в НИИ онкологии Томского НИМЦ. История создания терапевтического комплекса для нейтронной терапии уходит в 1979 г. Осенью 1979 г. во время визита в Томск проф. В.А. Анкудинова, руководителя одного из отделений лучевой терапии ВОНЦ (Всесоюзный онкологический научный центр), произошла его встреча с директором НИИ ядерной физики (НИИ ЯФ) при Томском политехническом институте (ТПИ) проф. А.Н. Диденко, в ходе которой обсуждался вопрос об участии ТПИ в обеспечении лучевой терапии в НИИ онкологии г. Томска. Проф. А.Н. Диденко предложил рассмотреть возможность организации на базе НИИ ЯФ службы нейтронной терапии. В то время зарубежные научные публикации свидетельствовали о высоком интересе исследователей к применению этого вида для лечения злокачественных новообразований. А.Н. Диденко сообщил, что НИИ ЯФ имеет возможность создать источник излучения для нейтронной терапии с применением циклотрона У-120.
В январе 1981 г. команда из 4 специалистов СФ ВОНЦ (Сибирский филиал Всесоюзного онкологического научного центра) во главе с Б.Н. Зыряновым отправилась в Киев знакомиться с ведущимися там радиобиологическими исследованиями на аналогичном циклотроне, руководимыми к.м.н. В.Н. Летовым, которого в дальнейшем пригласили возглавить лабораторию радиобиологии в НИИ онкологии г. Томска. Изначально все разделы работ по созданию базы для нейтронной терапии находились в компетенции этой лаборатории.
Необходимые для проведения нейтронной терапии дозиметрические измерения были выполнены осенью 1983 г., а в конце декабря того же года проведены первые сеансы НТ. Работы по клиническим исследованиям эффективности нейтронной терапии при различных локализациях опухолевого процесса возглавила приглашенная из Алма-Аты на должность руководителя отделения радиологии СФ ВОНЦ к.м.н. Л.И. Мусабаева.
Своевременное решение организационных и технических вопросов позволило состояться нейтронной терапии в НИИ онкологии г. Томска. Будучи новым направлением в лучевой терапии злокачественных новообразований не только для Томска, но и для всей страны, нейтронная терапия при своем становлении привлекла широкое внимание общественности и прессы. С тех пор нейтронная терапия остается научным знаменем НИИ онкологии.
В течение нескольких десятилетий после начала проведения нейтронной терапии в Томске велись клинические исследования, расширялся список показаний к применению, разрабатывались программы лечения больных со злокачественными опухолями различных локализаций, а также изучались изменения нормальных тканей при НТ и создавались комплексные программы по предупреждению и лечению лучевых реакций и повреждений окружающих органов и тканей. В 2011–15 гг. были изучены цитогенетические эффекты НТ (совместные исследования с НИИ медицинской генетики Томского НИМЦ) у больных с рецидивами РМЖ и опухолями слюнных желез. Впервые зарегистрирован мутагенный эффект нейтронной терапии в лимфоцитах. Значимое повышение отдельных цитогенетических показателей поднимает вопрос о возможности использования последних с целью индикации лучевой нагрузки при лечении быстрыми нейтронами [25].
По результатам проведенной за 40 лет работы получено более 50 патентов на изобретения, издано 4 монографии, защищено 6 докторских и 7 кандидатских диссертаций. В настоящее время в НИИ онкологии Томского НИМЦ продолжаются исследования, посвященные изучению эффективности терапии быстрыми нейтронами в самостоятельном, комбинированном и комплексном лечении больных злокачественными новообразованиями области головы и шеи, местнораспространенными и рецидивными формами рака молочной железы. По-прежнему актуальными остаются определение четких показаний к назначению курса нейтронной/ нейтронно-фотонной терапии, а также радиобиологические исследования по анализу отдаленных последствий использования плотноионизирующе-го излучения.
В статье представлены значимые результаты текущих научных исследований, проводимых в НИИ онкологии Томского НИМЦ и посвященных изучению эффективности дистанционной нейтронной терапии в лечении радиорезистентных опухолей различных локализаций.
Материал и методы
Медико-биологический комплекс расположен в отдельном блоке здания и состоит из процедур- ного помещения для проведения лучевой терапии, врачебной комнаты для подготовки больных к облучению, пультовой и помещения для дозиметрического контроля.
Топометрическая предлучевая подготовка больных включала в себя спиральную компьютерную томографию, оконтуривание очага и критических органов на планирующей системе XiO с последующим расчетом изодозного распределения и показателей запланированного курса нейтронной терапии.
Злокачественные опухоли слюнных желез
В основную группу включены больные раком больших слюнных желез (n=90), возрастная медиана – 56 лет. Среди гистологических вариантов преобладали аденокарциномы (26,7 %), мукоэпидермоидный (23,3 %) и аденокистозный рак (15,5 %). По местной распространенности преимущественно диагностировались опухоли T3 и T4 стадии (72,2 %), с наличием регионарных метастазов (32,2 %). На первом этапе всем больным проводилось хирургическое вмешательство в объеме паротидэктомии или стандартных операций (удаление пораженной железы), при необходимости с фасциально-футлярным иссечением клетчатки шеи. У 21 больного раком околоушной слюнной железы паротидэктомия дополнялась резекцией ствола и ветвей лицевого нерва. Больным, у которых лицевой нерв не вовлекался в опухолевый процесс, выполнялась органосохраняющая операция с выделением основного ствола и препаровкой ветвей лицевого нерва (n=44).
В послеоперационном периоде после заживления раны больным основной группы проводилась нейтронно-фотонная лучевая терапия. Разовая очаговая доза (РОД) быстрых нейтронов составляла 1,6–2,4 Гр, СОД – 6,4–7,2 Гр, что по изоэффекту составляло 28–38 Гр в пересчете на стандартный курс лучевой терапии. Облучение осуществлялось статическим пучком с 1–2 полей. Нейтронная терапия дополнялась стандартной гамма-терапией до курсовой очаговой дозы 50–60 Гр с учетом факторов прогноза (стадия, гистология, вовлеченность лицевого нерва и т.д.).
В контрольной группе (n=40) – возрастная медиана 53 года – преобладали мукоэпидермоидный рак (35 %) и аденокарциномы (32,5 %). По местной распространенности в 65 % случаев диагностирована T3 стадия опухолевого процесса, метастазы в лимфоузлы шеи выявлялись у 50 % больных. На первом этапе выполнялись оперативные вмешательства аналогичного с основной группой объема. Основным отличием между сравниваемыми группами был вид ионизирующего излучения, который применялся для лечения в адъювантном режиме. В группе контроля пациентам после заживления послеоперационной раны проводился курс стандартной дистанционной гамма-терапии до СОД 50–60 Гр. Группы больных раком слюнных желез были репрезентативны по основным клиникоморфологическим параметрам.
Рецидивы рака молочной железы
В исследование включено 125 больных с местными рецидивами РМЖ T2–4N0–3M0, возрастная медиана – 52 года. Средний срок наблюдения составил 10 ± 2,7 года.
Основная группа (n=86) – нейтронная или нейтронно-фотонная терапия на область местного рецидива РМЖ (с 2007 по 2022 г.). Среди гистологических подтипов преобладали тройной негативный (38,4 %), не люминальный Her2-позитивный (22,1 %) и люминальный В Her2-позитивный (19,8 %) РМЖ. Люминальный А подтип РМЖ отмечен у 5,8 %, люминальный В Her2-негативный – у 13,9 % больных.
Радиорезистентность рецидивной опухоли у 78 (90,7 %) больных основной группы была обусловлена ранее проводимой по поводу первичного РМЖ фотонной или электронной лучевой терапией. Ранее у 73 (84,9 %) больных РМЖ T2N1–2M0, T3–4N03M0 была проведена послеоперационная ДЛТ на область передней грудной стенки и зоны регионарного лимфооттока стандартными фракциями, у 5 (5,8 %) больных РМЖ T3–4N0–2M0 – предоперационная ДЛТ на область молочной железы и зоны лимфооттока – крупными фракциями. У 8 (9,3 %) больных послеоперационная ДЛТ по поводу первичной стадии РМЖ T2N0M0 не проводилась. Кроме того, у 19 (22,1 %) больных местный рецидив опухоли был повторным (после ранее проведенной электронной терапии на область первичного рецидива РМЖ). В связи с этим в зоне предыдущего облучения у некоторых больных отмечался фиброз кожи, поэтому при назначении нейтронной или нейтронно-фотонной терапии дополнительно использовали лечебнопрофилактические методы для снижения местных постлучевых осложнений.
В зависимости от распространенности местного рецидива РМЖ применяли от одного до трех полей облучения. Площадь облучения варьировала от 96 до 300 см2. Разовая очаговая доза быстрых нейтронов составила 1,6–1,8 Гр. За весь курс лечения больным с местными рецидивами рака молочной железы было проведено 3–5 сеансов НТ с интервалом 48 и 72 ч. Нейтронную терапию в СОД 30–40 изоГр получили 28 пациенток, нейтронно-фотонную терапию в СОД 55–60 изоГр – 58 больных. Показаниями к смешанной нейтроннофотонной терапии (НФТ) являлись большая распространенность рецидивной опухоли по передней грудной стенке, а также опухолевая инвазия подлежащей ткани (подкожно-жировой клетчатки, прилежащих ребер). Фотонная терапия (на аппаратах Тератрон 1,25 МэВ или на ЛУ 6 МэВ, РОД 2,0 Гр, СОД 20–30 Гр) проводилась сразу после завершения нейтронной терапии.
Группа сравнения (n=39) – электронная терапия (ЭТ) на область местного рецидива РМЖ (с 2007 по 2009 г.). Гистологические подтипы РМЖ: тройной негативный – 35,9 %, не люминальный Her2-позитивный – 20,5 %, люминальный А – 17,9 %, люминальный В Her2-позитивный – 15,4 %, люминальный В Her2-негативный – 10,3 % больных.
На момент установления первичного диагноза РМЖ у 36 (92,3 %) больных с местными рецидивами ранее применялась лучевая терапия: у 34 (87,2 %) с учетом стадии T2N1–2M0, T3–4N0–3M0 – послеоперационная ДЛТ на область передней грудной стенки и зоны регионарного лимфооттока, в 2 (5,1 %) случаях при T3–4N0–2M0 – предоперационная ДЛТ крупными фракциями на область молочной железы и зоны лимфооттока. У 3 (7,7 %) больных со стадией T2N0M0 послеоперационная ДЛТ не проводилась.
Рецидив РМЖ у всех больных был первичным. Электронная терапия на область местного рецидива РМЖ проводилась на малогабаритном бетатроне (ПМБ – 7 МэВ), РОД 3,0 Гр, ежедневно 5 раз в нед, 16 сеансов, СОД 48 Гр, что соответствует 60 изоГр. В зависимости от размера рецидивной опухоли применялось от 1 до 3 полей облучения, коллиматор 6×8 см.
Для представления характеристик клинических групп использовалась описательная статистика. Анализ отдаленных результатов лечения проводился с помощью метода Каплана–Мейера, сравнение выживаемости в двух и более группах – с помощью теста long-rank со статистически значимым показателем p<0,05. Наблюдения считались цензурированными до момента наступления события: смерти (общая выживаемость), возникновения рецидива (безрецидивная выживаемость), диагностирования отдаленного метастаза (безметастатическая выживаемость). Статистическая обработка результатов проводилась с помощью компьютерной программы Statistica 10.0.
Результаты и обсуждение
Злокачественные опухоли слюнных желез
Общая пятилетняя выживаемость в основной группе составила 73,8 ± 9,5 %, в группе контроля – 43,2 ± 9,4 % (рис. 1), безрецидивная выживаемость – 65,6 ± 7,5 % и 34,8 ± 9,1 % соответственно (рис. 2). Различия статистически значимы (р<0,05).
В основной группе после комбинированного лечения с послеоперационным курсом НТ рецидивы опухоли возникли у 19 (21,1 %) больных: на 1-м году наблюдения – 11 случаев, на 2-м году – 5 случаев
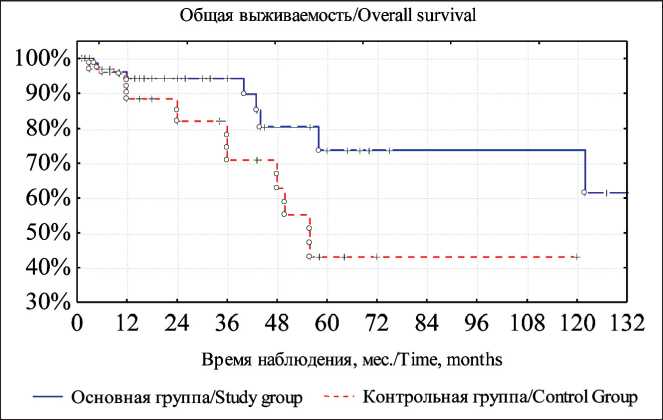
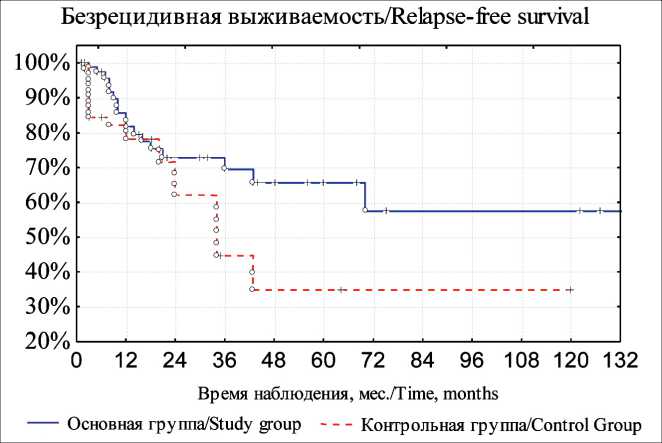
Рис. 1. Общая выживаемость больных раком слюнных желез после комбинированного лечения. Примечание: рисунок выполнен авторами Fig. 1. Overall survival of patients with salivary gland cancer after combined modality treatment.
Note: created by the authors
Рис. 2. Безрецидивная выживаемость больных раком слюнных желез после комбинированного лечения. Примечание: рисунок выполнен авторами
Fig. 2. Relapse-free survival of patients with salivary gland cancer after combined modality treatment. Note: created by the authors
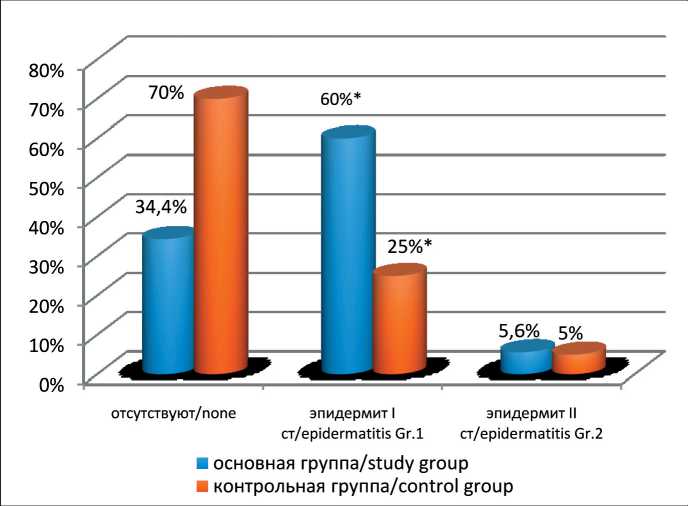
Рис. 3. Частота и характер местных лучевых реакций кожи на полях облучения у больных раком слюнных желез после комбинированного лечения. Примечания: * – различия между группами статистически значимы (р=0,022); рисунок выполнен авторами
Fig. 3. Frequency and type of radiation-induced skin reactions in patients with salivary gland cancer after combined modality treatment.
Notes: * – the difference between the groups is statistically significant (р=0.022); created by the authors и по одному случаю – на 3, 4 и 5-м годах наблюдения. Количество рецидивов в контрольной группе составило 18 (45 %): на 1-м году наблюдения – 8 случаев, на 2-м году – 6 случаев, по 2 случая – на 3-м, 4-м годах наблюдения. Различая в частоте рецидивов статистически значимы (р<0,05).
Особенности распределения дозы быстрых нейтронов определяют характер местных лучевых реакций, из которых самым частым проявлением являются эпидермиты, частота которых в основной группе составила 65,6 %, в группе контроля – 30 % (рис. 3) (р=0,022). В основной группе лучевой дерматит I степени наблюдался у 60 % пациентов, II степени – у 5,6 %, отсутствие лучевых реакций зарегистрировано у 34,4 % больных. В группе контроля также самым частым видом острых лучевых реакций был эпидермит I степени, который проявлялся в виде эритемы кожи на полях облучения, его частота составила 25 %. Лучевой дерматит II степени отмечен у 5 % больных, кожные реакции отсутствовали у 70 % пациентов.
При анализе данных о поздних лучевых повреждениях кожи и подкожной клетчатки не зарегистрировано значимых различий в частоте осложнений между группами. В основной группе поздние лучевые осложнения наблюдались в 42,2 %, в контрольной – в 20 % (р=0,056). Поздние осложнения I степени в группе исследования возникли у 34,4 %, II степени – у 7,8 % больных. В группе контроля у 20 % пациентов наблюдались поздние постлучевые осложнения только I степени.
Местные лучевые реакции со стороны слизистых проявлялись эпителиитами полости рта, фарингитами. В группе контроля частота эпите-лиитов I–II степени составила 20 %. В основной группе частота осложнений со стороны слизистых была несколько ниже – 16,7 %. Симптомы общей лучевой реакции, включая слабость, головокружение, тошноту, наблюдались у 26 (28,8 %) больных основной и у 7 (17,5 %) больных контрольной группы, различия не значимы (р=0,194). Как правило, симптомы умеренной степени выраженности нарастали в течение нескольких часов после сеанса НТ, купировались назначением симптоматической терапии и не приводили к перерыву в лечении.
Таким образом, нейтронная терапия, ранее подтвердившая свою эффективность в лечении неоперабельных опухолей слюнных желез, доказала свою безопасность и эффективность и в комбинированном лечении злокачественных опухолей слюнных желез, большая часть которых имела значительную местную распространенность. Целесообразность применения НТ в послеоперационном периоде подтверждена снижением частоты рецидивов, повышением показателей общей и безрецидивной выживаемости при отсутствии выраженных побочных реакций и повреждений нормальных тканей и критических органов.
Рецидивы рака молочной железы
Частота полной регрессии местного рецидива РМЖ после НТ и НФТ составила 91,8 %, что значимо выше, чем после ЭТ – 51,3 % (p<0,05). У 80 (93 %) больных основной группы возобновления рецидивной опухоли не отмечалось. Лишь у 6 (7 %) больных после НФТ возник повторный местный рецидив РМЖ вне зоны облучения (краевой). В группе с ЭТ повторные местные рецидивы РМЖ развились непосредственно в области облучения у 15 (38,4 %) больных. Десятилетняя выживаемость больных без повторных признаков рецидива РМЖ после НТ и НФТ составила 77,4 ± 8,7 %, после ЭТ – 44,7 ± 8,8 % (рис. 4). Различия статистически значимы (p<0,05).
Переносимость нейтронной и нейтроннофотонной терапии была удовлетворительной. Лучевые реакции кожи наблюдались у 24 (27,9 %) больных: у 9 (10,5 %) – после НТ на область мест-
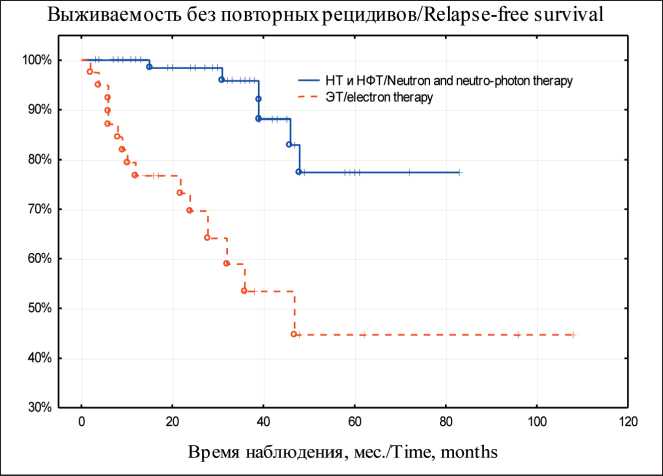
Рис. 4. Выживаемость больных без повторных признаков рецидива РМЖ в основной группе и группе сравнения. Примечание: рисунок выполнен авторами
Fig. 4. Survival of patients with no evidence of rerecurrence of breast cancer in the study group and the control group. Note: created by the authors
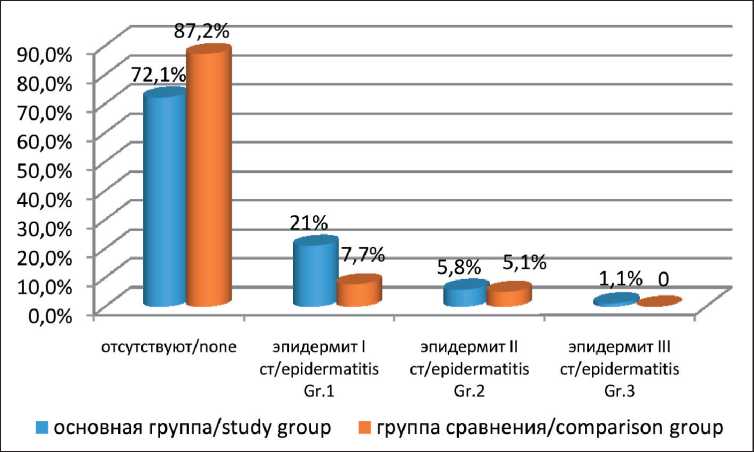
Рис. 5. Частота и характер местных лучевых реакций кожи на полях облучения у больных с местными рецидивами РМЖ в зависимости от вида ионизирующего излучения (p>0,05). Примечание: рисунок выполнен авторами
Fig. 5. The frequency and nature of local radiation-induced skin reactions in patients with local recurrence of breast cancer, depending on the type of ionizing radiation (p>0.05). Note: created by the authors
ного рецидива РМЖ, у 15 (17,4 %) – после НФТ. С учетом распространенности рецидивной опухоли у всех 24 больных площадь облучения при нейтронной терапии составляла 200–300 см2.
Лучевые повреждения кожи и подкожной клетчатки в сроки от 1 до 3 лет отмечались только в случае смешанной нейтронно-фотонной терапии на область местного рецидива РМЖ и диагностированы у 13 (15,1 %) больных, из них у 7 (8,1 %) в виде очаговой атрофии и телеангиоэктазий, у 3 (3,5 %) – в виде выраженного фиброза, лучевые язвы – у 3 (3,5 %) больных (по шкале RTOG/EORTC, 1995 г.). Лучевые пневмониты диагностированы у 27 (31,4 %) больных с местными рецидивами РМЖ: у 6 (7 %) – после НТ, у 21 (24,4 %) – после НФТ. Лучевые пневмофиброзы I степени отмечались у 9 (10,5 %) пациенток с местными рецидивами РМЖ, II степени – у 5 (5,8 %), III степени – у 1 (1,2 %) больной. С целью коррекции лучевых повреждений легких всем больным проводилось лечение с использованием антибактериальных и гормональных препаратов с положительным эф- фектом. В группе сравнения после электронной терапии лучевые реакции кожи отмечались у 5 (12,8 %) из 39 больных с местными рецидивами РМЖ. При анализе данных о частоте и степени лучевых реакций кожи в обеих группах исследования значимых различий не отмечено (p>0,05) (рис. 5). Лучевые пневмониты и пневмофиброзы после электронной терапии не наблюдались, что обусловлено гомогенным облучением очага поражения с резким спадом дозы в критических точках, чем и достигается максимальное щажение окружающих здоровых тканей.
Таким образом, применение быстрых нейтронов у достаточно сложного контингента пациентов с местными радиорезистентными рецидивами РМЖ обеспечивало местный контроль над развитием повторных рецидивов, способствовало улучшению десятилетней безрецидивной и общей выживаемости при наличии небольшой частоты местных лучевых реакций и повреждений нормальных тканей.
Заключение
Обобщая изложенный материал, стоит отметить, что использование плотноионизирующего излучения может сыграть решающую роль в лечении ряда злокачественных новообразований. Также нейтронная терапия может играть важную роль в паллиативной помощи, улучшая качество жизни больных. Данные литературы и представленные результаты исследования подтверждают актуальность создания аппаратуры медицинского назначения, генерирующей нейтронные пучки, которая будет оснащена всеми приспособлениями, необходимыми для радиологической техники, – подвижной диафрагмой, защитными блоками и прочими устройствами. Поэтому с целью обеспечения более высоких показателей конформности, а также расширения спектра показаний к проведению нейтронной терапии совместно с Технологическим референсным центром ионизирующего излучения в радиологии, лучевой терапии и ядерной медицине Инженерной школы ядерных
Список литературы Дистанционная нейтронная терапия в Томске: 40 лет на службе онкологии
- Rockhill J.K., Laramore G.E. Neutron Radiotherapy. Clinical Radiation Oncology. 3rd edition. Philadelphia, PA, USA: Elsevier Churchill Livingston, 2011. 1660 p.
- Brennan J.T., Phillips T.L. Evaluation of past experience with fast neutron teletherapy and its implications for future applications. Eur J Cancer (1965). 1971; 7(2): 219-25. https://doi.org/10.1016/0014-2964(71)90020-x.
- Catterall M., Bewly D.K. Fast neutrons in the Treatment of Cancer. London: Academic Press, New York, Grune and Stratto, 1979. 394 p.
- Catterall M. Neutron therapy at Hammersmith Hospital 1970 to 1985. A re-examination of results. Strahlenther Onkol. 1989; 165(4): 298-301.
- Wagner F.M., Loeper-Kabasakal B., Breitkreutz H. Neutron medical treatment of tumours - a survey of facilities. J. of Instrumentation. 2012; 7: C03041. https://doi.org/10.1088/1748-0221/7/03/C03041.
- Macomber M.W., Tarabadkar E.S., Mayr N.A., Laramore G.E., Bhatia S., Tseng Y.D., Liao J., Arbuckle T., Nghiem P., Parvathaneni U. Neutron Radiation Therapy for Treatment of Refractory Merkel Cell Carcinoma. Int J Part Ther. 2017; 3(4): 485-91. https://doi.org/10.14338/IJPT-17-00003.1.
- Musabaeva L.I., Gribova O.V., Choinzonov E.L., Dubskii S.V. Sposob neitronno-fotonnoi terapii neoperabel'nykh form anaplasticheskogo raka shchitovidnoi zhelezy. Patent № 2344851 RF. Zayavl. 30.07.2007; Opubl. 27.01.2009.
- Dubskii S.V., Kitsmanyuk Z.D., Musabaeva L.I., Choinzonov E.L. Sposob kombinirovannogo lecheniya nedifferentsirovannogo raka shchitovidnoi zhelezy. Patent № 2194550 RF. Zayavl. 17.07.2000; Opubl. 20.12.2002.
- Musabaeva L.I., Velikaya V.V., Zhogina Zh.A., Lisin V.A. Sposob profilaktiki mestnogo retsidiva u bol'nykh mestno-rasprostranennym rakom molochnoi zhelezy T2-4N1-3M0-1 s neblagopriyatnymi prognosticheskimi priznakami. Patent № 2444386 RF. Zayavl. 22.06.2010; Opubl. 10.03.2012.
- Choinzonov E.L., Musabaeva L.I., Lisin V.A. Sposob kombinirovannogo lecheniya zlokachestvennykh novoobrazovanii okoloushnoi slyunnoi zhelezy. Patent № 2206277 RF. Zayavl. 13.04.2001; Opubl. 20.06.2003.
- Musabaeva L.I., Choinzonov E.L. Sposob kombinirovannogo lecheniya zlokachestvennykh novoobrazovanii okoloushnoi slyunnoi zhelezy s posleoperatsionnoi neitronnoi terapiei. Patent № 2145893 RF. Zayavl. 24.06.1998; Opubl. 27.02.2000.
- Musabaeva L.I., Zhogina Zh.A., Velikaya V.V., Lisin V.A. Sposob lecheniya mestnykh retsidivov raka molochnoi zhelezy. Patent № 2286818 RF. Zayavl. 25.05.2004; Opubl. 10.11.2006.
- Musabaeva L.I., Lisin V.A., Slonimskaya E.M. Sposob neitronno-fotonnoi terapii mestno-rasprostranennogo raka molochnoi zhelezy. Patent № 2186591 RF. Zayavl. 04.02.1997; Opubl. 10.08.2002.
- Novikov V.A., Musabaeva L.I., Bushmanova T.G., Lisin V.A., Yasenchuk Yu.F. Sposob kombinirovannogo lecheniya zlokachestvennykh novoobrazovanii polosti nosa i okolonosovykh pazukh. Patent № 2153903 RF. Zayavl. 09.09.1997; Opubl. 10.08.2000.
- Choinzonov E.L., Lisin V.A., Gribova O.V., Novikov V.A., Startseva Zh.A. Neitronnaya terapiya zlokachestvennykh novoobrazovanii golovy i shei. M., 2021. 328 s.
- Choinzonov E.L., Musabaeva L.I., Gribova O.V., Lisin V.A., Avdeenko M.N. Kombinirovannoe i luchevoe lechenie zlokachestvennykh novoobrazovanii slyunnykh i shchitovidnoi zhelezy s primeneniem bystrykh neitronov 6,3 MeV. Neitronnaya terapiya zlokachestvennykh novoobrazovanii. Tomsk, 2008. S. 43-117.
- Choinzonov E.L., Lisin V.A., Gribova O.V., Velikaya V.V., Startseva Zh.A. Metodicheskie osnovy preduprezhdeniya luchevykh reaktsii u patsientov pri neitronno-fotonnoi terapii zlokachestvennykh novoobrazovanii. Sibirskii onkologicheskii zhurnal. 2019; 18(2): 44-51. https://doi.org/10.21294/1814-4861-2019-18-2-44-51.
- Musabaeva L.I., Choinzonov E.L., Gribova O.V., Startseva Zh.A., Velikaya V.V., Lisin V.A. Neitronnaya terapiya v lechenii radiorezistentnykh zlokachestvennykh novoobrazovanii. Sibirskii onkologicheskii zhurnal. 2016; 15(3): 67-71. https://doi.org/10.21294/1814-4861-2016-15-3-67-71.
- Gribova O.V., Musabaeva L.I., Choinzonov E.L., Novikov V.A., Lisin V.A. Primenenie bystrykh neitronov v lechenii zlokachestvennykh novoobrazovanii golovy i shei. Voprosy onkologii. 2015; 61(1): 149-53.
- Novikov V., Musabaeva L., Gribova O. Combined modality treatment including neutron therapy for tumors of the nasal cavity and paranasal sinuses. Adv Mat Res. 2015; 1084: 365-8. https://doi.org/10.4028/www.scientific.net/AMR.1084.365.
- Gribova O., Musabaeva L., Choynzonov E., Novikov V. Neutron and neutron-photon therapy for head and neck cancer. Adv Mat Res. 2015; 1084: 409-12. https://doi.org/10.4028/www.scientific.net/AMR.1084.409.
- Musabaeva L.I., Lisin V.A., Startseva Zh.A., Gribova O.V., Velikaya V.V., Mel'nikov A.A. Neitronnaya terapiya na tsiklotrone U-120. K 30-letiyu primeneniya neitronnoi terapii - obzor rezul'tatov nauchnykh issledovanii. Meditsinskaya radiologiya i radiatsionnaya bezopasnost'. 2013; 58(2): 53-61.
- Velikaya V.V., Startseva Zh.A., Lisin V.A., Gol'dberg V.E., Popova N.O. Ad"yuvantnaya neitronnaya terapiya v kompleksnom lechenii bol'nykh pervichno-metastaticheskim rakom molochnoi zhelezy. Meditsinskaya radiologiya i radiatsionnaya bezopasnost'. 2022; 67(5): 64-8. https://doi.org/10.33266/1024-6177-2022-67-5-64-68.
- Velikaya V.V., Startseva Zh.A., Gol'dberg V.E., Popova N.O., Lisin V.A. Otdalennye rezul'taty kompleksnogo lecheniya s primeneniem neitronnoi terapii u bol'nykh s mestnymi retsidivami raka molochnoi zhelezy. Onkologicheskii zhurnal: luchevaya diagnostika, luchevaya terapiya. 2019; 2(1): 27-32. https://doi.org/10.37174/2587-7593-2019-2-1-27-32.
- Mel'nikov A.A., Vasil'ev S.A., Smol'nikova E.V., Urazova L.N., Musabaeva L.I., Velikaya V.V., Gribova O.V., Lebedev I.N., Choinzonov E.L., Startseva Zh.A. Dinamika khromosomnykh aberratsii i mikroyader v limfotsitakh bol'nykh zlokachestvennymi novoobrazovaniyami pri neitronnoi terapii. Sibirskii onkologicheskii zhurnal. 2012; 4: 52-6.


