Длительньное применение бевацизумаба с интерфероном-альфа в качестве первой линии таргетной терапии распространенного рака почки
Автор: Иванов Сергей Анатольевич, Клименко Александр Анатольевич, Добровольская Наталья Юрьевна
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Оригинальные статьи, собственные исследования
Статья в выпуске: 2 (9), 2014 года.
Бесплатный доступ
Определить эффективность и возможные нежелательные явления при проведении лечения почечно-клеточного рака комбинацией бевацизумаба с интерфероном-а.
Почечно-клеточный рак, ангиогенез, таргетная терапия, нежелательные явления
Короткий адрес: https://sciup.org/14045478
IDR: 14045478
Текст научной статьи Длительньное применение бевацизумаба с интерфероном-альфа в качестве первой линии таргетной терапии распространенного рака почки
Почечно-клеточный рак (ПКР) — наиболее распространенная разновидность рака почки. В структуре онкологических заболеваний на почечно-клеточный рак приходится 4%. По темпам прироста онкологической заболеваемости в России ПКР устойчиво занимает третье место после рака предстательной и щитовидной железы (35,83%). Ежегодно в России от ПКР умирает более 8 тыс человек. Стандартизованный показатель заболеваемости населения России злокачественными опухолями почки — 8,09 на 100 тыс населения [1]. В настоящее время в 25– 40% случаев заболевание выявляют случайно при профилактическом обследовании. Частота почечно-клеточного рака постепенно увеличивается. 5-летняя выживаемость при этой патологии достигает 60%. Однако при наличии метастазов 2-летняя выживаемость колеблется от 0 до 20% [9, 11]. О том, насколько актуальна проблема лечения распространенных форм, говорят следующие факты: сосудистая инвазия отмечается у 5–10% больных раком почки, и одна треть из них также имеет отдаленные метастазы. От 25% до 50% больных имеют метастазы на момент установления диагноза. Более того, приблизительно у половины больных после радикальной нефрэктомии впоследствии появляются метастазы [10].
Ангиогенез является ключевым патогенетическим механизмом роста злокачественного новообразования и диссеминации опухолевого процесса, в связи с чем одними из основных целей противоопухолевой таргетной терапии являются внутриклеточные мишени, вовлечен- ные в процесс стимуляции ангиогенеза и опухолевого роста. Разработано несколько препаратов, влияющих на разные внутриклеточные мишени, относящиеся к патогенетическому пути, связанному с инактивацией гена VHL (фон Хиппель-Линдау). Однако мишени таргет-ных препаратов неспецифичны. Они определяются в нормальных клетках и тканях организма, обеспечивая их физиологические функции (рост, дифференцировку, репарацию и т.д.) [8, 11]. Таким образом, токсический спектр целенаправленной терапии определяется механизмом действия и распределением препарата в организме, дозой и длительностью его применения, а также временем полувыведения лекарственного средства.
Побочные реакции наблюдаются со стороны сердечно-сосудистой системы (изменение артериального давления, тромбозы, нарушения в электрокардиограмме, аритмии, кардиомиопатия, сердечная недостаточность (чаще левожелудочковая)); мочевыделительной системы (протеинурия); желудочно-кишечного тракта (диарея, мукозиты, перфорации); центральной нервной системы (синдром задней обратимой лейкоэнцефалопатии); кожи (ладонно-подошвенный синдром). Особенностью таргетных препаратов, учитывая механизм их действия, является то, что они могут перевести активно растущую злокачественную опухоль в хроническое заболевание. Поэтому раннее и, особенно, отсроченное (на фоне длительного приема препарата) развитие осложнений терапии представляет огромное значение [2, 14].
Бевацизумаб (Авастин) представляет собой рекомбинантное человеческое монокли-
Длительньное применение бевацизумаба с интерфероном-альфа в качестве первой линии таргетной терапии распространенного рака почки нальное антитело, связывающееся с VEGF (фактор роста сосудистого эндотелия) и ингибирующее его биологическую активность как in vitro, так и in vivo. Бевацизумаб (Авастин) вместе с интерфероном-альфа (ИНФ-а) одобрен в Европе с 2007 года в качестве первой линии лечения распространенного рака почки у больных с благоприятным и промежуточным прогнозом по критериям MSKCC (Мемориальный Раковый Центр Слоун-Кеттеринг), а в России — с 2008 года после регистрации [4, 5, 9, 10].
Материалы и методы
В ФГБУ РНЦРР Минздрава России было проведено лечение у 22 больных с распространенным почечно-клеточным раком. Критериями включения являлись морфологически подтвержденный светлоклеточный нерезекта-бельный или метастатический рак почки, наличие измеряемого опухолевого образования, благоприятный или промежуточный прогноз по Motzer [3, 4]. Из них 5 (23%) женщин и 17 (77%) мужчин. Возраст от 47 до 79 лет, средний возраст — 56 лет (±3). Первичной целью исследования являлась оценка общей выживаемости, вторичными целями — выживаемость без прогрессирования, частота объективного ответа на лечение, безопасность и переносимость терапии, наступление нежелательных явлений и борьба с ними.
У 20 (90%) больных на первом этапе была проведена нефрэктомия, 2 (9%) больным в связи с сопутствующей сердечно-сосудистой патологией, нарушением внешнего дыхания и распространенностью болезни хирургическое лечение не проводилось. У 8 (36%) больных выявлен распространенный процесс до хирургического этапа лечения, и операция носила циторедуктивный характер. У 12 (54%) больных прогрессия наступила в сроки от 1 года до 5 лет. У 3 больных имелись солидарные очаги, у 19 (86%) носили множественный характер. В 73% метастазы обнаружены в легких, в 39% — в лимфатические узлы, в 18% — в кости скелета и 24% — в другие органы (надпочечники, почку, печень и забрюшинное пространство). Больным проводилась терапия в режиме бевациз-умаб 10 мг/кг внутривенно капельно каж- дые 14 дней и ИНФ-а по 3 млн.ед подкожно 3 раза в неделю. Каждые 2 недели проводился контроль общего анализа, биохимического анализов крови, коагулограмма и общего анализа мочи. Каждые 3 месяца проводилась компьютерная томография грудной клетки, брюшной полости и таза.
В случае наступления нежелательных явлений проводилась модификация дозы или временная отмена, до улучшения состояния больных. В случае стойких изменений таргет-ная терапия прекращалась.
Период наблюдения составил более 5 лет, медиана продолжительности терапии более 2-х лет (от одного года до трех лет).
Результаты
Через 24 месяца у 14 (63%) больных в ходе лечения отмечено прогрессирование заболевания, стабилизация у 5 (22%) и у 3 (15%) частичный ответ. Полного ответа не отмечено ни у одного пациента. Все больные из благоприятной группы прогноза имели единичные очаги в паренхиматозных органах. У 8 (36%) больных отмечена стабилизация в течение 15 месяцев, затем наступило прогрессирование заболевания. У 4 (18%) больных отмечена прогрессирование в ходе лечения в период до 6 месяцев лечения. Метастатические очаги у всех были множественные и у большинства присутствовали в костях. У 2 (9%) больных стабилизация в течение 9 месяцев, а затем отмечена прогрессия заболевания (Рис. 1).
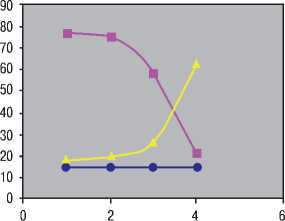
—•— Частичный ответ
—■— Стабилизация
Рисунок 1.
Прогрессирование заболевания
При анализе нежелательных явлений двое (9%) больных отказались от проводимого лечения в период 3 месяцев терапии в связи с плохой переносимостью лечения (слабость, тошнота, рвота на фоне терапии), нежелательные явления у них составили 3 степень (G3).
Слабость на фоне проводимого лечения отмечалась у всех больных, у 19 (86%) не превышала 2 ст. и не требовала дополнительных действий и отмены таргетного препарата. Наличие слабости нами расценивалось как побочный эффект применения ИНФ-а.
Артериальная гипертензия наблюдалась у большинства больных, из которых 4 больных (18%, по данным международного обследования AVOREN — 26%) уже принимали гипотензивные препараты до начала лечения бевацизумабом. Всем больным назначался ежедневный мониторинг артериального давления. При превышении артериального давления выше 130/100 мм рт. ст. пациентам начиналась гипотензивная терапия после консультации кардиолога. Назначались блокаторы кальциевых каналов, при превышении артериального давления выше 160/100 мм рт. ст. назанчались нитраты длительного действия. В случае некупируе-мости повышенного артериального давления проводилась временная отмена таргетной терапии.
Кожные проявления не характерны для приема бевацизумаба, однако нами было выявлено у 6 (27%) пациентов в виде локализованной эритемы (1 степень), которые проходили после назначения антигистаминных препаратов и локального применения витаминных кремов. Мы считаем, что это связано с длительным периодом лечения больных, который превышал период международных исследований.
Со стороны желудочно-кишечного тракта у 11 (50%) больных отмечалась тошнота, которая не превышала 1 степени. Периодическая рвота выявлена у 7 (31%) больных и тоже не превышала 1–2 степени выраженности и не потребовала дополнительного лечения.
Диарея отмечалась у 12 (54%, в исследовании AVOREN — 20%) больных и соответствовала 1 степени выраженности.
При наступлении нежелательных явлений со стороны желудочно-кишечного тракта боль- ным назначалась щадящая диета, ферментативные препараты, обволакивающие средства. Отмена таргетной терапии по поводу этих нежелательных явлений не проводилась ни одному пациенту.
При проведении лабораторных исследований перемежающаяся протеинурия в ходе лечения выявлена была у 14 пациентов (63%) и не превышала 1–2 ст. выраженности у 10 (45%) пациентов, 3 ст. — у 4 (18%, в исследовании AVOREN –18%).
Печеночные ферменты и билирубин незначительно повышались у 17 (77%) больных при длительном периоде лечения и наблюдения и также не требовали лекарственной коррекции (1 степень нежелательного явления — G1).
Нежелательные явления у остальных пациентов не превышали 1 степени и купировались симптоматической терапией. Основным побочным действием было повышение артериального давления и повышения температуры. У 14 (63%) пациентов появлялась протеинурия, которая не потребовала дополнительного лечения и снижения дозы бева-цизумаба.
Обсуждение результатов
В процессе применения бевацизумаба в комбинации с ИНФ-а в качестве первой линии терапии почечно-клеточного рака нами было выявлено, что медиана выживаемости без прогрессии у больных ПКР составила 12 месяцев, общая выживаемость 21 месяц (8–36 месяцев). Эффективность проводимой терапии составила через 6 месяцев 82%, а через 12 месяцев 71% и через 24 месяца 36%, выживаемость на фоне проводимой терапии в 6 месяцев составила 100%, 12 месяцев — 82%, 24 месяца — 72%.
Количество проанализированных пациентов к концу наблюдения составило 6 больных (27%) со стабилизацией и частичным ответом, у 16 (73%) больных отмечено прогрессирование заболевания, 9 (40%) пациентов были переведены на 2 линию терапии, 7 (33%) пациентов умерли в процессе наблюдения.
Длительньное применение бевацизумаба с интерфероном-альфа в качестве первой линии таргетной терапии распространенного рака почки
Рисунок 1. Кумулятивная выживаемость (%)
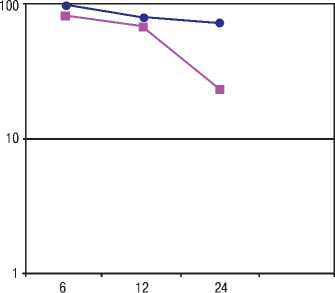
• Общая выживаемость
■ Выживаемость без прогрессирования
Следует отметить, что лечение получали только пациенты из групп благоприятного и промежуточного прогноза. Худшие результаты лечения отмечены у больных с костными метастазами и имеющие больше двух очагов метастазов, а лучшие — имеющие единичные очаги в паренхиматозных органах. Полученные клинические данные сходны с данными других авторов и международных исследований [5, 8].
Анализ нежелательных явлений также показал, что при проведении таргетной терапии препаратом бевацизумаб с низкими дозами ИНФ-а отмечалась неплохая переносимость лечения, основными побочными эффектами были слабость и повышение артериального давления, что требовало дополнительного лечения и в некоторых случаях временной отмены препарата.
Структура нежелательных явлений представлена в таблице 1.
Таблица 1. Нежелательные явления при проведении терапии бевацизумабом и интерфероном -а
|
Нежелательные явления |
1–2 степень тяжести (%) ФГБУ РНЦРР n=22 |
3–4 степень тяжести (%) |
|
|
ФГБУ РНЦРР n=22 |
E/Badjetta (2008 г.) n=121 |
||
|
Слабость |
19 (86) |
31 (4) |
22 (18) |
|
Артериальная гипертензия |
16 (72) |
3 (13) |
4 (3) |
|
Тошнота, рвота |
11 (50) |
0 |
17 (14) |
|
Диарея |
12 (54) |
2 (0.9) |
– |
|
Кожные проявления |
6 (27) |
0 |
– |
|
Протеинурия |
10 (45) |
4 (18) |
8 (7) |
Выводы
Применение бевацизумаба 10 мг/кг внутривенно капельно каждые 14 дней и ИНФ-а-2А по 3 млн ед подкожно 3 раза в неделю в качестве первой линии терапии у больных почечно-клеточным раком повышает общую и выживаемость без прогрессии и является эффективным лечением. Побочные эффекты проводимого лечения связаны в основном с применение ИНФ-а-2А в низких дозах и практически не вызывает побочных эффектов высоких степеней тяжести, требующих проведения специального лечения или отмены проводимого лечения.
Вовремя проведенные превентивные меры позволяют уменьшить побочные эффекты таргет-ных препаратов и улучшить качество жизни данной категории больных. Полученные данные соответствуют данным других исследователей и международных многоцентровых исследований [1, 3, 4, 7, 12].
Полученные результаты соответствуют литературным данным мирового опыта проведения данной терапии, а побочные эффекты не превышают международных данных [1, 3, 4, 7, 8, 12].
Список литературы Длительньное применение бевацизумаба с интерфероном-альфа в качестве первой линии таргетной терапии распространенного рака почки
- Б. Я. Алексеев, А. С. Калпинский, К. М. Нюшко, А. А. Клименко, Ю. В. Анжиганова, С. А. Варламов, С. А. Бичурина, Л. А. Васильев, А. В. Архипов, Л. И. Гурина, О. В. Леонов. Определение факторов прогноза эффективности терапии бевацизумабом у больных метастатическим почечно-клеточным раком, Онкоурология, выпуск N 3, 2013, стр.17
- В. И. Чиссов, В. В. Старинский, Г. В. Петрова, Злокачественные новообразования в России в 2010 году, Москва, 2012 год
- В. А. Чубенко, Осложнения таргетной терапии RUSSCO, выпуск 9, 2012 г., стр. 3
- А. С. Калпинский, Б. Я. Алексеев, А. Д. Каприн. Применение комбинации Авастина с низкими дозами интерферона-а в первой линии лечения метастатического почечно-клеточного рака, Онкоурология, выпуск № 3, 2013, стр. 3
- Motzer R. J., Masumdar M., Bacic J.et al. Survival and prognostic stratification of 670 patients with advanced renal cell сarcinoma. 6. J Clin Oncol. 999;17 (8):2530-40
- Motzer R. J., Bacik J., Murphy B. A.et al. Interferon-alfa as a comparative treatment for clinical trials of new therapies against advanced renal cell carcinoma.J Clin Oncol 2002;20 (1):289-96
- Bukowski R. M., Kabbinavar F. F., Figlin R. A. et al. Randomized phase II study of erlotinib combined with bevacizumabcompared with bevacizumab lone in metastatic renal cell cancer. J Clin Oncol 2007;25:4536-41
- Bui M. H., Seligson D., Han K. R. et al. Carbonic anhydrase IX is an independent predictor of survival in advanced renal clear cell carcinoma: implications for prognosis and therapy//Clin. Cancer Res. 2003. N 9. P. 802-811
- National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: kidney cancer .Available at physician_ gls/PDF/kidney.pdf
- Feldman D. R., Kondagunta G. V., Ronnen E. A. et al.Phase I trial of bevacizumab plus sunitinib in patients (pts) with metastatic renal cell carcinoma (mRCC). Proc ASCO J Clin Oncol 2007;25:5099
- Figlin RA, Hutson TE, Tomczak P, et al. Overall survival with Sunitinib versus interferon-alfa (IFN-) as first-line treatment of metastatic renal cell carcinoma (mRCC). J Clin Oncol. 2008;26 (Suppl.):256s. Abstr.5024
- Farrell M. A., Di Marco D. C. Imaging-guided radiofrequency ablation of solid renal tumors//AJR Amer. J. Roentgenol. -2003.-Vol.180.-P.1509
- Giberti C., Oneto F., Martorana G. et al. Radical nephrectomy for renal cell carcinoma: long-term results and prognostic factors on a series of 328 cases//Eur. Urol. 1997. Vol. 31. № 1. P. 40-48
- Randall, L. M. and Monk, B. J. Bevacizumab toxicities and their management in ovarian cancer. Gynecol Oncol. 117. 3. p. 497-504. 2010


