ДНК-технологии (молекулярное маркирование) в селекции томата на устойчивость к Tobacco mosaic virus
Автор: Горун Олеся Леонидовна, Дубина Елена Викторовна, Козлова Ирина Викторовна, Балясный Иван Валерьевич, Гаркуша Сергей Валентинович
Журнал: Овощи России @vegetables
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 4 (60), 2021 года.
Бесплатный доступ
Актуальность. Целью данной работы является создание на основе современных биотехнологических подходов (молекулярное маркирование) новых конкурентоспособных генотипов томата с повышенной устойчивостью к вирусу табачной мозаики, хозяйственно-ценными признаками и адаптированных к почвенно-климатическим условиям выращивания в южных регионах РФ. Материал и методика. На первом этапе исследования выполнена апробация SSR-маркеров, взятых из литературных источников [1;2] и оптимизированы условия ПЦР для идентификации целевых генов Tm (Tm2a, Tm22, обеспечивающих устойчивость к вирусу табачной мозаики на тканевом уровне) в селекционном материале, имеющемся в отделе овощекартофелеводства. Результаты. Отобрано два информативных молекулярных маркера Tms 37 и UMD 2060, которые выявляют аллельную разницу между устойчивыми и восприимчивыми образцами. Проведена гибридизация ФМС-линий томата с образцами, имеющими в генотипе искомые гены интереса для получения резистентных к ВТМ линий томата. Получены семена отцовских форм - доноров целевых генов для дальнейшего их использования в селекционной работе. Научная новизна заключается в изучении дискретного генетического материала Solanum lycopersicum, используемого в селекционном процессе и сохраняющего свои функции в новом генетическом окружении.
Селекция, томат, втм, ssr-маркеры, пцр
Короткий адрес: https://sciup.org/140257609
IDR: 140257609 | УДК: 635.64:631.524.86:632.38 | DOI: 10.18619/2072-9146-2021-4-34-41
Текст научной статьи ДНК-технологии (молекулярное маркирование) в селекции томата на устойчивость к Tobacco mosaic virus
Forcitations:Gorun O.L., Dubina E.V., Kozlova I.V., Balyasny I.V., Garkusha S.V. DNA technologies (molecular marking) in tomato breeding for resistance to Tobacco Mosaic Virus. Vegetable crops of Russia. 2021;(4):34-41. (In Russ.)
Основной целью в стратегии развития сельского хозяйства является обеспечение про- довольственной безопасности Российской
Федерации. Овощеводство – одна из важных и перспективных отраслей в Краснодарском крае. В связи с политическими и экономическим процессами в мире в минувшие пять-семь лет, введением экономических санкций и пр. в регионе реализуется программа по импортозамещению в сфере производства сельскохозяйственной продукции, в том числе и для овощеводства.В настоящее время разработана подпрограмма «Развитие селекции и семеноводства сельскохозяйственных культур в Краснодарском крае» на период с 2016-2021 годы, целью которой является создание на территории Краснодарского края оптимальных условий для развития селекции и производства конкурентоспособных отечественных сортов и гибридов сельскохозяйственных культур, адаптированных к местным условиям,и развития собственного конкурентоспособного рынка семян сельскохозяйственных культур. Для эффективного импортозамещения, необходимо обеспечить товаропроизводителей посевным материалом отечественных сортов и гибридов томата не менее,чем на 80%.
Томат – одна из самых распространенных овощных культур в Краснодарском крае. Исключительная ценность его плодов заключается в том, что они содержат очень важные витамины, органические кислоты, минеральные соли, необходимые для лучшего обмена веществ и сохранения трудоспособности человека [1, 2].
Наряду с развитием технологий,создание новых сортов и гибридов томата, обладающих комплексом хозяйственно-ценных признаков и устойчивостью к болезням являются обязательным условием для повышения экономической эффективности отрасли. К сожалению, на настоящий момент значительная часть семенного материала томатов импортируется.В связи с этим возрастает необходимость развития отечественной селекции и семеноводства данной культуры. Очевидно, что для повышения эффективности селекционного процесса и процесса семеноводства необходимо комплексное изучение имеющихся генетических ресур-сов,в том числе и с использованием современных методов молекулярно-генетического анализа и внедрение таких методов в процесс селекции для ее ускорения.При этом,использование в качестве ключевого селекционного «инструмента» методов молекулярно-генетической идентификации целевых генов, детерминирующих хозяйственно-ценные признаки,даст возможность выполнения программ по созданию сортов и гибридов с комплексной устойчивостью к болезням за счет пирамидирования нескольких генов устойчивости (объединение в одном генотипе), что является труднодостижимым при использовании классического фитопатологического тестирования [3, 4, 5].
Одним из самых распространенных вирусных заболеваний томата является вирус табачной мозаики (ВТМ). При заражении ВТМ потери урожая достигают более 50%. Заболевание характеризуется появлением мозаичной окраски листьев,стеб-лей и плодов с последующей их деформацией и увяданием.Реакция растения томата на заражение вирусом зависит не только от генетики хозяина (наличия или отсутствия генов Тm), но и от генотипа вируса.ВТМ передается механически и насекомыми.
Есть три доминантных гена 2-х типов устойчивости квирусу: Tm-1, Tm-2 и Tm -2a. Tm -1, локализованный на хромосоме 5, обеспечивает устойчивость томата к ВТМ на клеточном уровне и не дает полной устойчивости. Ген Tm -2a обеспечивает большую устойчивость к различным штаммам вируса. Гены Tm-2 и Tm-22, локализованные на хромосо-ме9, придают устойчивость на тканевом уровне – блокируют передвижениевируса от клетки к клетке, а также вызывают реакцию гиперчувствительности [6, 7].
Заболевание вызывается вирусом, относящимся к группе Toba movirus. Типичным представителем этой группы является вирус табачной мозаики ( Tobacco mosaic virus – TMV ). В прошлом к нему относились и специализированные штаммы, которые повреждают томат. В настоящее время он рассматривается как самостоятельный вирус мозаики томата ( Tomatomosaicvirus – ToMV ). Установлены две расы ToMV–0 и 1. Вирион этого вируса – палочковидный. Он обладает высокой термоустойчивостью и инактивируется при нагревании до 93°С в течение 10 мин [8].
Цель работы – создать на основе современных биотехнологических подходов (молекулярное маркирование) новые дискретные конкурентоспособные генотипы томата с повышенной устойчивостью к вирусу табачной мозаики, хозяйственно-ценными признаками и адаптированные к почвенно-климатическим условиям выращивания в южных регионах РФ.
Задачи исследования:
1.Провести скрининг имеющегося селекционного материала томата в отделе овощекартофелевод-ства и выделить генотипы по комплексу хозяйственно ценных признаков и устойчивости к вирусным болезням. Подобрать родительские формы для гибридизации.
-
2. Выполнить апробацию SSR-маркеров в количестве не менее 10. Оптимизировать условия ПЦР (экспериментальные параметры) и электрофореза для идентификации целевых генов Tm (устойчивости к вирусу табачной мозаики) в селекционном материале и выполнить ДНК-маркерный скрининг на выборке не менее,чем 50 образцов.
-
3. Провести гибридизацию ФМС-линий томата с образцами, обладающими устойчивостью к генам-интереса для получения ФМС-линий с генами резистентности к ВТМ.
-
4. Получить семена отцовских форм – доноров целевых генов для дальнейшего их использования в селекционной работе.
-
5. При использовании камеры искусственного климата получить F 2 -поколение ФМС-линий с генами устойчивости Tm.
Методы
Создание исходного материала томата, устойчивого к вирусу табачной мозаики нового поколения с заданными характеристиками, предполагает серию скрещиваний ФМС-линий типа Врбычанский низкий (ps-2) с донорами устойчивости к ВТМ и дальнейшим отбором в F 2 стерильных форм, обладающих заданными параметрами.В семеноводстве гетерозисных гибридов томата использование линий с признаком функциональной мужской стерильности (ФМС) в качестве материнских компонентов является перспективным способом получения дешевых семян.Этот метод позволяет обеспечить 100% гибридность производимых семян, сократить время на их производство и снизить затраты труда на опыление и маркировку цветов примерно вдвое. Для закрепления признака устойчивости к ВТМ проводится беккроссные скрещивания.
Гибридизацию донорных и реципиентных форм томата проводится путём кастрации материнских растений и опыление путём нанесения пыльцы рекуррента на рыльце пестика реципиента [9].
Для молекулярно-генетического исследования ДНК из анализируемых образцов выделяется из свежесрезанной части листовой пластинки растений томата на стадии 4-5 листьев методом СТАВ с модификациями [10].
Экстракция ДНК проводится буфером следующего состава: 1М Tris-HCl (pH 7.5), 5MNaCl, 0.5MEDTA (pH 8.0), 10% SDS. Часть листа (2-3 см) растирали в 500 мкл экстрагирующего буфера в пластиковой пробирке объемом 1,5 мл.
Образцы инкубируются при 60ºС в течение 31 часа. Затем охлаждаются до комнатной температуры. Супернатант отделяется центрифугированием при 12000 об/мин. К перенесенной в чистую пробирку верхней фазе добавляется 500 мк лизопропа-нола и оставляется на 10 минут, предварительно перемешав.После этого образцы центрифугируются 5 минут при 12000 об/мин. Полученный осадок промывается 300 мкл 70% этанола, высушивается и растворяется в 50 мкл 0,1*ТЕ. В ПЦР смесь добавляется по 3 мкл раствора ДНК, выделенного данным методом [11].
ПЦР проводится по следующему разработанному протоколу:
-
1) Состав реакционной смеси: 0,05 мМ дезоксирибонуклеозидфосфатов (dNTPs), по 0,3 mМ каждого праймера, 25 мM KCL, 60 мM Tris-HCL (pH 8,5), 0,1% Тритон Х-100,10 мМ 2-меркаптоэтанола, 1,5 мМ MgCL 2 , 1 единица Taq-полимеразы с 40-50 нг ДНК в конечном объеме 25 мкл [12].
-
2) Условия ДНК-амплификации: начальная денатурация ДНК при 940С – 4 минуты, следующие 45 циклов: 30 сек – денатурация при 9 40С; 30 сек – отжиг праймеров при ТoC, указанной в таблице 1; 30 сек – элонгация при 720С; последний цикл синтеза 7 минут при 720С. Для ДНК-анализа применяются нейтральные кодоминантные микросателлитные маркеры, взятые из литературных источников [12, 13] и базы данных на сайте https://vegmarks.nivot.affrc.go.jp/VegMarks/app/pa ge/home, разработанные для оценки уровня полиморфизма у растений S olanum lycopersicum . Специфичные праймеры,использованные в исследованиях (табл.1), синтезированы фирмой ЗАО «Синтол» (г. Москва).
ДНК-амплификация проводится на амплификато-рах «Терцик» («ДНК-технология», г. Москва) и «BioRad» (производства Германия).
-
3) Разделение продуктов реакции амплификации проводится методом электрофореза в 2%-ном агарозном геле.
-
4) Визуализация результата электрофоретического разделения продуктов ПЦР проводится в УФ-свете и фотографируется.
Результаты исследований
ДНК-скрининг селекционного материала с использованием высокоинформативных SSR- маркеров сопутствует селекционной схеме для прицельного отбора генотипов,несущих максимальное
Таблица 1. Нуклеотидная последовательность праймеров для идентификации генов устойчивости Tm–2 [12, 13] Table 1. Nucleotide sequence of primers for identification of Tm–2 resistance genes [12, 13]
|
Маркер |
Сиквенс праймеров |
T отжига, oC |
|
|
F-праймер 5′-3′ |
R-праймер 5′-3′ |
||
|
UMD- 1958 |
tccgttgttctgtcaatcca |
cctcccacaaaaagaccaaa |
60 |
|
UMD -2060 |
ttccctggatcatctgtcact |
acagcttgttgttgctgctg |
60 |
|
UMD- 2781 |
ttctccttacccctgccttt |
ttggcattcaatcaacaagaa |
60 |
|
UMD-88 |
ggtaatgatggtctttgtggtcctcc |
tcttgttgatgattcttgttgcgacg |
65 |
|
Tms 22 |
tgttggttggagaaactccc |
aggcatttaaaccaatagtagc |
55 |
|
Tms 9 |
ttggtaatttatgttcggga |
ttgagccaattgattataagtt |
55 |
|
Ssr 63 |
ccacaaacaattccatctca |
gcttccgccatactgatacg |
55 |
|
Leef 1Аa |
aaataattagcttgccaattg |
ctgaaagcagcaacagtattt |
55 |
|
Tms 37 |
acaaactcaagataagtaagagc |
gtgaattgtgttttaacatgg |
55 |
|
Est 253712 |
gaaatgaagctctgacatcaa |
tcattgcttgcatatgttcatg |
55 |
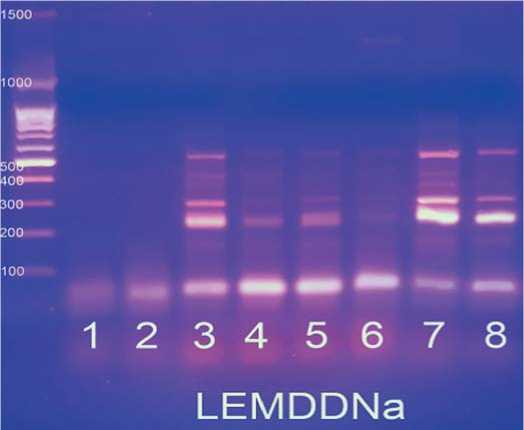
Рис.1.Визуализация продуктов ПЦР по локусу LEMDDNaв 2%-ном агарозном геле.
Примечание:Mm – маркер молекулярной массы 100 bp+1,5 Kb (поставщик – комп.Синтол, Россия);1-4 – неустойчивые формы к ВТМ;5-8 – устойчивые линии Fig.1.Visualization ofPCR products by the LEMDDNalocusin a 2% agarose gel.
1-4 –unstable formsfor VTM;5-8 – stable lines число ценных аллелей. В итоге в разы сокращается время, необходимое для вывода на рынок конкурентоспособных селекционных продуктов, вследствие чего снижается себестоимость их производства, что непременно сказывается на цене посевной единицы при их коммерциализации.
Для изучения уровня полиморфизма микрοсателлитных локусов между устойчивыми и неустойчивыми формами томата, испοльзуемыми в качестве родительских форм в селекционной работе, нами апробированы SSR маркеры, взятые из литературных источников и базы данных на сайте ge/home [12, 13, 15].
Отбор маркеров, пригодных для оценки полиморфизма ДНК сортов томата, отличающихся по устойчивости к ВТМ, проводился на материале, имеющемся в коллекции ФГБНУ «ФНЦ риса».
Некоторые результаты оценки уровня полиморфизма использованных в работе SSR-маркеров между контрастными (устойчивыми/неустойчивы-ми) фермами томата представлены на рисунках 1-5.
Из рисунка 1 видно, что по данному локусу неустойчивый образец под №3 имеет идентичный ДНК-профиль с устойчивым образцом №7; неустойчивый образец №4 имеет ПЦР-продукт, аналогичный устойчивому образцу №8; ДНК-профили устойчивых образцов № 5 и 6 также отличаются между собой, т.е. нет единообразия ДНК-профилей как у устойчивых образцов между собой, так и у неустой-чивых,поэтому данный маркер является не информативным и не эффективным для использования его при идентификации донорных аллелей целевого гена Tm2a . Размеры ожидаемых целевых фрагментов – 229 и полученных –220 и 280.
Рисунок 2 демонстрирует результаты амплификации между контрастными образцами по локусам Est 253712 и Leef1Aa. Как видно, полиморфизм между анализируемыми контрастными образцами по локусу Est 253712 не выявлен. По локусу Leef1Aa из анализируемых неустойчивых образцов идентичный ДНК-профиль имеют только №1 и 4; из устойчивых: № 6, 7, и 8. Таким образом, данные маркеры также не пригодны для визуализации донорных аллелей целевого гена.Размеры ожидаемых целевых фрагментов для маркера Est 253712 – 147 и полученных – 125 и 140. Размеры ожидаемых целевых фрагментов для маркера Leef1Aa – 203 и полученных – 209.
На рисунке 3 видно, что полиморфизм между анализируемыми устойчивыми и неустойчивыми образцами по локусу Ssr63 не выявлен. По локусу Tms 37 четко выявлена аллельная разница между восприимчивыми и резистентными формами тома-
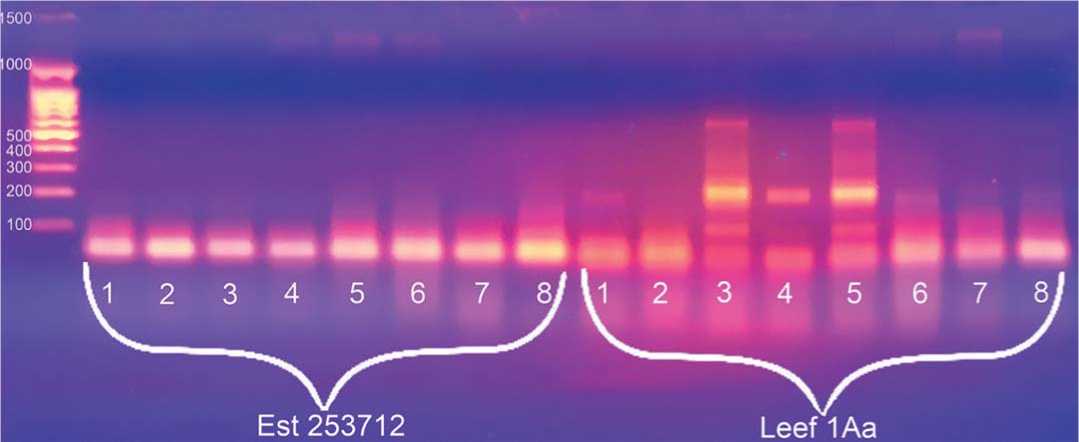
Рис.2.Визуализация продуктов ПЦР по локусам Est253712 и Leef1Aaв 2%-ном агарозном геле.Примечание:Mm – маркер молекулярной массы 100 bp+1,5 Kb (поставщик – комп.Синтол, Россия);
1-4 – неустойчивые формы к ВТМ;5-8- устойчивые линии
Fig.2.Visualization ofPCR productsby Est253712 and Leef1Aalociin a 2% agarose gel.
1-4 – unstable formsfor VTM;5-8– stable lines
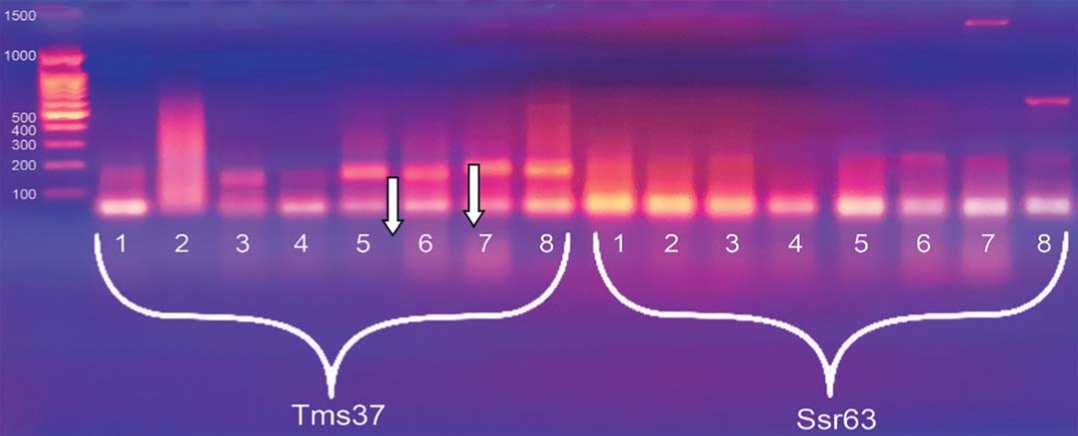
Рис.3.Визуализация продуктов ПЦР по локусам Tms37 и Ssr63 в 2%-ном агарозном геле.
Примечание:Mm - маркер молекулярной массы 100 bp+1,5 Kb (поставщик – комп.Синтол, Россия); 1-4 – неустойчивые формы к ВТМ;5-8– устойчивые линии
Fig.3.Visualization ofPCR productsby Tms37 and Ssr63 loci in a 2% agarose gel.
1-4 – unstable formsfor VTM;5-8– stable lines
та.Агарозный гель,в котором проводилась визуализация продуктов ПЦР, хоть и является удобным с технической точки зрения, но иногда может не показывать какие-либо минорные компоненты, выявляющие аллельную разницу между контрастными сортами, а при выборе маркерной системы они могут быть полезными в данном направлении, поэтому мы дополнительно провели визуализацию по данным маркерам и в 8%-ном полиакриламидном геле (рис. 5, 6, 7). Размеры ожидаемых целевых фрагментов для маркера Ssr63 – 208 и полученных – 210. Размеры ожидаемых целевых фрагментов для маркера Tms 37 – 191 и полученных – 195.
Рисунок 4 демонстрирует результаты амплификации между контрастными образцами по локусам
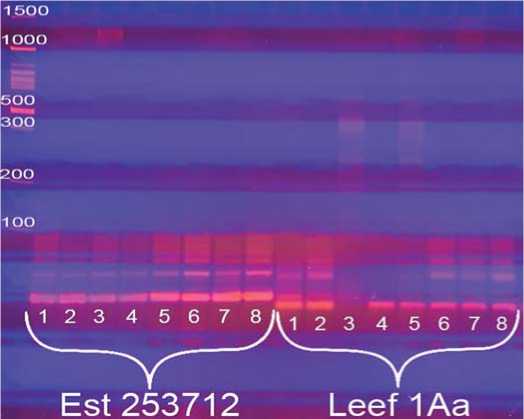
Рис.4.Визуализация продуктов
ПЦР по локусам Est253712 и Leef1Aaв 8%-ном ПААГ.
Примечание:Mm - маркер молекулярной массы
100 bp+1,5 Kb (поставщик – комп.Синтол, Россия);
1-4 – неустойчивые формы к ВТМ;5-8– устойчивые линии
Fig.4.Visualization ofPCR products by Est253712 and Leef1Aa lociin 8% PAAG.
1-4 – unstable formsfor VTM;5-8– stable lines
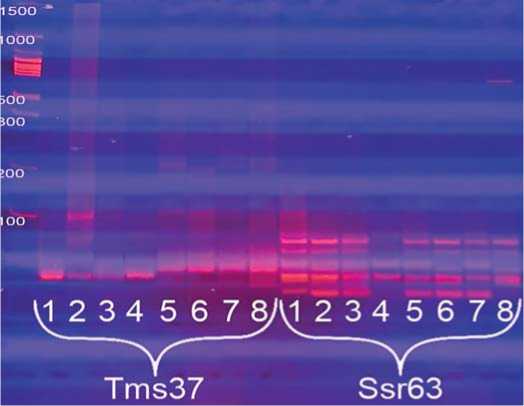
Рис.5. Визуализация продуктов
ПЦР по локусам Tms37 и Ssr63 в 8%-ном ПААГ.
Примечание:Mm - маркер молекулярной массы 100 bp+1,5 Kb (поставщик – комп.Синтол, Россия);1-4 – неустойчивые формы к ВТМ;5-8 – устойчивые линии
Fig.5.Visualization ofPCR products by Tms37 and Ssr63 lociin 8% PAAG.
1-4 – unstable forms for VTM;5-8 – stable lines
Est 253712 и Leef1Aa. Как видно, полиморфизм между анализируемыми образцами по локусу Est 253712 также не выявлен. По локусу Leef1Aa из анализируемых неустойчивых образцов идентичный ДНК-профиль имеют только №1 и 2; из устойчивых: № 6, 7, и 8. Таким образом, данные маркеры также не пригодны для визуализации донорных аллелей целевого гена.
На рисунке 5 показаны результаты визуализации продуктов ПЦР в полиакриламидном геле. На фореграмме видно, что полиморфизм между анализируемыми устойчивыми и неустойчивыми образцами по локусу Ssr63 также отсутствует. Отличие по группам (неусточивые/устойчивые) показали образцы № 4 и 8. По локусу Tms 37 четко выявлена аллельная разница между восприимчивыми и резистентными формами томата.
Создание и вовлечение линий с функциональной мужской стерильностью (генетически чистые гомозиготные материнские формы) с заданными параметрами устойчивости к болезням и адаптивностью к условиям выращивания в процесс гибридизации позволяет создавать высокопродуктивные гетерозисные гибриды,способные конкурировать с зарубежными и отечественными аналогами. С этой целью в задачу любого селекционера входит правильно и эффективно подобрать родительские пары. Для этого мы на основе метода ПЦР с использованием отобранного информативного молекулярного маркера UMD 2060 провели анализ ДНК всех материнских (24 образца) и отцовских (69 образцов) форм – претендентов для гибридизации, с целью выбрать те образца, которые по ДНК-профилю имели донорный аллель целевого гена Tm2a .
Некоторые результаты представлены на рисунках 6-10.
Из рисунка 6 видно, что образцы под № 4, 5, 9 и 16 имеют ДНК-профиль, как у устойчивых донорных образцов. Они были включены в гибридизацию в качестве материнских форм. Размеры ожидаемых целевых фрагментов – 159 и полученных – 280.
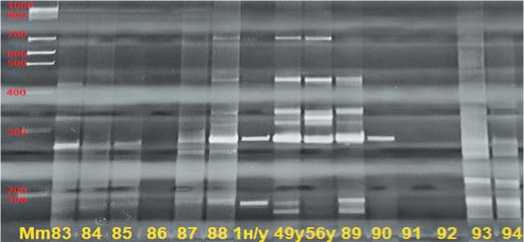
На рисунке 7 видно, что только образцы №83 и 88 имеет ДНК-профиль, как у донорных линий. Размеры ожидаемых целевых фрагментов – 159 и полученных – 280.
Размеры ожидаемых целевых фрагментов для маркера UMD 2060 – 159 и полученных – 160.
Размеры ожидаемых целевых фрагментов для маркера UMD 2060 – 159 и полученных – 160.
В гибридизацию в качестве отцовских форм из всех проанализированных образцов включены № 37, 65, 70, 82, 49, 56.
На рисунках 10, 11 представлены результаты гибридизации донорных и реципиентных форм томата в камерах искусственного климата.
В настоящее время полученный гибридный селекционный материал с генами-интереса выса-
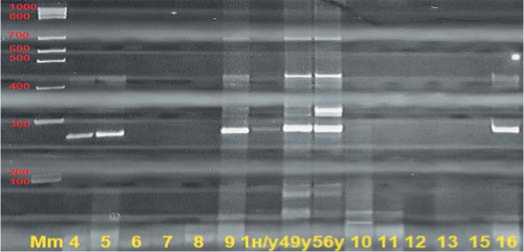
Рис.6.Электрофореграмма продуктов амплификации геномной ДНК по локусу UMD 2060 в 8%-ном ПААГ.
Примечание:Mm – маркер молекулярной массы 100 bp+1,5 Kb(поставщик – комп.Хеликон, Россия);4…16 – анализируемые материнские растения, 1 – неустойчивая форма;49 и 56 – донор устойчивости к ВТМ
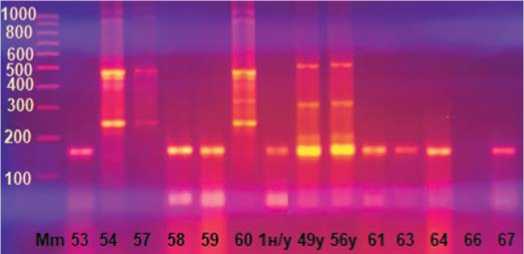
Рис.8.Электрофореграмма продуктов амплификации геномной ДНК по локусу UMD 2060 в 2%-ном агарозном геле.
Примечание:Mm – маркер молекулярной массы 100 bp+1,5 KbI(поставщик – комп.Хеликон, Россия);53…67 – анализируемые отцовские растения, 1 – неустойчивая форма;49 и 56 – донор устойчивости к ВТМ
Fig.8.Electrophoregram ofgenomic DNA amplification products atthe UMD 2060 locusin a 2% agarose gel.
Note:Mm isa molecular weightmarker 100 bp+1,5 Kb (supplier – comp.Helicon, Russia);53...67 – analyzed paternalplants, 1 – unstable form;49 and 56 – donor ofresistance to TMV
500 400
Рис.7.Электрофореграмма продуктов амплификации геномной ДНК по локусу UMD 2060 в 8%-ном ПААГ.
Примечание:Mm - маркер молекулярной массы 100 bp+1,5 Kb(поставщик – комп.Хеликон, Россия);83…94 – анализируемые материнские растения, 1 – неустойчивая форма; 49 и 56 – донор устойчивости к ВТМ
Рис.9.Электрофореграмма продуктов амплификации геномной ДНК по локусу UMD 2060 в 2%-ном агарозном геле
Примечание:Mm – маркер молекулярной массы 100 bp+1,5 Kb(поставщик – комп.Хеликон, Россия);68…3 – анализируемые отцовские растения, 1 – неустойчивая форма; 49 и 56 – донор устойчивости к ВТМ
Fig.9.Electrophoregram ofgenomic DNA amplification products atthe UMD 2060 locusin a 2% agarose gel
Note:Mm isa molecular weightmarker 100 bp+1,5 Kb (supplier – comp.Helicon, Russia);68...3 –analyzed paternalplants, 1-unsta-ble form;49 and 56 – donorsofresistance to VTM

а
б
Рис.10 (а,б).Гибридизация донорных и реципиентных форм томата
Fig.10 (a,b).Hybridization ofdonor and recipientformsoftomato

а
б
Рис.11 (а,б).Получение гибридного селекционного материала томата
Fig.11 (a,b).Obtaining ahybrid tomato breeding material
жен в открытый грунт на оценку по устойчивости к ВТМ, по результатам которой будут отобраны резистентные формы и вовлечены в последующие звенья селекционного процесса. Результаты проведённой фенотипической оценки будут сравниваться с результатами проведенных ПЦР-анали-зов.
Заключение
В результате научных исследований проведен скрининг имеющегося селекционного материала томата в отделе овощекартофелеводства и по результатам ДНК-анализа и по комплексу хозяйственно-ценных признаков выделены генотипы, устойчивые к Toba cco M osa ic Virus. Подобраны родительские формы для гибридизации. Выполнена апробация SSR-маркеров и оптимизированы условия ПЦР (экспериментальные параметры) для идентификации целевых генов Tm (устойчивости к вирусу табачной мозаики) в селекционном материале. Отобрано два информативных молекулярных маркера Tms 37 и U M D 2060, которые выявляют аллельную разницу между устойчивыми и восприимчивыми образца-ми.Проведена гибридизация ФМС-линий томата с образцами, обладающими устойчивостью к генам-интереса для получения ФМС-линий с генами резистентности к ВТМ. Получены семена отцовских форм – доноров целевых генов для дальнейшего их использования в селекционной работе.
Об авторах:
Aboutthe authors:
Olesya L.Gorun – Junior Researcher of the Laboratory of Information,
Irina V.Kozlova – Researcher of the Department of vegetable and potato growing
Ivan V.Balyasny – Deputy Director
Sergey V.Garkusha – Doc. Sci. (Agriculture),
Professor, Acting Director
Список литературы ДНК-технологии (молекулярное маркирование) в селекции томата на устойчивость к Tobacco mosaic virus
- Гавриш С.Ф., Будылин М.В. Использование молекулярных маркеров при создании гибридов томата, устойчивых к грибным заболеваниям. Гавриш. 2016;(6):24-33.
- Arens P. et al. Development and evaluation of robust molecular markers linked to disease resistance in tomato for distinctness, uniformity and stability testing. Theoretical and applied genetics. 2010;120(3):655-664. DOI:10.1007/s00122-009-1183-2
- Barone A., Frusciante L. Molecular marker-assisted selection for resistance to pathogens in tomato. Marker-assisted selection: Current status and future perspectives in crops, livestock, forestry and fish. Food & Agriculture Org. Ed. Elcio P. Guimarães. 2007;(9):151-164.
- Foolad M.R., Sharma A. Molecular markers as selection tools in tomato breeding. ISHS Acta Horticulturae. 2005;(695):225-240.
- Будылин М.В. Обыкновенное чудо. Молекулярные маркеры в современной селекции. Гавриш дайджест. Технологии. 2015. С.149-151.
- Foolad M.R. Genome mapping and molecular breeding of tomato. International Journal of Plant Genomics. 2007(2):64358. DOI:10.1155/2007/64358
- Panthee G.R., Brown A.F., Yousef G.G., Ibrahe R., Anderson C. Novel molecular marker associated with Tm2a gene conferring resistance to tomato mosaic virus in tomato. Plant Breeding. 2013;(132):413-416.
- Shi A. et al. Molecular markers for Tm-2 alleles of Tomato mosaic virus resistance in tomato. American Journal of Plant Sciences. 2011;2(02):180.
- Нгуен Т.Л. Комбинационная способность стерильных индетерминантных и фертильных детерминантных линий томата с групповой устойчивостью к заболеваниям. 2015.
- Мюррей М.Г. Быстрое выделение высокомолекулярной ДНК растений. Геномт. 1980;(40):379-378.
- Буц А.В., Цаценко Л.В. Использования гибридизационных зондов Realtime PCR, на примере маркёра гена устойчивости к ВТМ культуры томата. Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. 2020;(158):168-180.
- Аджиева В.Ф. Сравнительный анализ полиморфизма микросателлитных маркеров генотипов томата (Solanum lycopersicum L.) белорусской и зарубежной селекции. Молекулярная и прикладная генетика. 2010;(11):7-11.
- Заморзаева И., Барбакарь Н. SSR маркеры, созданные на основе кодирующих нуклеотидных последовательностей томата. Селекция и семеноводство овощных культур. 2014;(45.):287-293.
- Smulders M.J.M. et al. Use of short microsatellites from database sequences to generate polymorphisms among Lycopersicon esculentum cultivars and accessions of other Lycopersicon species. Theor. Appl. Genet. 1997;(94):264–272.
- Aishwarya V., Sharma P.C. UgMicroSatdb: database for mining microsatellites from unigenes. Nucl. Acids Research, 2008;(36). Database issue: D53–D56.


