Добавки на основе амаранта багряного (Amaranthus cruentus L.) для усиления метаногенеза при биоконверсии органических отходов
Автор: Минзанова С.Т., Миронов В.Ф., Белостоцкий Д.Е., Миндубаев А.З., Миронова Л.Г., Гинс М.С., Гинс В.К., Кононков П.Ф., Милюков В.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Биоинженерия, биотехнологии
Статья в выпуске: 1 т.53, 2018 года.
Бесплатный доступ
Метановое брожение, или биометаногенез - образование смеси, состоящей приблизительно из 65 % СH4, 30 % CO2, 1 % Н2S и незначительных количеств N2, O2, H2 и CO, осуществляется в анаэробных условиях многокомпонентным микробным консорциумом. Его особенность заключается в способности конвертировать в биогаз практически все классы органических соединений, бытовые, сельскохозяйственные и некоторые промышленные отходы. Нами впервые проведена оценка влияния добавок на основе амаранта багряного ( Amaranthus cruentus L.) на эффективность процесса получения биогаза из органических отходов. Установлено, что оптимизация субстрата по органическому веществу с использованием фитомассы или жома амаранта, полученного после извлечения всех практически ценных веществ, позволяет производить биогаз из осадков сточных вод, решая экологическую проблему обеззараживания и утилизации отходов, а также энергетическую задачу получения дешевого возобновляемого источника топлива. Амарант багряный - высокоурожайная культура, для которой характерно высокое содержание белка. Его биомасса служит промышленно воспроизводимым растительным сырьем. В результате цикла исследований по разработке оригинальных способов получения рутина, растительного белка, пектина на основе A. cruentus нами предложена схема комплексной переработки, включающей экстрактивное извлечение указанных веществ из высушенной фитомассы растения в едином технологическом цикле. Жом амаранта после извлечения всех ценных соединений был предложен в качестве косубстрата для анаэробного сбраживания органических отходов. Влияние добавок амаранта на получение биогаза моделировали в лабораторных условиях, используя в качестве субстрата крупнотоннажный осадок сточных вод (ОСВ) с городских очистных сооружений. Выявлена зависимость эффекта от количества добавки (избыток фитомассы амаранта 74 % и 87 % подавлял метаногенез). Изучение сбраживания ОСВ после фильтр-пресса (влажность 45 %) в мезофильном (37 °С) и термофильном (50 °С) режимах с добавлением жома амаранта показало преимущество термофильного режима (удельный выход биогаза составил 354 мл/г сухого вещества). Кроме того, в присутствии амарантового жома продуктивность биометаногенеза в мезофильном режиме тоже повышалась на 87,0 %, при этом практически отсутствовала лаг-фаза, содержание CH4 в течение всего эксперимента составляло около 60 %, а удельный выход биогаза достигал 251,9 мл/г сухого вещества, или ~ 0,25 м3 биогаза из 1 кг сухого вещества органического сырья. С целью поиска активной фракции фитомассы амаранта провели серию экспериментов с экстрактами амаранта при использовании растворителей различной полярности - дихлорметана, 70 % водного этанола и дистиллированной воды. Установлено, что в случае экстрактов CH2Cl2 и EtOH лаг-фаза сокращалась до 10 сут, что сопоставимо с действием фитомассы амаранта. Очевидно, в этих экстрактах содержатся компоненты, которые либо подвергаются быстрой деструкции под влиянием сообщества микроорганизмов, превращаясь в биогаз, либо способствуют росту бактерий. При добавлении дихлорметанового экстракта к субстрату происходило наиболее эффективное выделение биогаза, что согласуется с данными литературы. Полученные результаты указывают на экологическую и экономическую целесообразность использования жома амаранта при утилизации органических отходов.
Амарант, метаногенез, косубстрат, экстракт фитомассы амаранта, биогаз, осадок сточных вод, жом амаранта
Короткий адрес: https://sciup.org/142214120
IDR: 142214120 | DOI: 10.15389/agrobiology.2018.1.209rus
Текст научной статьи Добавки на основе амаранта багряного (Amaranthus cruentus L.) для усиления метаногенеза при биоконверсии органических отходов
Метановое брожение, или биометаногенез, — известный процесс превращения биомассы в энергию (1). Образование биогаза (смесь, состоящая приблизительно из 65 % СH4, 30 % CO2, 1 % Н2S и незначительных количеств N2, O2, H2, CO) осуществляется в анаэробных условиях многокомпонентным микробным консорциумом, особенность которого заключается в способности конвертировать в биогаз практически все классы органических соединений, бытовые, сельскохозяйственные и некоторые
Работа выполнена при финансовой поддержке программы ¹ 3 Президиума РАН и гранта РФФИ ¹ 1408-31768.
промышленные отходы (2). Метаногенез осуществляют крайне специализированные прокариоты — очень древние архебактерии, или археи, родов Methanobacterium , Methanosaeta ( Methanothrix ), Methanococcus , Methanosarcina , Methanocorpusculum , Methanobrevibacteria и Methanopyrus (3-6).
Анализ состояния работ по получению биогаза (7-10) показывает, что задача интенсификации метанового сбраживания органического сырья сохраняет актуальность. Одно из перспективных направлений — поиск растительных стимуляторов и ингибиторов метаногенеза. Так, было выполнено сравнение состава летучих жирных кислот (ЛЖК) и выхода биогаза под влиянием 13 растительных экстрактов, выбранных по наивысшей флавоноидной активности (11) (сбраживали смесь экстракта из травяной фитомассы и ячменного зерна в соотношении 50:50). Эксперименты показали, что экстракты из Lavandula officinalis и Solidago virgaurea стимулируют брожения, а из Equisetum arvense и Salvia officinalis — ингибируют выработку метана. Вызывает интерес работа, посвященная изучению действия экстрактов травянистых растений (21 вид) на метаногенез, на грамполо-жительные и грамотрицательные бактерии, их антимикробный потенциал, а также деструкцию сухого вещества in vitro (12). Экстракты получали с помощью метанола, ацетона или воды и определяли содержание в них общих сахаров, танинов и сапонинов. Антимикробный потенциал оценивали на грамположительных стрептококках и стафилококках и грамотрицатель-ных бактериях Esherichia coli и Enterobacter . Ацетоновый и метанольный экстракты из Eucalyptus globulus и водный экстракт из Sapindus mukorossi и E . globulus ингибировали метаногенез in vitro. При изучении влияния богатых сапонинами экстрактов из листьев Carduus, Sesbania и Knautia , а также из семян пажитника сенного ( Trigonella foenum-graecum ) на брожение в рубце, выделение метана и микробное сообщество (13) показано, что сапонины, обладая антипротозойной активностью, не угнетают метаногенез. Сапонины семян пажитника повышают активность содержимого рубца и влияют на микробное сообщество, усиливая рост бактерий, расщепляющих волокна, и подавляя рост популяции грибов.
Для повышения производительности метантенков также широко практикуется добавление в осадок очистных сооружений различной растительной биомассы (14). Добавление косубстратов, например навоза, позволяет обогатить бедный по углероду субстрат органическим веществом. Более 50 % получаемого биогаза в Европе основано на использовании растений (15, 16). Поиск косубстратов для эффективной биоконверсии органических отходов сельского хозяйства и городских стоков в биогаз с высоким содержанием метана остается актуальной задачей.
Нами впервые в качестве косубстратов изучены фитомасса и жом культурного амаранта, полученный после извлечения всех практически ценных веществ, и определено его оптимальное соотношение с субстратом (осадок городских сточных вод), усиливающее образование биогаза и метановое брожение.
Целью работы была оценка влияния добавок на основе амаранта багряного на эффективность конверсии осадочного ила очистных сооружений и органических отходов в биогаз с высоким содержанием метана.
Методика. В качестве субстрата использовали осадок сточных вод (ОСВ, влажность 80,4 %; уплотненный ОСВ, влажность 98,4 %; ОСВ после фильтр-пресса, влажность 45,0 %) г. Казани, косубстрата — фитомассу, жом, образующийся после комплексной переработки (выделения пектинов, рутина и растительного белка), и экстракты (спиртовой, дихлорметановый и водный) жома амаранта ( Amaranthus cruentus L.) сорта Дюймовочка. В суб-210
страте и косубстрате определяли элементный состав (С, Н, N и S) на анализаторе CHN-3 (ОКБА НПО «Химавтоматика», Россия); стандартом служил стрептоцид (С — 41,85 %, Н — 4,65 %, N — 16,26 %, S — 18,58 %).
В экспериментах варьировали вид субстрата, вид косубстрата, соотношение субстрата и косубстрата, температуру инкубации. Ферментацию проводили в лабораторных реакторах, состоящих из водяной бани LB-160 и погружного термостата-циркулятора LT-100 (бутыли из стекла МТО БКЗ-50, V = 500 мл) («LOIP», Россия).
При сравнении метанообразования в зависимости от доли косуб-страта в смеси с ОСВ (24, 52, 74 и 87 % по абсолютно-сухой массе, рассчитанной с учетом влажности ОСВ и косубстрата) использовали высушенную фитомассу амаранта; ко всем образцам добавляли 100,5 г уплотненного ОСВ, ферментацию проводили при 37 °С. Воздействие мезофильного (37 °С) и термофильного (50 °С) режимов инкубации исследовали при сбраживании ОСВ после фильтр-пресса (количество субстрата — 50,0 г с добавлением 100 мл дистиллированной воды). В том же опыте изучили влияние амарантового жома как косубстрата на эффективность мезофильной (37 °С) ферментации (количество субстрата — 22,5 г, жома с влажностью 9,2 % — 16,7 г; 100 мл дистиллированной воды). При определении эффекта экстрактов жома к субстрату (смесь 37,5 г ОСВ и 105,0 г уплотненного ОСВ) добавляли 0,2 г дихлорметанового (CH2Cl2), 0,2 г спиртового (EtOH) или 2,3 г водного экстракта амаранта (экстракты были получены упариванием досуха в ротационном испарителе ИР-1ЛТ, Россия); для сравнения экстракты заменяли жомом амаранта (5,0 г) (инкубация при 37 °С).
Объем выделяемого биогаза определяли ежесуточно волюмометриче-ски (17). Содержание метана в пробах контролировали методом газожидкостной хроматографии (ГЖХ) (CHROM-5, «Laboratorn i p fi stroje», Чехия, колонка 2,4 м с наполнителем Porapak Q, 80-100 меш, «Sigma-Aldrich Co.», США; 80 °С; детектор по теплопроводности, газ-носитель гелий).
Изменение состава микроорганизмов в процессе сбраживания ОСВ выявляли при культивировании на средах для метаногенов (18) и окрашивании по Граму с микрокопированием (МБИ-15, АО «ЛОМО», Россия).
Данные обрабатывали в программе Origin 6.1 . В таблицах и на рисунках приведены средние (M) и стандартные ошибки средних (±SEM). Достоверность различий оценивали по t-критерию Стьюдента. Различия считали статистически значимыми при р = 0,05.
Результаты. Выбор амаранта Amaranthus cruentus обусловлен тем, что у этой культуры, имеющей высокую урожайность, биомасса с высоким содержанием белка (19-21) служит промышленно воспроизводимым растительным сырьем. Нами в цикле исследований разработаны оригинальные способы и схема получения рутина, растительного белка и пектина при комплексной переработке амаранта (20) на основе экстрактивного извлечения из высушенной фитомассы в едином технологическом цикле.
1. Элементный состав осадка сточных вод (ОСВ), фитомассы и жома амаранта ( Amaranthus cruentus L.) сорта Дюймовочка, использованных при лабораторном моделировании производства биогаза
|
Субстрат, косубстрат |
C, % |
H, % |
N, % |
С/N |
|
Уплотненный ОСВ |
34,65 |
6,20 |
7,15 |
4,9 |
|
ОСВ |
39,82 |
7,05 |
5,81 |
6,9 |
|
Фитомасса амаранта |
36,98 |
4,67 |
3,47 |
10,7 |
|
Жом амаранта |
42,11 |
6,42 |
5,20 |
8,1 |
Характеристика использованных в эксперименте субстратов и ко- субстратов приведена в таблицах 1 и 2. Процесс метаногенеза моделировали в лабораторных условиях, используя биореактор (рис. 1).
-
2. Характеристика субстратов с разным содержанием высушенной фитомассы амаранта ( Amaranthus cruentus L.) сорта Дюймовочка, использованных при лабораторном моделировании производства биогаза ( n = 3, M ±SEM)
Доля амаранта, %
Сухое вещество, г
Органическое сухое вещество, г
Влажность, %
24
11,2±0,34
7,3±0,22
92,1±2,76
52
15,9±0,48
11,3±0,34
89,0±2,67
74
18,1±0,54
13,7±0,41
86,7±2,60
87
21,5±0,65
16,9±0,51
83,2±2,50

Рис. 1. Лабораторная установка для получения биогаза (V = 500 мл, «LOIP», Россия).
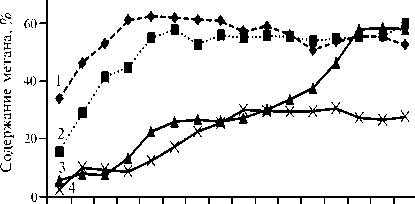
Кинетика выделения CH4 при добавлении 24, 52, 74 и 87 % сухой фитомассы амаранта в качестве косубстра-та (рис. 2) свидетельствовала о наибольшем повышении выхода биогаза в варианте с 24 % (291,1 мл/г сухого вещества, достоверно при р = 0,05). Эффект сохранялся в течение 50 сут (табл. 3), содержание CH4 в биогазе составляло при этом около 60 % (см. рис. 2). Более объективным критерием эффективности процесса служит удельный выход биогаза при пересчете на содержание органического сухого вещества в субстрате, ко- торый также оказался высоким (см. табл. 3).
7 15 22 28 41 50 57 63 78 84 104 111 117 124 132 138
Продолжительность процесса, сут
Рис. 2. Кинетика выделения CH 4 при биоконверсии осадка городских сточных вод в зависимости от содержания сухой фитомассы амаранта ( Amaranthus cruentus L.) сорта Дюймовочка в субстрате: 1 — 24 %, 2 — 52 %, 3 — 74 %, 4 — 87 % (среднее для 3 повторностей, лабораторный опыт).
Добавление 52 % амаранта приводило к выходу биогаза 226,6 мл/г сухого вещества (достоверно при р = 0,05). Выделение биогаза происходило в тече- ние 138 сут, а содержание метана при этом составляло примерно 55 % (см. рис. 2).
-
3. Продукция биогаза при биоконверсии осадка городских сточных вод в зависимости от содержания сухой фитомассы амаранта ( Amaranthus cruentus L.) сорта Дюймовочка в субстрате ( n = 3, M ±SEM, достоверно при уровне значимости 5 %, лабораторный опыт)
|
Доля амаранта, % |
Удельный выход |
||
|
мл газа/мл субстрата |
мл газа/г сухого вещества |
мл газа/г органического сухого вещества |
|
|
24 |
23,0±1,15а |
291,1±14,60 |
445,1±22,26 |
|
52 |
24,9±1,25а |
226,6±11,33 |
318,5±15,93 |
|
74 |
17,0±0,85 |
127,8±6,39 |
168,4±8,42 |
|
87 |
4,7±0,24 |
29,1±1,46 |
36,9±1,85 |
П рим еч а ни е. Между вариантами, помеченными буквой (а), отсутствуют статистически значимые различия при р = 0,05.
При содержании фитомассы амаранта 74 % процесс имел длительную лаг-фазу — активация газообразования происходила только после
110-х сут. Избыток амаранта угнетал метаногенез: удельный выход биогаза составлял 127,8 мл/г сухого вещества (см. табл. 3). При 87 % амаранта содержание метана в биогазе не превышало 30 % (см. рис. 2) при выходе биогаза 29,1 мл/г сухого вещества (достоверно при p = 0,05, см. табл. 3). Соотнесение этих результатов с данными, представленными в таблице 2, показывает, что оптимальная влажность субстрата для метаногенеза — не менее 90 %, и с ее уменьшением газообразование снижалось. Следовательно, добавление фитомассы амаранта к субстрату было эффективно только при определенном количественном соотношении с ОСВ, тогда как при избытке фитомассы амаранта метаногенез подавлялся.
Динамику изменения рН ОСВ при добавлении фитомассы амаранта (52 %) иллюстрирует рисунок 3.
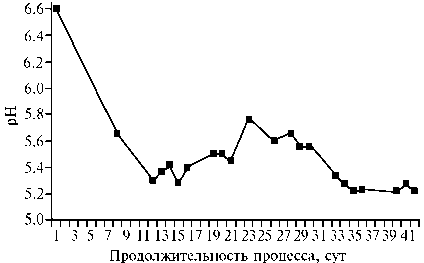
Рис. 3. Повышение кислотности среды при анаэробном сбраживании осадка городских сточных вод с добавлением 52 % сухой фитомассы амаранта ( Amaranthus cruentus L.) сорта Дюймовочка (среднее для 3 повторностей, лабораторный опыт).
При использовании в качестве косубстрата жома амаранта, образующегося после комплексной переработки и извлечения пектинов, рутина и растительного белка (22, 23), лаг-фаза в мезофильном режиме занимала 30 сут. При достижении максимального суточного выхода биогаза (около 120 мл на 40-е сут) в нем отмечали высокое (60 %) содержание CH4 (рис. 4). Удельная продуктивность в эксперименте составила 134,7 мл/г сухого вещества (достоверно при р = 0,05, табл. 4). В термофильном режиме объем выделяемого биогаза значительно увеличивался: более 20 сут его выход превышал 200 мл. Кроме того, лаг-фаза процесса сокращалась до 14 сут при содержании CH4 в биогазе более 50 % (см. рис. 4).
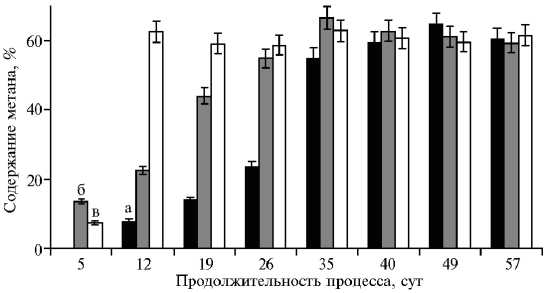
Рис. 4. Содержание CH 4 в биогазе при разных температурных режимах анаэробного сбраживания осадка городских сточных вод (ОСВ) в присутствии жома амаранта ( Amaranthus cruentus L.) сорта Дюймовочка: а — ОСВ, мезофильный режим (37 ° С), б — ОСВ, термофильный режим (50 ° С), в — ОСВ, жом, мезофильный режим ( n = 3, р = 0,05, лабораторный опыт).
Удельный выход биогаза составлял 354,0 мл/г сухого вещества (достоверно при р = 0,05), что указывает на преимущество термофильного режима сбраживания ОСВ без добавления амаранта. При добавлении амарантового жома в субстрат выход биогаза в мезофильном режиме повышался (лаг-фаза практически отсутствовала, на 12-е сут количество биогаза достигало 80 мл при содержании CH4 62 %) (см. рис. 4). Только после 60-х сут выход газа уменьшался до 20 мл при содержании CH4 около 60 % до завершения эксперимента. Удельный выход биогаза при добавлении амарантового жома в мезофильном режиме соответствовал ~ 0,25 м3 на 1 кг сухого вещества органического сырья.
-
4. Продукция биогаза при биоконверсии осадка городских сточных вод (ОСВ) в зависимости от температурного режима и содержания жома амаранта ( Am-aranthus cruentus L.) сорта Дюймовочка в субстрате ( n = 3, M ±SEM, достоверно при уровне значимости 5 %, лабораторный опыт)
|
Состав среды |
Режим |
Удельный выход |
|
(мл газа/мл субстрата) (мл газа/г сухого вещества) |
ОСВ Мезофильный, 37 ° С 20,5±1,03а 134,7±6,74
ОСВ + жом амаранта Мезофильный, 37 ° С 22,7±1,14а 251,9±12,60
ОСВ Термофильный, 50 ° С 53,1±2,66 354,0±17,70
П рим еч а ни е. Между вариантами, помеченными буквой (а), отсутствуют статистически значимые различия при р = 0,05.
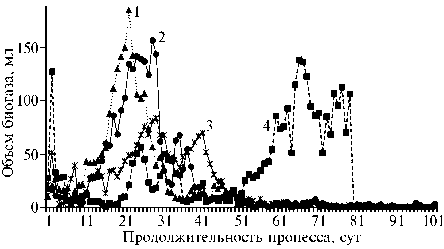
Рис. 5. Кинетика выделения биогаза при биоконверсии осадка городских сточных вод с добавлением спиртового (1) , дихлорметанового (2) и водного (3) экстрактов и жома амаранта ( Amaranthus cruentus L.) сорта Дюймовочка (4) (среднее для 3 повторностей, лабораторный опыт).
Дихлорметановый экстракт фитомассы амаранта (22) имеет зеленый цвет благодаря присутствию хлорофилла, водный экстракт содержит углеводы, белки, минеральные соли и амарантин, а этанольный богат фенольными соединениями — рутином и кверцетином. Жом после трех экстракций содержал клетчатку, белок, углеводы и пектины (22). Наблюдаемая кинетика газообразования при мезофильном сбраживании смеси ОСВ и уплотненного ОСВ (рис. 5) подтвердила, что при добавлении экстрактов CH2Cl2 и EtOH к субстрату лаг-фаза сокращалась до 10 сут. Это сопоставимо с действием фитомассы амаранта. Оче- видно, в дихлорметановом и этанольном экстрактах содержатся компоненты, которые либо подвергаются быстрой деструкции под влиянием сообщества микроорганизмов, превращаясь в биогаз, либо способствуют росту биомассы. При добавлении CH2Cl2-экстракта к субстрату наблюдалось наиболее эффективное выделение биогаза, что согласуется с данными литературы (11, 24-27) (табл. 5).
-
5. Продукция биогаза при биоконверсии осадка городских сточных вод с добавлением разных экстрактов и жома амаранта ( Amaranthus cruentus L.) сорта Дюймовочка ( n = 3, M ±SEM, достоверно при уровне значимости 5 %, лабораторный опыт)
|
Косубстрат |
Удельный выход |
||
|
мл газа/мл субстрата |
мл газа/г сухого вещества |
мл газа/г органического сухого вещества |
|
|
Экстракт CH2Cl2 |
16,2±0,81а |
266,1±13,31b |
433,5±21,68 |
|
Экстракт EtOH |
14,5±0,73а |
236,1±11,81c, d |
382,5±19,13e |
|
Водный экстракт |
16,6±0,83а |
221,8±11,09c |
345,8±17,29e |
|
Жом амаранта |
23,7±1,19 |
259,1±12,96b, d |
355,4±17,77e |
П рим еч а ни е. Между вариантами, помеченными одинаковыми буквами, отсутствуют статистически значимые различия при р = 0,05.
При добавлении жома удельный выход биогаза составил 259,1 мл/г сухого вещества (достоверно при р = 0,05), что сопоставимо с аналогичным показателем (266,1 мл/г сухого вещества) для экстракта, полученного с использованием CH2Cl2, при содержании CH4 на 98-е сут 82,5 % (мак214
симальное значение за весь период исследований. Отметим, что жом амаранта после трех экстракций (см. табл. 5), как и фитомасса амаранта (см. табл. 3), служит активирующим косубстратом метаногенеза (Патент РФ ¹ 2351552). Таким образом, в присутствии амарантового жома продуктивность биометаногенеза в мезофильном режиме тоже возрастала (на 12,8 %, достоверно при р = 0,05), что в целом повышает эффективность комплексной переработки сырья, получаемого при выращивании этой культуры. Представленные результаты указывают на экологическую и экономическую целесообразность использования жома амаранта.
Микробиологическое изучение образцов при анаэробном сбраживании ОСВ показало, что для исходного субстрата характерно присутствие крупных эукариотических форм. В период максимальной активности газообразования (40-е сут) в среде преобладали грамположительные мелкие палочковидные бактерии — как одиночные, так и собранные в длинные цепочки. Очень мелкие одиночные формы были более типичны для питательной среды на основе ацетата. На МПА (18) наблюдали образование гладких и шероховатых колоний. На среде для метаногенов выросло значительное количество очень мелких колоний. Встречались как грамположительные, так и грамотрицательные формы.
Итак, наши исследования показали, что оптимизация субстрата по органическому веществу с использованием фитомассы или жома амаранта позволяет производить биогаз из осадков сточных вод с более высокой эффективностью, решая задачу утилизации отходов и получения топлива из дешевого возобновляемого источника .
Список литературы Добавки на основе амаранта багряного (Amaranthus cruentus L.) для усиления метаногенеза при биоконверсии органических отходов
- Варфоломеев С.Д., Ефременко Е.Н., Крылова Л.П. Биотоплива. Успехи химии, 2010, 79(6): 544-564.
- Варфоломеев С.Д., Моисеев И.И., Мясоедов Б.Ф. Энергоносители из возобновляемого сырья. Вестник Российской академии наук, 2009, 79(7): 595-604.
- Gerardi M.H. The microbiology of anaerobic digesters. John Wiley & Sons, Inc., Hoboken, New Jersey, 2003.
- Schiraldi C., Giuliano M., de Rosa M. Perspectives on biotechnological applications of Archaea. Archaea, 2002, 1(2): 75-86 ( ) DOI: 10.1155/2002/436561
- Vogt C., Kleinsteuber S. Richnow H.-H. Anaerobic benzene degradation by bacteria. Microbial Biotechnol., 2011, 4(6): 710-724 ( ) DOI: 10.1111/j.1751-7915.2011.00260.x
- Fowler S.J., Dong X., Sensen C.W., Suflita J.M., Gieg L.M. Methanogenic toluene metabolism: community structure and intermediates. Environ. Microbiol., 2012, 14(3): 754-764 ( ) DOI: 10.1111/j.1462-2920.2011.02631.x
- Ahring B.K., Ellegaard L., Angelidaki I., Schmidt J.E., Gavala H.N., Skiadas I.V., Ahring B.K., Haagensen F., Dolfing J., Mogensen A.S., Lyberatos G., Stamatelatou K., Pind P.F. Biomethanation II/B.K. Ahring (ed.). Springer, Berlin, 2003 ( ) DOI: 10.1007/3-540-45838-7
- Deublein D., Steinhauser A. Biogas from waste and renewable resources. Wiley-VCH Verlag GmbH & Co. KGaAiley, Weinheim, Germany, 2008 ( ) DOI: 10.1002/9783527632794
- Samer M. Biogas plant constructions. In: Biogas/S. Kumar (ed.). InTech, Rijeka, Croatia, 2012: 343-368.
- Pisarikova B., Peterka J., Trackova M., Moudry J., Zraly Z., Herzig I. Chemical composition of the above-ground biomass of Amaranthus cruentus and A. hypochondriacus. Acta Vet. BRNO, 2006, 75(1): 133-138.
- Broudiscou L.P. Papon G., Broudiscou A.F. Effects of dry plant extracts on fermentation and methanogenesis in continuous culture of rumen microbes. Anim. Feed Sci. Technol., 2000, 87(3-4): 263-277 ( ) DOI: 10.1016/S0377-8401(00)00193-0
- Sirohi S.K., Pandey N., Goel N., Singh B., Mohini M., Pandey P., Chaudhry P.P. Microbial activity and ruminal methanogenesis as affected by plant secondary metabolites in different plant extracts. International Journal of Environmental Science and Engineering, 2009, 1(1): 52-58.
- Goel G., Makkar H.P.S., Becker K. Changes in microbial community structure, methanogenesis and rumen fermentation in response to saponin-rich fractions from different plant materials. J. Appl. Microbiol., 2008, 105(3): 770-777 ( ) DOI: 10.1111/j.1365-2672.2008.03818.x
- Mursec B., Vindis P., Janzekovic M., Brus M., Cus F. Analysis of different substrates for processing into biogas. Journal of Achievements in Materials and Manufacturing Engineering, 2009, 37(2): 652-659.
- Karpenstein-Machan M. Energiepflanzenbau für Biogasanlagenbetreiber. DLG-Verlag, Frankfurt am Main, 2005.
- Ferry J.G., Kastead K.A. Methanogenesis. In: Archaea: molecular and cellular biology/R. Cavicchioli (ed.). ASM Press, Washington, 2007, Ch. 13: 288-314.
- Губен-Вейль Н.Н. Методы органической химии. М., 1963.
- Нетрусов А.И., Котова И.Б. Микробиология. М., 2006.
- Минзанова С.Т., Миронов В.Ф., Коновалов А.И., Выштакалюк А.Б., Цепаева О.В., Миндубаев А.З., Миронова Л.Г., Зобов В.В. Пектины из нетрадиционных источников: технология, структура, свойства и биологическая активность. Казань, 2011.
- Гинс В.К., Кононков П.Ф., Пивоваров В.Ф., Гинс М.С. Создание сортов и гибридов овощных культур с повышенным содержанием биологически активных веществ и антиоксидантов. Сельскохозяйственная биология, 2003, 1: 108-113.
- Высочина Г.И. Амарант (Amaranthus L.): химический состав и перспективы использования. Химия растительного сырья, 2013, 2: 5-14.
- Минзанова С.Т., Миронов В.Ф., Выштакалюк А.Б., Цепаева О.В., Миронова Л.Г., Коновалов А.И. Пектиновые полисахариды из растения Amaranthus cruentus. Водорастворимые комплексы амарантового пектина с макро-и микроэлементами. Известия АН. Сер. хим., 2014, 9: 2142-2155.
- Миндубаев А.З., Минзанова С.Т., Скворцов Е.В., Миронов В.Ф., Зобов В.В., Ахмадуллина Ф.Ю., Миронова Л.Г., Белостоцкий Д.Е., Коновалов А.И. Cтимулирующее влияние сухой фитомассы амаранта Amaranthus cruentus на биометаногенез в трудноферментируемых субстратах. Вестник Казанского технологического университета, 2009, 4: 220-226.
- Oh S., Shintani R., Koike S., Kobayashi Y. Ginkgo fruit extract as an additive to modify rumen microbiota and fermentation and to mitigate methane production. J. Dairy Sci., 2017, 100(3): 1923-1934 ( ) DOI: 10.3168/jds.2016-11928
- Perna F.F. Jr., Cassiano E.C.O., Martins M.F., Romero L.A., Zapata D.C.V., Pinedo L.A., Marino C.T., Rodrigues P.H.M. Effect of tannins-rich extract from Acacia mearnsii or monensin as feed additives on ruminal fermentation efficiency in cattle. Livest. Sci., 2017, 203: 21-29 ( ) DOI: 10.1016/j.livsci.2017.06.009
- Medjekal S., Bodas R., Bousseboua H., López S. Evaluation of three medicinal plants for methane production potential, fiber digestion and rumen fermentation in vitro. Energy Procedia, 2017, 119: 632-641 ( ) DOI: 10.1016/j.egypro.2017.07.089
- Bodas R., Prieto N., García-González R., Andrés S., Lуpez S. Manipulation of rumen fermentation and methane production with plant secondary metabolites. Anim. Feed Sci. Tech., 2012, 176(1-4): 78-93 ( ) DOI: 10.1016/j.anifeedsci.2012.07.010


