Доказательство строения новых 4-нитрозопиразолов методами хромато-масс спектрометрии, ЯМР 13С и ИК спектроскопии
Автор: Бобров П.С., Андреева А.В., Неупокоева Е.В.
Журнал: Форум молодых ученых @forum-nauka
Статья в выпуске: 1-1 (29), 2019 года.
Бесплатный доступ
В данной работе проведено доказательство строения продуктов циклоароматизации 1-(1-нафтил)-бутан-1,2,3-трион-2-оксима с метил- и этилгидразином методами хромато-масс спектрометрии, ЯМР 13С и ИК спектроскопии.
4-нитрозопиразол, нафтилпиразол, циклоароматизация, n-алкилпиразол, ямр 13с спектроскопия, ик спектроскопия, хромато-масс спектрометрия
Короткий адрес: https://sciup.org/140284507
IDR: 140284507 | УДК: 547.773
Текст научной статьи Доказательство строения новых 4-нитрозопиразолов методами хромато-масс спектрометрии, ЯМР 13С и ИК спектроскопии
Ключевые слова: 4-нитрозопиразол, нафтилпиразол, циклоароматизация, N-алкилпиразол, ЯМР 13С спектроскопия, ИК спектроскопия, хромато-масс спектрометрия
P.S. Bobrov Master student
2nd year of study, Faculty of Chemical Technology Reshetnev Siberian State University of Science and Technology Russian Federation, Krasnoyarsk A.V. Andreeva Master student
1st year of study, Faculty of Chemical Technology Reshetnev Siberian State University of Science and Technology Russian Federation, Krasnoyarsk E.V. Neupokoeva Master student
1st year of study, Faculty of Chemical Technology Reshetnev Siberian State University of Science and Technology Russian Federation, Krasnoyarsk
PROOF OF THE STRUCTURE OF NEW 4-NITROZOPIRAZOLES BY
CHROMATO-MASS SPECTROMETRY, 13C NMR AND IR SPECTROSCOPY
Annotation: In this paper a proof of the structure of cycloaromatisation products of 1- (1-naphthyl) -butane-1,2,3-trion-2-oxime with methyl- and ethyl hydrazine using chromato-mass spectrometry, 13C NMR and IR spectroscopy.
Производные пиразола находят применение в различных отраслях промышленности и сельского хозяйства [1-4]. Проявляя высокую и разнообразную биологическую активность, этот класс гетероциклических соединений уже более 100 лет привлекает интерес химиков-синтетиков.
Реакция 1,3-дикарбонильных соединений с производными гидразина является наиболее удобным подходом для синтеза пиразолов [5].
Ранее нами осуществлена циклоконденсация 1-(1-нафтил)-бутан-1,2,3-трион-2-оксима (III) с метил- и этилгидразинами по схеме, изображённой на рисунке 1. В результате были получены 4 новых соединения (IV-a,b; V-a,b), строение которых подтверждено методами электронной и ЯМР 1Н спектроскопии.
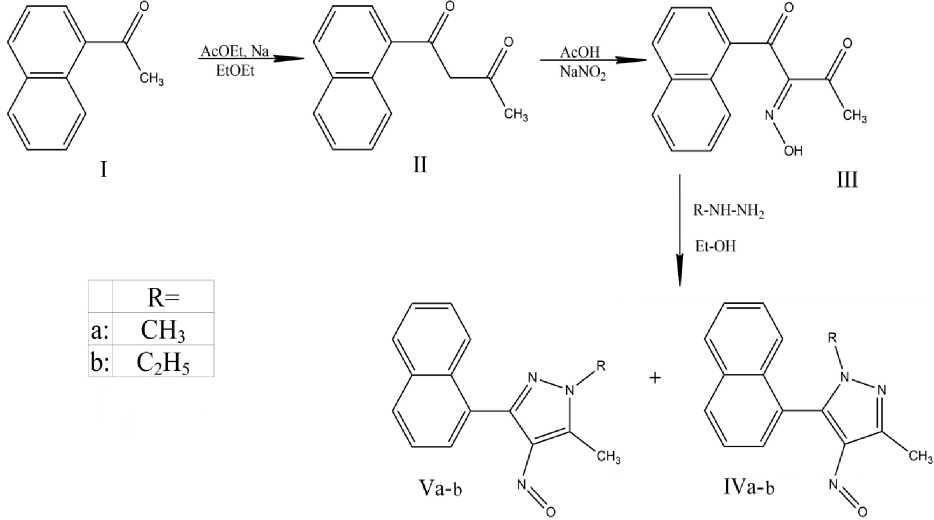
Рис. 1. Синтез новых 4-нитрозопиразолов
Однако для идентификации впервые полученных 4-нитрозопиразолов не были применены методы хромато-масс спектрометрии, ЯМР 13С и ИК спектроскопии. Поэтому целью данной работы стало применение этих методов для окончательного подтверждения структуры синтезированных веществ.
Спектры ЯМР 13С записывали на приборе Bruker Avance III 600,13 МГц в ДМСО – D6. Масс-спектры соединений V a-b регистрировали на приборе Finnigan MAT 8200. Запись масс-спектров соединений IV a-b проводилась на приборе Shimadzy LS/MS-2020 с колонкой RAPTOR ARC-18 100. ИК спектры записаны на ИК микроскопе SpecTRA TECH InspectIR на базе ИК Фурье спектрофотометра Impact 400. Все спектральные данные сведены в таблицу 1.
На ИК спектрах соединений IV a-b и Va-b присутствуют характерные полосы поглощения в области 1324-1346 см-1, вызванные валентными колебаниями нитрозогруппы.
На масс спектрах всех полученных соединений присутствуют пики молекулярных ионов, а на спектрах соединений V a-b присутствуют пики [M-17]+ с интенсивностью 100%, что можно объяснить элиминированием гидроксила.
Строение углеродного скелета подтверждается с помощью ЯМР 13C спектроскопии. На спектрах изомерных соединений IVa и Va в сильном поле в области 10,27 - 13,1 м. д. расположены сигналы атомов углерода, характерные для метильных заместителей в 3 (5) положении пиразольного цикла. Сигналы в области 35,98 - 36,83 м. д. соответствуют атомам углерода метильных заместителей при атомах азота. Области 124,43 – 160.61 для IVa и 124,89 – 159,91 для Va содержат сигналы атомов углерода нафтильного заместителя и пиразола.
Строение изомерных соединений IV b и V b также было подтверждено результатами ЯМР 13C спектроскопии. В области 13,25 и 44,72 м. д. для соединения IV b расположены сигналы ядер атомов углерода этильного заместителя. Для соединения V b сигналы атомов углерода этильного заместителя расположены в области 9,94-30,91 м. д. В сильном поле в области 14,51-14,94 м. д. расположены сигналы ядер атомов углерода, характерные для метильных заместителей в 3 (5) положении пиразольного цикла. Области 124,63 – 160.76 для IV b и 125,30 – 160,52 для V b содержат сигналы ядер атомов углерода нафтильного заместителя и пиразола.
Таблица 1
Спектральные данные полученных соединений
|
Вещество |
ИК спектр, ν, см–1 |
Масс спектр, m/z (Iотн., %) |
ЯМР 13C, δ, м. д. |
|
IV a |
1334, 778 |
251[M]+(10.35), 248 (73.27), 178 (43.65), 127 (40.72), 143 (39.69), 146 (28.40), 126 (20.07), 228 (14.92), 218 (12.80), 166 (12.63), 216 (11.90), 86 (10.73), 184 (10.27). |
13.10, 36.83, 124.43, 124.47, 124.57, 125.01, 126.51, 127.45, 128.66, 129.62, 130.84, 131.82, 133.51, 160.61 |
|
V a |
1325, 776 |
265 [M]+ (1.5), 248 [M-17]+ (100), 249 (24.32), 42 (12.71), 220 (12.01), 153 (10.91), 179 (7.51), 152 (6.91), 221 (2.2) |
10.27, 35.98, 124.89, 125.33, 125.76, 126.37, 128.25, 129.06, 129.54, 131.75, 133.47, 159.91 |
|
IV b |
1332, 771 |
265 [M]+ (26.31), 206 (19.38), 264 (13.19), 255 (13.19), 253 (12.32), 79 (11.3), 183 (11.75), 246 (10.84), 217 (9.82), 184 (6.09), 166 (1.78), 126 (1.04) |
13.25, 14.94, 44.72, 124.63, 125.00, 126.53, 127.32, 128.56, 129.24, 130.69, 132.09, 133.47, 160.76 |
|
V b |
1346, 780 |
265 [M]+ (1.5), 248 [M-17]+ (100), 249 (24.32), 42 (12.71), 220 (12.01), 153 (10.91), 179 (7.51), 152 (6.91), 221 (2.2). |
9.94, 14.51, 30.91, 44.21, 125.30, 125.49, 126.44, 126.94, 128.62, 128.98, 129.60, 131.52, 133.22, 160.52 |
Список литературы Доказательство строения новых 4-нитрозопиразолов методами хромато-масс спектрометрии, ЯМР 13С и ИК спектроскопии
- C. Alka, P.K. Sharma, K. Niranjan. Pyrazole: A Versatile Moiety. Int. J. Chem. Tech. Res. 3, 1, 11-15, (2011).
- R. E. Orth. Biologically Active Pyrazoles. Pharm. Sci. 1968, vol. 57, № 4, p. 537-556
- E. Tzanetou, S. Liekens, K.M. Kasiotis, Arch. Pharm. Chem. Life Sci., 345, 804-820, (2012).
- Z. Tabarelli, M.A. Rubin, D.B. Berlese, P.D. Sauzem, Braz. J. Med. Biol. Res., 37, 1531, (2004).
- Elguero, J. In Comprehensive Heterocyclic Chemistry I; Katritzky, A. R.; Rees, C. W., Eds.; Pergamon Press: Oxford, 1984; Vol. 5, Chapter 4.04.
- Казицына Л. А, Куплетская Н. Б, Применение УФ-, ИК- и ЯМР-спектроскопии в органической химии, Учеб.пособие для вузов. М., «Высшая школа», 1971.


