Доочистка загрязненной органическими веществами воды наядой мелкозубчатой
Автор: Быкова Г.С., Шаталаев И.Ф., Воронин А.В., Чистяков Н.Е.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Промышленная экология
Статья в выпуске: 1-6 т.11, 2009 года.
Бесплатный доступ
Приведены методики фотометрического определения фенола, о-резола, м-аминофенола, пирокатехина, гидрохинона, резорцина, анилина, о-толуидина, п-нитроанилина, сульфаниловой кислоты, п-фенилендиамина, бензидина, лаурилсульфата натрия в модельных образцах сточных вод. Показана возможность и целесообразность использования наяды мелкозубчатой (Najas microdon) для проведения доочистки сточных вод
Загрязнение, органические вещества, вода, наяда мелкозубчатая
Короткий адрес: https://sciup.org/148198505
IDR: 148198505 | УДК: 658.5
Текст научной статьи Доочистка загрязненной органическими веществами воды наядой мелкозубчатой
Человеку и всему живому в биосфере нужна не просто вода как вещество с формулой H2O, а вода определенного качества, т.е. имеющая определенную прозрачность, температуру, сопутствующие примеси и т.п. Водная среда загрязняется человеком, его нельзя объяснить только деятельностью промышленных предприятий. Не менее интенсивно загрязняет природу и современное сельское хозяйство, интенсивн о использ уя удобрени я и средств а защиты растений. Вносят свою лепту и коммунальные хозяйства, строительные и транспортные службы. В настоящее время требования, предъявляемые природоохранным законодательством к качеству очищенных сточных вод, сбрасываемых в водоемы, достаточно высоки.
В ходе эволюции растения выработали ряд защитных механизмов, и их присутствие способствует разложению многих химических соединений. Выделяя органогенный кислород и аэрируя воду, высшая водная растительность способствует окислению органических веществ бактериями, одновременно используя полученные продукты распада для своей жизнедеятельности. Кроме того, она обладает способностью поглощать органические вещества и разрушать их. Благодаря этим качествам в последнее время проводится целенаправленное культивирование некоторых видов высших водных растений (макрофитов) с целью доочистки сточных вод от биогенных и органических веществ. Чаще всего используются такие виды высших водных растений, как тростник
Быкова Галина Сергеевна, ассистент кафедры химии фармацевтического факультета. E-mail:
Шаталаев Иван Федорович, доктор биологических наук, профессор кафедры химии фармацевтического факультета
Воронин Александр Васильевич, кандидат фармацевтических наук, доцент кафедры химии фармацевтического факультета
Чистяков Николай Егорович, доцент кафедры водоснабжения и водоотведения обыкновенный, камыш озерный и лесной, рогоз узколистный и широколистный, рдест гребенчатый и курчавый, уруть, аир тростниковый циперус очереднолистный, водный гиацинт (эйхорния), хара, ирис ложноаировый, гречиха земноводная и пр. [2]. В зимний период в средней полосе России использование большинства предлагаемых высших водных растений ограничено, т.к. их фотосинтезирующие части находятся над водой и при пониженных температурах погибают. Строительство очистных сооружений оранжерейного типа для создания оптимальных условий произрастания таких растений подразумевает значительные материальные затраты.
Решением проблемы можно считать использование полностью погруженных в воду растений, к которым относится наяда мелкозубчатая (Najas microdon). Наяда мелкозубчатая — это вечнозеленое, многолетнее растение с тонкими ломкими ветвистыми стеблями, с расположенными на них узколинейными листьями светло-зеленого цвета. Растение неприхотливое, легко размножается вегетативно - небольшие фрагменты побега быстро формируют новые растения. Может существовать как в толще воды, так и в укорененном виде, закрепляясь в грунте с помощью корней. Ранее проводились исследования способности поглощения наядой мелкозубчатой ряда биогенных веществ неорганической природы -нитратов, нитритов, фосфатов, ионов аммония. Исследования дали положительные результаты [3] Актуальным остается вопрос о возможности использования наяды мелкозубчатой для доочистки сточных вод от органических веществ.
Цель данной работы: провести исследование способности поглощения наядой мелкозубчатой из водных растворов некоторых органических веществ ряда фенолов (фенол, о -крезол, м -аминофенол, пирокатехин, гидрохинон, резорцин), ряда ароматических аминов (анилин, о -толуидин, п шитроанилин, сульфаниловая кислота, п -фенилендиамин, м -аминофенол, бензидин) и ПАВ (лаурилсульфат натрия).
Методика исследований.
-
1. Количественное определение содержания фенола, о -крезола, м -аминофенола, пирокатехина, гидрохинона, резорцина в водных растворах проводили с помощью фотометрического метода, основанного на образовании окрашенных соединений фенола, его производных и гомологов с 4-аминоантипирином в присутствии калия гексацианоферрата (III) в щелочной среде [4].
-
2. Количественное определение анилина, о -толуидина, л -нитроанилина, сульфаниловой кислоты, л -фенилендиамина, м -аминофенола, бензидина в водных растворах проводили с помощью фотометрического метода, основанного на образовании азокрасителя при взаимодействии диазотированного анализируемого первичного ароматического амина и тимола в щелочной среде [5].
-
3. Количественное определение содержания лаурилсульфата натрия в водном растворе проводили с помощью экстракционнофотометрического метода, основанного на том, что анионоактивные ПАВ образуют с метиленовым синим комплексные ассоциаты, растворимые в хлороформе с образованием окрашенных растворов [4].
10 мл исследуемого раствора помещали в колбу на 100 мл и разбавляли дистиллированной водой до 100 мл, добавляли 1 мл аммиачного буферного раствора (pH=9,95) и 2 мл 2%-ного раствора 4-аминоантипирина и содержимое перемешивали. Затем прибавляли 2 мл 8%-ного раствора калия гексацианоферрата (III) и вновь перемешивали. Аналогично готовили раствор, не содержащий анализируемого вещества (холостая проба), с тем же количеством реактивов. Также готовили окрашенные растворы из стандартных растворов анализируемого вещества в диапазоне концентраций 5-50 мг/л.
Через 15 минут после добавления всех реактивов проводили фотоколориметрическое определение исследуемого вещества. Величину оптической плотности окрашенных растворов исследуемых образцов, стандартных растворов определяли относительно «холостой» пробы на фотоколориметре КФК-2: для фенола, о -крезола, м -аминофенола, резорцина светофильтр =540 нм, кювета с толщиной рабочего слоя 20 мм; для пирокатехина и гидрохинона светофильтр =490 нм, кювета с толщиной рабочего слоя 50 мм. Концентрацию фенола в исследуемых образцах рассчитывали по калибровочному графику.
5 мл исследуемого раствора помещали в мерную колбу на 100 мл, добавляли 2,5 мл 10%-ной соляной кислоты и 2,5 мл дистиллированной воды, перемешивали и охлаждали до 0°С в бане со льдом. Добавляли 5 мл свежеприготовленного 0,5%-ного раствора натрия нитрита, затем вынимали из охлаждающей бани и через 5 мин добавляли 1 г мочевины для разложения избытка нитрита. Далее выдерживали при охлаждении и частом перемешивании в течение 15 мин. Когда прекращалось выделение газа, добавляли 1 мл 0,5%-ного раствора тимола в 10%-ном растворе едкого натра и сразу же после этого 5 мл 10%-ного раствора едкого натра. Вынимали из охлаждающей бани и через 10 мин доводили объем дистиллированной водой до 100 мл. Также готовили окрашенные растворы из стандартных растворов исследуемого первичного ароматического амина в диапазоне концентраций 5-50 мг/л.
Величину оптической плотности окрашенных растворов исследуемых образцов, стандартных растворов определяли относительно дистиллированной воды на фотоколориметре КФК-2: кювета с толщиной рабочего слоя 20 мм; светофильтр =440 нм для анилина, о -толуидина, сульфаниловой кислоты и м- аминофенола; светофильтр =490 нм для л -нитроанилина, бензидина и л -фенилендиамина. Концентрацию амина в исследуемых образцах рассчитывали по калибровочному графику.
100 мл исследуемого раствора помещали в делительную воронку вместимостью 250 мл, прибавляли 10 мл фосфатного буферного раствора (pH=10), 5 мл 0,035%-ного раствора метиленового синего и 15 мл хлороформа. Осторожно взбалтывали 1 мин и выдерживали 1 мин для расслоения жидкости. Затем сливали слой хлороформа в другую делительную воронку, в которую предварительно наливали 110 мл дистиллированной воды и 5 мл кислого 0,035%-ного раствора метиленового синего (6,5 мл конц. соляной кислоты в 1 л раствора). Содержимое второй воронки взбалтывали так же, как и содержимое первой, давали жидкости расслоиться и сливали нижний хлороформный слой через маленькую воронку, в которую предварительно помещали тампон ваты, пропитанной хлороформом, в мерную колбу вместимостью 50 мл. В первую воронку наливали еще 10 мл хлороформа и повторяли вышеописанные операции. Экстракцию проводили двукратно порциями хлороформа 10 мл и 5 мл. Объединенные хлороформные экстракты доводили хлороформом до 50 мл в мерной колбе. Оптическую плотность окрашенных хлороформных растворов исследуемых образцов и стандартных растворов определяли на фотоколориметре КФК-2 со светофильтром Х =670 нм в кювете с толщиной рабочего слоя 30 мм относительно «холостой» пробы. Концентрацию лаурилсульфата натрия в исследуемых образцах рассчитывали по калибровочному графику, построенному в диапазоне концентраций 0,5-3 мг/л.
Для исследования поглощения фенола, о-крезола, м-аминофенола, пирокатехина, гидрохинона, резорцина, анилина, о-толуидина, п-нитроанилина, сульфаниловой кислоты, п-фенилендиамина, м-аминофенола, бензидина, лаурилсульфата натрия биомассу наяды мелкозубчатой из расчета 5 г на 1 л раствора помещали в водные растворы указанных веществ заданной концентрации. Анализ проб воды проводили с интервалом в 1 сутки в течение нескольких дней. Исходные концентрации растворов органических соединений представлены в таблице 1. Параллельно проводили анализ проб воды «контрольных» растворов органических веществ (без наяды мелкозубчатой) с такими же концентрациями. Интенсивность поглощения органического вещества рассчитывали как разницу между концентрациями вещества в «контрольном» и опытном растворах. Таким образом, учитывали естественную убыль растворенного загрязнителя.
Таблица 1. Результаты исследования интенсивности поглощения органических веществ из водных растворов наядой мелкозубчатой
|
Показатели |
Исходная концентрация, мг/л |
Время прохождения эксперимента, сутки |
Средняя интенсивность поглощения органического вещества, мг/г биомассы |
|
пирокатехин |
50,0 |
9 |
1,132 |
|
гидрохинон |
50,0 |
9 |
0,899 |
|
резорцин |
50,0 |
11 |
0,503 |
|
фенол |
50,0 |
11 |
0,296 |
|
о -крезол |
50,0 |
11 |
0,272 |
|
м -аминофенол |
50,0 |
9 |
0,048 |
|
анилин |
50,0 |
6 |
1,385 |
|
о -толуидин |
50,0 |
7 |
0,145 |
|
бензидин |
10,0 |
7 |
0,043 |
|
п -фенилендиамин |
50,0 |
4 |
^^^^^^^^^^^^^^^^» |
|
сульфаниловая к-та |
50,0 |
4 |
0,140 |
|
п -нитроанилин |
10,0 |
4 |
0,026 |
|
лаурилсульфат натрия |
3,0 |
3 |
0,200 |
Результаты и их обсуждение. Исследование способности поглощения наядой мелкозубчатой органических веществ ряда фенола (рис. 1 и 2) из модельных образцов сточных вод показало, что введение в ароматическое кольцо фенола дополнительной гидроксильной группы приводит к повышению средней интенсивности поглощения вещества по сравнению с фенолом. Для двухатомных фенолов: пирокатехина — 1,132 мг/г биомассы, гидрохинона — 0,899 мг/г, резорцина — 0,503 мг/г по сравнению с фенолом — 0,296 мг/г. Средняя интенсивность поглощения о-крезола (о-метилфенола) — 0,272 мг/г биомассы — сравнима с таковой для фенола. Поглощение же м-аминофенола затруднено — 0,048 мг/г биомассы.
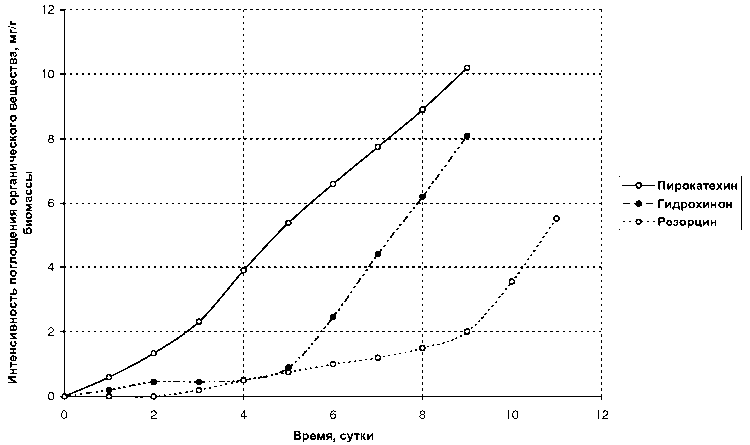
Рис. 1. Интенсивность поглощения из водных растворов пирокатехина, гидрохинона, резорцина наядой мелкозубчатой с плотностью биомассы 5 г/л
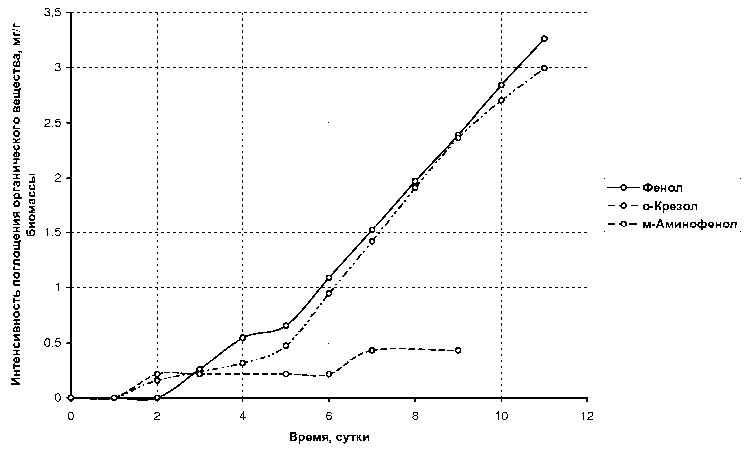
Рис. 2. Интенсивность поглощения из водных растворов фенола, о -крезола, м -аминофенола наядой мелкозубчатой с плотностью биомассы 5 г/л
При сравнении величин средней интенсивности поглощения веществ из ряда первичных ароматических аминов (рис. 3 и 4) видно, что при введении в кольцо анилина углеводородных радикалов или функциональных групп снижается интенсивность поглощения. В значительной мере для бензидина — 0,043 мг/г биомассы, я-нитроанилина. — 0,026 мг/г по сравнению с анилином — 1,385 мг/г; и в меньшей степени для о-толуидина — 0,145 мг/г, сульфаниловой кислоты — 0,140 мг/г. Динамика поглощения лаурилсульфата натрия показана на рис. 5.
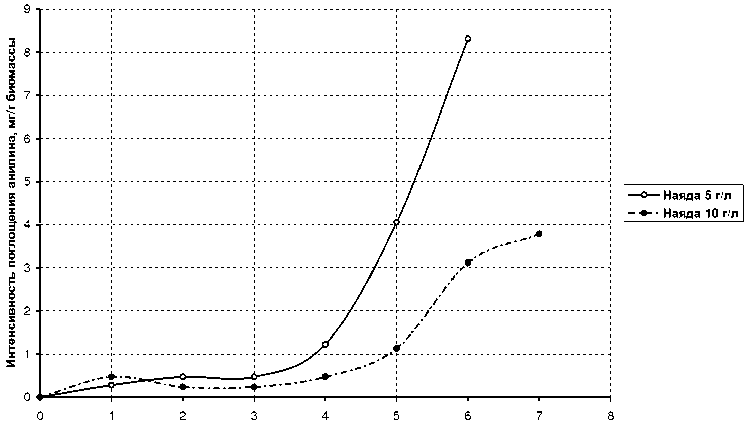
Проведенные эксперименты показали положительную динамику поглощения наядой мелкозубчатой всех исследуемых в данной работе веществ. Результаты исследования представлены в таблице 1. Дополнительные исследования с растворами анилина и о- толуидина (рис. 6 и 7) показали, что с увеличением плотности биомассы растения с 5 г/л до 10 г/л увеличение эффективности удаления органических веществ не наблюдается.
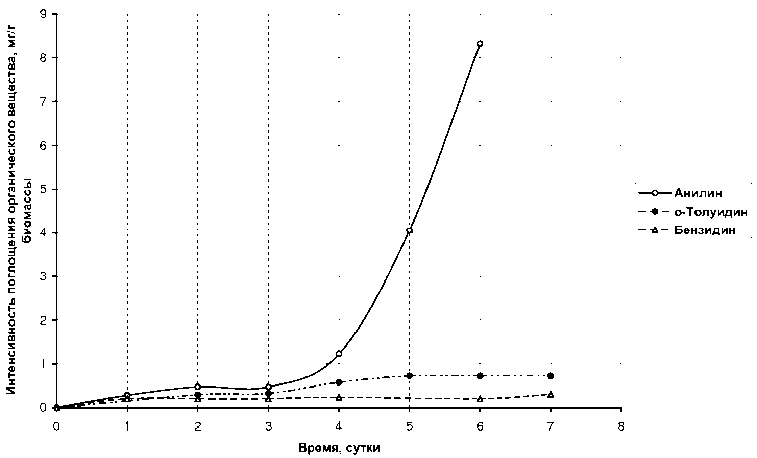
Рис. 3. Интенсивность поглощения из водных растворов о -толуидина, анилина, бензидина наядой мелкозубчатой с плотностью биомассы 5 г/л
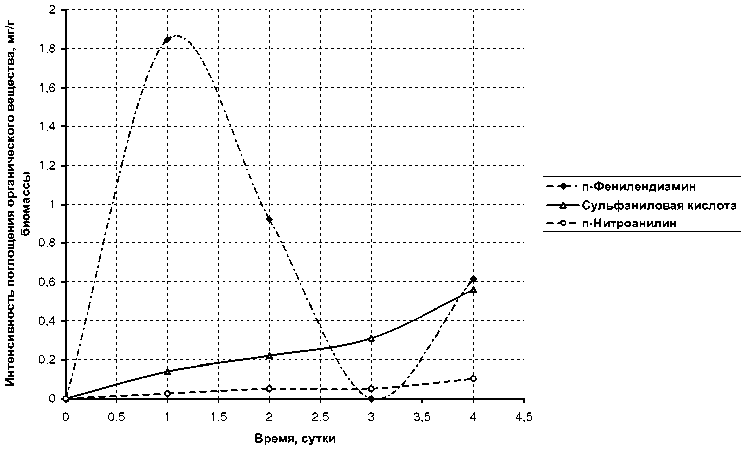
Рис. 4. Интенсивность поглощения из водных растворов сульфаниловой кислоты, ^ -нитроанилина, ^ -фенилендиамина наядой мелкозубчатой с плотностью биомассы 5 г/л
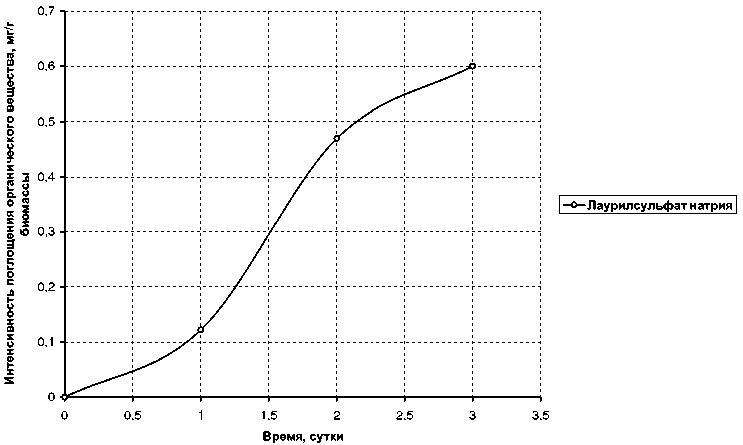
Рис. 5. Интенсивность поглощения из водного раствора лаурилсульфата натрия наядой мелкозубчатой с плотностью биомассы 5 г/л
Проведенные эксперименты показали положительную динамику поглощения наядой мелкозубчатой всех исследуемых в данной работе веществ. Результаты исследования представлены в таблице 1. Дополнительные ис следования с растворами анилина и о-толуидина (рис. 6 и 7) показали, что с увеличением плотности биомассы растения с 5 г/л до 10 г/л увеличение эффективности удаления органических веществ не наблюдается.
Время, сутки
Рис. 6. Зависимость интенсивности поглощения анилина наядой мелкозубчатой от плотности ее биомассы
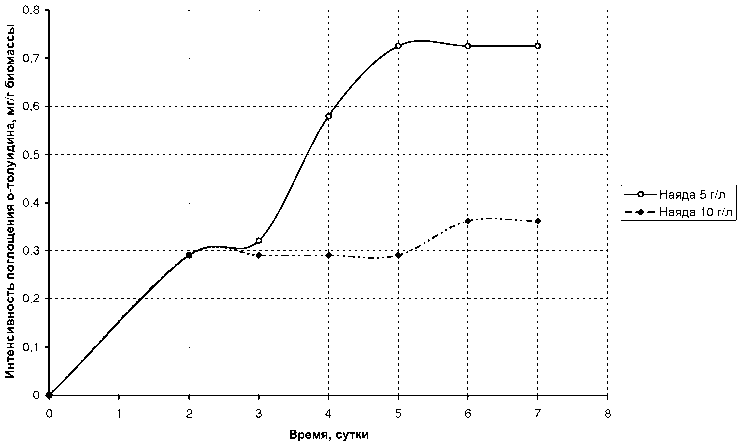
Рис. 7. Зависимость интенсивности поглощения о -толуидина наядой мелкозубчатой от плотности ее биомассы
Выводы: полученные результаты указывают на возможность и целесообразность использования наяды мелкозубчатой для проведения доочистки сточных вод, содержащих фенол, о -крезол, м -аминофенол, пирокатехин, гидрохинон, резорцин, анилин, о -толуидин, п- нитроанилин, сульфаниловую кислоту, п -фенилендиамин, бензидин и лаурилсульфат натрия. Плотность биомассы наяды мелкозубчатой рекомендуется удерживать на уровне 5 г/л.
Список литературы Доочистка загрязненной органическими веществами воды наядой мелкозубчатой
- Фелленберг, Г. Загрязнение природной среды. Введение в экологическую химию: Пер. с нем. М.: Мир, 1997. -232 с.
- Артамонов, В.И. Растения и чистота природной среды. М.: Наука, 1986. -242 с.
- Пат. 2081852 Российская Федерация, C 02 F 3/32. Способ очистки сточных вод./Матвеев В.И., Чистяков Н.Е., Кузнецов Ю.Р. -№ 2081852; Заявл. 24.11.94; Опубл. 20.06.97.
- Лурье, Ю.Ю. Аналитическая химия промышленный сточных вод. М.: Химия, 1984. -448 с.
- Полюдек-Фабини, Р. Органический анализ: Руководство по анализу органических соединений, в том числе и лекарственных веществ. Пер. с нем/Р. Полюдек-Фабини, Т. Бейрих//Л.: Химия, 1981 -624 с.


