Доступ к межжелудочковой перегородке с пересечением и восстановлением фиброзного кольца аортального клапана (экспериментальное исследование)
Автор: Гурщенков А.В., Дьяченко Я.А., Майстренко А.Д., Успенский В.Е., Ибрагимов А.Н., Филиппов А.А., Гордеев М.Л.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 1 т.36, 2021 года.
Бесплатный доступ
Септальная миоэктомия является одним из наиболее надежных методов лечения обструктивных форм гипертрофической кардиомиопатии (ГКМП). Наиболее часто эта операция выполняется с применением трансаортального доступа. Хорошие непосредственные и отдаленные результаты операции наблюдаются более чем в 90% случаев. Одной из причин неэффективности миоэктомии и ряда осложнений является ограниченная визуализация межжелудочковой перегородки (МЖП) через створ аортального клапана (АК). Данная задача может быть решена путем использования расширенного трансаортального доступа к МЖП, подразумевающего пересечение фиброзного кольца (ФК) АК.Цель: оценить эффективность расширенного трансаортального доступа к МЖП путем рассечения и восстановления ФК АК в зоне комиссуры с последующей оценкой его запирательной функции в эксперименте.Материал и методы. В качестве экспериментальных моделей использовались трупные свиные сердца. Выделялся корень аорты, коронарные артерии перевязывались. Выполнено 30 экспериментальных операций рассечения с последующим восстановлением одной комиссуры нативного АК. Оценивалось влияние исследуемого метода восстановления комиссуры на диаметр ФК АК. Запирательная функция АК после восстановления ФК исследовалась на специальном испытательном стенде путем проведения водяных проб с достижением максимального давления 200 мм рт. ст. и оценкой объема регургитации.Результаты. Был теоретически обоснован и изучен в эксперименте вариант шва стенки аорты для восстановления комиссуры нативного АК. При оценке состоятельности АК после рассечения и восстановления комиссуры во всех случаях значимая регургитация на АК отсутствовала. При прямом измерении диаметра ФК АК его значимого уменьшения после реконструкции не отмечалось. В 26 (87%) случаях диаметр ФК не изменился, в 4 (13%) случаях после коррекции диаметр уменьшился на 1 мм (р = 0,570).Заключение. В эксперименте показана возможность рассечения и успешного восстановления ФК АК в зонекомиссуры без нарушения его функции и существенного изменения диаметра ФК. Данная методика может стать ключевой в разработке как расширенного трансаортального доступа к МЖП, так и новых вариантов клапаносберегающих вмешательств на корне аорты.
Септальная миоэктомия, расширенный трансаортальный доступ, межжелудочковая перегородка, аортальный клапан
Короткий адрес: https://sciup.org/149136632
IDR: 149136632 | УДК: 616.124.6-089:616.126.52-089.844 | DOI: 10.29001/2073-8552-2021-36-1-134-140
Текст научной статьи Доступ к межжелудочковой перегородке с пересечением и восстановлением фиброзного кольца аортального клапана (экспериментальное исследование)
Септальная миоэктомия успешно применяется при лечении обструктивных форм гипертрофической кардиомиопатии (ГКМП) уже более 60 лет. Для выполнения миоэктомии наиболее часто используется трансаортальный доступ, при этом иссечение миокарда межжелудочковой перегородки (МЖП), как правило, не вызывает проблем. Хорошие непосредственные и отдаленные результаты вмешательства наблюдаются более чем в 90% случаев [1]. Однако бывают ситуации, когда визуализация МЖП существенно затруднена. Причинами этого являются уз- кое фиброзное кольцо (ФК) аортального клапана (АК), большое расстояние от него до зоны митрально-септального контакта, наличие среднежелудочковой обструкции, особенности расположения сердца, глубокая грудная клетка, деформации позвоночника [2, 3]. В таких случаях в некоторой степени могут помочь различные способы мобилизации сердца, позволяющие перевести МЖП в вертикальное положение и улучшить ее визуализацию через створ АК [4], что не избавляет от наиболее узкого места хирургического доступа – ФК АК. Известна модифицированная операция Konno с сохранением нативного АК, используемая для лечения обструкции выходного тракта левого желудочка (ЛЖ) [5]. АК при этом не затрагивается, а доступ в полость ЛЖ осуществляется через короткий разрез гипертрофированной МЖП, обеспечивающий весьма ограниченную визуализацию. Приведенные обстоятельства побудили нас рассмотреть возможность осуществления расширенного доступа к МЖП с пересечением ФК АК. В случае необходимости протезирования АК задача сильно упрощается, подобные операции пластики узкого ФК давно описаны и с успехом применяются [6, 7]. Однако у больных с ГКМП створки АК чаще всего интактны, и задача состоит в рассечении ФК, но сохранении нативного АК. Подобные хирургические приемы также известны: пластика АК по методу D. Merphy [8], би-куспидализация АК [9], модификация операции Konno с рассечением и восстановлением комиссуры АК [10]. Эти виды реконструкции предусматривают рассечение и восстановление нативной комиссуры АК. Имеются данные об отсутствии аортальной недостаточности (АН) у пациентов после этих операций в сроки до 3 лет и более [9, 10]. Подобные наблюдения подтверждают возможность осуществления расширенного трансаортального доступа к МЖП с рассечением АК в области комиссур. Рассечение комиссуры между некоронарной и правой коронарной створками представляется малоперспективным в силу близкого расположения элементов проводящей системы сердца и правой коронарной артерии. Рассечение комиссур между правой и левой, а также между левой и некоронарной створками АК возможно без повреждения проводящих путей и коронарных артерий [6, 7].
Нами было проведено экспериментальное исследование для оценки возможности выполнения расширенного трансаортального доступа к МЖП путем рассечения и последующего восстановления комиссуры АК при условии сохранения его запирательной функции. Под расширенным доступом к МЖП понимается рассечение комиссуры между некоронарной и левой коронарной створками АК с пересечением аортально-митрального сочленения и дальнейшим переходом разреза одновременно на переднюю створку митрального клапана и купол левого предсердия вдоль правой ветви легочной артерии.
Материал и методы
В качестве экспериментальных моделей использовались трупные свиные сердца, обладающие схожей анатомией с сердцем человека [11]. На подготовительном этапе выполнялось выделение корня аорты с прилежащими тканями (восходящая аорта, элементы выходного тракта ЛЖ), коронарные артерии перевязывались. Таким образом, изготавливались препараты изолированного корня аорты (рис. 1).
Запирательная функция АК оценивалась на специальном испытательном стенде путем проведения водяной пробы с достижением давления 200 мм рт. ст. (рис. 2).
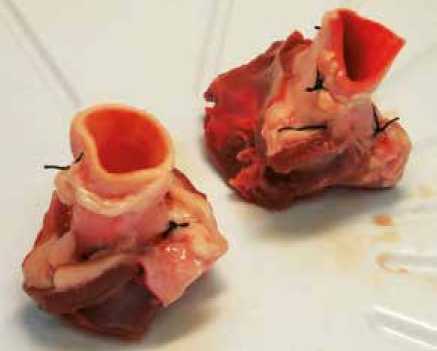
Рис. 1. Препараты корня аорты с перевязанными коронарными артериями
Fig. 1. Aortic root preparations with ligated coronary arteries
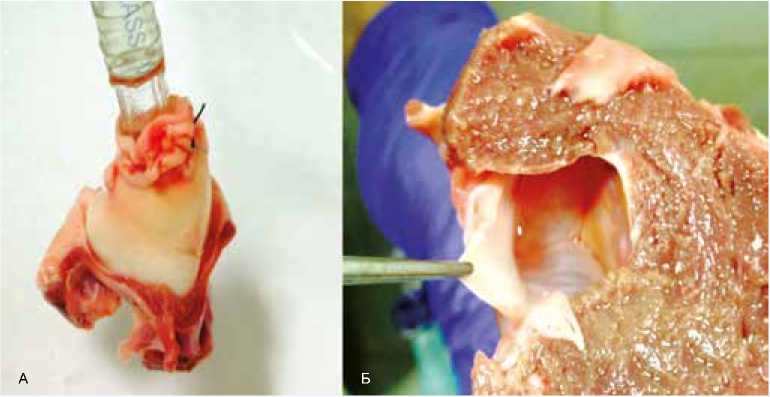
Рис. 2. Водяная проба. Аортальный клапан герметичен. А – вид снаружи. Б – вид со стороны левого желудочка
Fig. 2. Water test. The aortic valve is sealed. A – outside view. B – view from the left ventricle
Стенд для проведения водяной пробы был изготовлен из компонентов аппарата искусственного кровообращения. Нагнетание жидкости производилось при помощи шприца. Для измерения давления в системе использовался манометр B. Well (Swiss AG) с диапазоном измере- ний 20–300 мм рт. ст. и точностью измерений ±3 мм рт. ст. (рис. 3). Все изготовленные препараты изолированного корня аорты первоначально тестировались на запирательную способность АК. Для включения в эксперимент отбирались только те, у которых АК оставался гермети- чен при статическом давлении 200 мм рт. ст. Cуть экспериментов заключалась в рассечении комиссуры АК без повреждения его створок с последующим ее восстановлением. До рассечения и после восстановления комиссуры АК проводилось измерение диаметра ФК АК стандартными калибрами для клапанов Мединж и Карбоникс диаметром от 19 до 25 мм.
После восстановления целостности стенки аорты проводилась водяная проба, для этого изолированный корень аорты фиксировался на канюле двумя лигатурами, в корень аорты подавалась вода с достижением давления 200 мм рт. ст., оценивалось наличие АН. Степень АН мы определяли подсчетом объема вытекающей жидкости в течение 10 с наблюдения. Для рассечения комиссуры были использованы лигатурные ножницы 180 мм, 7” (BC295W Aesculap), при восстановлении комиссуры применялся шовный материал Premilene 5/0 c иглой 17 мм (B. Braun). Для фиксации корня аорты к канюле при проведении водяной пробы, а также для перевязки коронарных артерий использовалась нить Nurolon 0 (Ethicon) без иглы. После отработки варианта шва стенки аорты была выполнена контрольная серия из 30 экспериментальных операций рассечения и восстановления одной комиссуры АК.

Рис. 3. Стенд для проведения водяной пробы
Fig. 3. A device for performing the water test
Результаты
При проведении водяной пробы после реконструкции одной комиссуры нативного АК в 23 (77%) случаях регургитация на АК отсутствовала. В оставшихся 7 (23%) случаях отмечалась небольшая регургитация в виде капельного поступления жидкости со скоростью до 3 мл в минуту (10 капель за 10 с). Учитывая возможную длительность сердечного цикла, такая регургитация представляется незначительной. Таким образом, после реконструкции во всех случаях была сохранена адекватная запирательная функция АК.
При прямом измерении диаметра ФК АК в 26 (87%) случаях после реконструкции он не изменился, в 4 (13%) случаях уменьшился на 1 мм. Различия диаметров до и после реконструкции комиссуры незначимы ( р = 0,570; критерий Вилкоксона).
Обсуждение
В истории человечества имеется ряд бытовых проблем, которые существуют в течение сотен и даже тысяч лет, такие, например, как слетающая головка молотка или топорище у топора. Так и в случае с трансаортальным доступом к МЖП: существующая более 60 лет проблема «узкого места», которым является створ АК, ограничивает манипуляции в полости ЛЖ при хирургических вмешательствах по поводу ГКМП. Эта проблема не является критической, хорошие результаты операции наблюдаются более чем в 90% случаев. Сложности визуализации МЖП возникают при необходимости устранения сопутствующей среднежелудочковой обструкции, а также при наличии сложных анатомических условий (аномалии положения сердца, глубокая грудная клетка, деформации позвоночника (травмы, болезнь Бехтерева), малый диаметр ФК АК). Предложены различные способы решения проблемы – альтернативные внутрисердечные доступы [12–14], мобилизация сердца [4], имплантация апико-аортального кондуита [15]. Указанные подходы требуют опыта, чреваты осложнениями и используются ограниченно. Наиболее распространенным и привычным остается трансаортальный доступ. Наша работа является попыткой решить проблему «узкого места» – увеличить площадь зоны доступности при использовании трансаортального доступа.
Восстановление рассеченной комиссуры АК проводится путем наложения швов, которые захватывают как основание створок АК, так и прилежащую стенку аорты (рис. 4А). Простые расчеты показывают, что если при формировании складки стенки аорты в области комиссуры ширина захвата в шов основания прилежащих створок (размер X) больше или равна ширине складки стенки аорты (размер Y), диаметр корня аорты уменьшается значительно меньше, чем подтягиваются края прилежащих створок. Когда X = Y, уменьшение диаметра аорты составляет 2Y/3,14 = 0,64Y, а укорочение прилежащих краев створок происходит на Y. На практике это приводит к нарушению коаптации створок и появлению недостаточности, поэтому оптимальным вариантом проведения шва при восстановлении комиссуры выбран тот, когда X существенно меньше Y – нить проводится через основание створки (рис. 4Б).
При выборе рядности шва (одно или двухрядный) предпочтение было отдано двухрядному шву как более прочному. При проведении водяных проб было замечено, что наиболее прочными двухрядные швы получались в случае, если оба ряда швов накладывались на одном уровне, тогда они выдерживали давление до 270 мм рт. ст. и более. При наложении швов на разных уровнях прорезывание первого ряда наблюдалось уже при относительно невысоком давлении (до 200 мм рт. ст.). С нашей точки зрения, оптимальным вариантом наложения швов является следующий: первый ряд формирует непрерывный «П»-образный шов. В зоне выше ФК АК на одном уровне вкол осуществляется снаружи аорты, выкол изнутри, затем вкол под основание створки АК, выкол в разрез комиссуры, затем вкол под основание прилежащей створки АК, выкол внутри полулуния и далее вкол изнутри и выкол снаружи стенки аорты. Далее указанный алгоритм повторяется на следующем уровне – на 3–4 мм выше предыдущего и так далее до уровня синотубуляр- ной зоны, где шов продолжается как обычный непрерывный «П»-образный до края поперечного разреза аорты. Вторым рядом накладывается непрерывный обвивной шов, не выходя за пределы первого ряда (рис. 5).
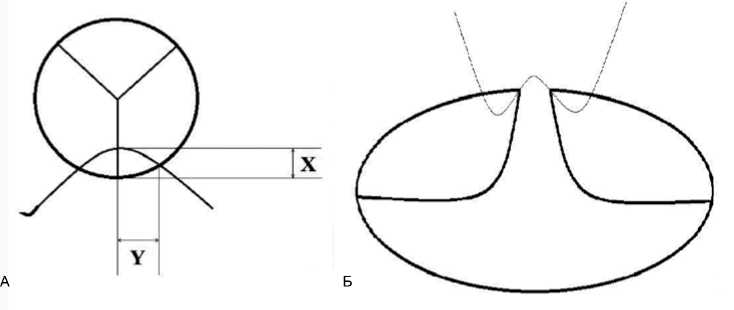
Рис. 4. А: cхема проведения шва в зоне комиссуры аортального клапана. Размер Х – ширина захвата в шов основания прилежащих створок. Размер Y – ширина складки стенки аорты. Б: oптимальный вариант проведения нити первого ряда швов при восстановлении комиссуры аортального клапана
Fig. 4. A: a scheme of stitching in the area of aortic valve commissure. Dimension X is the width of capture in the seam of the base of adjacent cusps. Dimension Y is the width of aortic wall fold. B: the best option for the thread of the first row of sutures in the restoration of aortic valve commissure
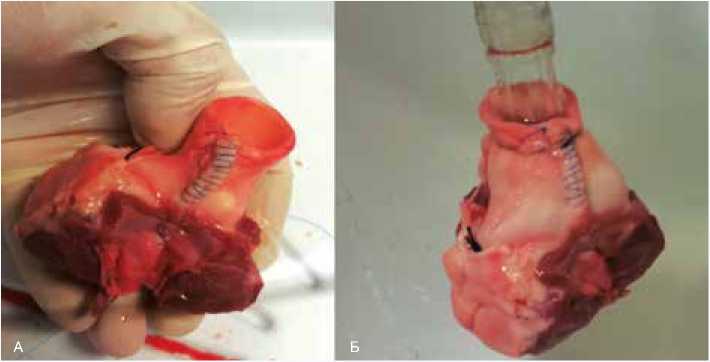
Рис. 5. Препараты изолированного корня аорты после рассечения и восстановления комиссуры. А – до испытания. Б – проведение водяной пробы Fig. 5. The preparations of isolated aortic root after the dissection and restoration of commissure. A – before testing. Б – water test
Согласно теоретическим расчетам, при ширине формируемой складки стенки аорты в 4 мм диаметр корня должен уменьшаться на 2,5 мм (отношение длины окружности к диметру = 3,14/1). В нашем случае прямые измерения диаметра ФК АК при помощи клапанных калибров дали противоречивые результаты, что, по всей видимости, связано с эластичностью тканей и невысокой точностью использованного метода оценки.
Опробованная технология представляется ключевой как при осуществлении расширенного доступа к МЖП, так и при выполнении модифицированных вариантов аортовентрикулопластики. Под расширенным доступом к МЖП понимается рассечение комиссуры между некоронарной и левой коронарной створками АК с пересечением аортально-митрального сочленения и дальнейшим переходом разреза одновременно на переднюю створку митрального клапана и на купол левого предсердия вдоль правой ветви легочной артерии. Разрез левого предсердия может быть продлен на его боковую стен- ку под пересеченной верхней полой веной (рис. 6), что одновременно обеспечит мобилизацию сердца. Доступ к МЖП и всей полости ЛЖ будет осуществляться через единый просвет, ограниченный ФК АК и митрального клапана, что увеличит площадь зоны доступности в 6–8 раз. Это позволит осуществлять вмешательства, невозможные при использовании традиционного трансаортального доступа. Аортовентрикулопластика является самостоятельным методом устранения подклапанной обструкции при диффузных формах ГКМП. Ее модифицированный вариант, не затрагивающий АК, подразумевает отдельные разрезы аорты, правого желудочка и МЖП. Два последних разреза впоследствии закрываются заплатами [5]. При этом иссечение миокарда и наложение швов для фиксации заплаты осуществляется через узкий глубокий разрез гипертрофированной МЖП, что технически непросто и чревато осложнениями. В данной ситуации рассечение комиссуры между правой и левой коронарными створками дает возможность значительно улучшить визуализацию зоны операции и выполнить ее более качественно. Модификация операции Konno с рассечением и последующим восстановлением комиссуры АК была описана в 1984 г. P. Vouhe [10]. Восстановление комиссуры производилось путем наложения обвивного шва мелкими стежками нитью Prolene 6/0. Разрез МЖП ушивался «край в край». Несмотря на хорошие результаты, операция не получила широкого распространения. Судя по более поздним публикациям, автор предпочитал в дальнейшем использовать вариант операции, при котором АК не затрагивается. Стремление избежать повреждения нативных клапанов сердца представляется разумным. Однако при возникновении непреодолимых затруднений опыт проведенной нами экспериментальной работы позволяет рассечь комиссуру АК для улучшения визуализации зоны операции. Описанный расширенный доступ, как и аортовентрикулопластика, являются травматичными процедурами. Использовать их предполагается ограниченно и только в тех ситуациях, когда иной подход не приносит успеха.
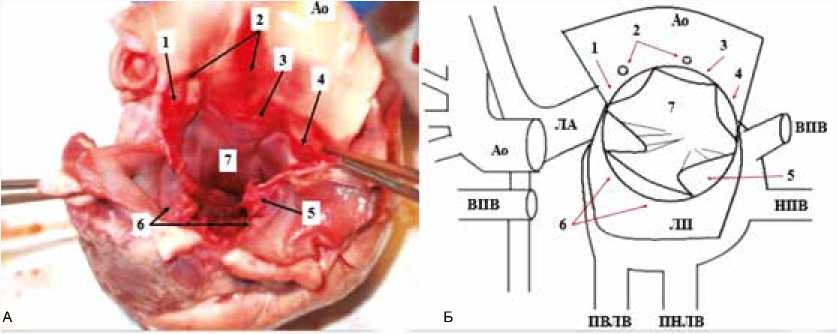
Рис. 6. Расширенный доступ к межжелудочковой перегородке. А – на трупном сердце. Б – схема. 1 – левая коронарная створка, 2 – устья коронарных артерий, 3 – правая коронарная створка, 4 – некоронарная створка, 5 – передняя створка митрального клапана (рассечена), 6 – задняя створка митрального клапана, 7 – межжелудочковая перегородка, Ао – аорта, ЛА – легочная артерия, ВПВ – верхняя полая вена, НПВ – нижняя полая вена, ЛП – полость левого предсердия, ПВЛВ – правая верхняя легочная вена, ПНЛВ – правая нижняя легочная вена
Fig. 6. Extended approach to IVS. A – on a cadaveric heart. B – scheme. 1 – left coronary cusp, 2 – the ostia of coronary arteries, 3 – right coronary cusp, 4 – non-coronary cusp, 5 – the anterior cusp of mitral valve (dissected), 6 – posterior cusp of the mitral valve, 7 – interventricular septum, Ao – aorta, ЛA – pulmonary artery, ВПВ – superior vena cava, НПВ – inferior vena cava, ЛП – left atrial cavity, ПВЛВ – right superior pulmonary vein, ПНЛВ – right inferior pulmonary vein
Выводы
В эксперименте показана возможность рассечения и восстановления комиссуры АК без значимого влияния на его функцию. Данная технология представляется ключевой для осуществления как расширенного трансаорталь-
Список литературы Доступ к межжелудочковой перегородке с пересечением и восстановлением фиброзного кольца аортального клапана (экспериментальное исследование)
- Hang D., Nguyen A., Schaff H. Surgical treatment for hypertrophic cardiomyopathy: A historical perspective. Ann. Cardiothorac. Surg. 2017;6(4):318-328. DOI: 10.21037/acs.2017.04.03.
- Kotkar K., Said S., Dearani J., Schaff H. Hypertrophic obstructive cardiomyopathy: The Mayo Clinic experience. Ann. Cardiothorac. Surg. 2017;6(4):329-336. DOI: 10.21037/acs.2017.07.03.
- 3 Dearani J.A. Modified Konno instead of myectomy: Another tool in the box? J. Thorac. Cardiovasc. Surg. 2018;56(6):2295-2296. DOI: 10.1016/j.jtcvs.2018.07.039.
- Гурщенков А.В., Сухова И.В., Зайцев В.В., Майстренко А.Д., Дьяченко Я.А., Агаев Р.С. и др. Пятилетний опыт использования мобилизации сердца при септальной миоэктомии. Кардиология и сердечно-сосудистая хирургия. 2018;11(4):54-58. DOI: 10.17116/ kardio201811454.
- Laredo M., Khraiche D., Raisky O., Gaudin R., Bajolle F., Maltret A. et al. Long-term results of the modified Konno procedure in high-risk children with obstructive hypertrophic cardiomyopathy. J. Thorac. Cardiovasc. Surg. 2018;156(6):2285-2294.e2. DOI: 10.1016/j.jtcvs.2018.06.040.
- Manouguian S., Seybold-Epting W. Patch enlargement of the aortic valve ring by extending the aortic incision into the anterior mitral leaflet: New operative technique. J. Thorac. Cardiovasc. Surg. 1979;78(3):402-412. DOI: 10.1016/s0022-5223(19)38105-x.
- Konno S., Imai Y., lida Y., Nakajima M., Tatsuno K. A new method for prosthetic valve replacement in congenital aortic stenosis associated with hypoplasia of the aortic valve ring. J. Thorac. Cardiovasc. Surg. 1975;70(5):909-917. DOI: 10.1016/s0022-5223(19)39673-4.
- Murphy D., Poirier N. A technique of aortic valvuloplasty for aortic insufficiency associated with ventricular septal defect. J. Thorac. Cardiovasc. Surg. 1972;64(5):800-802.
- Garamella J., Schmidt W., Jensen N., Lynch M. Clinical experiences with the bicuspid operation for aortic regurgitation. Ann. Surg. 1963;157(2):310-313. DOI: 10.1097/00000658-196302000-00021.
- Vouhe P., Poulain H., Bloch G., Loisance D., Gamain J., Lombaert M. et al. Aortoseptal approach for optimal resection of diffuse subvalvular aortic stenosis. J. Thorac. Cardiovasc. Surg. 1984;87(6):887-893. DOI: 10.1016/s0022-5223(19)38418-1.
- Reid K. The anatomy of the sinus of Valsalva. Thorax. 1970;25(1):79-85. DOI: 10.1136/thx.25.1.79.
- Gutermann H., Pettinari M., Van Kerrebroeck C., Vander Laenen M., Engelen K., Fret T. et al. Myectomy and mitral repair through the left atrium in hypertrophic obstructive cardiomyopathy: The preferred approach for contemporary surgical candidates? J. Thorac. Cardiovasc. Surg. 2014;147(6):1833-1836. DOI: 10.1016/j.jtcvs.2013.07.024.
- Borisov K. Right ventricle myectomy. Ann. Cardiothorac. Surg. 2017;6(4):402-409. DOI: 10.21037/acs.2017.07.10.
- Kotkar K., Said S., Schaff H. Transapical approach for myectomy in hypertrophic cardiomyopathy. Ann. Cardiothorac. Surg. 2017;6(4):419-422. DOI: 10.21037/acs.2017.06.02.
- Elmistekawy E., Lapierre H., Mesana T., Ruel M. Apico-aortic conduit for severe aortic stenosis: Technique, applications, and systematic review. J. Saudi Heart Assoc. 2010;22(4):187-194. DOI: 10.1016/j. jsha.2010.06.003.


