Дозиметрическое обеспечение клинических исследований альфа- излучающего радиофармпрепарата 225Ас-ПСМА-617 при проведении радионуклидной терапии метастатического кастрационно-резистентного рака предстательной железы
Автор: Степаненко В.Ф., Богачева В.В., Петухов А.Д., Дорохов А.В., Кочетова Т.Ю., Сигов М.А., Спиченкова О.Н., Власова О.П., Крылов В.В., Смолярчук М.Я., Шуринов А.Ю., Минаева Н.Г., Иванов С.А., Шегай П.В., Каприн А.Д.
Рубрика: Научные статьи
Статья в выпуске: 3 т.34, 2025 года.
Бесплатный доступ
Для расчётов доз внутреннего облучения опухолей и органов риска пациентов при клинических исследованиях радиофармпрепарата (РФП) 225Ac-ПСМА-617 использовался специализированный программный комплекс и пакет баз данных, разработанный в ФГБУ «НМИЦ радиологии» Минздрава России. Расчёты проводились на основе общей методологии Medical Internal Radiation Dose Committee (MIRD). Визуализация опухолевых образований (очагов) и органов риска пациентов выполнена методом ОФЭКТ/КТ (система Discovery NM/CT 670) с коллиматором высоких энергий при регистрации фотопиков гаммаизлучения 221Fr (218 кэВ) и 213Bi (444 кэВ) в дискретные моменты времени после введения РФП (172 ч). Величины эквивалентных доз внутреннего облучения были определены для всех визуализированных очагов и органов риска пациентов (околоушные и подчелюстные слюнные железы, почки, селезёнка, печень). Относительная биологическая эффективность для альфачастиц была принята равной 5. Установлена большая вариабельность величин индивидуальных эквивалентных доз облучения очагов при одной и той же введённой активности РФП: величины доз различаются в 79 раз в зависимости от индивидуальных объёмов очагов и от индивидуальных параметров фармакокинетики у пациентов. Вместе с тем дозы облучения очагов имеют тенденцию к увеличению с увеличением вводимой активности РФП и находятся в следующих пределах: 733 Зв (планируемая для введения активность – 6 МБк) и 6,455 Зв (планируемая для введения активность – 9 МБк). Индивидуальные дозы облучения органов риска также существенно различаются и находятся в следующих пределах: 0,11,5 Зв (слюнные железы) и 0,688,8 Зв (почки, селезёнка, печень), что значительно меньше общепринятых дозовых ограничений в радиотерапии («commonly applied dose constraints»). Полученные данные необходимы для анализа эффективности и безопасности РФП 225АсПСМА617 и позволяют оптимизировать выбор активности РФП индивидуально для каждого пациента.
Дозиметрия внутреннего облучения, индивидуальные дозы облучения, радиофармпрепараты, альфа-излучатели, 225Ас, лучевая терапия, клинические исследования, ядерная медицина
Короткий адрес: https://sciup.org/170210835
IDR: 170210835 | УДК: 616.65-006.6-033.2-085.849.2:546.797.02.225 | DOI: 10.21870/0131-3878-2025-34-3-30-42
Текст научной статьи Дозиметрическое обеспечение клинических исследований альфа- излучающего радиофармпрепарата 225Ас-ПСМА-617 при проведении радионуклидной терапии метастатического кастрационно-резистентного рака предстательной железы
Рак предстательной железы (РПЖ) является вторым в мире по распространённости и шестой по значимости причиной смерти от онкологических заболеваний среди мужчин [1]. В России РПЖ в структуре общей онкологической заболеваемости мужского населения также занимает второе место [2, 3]. Радионуклидная терапия с использованием высокоаффинного к простат-специфическому мембранному антигену (ПСМА) альфа-излучающего лечебного РФП
Степаненко В.Ф.* – зав. лаб., д.б.н., проф.; Богачева В.В . – в.н.с., к.б.н.; Петухов А.Д. – с.н.с., к.б.н.; Дорохов А.В. – инж.-иссл.; Кочетова Т.Ю. – врач-радиолог; Сигов М.А. – зав. отд.; Спиченкова О.Н. – вед. инж.; Власова О.П. – в.н.с., к.б.н.; Крылов В.В. – зав. отд., д.м.н.; Смолярчук М.Я. – врач-радиолог; Шуринов А.Ю. – с.н.с., к.м.н.; Минаева Н.Г. – уч. секр., к.б.н.; Иванов С.А. – директор, чл.-корр. РАН, д.м.н., проф. кафедры РУДН. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России. Шегай П.В. – зам. ген. директора, к.м.н.; Каприн А.Д. – ген. директор, директор МНИОИ им. П.А. Герцена, зав. каф. РУДН, акад. РАН, д.м.н., проф. ФГБУ «НМИЦ радиологии» Минздрава России.
225Ас-ПСМА-617 является многообещающей альтернативой для пациентов с метастатическим ка-страционно-резистентным раком предстательной железы, для которых исчерпаны все стандартные методы лечения, а также терапия с применением бета-излучающего РФП 177Lu-ПСМА-617 [4-6].
Плотноионизирующее альфа-излучение обладает высокой линейной передачей энергии (ЛПЭ), что обеспечивает, в отличие от редкоионизирующего бета- и фотонного излучения, высокую относительную биологическую эффективность (ОБЭ) альфа-частиц, связанную с большой вероятностью индукции плохо репарируемых двунитиевых разрывов ДНК, независимостью цитотоксического действия от степени оксигенации клеток или фазы клеточного цикла [7]. Поэтому альфа-излучающие радионуклиды в составе РФП, например, 225Ас-ПСМА-617, обладают рядом преимуществ по сравнению с бета-излучающими РФП, например, 177Lu-ПСМА-617, особенно в отношении воздействия на радиорезистентные опухолевые клетки [8].
В результате распада 225Ac образуется цепочка дочерних радионуклидов, испускающих в общей сложности, помимо бета-частиц со средней/максимальной энергиями от 198 кэВ/644 кэВ до 656 кэВ/1,944 МэВ, также альфа-частицы с энергиями 5,75 МэВ (100%), 6,297 МэВ (100%), 7,065 МэВ (100%), 8,375 МэВ (97,8%) и 5,750 МэВ (2,2%). Количественная визуализация распределения и динамики РФП 225Ас-ПСМА-617 в организме пациентов проводится, как правило, методом ОФЭКТ/КТ по фотопикам энергий гамма-квантов, излучаемых дочерними радионуклидами: 221Fr (период полураспада T 1/2 =4,9 мин, гамма-кванты с энергией 218 кэВ и интенсивностью 11,6%) и/или 213Bi (период полураспада T 1/2 =46 мин, гамма-кванты с энергией 444 кэВ и интенсивностью 26,1%) [9-11].
Наличие в цепочке распада 225Ac дочерних радионуклидов, излучающих плотноионизиру-ющие альфа-частицы, отличающиеся по величине ОБЭ от редкоионизирующих бета-частиц [12] и гамма-квантов, требует оценки эквивалентных доз облучения от этих компонент с учётом ОБЭ альфа-частиц.
Материалы и методы
В соответствии с рекомендациями Международной комиссии по радиологическим единицам и измерениям [13] для оценок поглощённых доз внутреннего облучения опухолевых образований (очагов) и органов риска применён общий подход, предлагаемый Medical Internal Radiation Dose Committee (MIRD) [14]. Непосредственно для наших дозиметрических расчётов использован комплекс программ и баз данных, разработанных в ФГБУ «НМИЦ радиологии» Минздрава России [15-21]. Расчёт пространственных распределений поглощённой энергии ионизирующего излучения в биологических структурах различной формы и размеров при внутреннем облучении альфа-частицами, электронами и фотонами с различными энергиями проводился с применением унифицированного подхода, описанного в работе [22].
Количественная визуализация очагов и органов риска пациентов выполнена методом ОФЭКТ/КТ на комбинированной системе Discovery NM/CT 670 при следующих параметрах сканирования: коллиматор высоких энергий, регистрация фотопиков гамма-излучения 221Fr (218 кэВ) и 213Bi (444 кэВ). Для оценки динамики активности 225Ас в очагах и визуализируемых органах риска (околоушные и подчелюстные слюнные железы, почки, селезёнка, печень) сканирование проводилось через 1-4 ч, 19-24 ч и 68-72 ч после введения РФП 225Ас-ПСМА-617.
Результаты
Учёт особенностей цепочки распада 225Ac
Радионуклид 225Ac (T 1/2 =10 сут) при своём распаде до стабильного 209Bi образует разветвлённую цепочку дочерних радионуклидов с существенно меньшими периодами физического полураспада: 221Fr (T 1/2 =4,9 мин); 217At (T 1/2 =32 мс); 213Bi (T 1/2 =46 мин); 213Po (T 1/2 =4,2 мкс); 209Tl (T 1/2 =2,2 мин); 209Pb (T 1/2 =3,3 ч) (см. рис. 1 с обобщённой, на основании данных работ [9, 10, 23], схемой распада 225Ас).
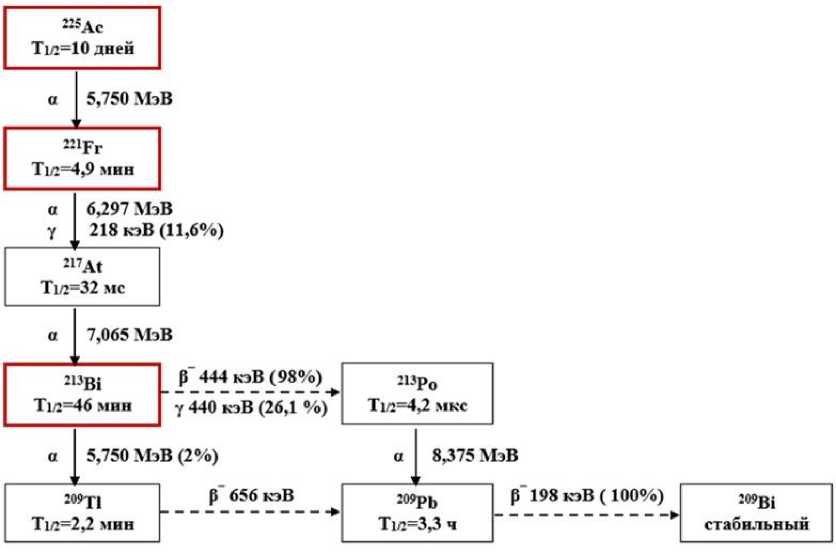
Рис. 1. Обобщённая схема распада 225Ac с указанием видов, энергий и интенсивностей ионизирующего излучения материнского и дочерних радионуклидов.
То обстоятельство, что периоды физического полураспада дочерних радионуклидов 225Ac существенно меньше по своей величине периода физического полураспада материнского 225Ac является весьма важным, т.к. после радиохимического выделения 225Ac распад его дочерних радионуклидов достаточно быстро приходит в равновесное состояние с распадом материнского радионуклида. Это обстоятельство используется при оценках поглощённых доз внутреннего облучения очагов и органов риска пациентов. Данный подход соответствует принятой практике оценок доз внутреннего облучения очагов и органов риска пациентов при терапевтическом применении РФП с 225Ac (см., например, [4, 24].
Эквивалентные дозы облучения очагов и органов риска при проведении радионуклидной терапии РФП 225Ас-ПСМА-617
На рис. 2-8 приведены типичные примеры доз облучения очагов и органов риска при проведении радионуклидной терапии РФП 225Ас-ПСМА-617 пациентам, включённым в Фазу 1 клинических исследований. Указаны эквивалентные дозы облучения с учётом ОБЭ=5 для альфа- излучения 225Ac и его дочерних радионуклидов [7, 13, 25, 26]. Оценки доз проведены с использованием комплекса программ и баз данных, разработанных в ФГБУ «НМИЦ радиологии» Мин- здрава России [22, 27].
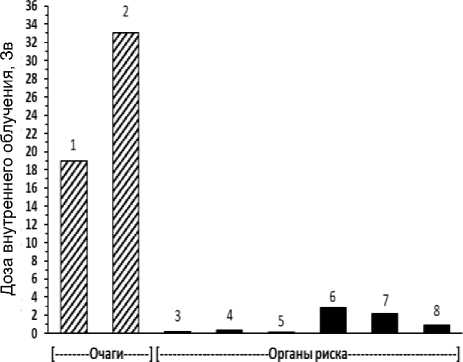
Рис. 2. Пациент Ф. Масса тела 82 кг. Препарат 225АС-ПСМА-617. Клинические исследования (1 фаза). Введённая активность 6,276 МБк. Очаги (локализация метастазов): 1 – очаг в S6 печени, Д=19 Зв, V=28 мл;
2 – портокавальный лимфоузел, Д=33 Зв, V=15 мл. Визуализированные органы риска: 3 – правая околоушная слюнная железа, Д=0,21 Зв, V=19 мл; 4 – левая околоушная слюнная железа, Д=0,35 Зв, V=20 мл; 5 – правая поднижнечелюстная слюнная железа, Д=0,1 Зв, V=11 мл;
6 – правая почка, Д=2,8 Зв, V=390 мл; 7 – левая почка, Д=2,2 Зв, V=240 мл; 8 – селезёнка, Д=0,9 Зв, V=180 мл.
Левая поднижнечелюстная слюнная железа не визуализируется.
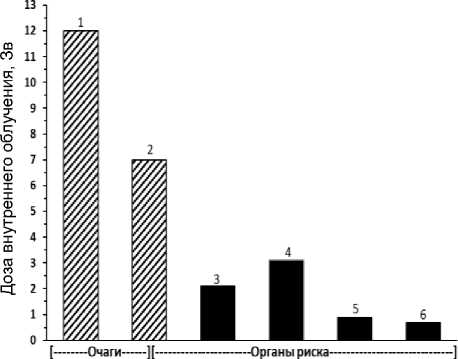
Рис. 3. Пациент В. Масса тела 70 кг. Препарат 225АС-ПСМА-617. Клинические исследования (1 фаза). Введённая активность 6,003 МБк. Очаги (локализация метастазов): 1 – правая вертлужная впадина, Д=12 Зв, V=47 мл; 2 – очаг в грудном отделе позвоночника Th9, Д=7 Зв, V=43 мл. Визуализированные органы риска: 3 – правая почка, Д=2,1 Зв, V=180 мл; 4 – левая почка, Д=3,1 Зв, V=190 мл; 5 – селезёнка, Д=0,9 Зв, V=250 мл;
6 – печень, Д=0,68 Зв, V=1770 мл. Левая и правая околоушные слюнные железы, а также левая и правая поднижнечелюстные слюнные железы не визуализируются.
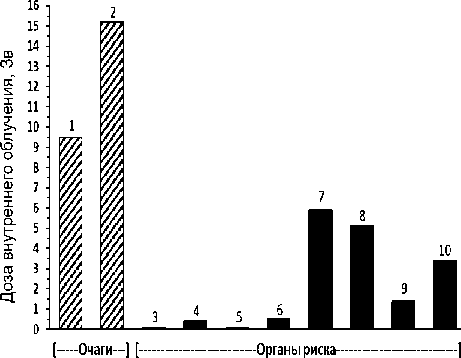
Рис. 4. Пациент Н. Масса тела 82 кг. Препарат 225АС-ПСМА-617. Клинические исследования (1 фаза). Введённая активность 9,00 МБк. Очаги (локализация метастазов): 1 – тело L3 позвонка, Д=9,5 Зв, V=52 мл;
2 – левый надключичный л/у, Д=15,2 Зв, V=33 мл. Визуализированные органы риска: 3 – правая околоушная слюнная железа, Д=0,1 Зв, V=19 мл; 4 – левая околоушная слюнная железа, Д=0,43 Зв, V=19 мл; 5 – правая поднижнечелюстная слюнная железа, Д=0,1 Зв, V=10 мл;
6 – левая поднижнечелюстная слюнная железа, Д=0,52 Зв, V=12 мл; 7 – правая почка, Д=5,9 Зв, V=210 мл; 8 – левая почка, Д=5,1 Зв, V=250 мл; 9 – селезёнка, Д=1,4 Зв, V=190 мл; 10 – печень, Д=3,4 Зв, V=1780 мл.
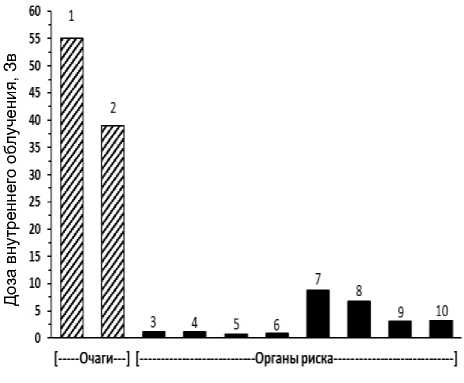
Рис. 5. Пациент П. Масса тела 55 кг. Препарат 225АС-ПСМА-617. Клинические исследования (1 фаза). Введённая активность 8,958 МБк. Очаги (локализация метастазов): 1 – очаг в теле L2, Д=55 Зв, V=37 мл; 2 – очаг в подвздошно-ободочных л/у, Д=39 Зв, V=110 мл. Визуализированные органы риска: 3 – правая околоушная слюнная железа, Д=1,1 Зв, V=16 мл; 4 – левая околоушная слюнная железа, Д=1,2 Зв, V=7,3 мл; 5 – правая поднижнечелюстная слюнная железа, Д=0,68 Зв, V=12 мл; 6 – левая поднижнечелюстная слюнная железа, Д=0,83 Зв, V=11 мл; 7 – правая почка, Д=8,8 Зв, V=180 мл; 8 – левая почка, Д=6,7 Зв, V=180 мл; 9 – селезёнка, Д=3,1 Зв, V=310 мл; 10 – печень, Д=3,2 Зв, V=1580 мл.
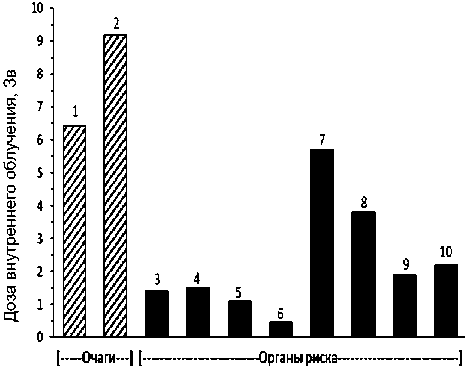
Рис. 6. Пациент Б. Масса тела 83,3 кг. Препарат 225АС-ПСМА-617. Клинические исследования (1 фаза). Введённая активность 9,134 МБк. Очаги (локализация метастазов): 1 – очаг в левой подвздошной кости, Д=6,4 Зв, V=102 мл; 2 – очаг лонной правой кости, Д=9,2 Зв, V=22 мл. Визуализированные органы риска: 3 – правая околоушная слюнная железа, Д=1,4 Зв, V=19 мл; 4 – левая околоушная слюнная железа, Д=1,5 Зв, V=18 мл; 5 – правая поднижнечелюстная слюнная железа, Д=1,1 Зв, V=12 мл; 6 – левая поднижнечелюстная слюнная железа, Д=0,47 Зв, V=12 мл;
7 – правая почка, Д=5,7 Зв, V=140 мл; 8 – левая почка, Д=3,8 Зв, V=170 мл; 9 – селезёнка, Д=1,9 Зв, V=250 мл;
10 – печень, Д=2,2 Зв, V=1430 мл.
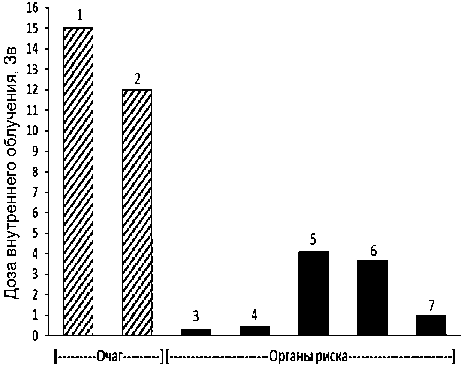
Рис. 7. Пациент: А. Масса тела 93,5 кг. Препарат 225АС-ПСМА-617. Клинические исследования (1 фаза). Введённая активность 6,299 МБк. Очаги (локализация метастазов): 1 – очаг в теле позвонка L3, Д=15 Зв, V=49 мл; 2 – очаг в грудине, Д=12 Зв, V=29 мл. Визуализированные органы риска: 3 – правая околоушная слюнная железа, Д=0,29 Зв, V=27 мл; 4 – левая околоушная слюнная железа, Д=0,47 Зв, V=23 мл; 5 – правая почка, Д=4,1 Зв, V=205 мл; 6 – левая почка, Д=3,7 Зв, V=215 мл; 7 – печень, Д=0,96 Зв, V=1490 мл. Левая и правая поднижнечелюстные слюнные железы не визуализируются.
Обсуждение
При расчётах доз внутреннего облучения очагов и органов риска учитывали вклад от излучений всех компонент ионизирующего излучения 225Ac и дочерних радионуклидов, включая альфа-излучение. Поэтому при расчётах величин доз внутреннего облучения следует учитывать ОБЭ альфа-излучения. Данному обстоятельству необходимо уделить специальное внимание.
На рис. 8 показаны величины ЛПЭ в зависимости от расстояния до источника в биологической ткани для основных групп альфа-частиц, излучаемых 225Ac и его дочерними радионуклидами. В подписи к рисунку указаны соответствующие величины пробегов альфа-частиц в биологической ткани.
Как известно, величина ЛПЭ определяет ОБЭ ионизирующего излучения. Кроме того, оценки биологической эффективности различны для разных биологических эффектов (например, стохастических или детерминистических), наблюдаемых для разных типов клеток, облучаемых в различных экспериментальных условиях (например, in vivo или in vitro ).
В связи с большим интересом к 225Ac как к перспективному РФП, вопросы, связанные с оценкой биологической эффективности его излучений при внутреннем облучении, специально обсуждались в литературе.
Альфа-излучение 225Ac и его дочерних радионуклидов имеет короткий пробег в биологической такни и большую величину ЛПЭ, неравномерно распределённую вдоль пробегов альфа-частиц (рис. 8), что может вызвать существенно большие радиобиологические эффекты, если сравнивать их с эффектами от бета- или гамма-излучения. Действительно «bystander» эффект наблюдается при терапии альфа-частицами даже при весьма умеренных поглощённых дозах, а эффективность терапии с использованием альфа-источников меньше зависит от особенностей фракционирования суммарной дозы, а также от мощности поглощённой дозы и степени гипоксии опухоли, если сравнивать её с эффективностью терапии бета-излучателями [25].
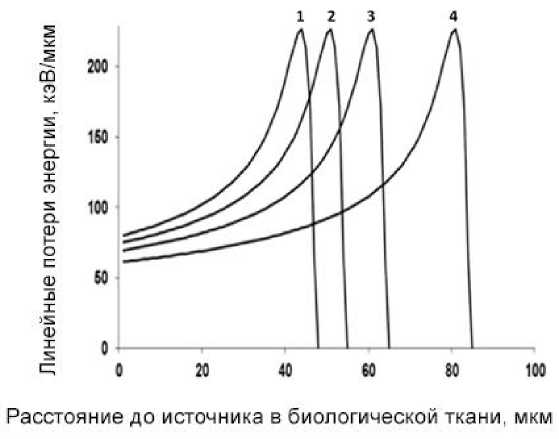
Рис. 8. Линейные потери энергии (ЛПЭ, кэВ/мкм) в зависимости от расстояния до источника в биологической ткани (Х, мкм) для основных групп альфа-частиц, излучаемых 225Ac и его дочерними радионуклидами: 1 – альфа-частицы 225Ac (5,750 МэВ, пробег – 47 мкм, начальная ЛПЭ – 80 кэВ/мкм); 2 – альфа-частицы 221Fr (6,297 МэВ, пробег – 54 мкм, начальная ЛПЭ – 75 кэВ/мкм); 3 – альфа-частицы 217At (7,065 МэВ, пробег – 64 мкм, начальная ЛПЭ – 69 кэВ/мкм); 4 – альфа-частицы 213Bi/213Po (8,375 МэВ, пробег – 85 мкм, начальная ЛПЭ – 61 кэВ/мкм).
Международная комиссия по радиологической защите указывает на величину ОБЭ, равной 20 для альфа-излучателей. Однако здесь необходимо подчеркнуть, что величина ОБЭ=20 относится только к стохастическим биологическим эффектам и поэтому данную рекомендацию не следует применять при использовании альфа-излучателей с терапевтическими целями, когда эффекты опухолевого ответа, а также токсические эффекты являются детерминистическими. Действительно, по результатам международного совещания о применении альфа-излучателей для радиотерапии, проведённого под эгидой Министерства энергетики США, было рекомендовано использовать величину ОБЭ 3-5 в отношении детерминистических эффектов для альфа-излучателей [25]. Это согласуется с последующими рекомендациями использовать ОБЭ=5 [7, 13, 26] как наиболее подходящую величину с учётом средней ЛПЭ альфа-частиц, излучаемых радионуклидами в цепочке распада 225Ac (рис. 1). В наших расчётах была принята величина ОБЭ=5, что, судя по данным литературы, считается оптимальным для детерминированных эффектов 225Ас-ПСМА-617 по сравнению с эффектами, наблюдаемыми при терапии бета-излучающими РФП на основе ПСМА.
Заключение
Величины эквивалентных доз внутреннего облучения определены для всех визуализированных опухолевых образований и органов риска пациентов (околоушные и подчелюстные слюнные железы, почки, селезёнка, печень).
Анализ распределения величин индивидуальных эквивалентных доз внутреннего облучения очагов показал большую вариабельность их величин при одной и той же введённой активности РФП: величины доз различаются в 7-9 раз в зависимости от индивидуальных объёмов очагов и от индивидуальных параметров фармакокинетики у пациентов. Вместе с тем, дозы облучения очагов имеют тенденцию к увеличению с увеличением вводимой активности РФП, и находятся в следующих пределах: 7-33 Зв (планируемая для введения активность 6 МБк) и 6,4-55 Зв (планируемая для введения активность 9 МБк). Индивидуальные дозы облучения органов риска также существенно различаются и находятся в следующих пределах: 0,1-1,5 Зв (слюнные железы) и 0,68-8,8 Зв (почки, селезёнка, печень), что значительно меньше общепринятых дозовых ограничений в радиотерапии («commonly applied dose constraints»).
Полученные данные необходимы для анализа эффективности и безопасности клинического применения РФП 225Ас-ПСМА-617 и позволяют оптимизировать выбор активности РФП индивидуально для каждого пациента.


