ДВС-синдром в практике терапевта: клинико-прогностические аспекты
Автор: Муркамилов И.Т., Айтбаев К.А., Юсупов Ф.А., Райимжанов З.Р., Юсупова З.Ф., Юсупова Т.Ф., Хакимов Ш.Ш., Нурматов Т.А., Солижонов Ж.И., Ыманкулов Д.С., Хабибуллаев К.К.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 2 т.11, 2025 года.
Бесплатный доступ
Синдром диссеминированного внутрисосудистого свёртывания (ДВС-синдром) представляет собой полиэтиологический клинико-лабораторный симптомокомплекс, который всегда является вторичным и сопровождает течение многих заболеваний внутренних органов. Основу ДВС-синдрома составляют патологическая активация системы гемостаза и тромбинемия, что приводит к генерализованному внутрисосудистому микротромбообразованию и нарушению микроциркуляции. Случаи внезапного развития ДВС-синдрома на фоне полного здоровья в литературе не описаны. По клиническому течению различают острый, подострый и хронический варианты синдрома. Патологический процесс проходит 4 стадии: гиперкоагуляция; коагулопатия потребления; выраженный дефицит прокоагулянтов вплоть до полного отсутствия фибриногена; восстановительная. В зависимости от тяжести симптомов выделяют компенсированный и декомпенсированный варианты, а также явный (overt) и неявный (non-overt) ДВС-синдром. Описание клинического случая. Пациент, 43 года, житель сельской местности, поступил в отделение реанимации с жалобами на трудно контролируемое носовое кровотечение, изменение цвета мочи («мясные помои»), подкожные кровоизлияния, мышечную слабость, головные боли и повышение артериального давления. Ранее перенесённых заболеваний и травм пациент не отмечал, эпидемиологический анамнез - отрицательный. Симптомы появились на фоне работы в ночное время на ферме, сопровождавшейся эпизодическими страхами. Многократные консультации ЛОР-врача, уролога и гематолога по поводу носового кровотечения и гематурии не выявили явной первичной причины. Анализы крови показывали анемию, лейкоцитоз, лимфопению и ускоренное СОЭ, а анализ мочи - протеинурию. Биохимическое исследование крови выявило гипергликемию и признаки ухудшения азотовыделительной функции почек. Признаки острой инфекции, лимфопролиферативных заболеваний и печёночной патологии исключены. Исследование системы гемостаза подтвердило отсутствие полноценного сгустка крови. В первые дни госпитализации продолжались носовые кровотечения и макрогематурия. Благодаря комплексной терапии, включающей гемостатические препараты, свежезамороженную плазму, эритроцитарную массу и глюкокортикоиды, удалось стабилизировать состояние пациента, восстановить параметры гемостаза и нормализовать результаты анализов крови и мочи. Пациент выписан с улучшением и стабильной гемодинамикой.
Двс-синдром, гипокоагуляция, фибриноген, повреждение эндотелия, стресс
Короткий адрес: https://sciup.org/14132077
IDR: 14132077 | УДК: 616-005.1, | DOI: 10.33619/2414-2948/111/28
Текст научной статьи ДВС-синдром в практике терапевта: клинико-прогностические аспекты
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616-005.1;616-005.1-08
В современной клинической практике значительное внимание уделяется проблемам нарушения гемостаза и гемореологии [1, 2].
Синдром диссеминированного внутрисосудистого свёртывания крови (ДВС-синдром, DIC — Disseminated Intravascular Coagulation) представляет собой сложный клиниколабораторный феномен, характеризующийся системными нарушениями гемостаза [3].
ДВС-синдром чаще всего развивается на фоне критических состояний и отличается прогрессирующим течением [4].
Следует подчеркнуть, что этот синдром всегда является вторичным процессом, отражающим основное заболевание и его тяжесть [5].
В большинстве случаев прогноз неблагоприятен, так как ДВС-синдром выступает завершающей стадией тяжёлых патологических процессов, часто необратимых [6].
Не случайно J. A. Spero охарактеризовал ДВС-синдром как «синдром приближения смерти» [7].
Цель исследования. Проанализировать литературные данные о ДВС-синдроме и представить результаты собственного клинического наблюдения, связанного с развитием острого ДВС-синдрома у мужчины 43 лет.
История изучения. История изучения ДВС-синдрома начинается с середины XX века, когда зарубежные исследователи впервые описали клинические случаи нарушений гемостаза у беременных женщин. Летальность при остром и подостром течении ДВС-синдрома остаётся высокой: даже при активной терапии смертность достигает 50% [8].
Клиническая сложность ДВС-синдрома заключается в его диагностике, которая чаще всего происходит на стадии гипокоагуляции. Эта стадия характеризуется носовыми и десневыми кровотечениями, а также кровотечениями из мест инъекций. Кровоточивость может носить петехиальный или гематомный характер [1, 2, 6].
З. С. Баркаган и А. П. Момот подчёркивают, что хронический ДВС-синдром имеет менее выраженные клинические проявления. Для него характерна длительная волнообразная активация фибринации, сопровождающаяся стойкой тромбинемией и органной дисфункцией. При этом геморрагические симптомы минимальны и зачастую ограничиваются поражением одного органа, тогда как тромбозы могут возникать в крупных венах [4].
Патогенез и эпидемиология. ДВС-синдром характеризуется неконтролируемым и чрезмерным расходом прокоагулянтов и тромбоцитов, а также истощением антикоагулянтной системы и фибринолиза [1, 3, 4].
Несмотря на значимость этой патологии, распространённость ДВС-синдрома в терапевтической практике остаётся недостаточно изученной. Согласно данным, представленным в источнике [6], клинически значимый ДВС-синдром нередко возникает в критических ситуациях (Рисунок 1).
В частности, в онкологии при солидных опухолях его частота достигает 34%. При тяжёлых травмах тканей вероятность развития этого состояния составляет около 30%. У пациентов с заболеваниями артерий мышечно-эластического типа ДВС-синдром встречается в 11% случаев. Для инфекционных заболеваний и акушерской патологии этот показатель составляет 6% и 3% соответственно. Зарубежные исследования также подтверждают высокую частоту ДВС-синдрома среди пациентов с политравмой [7].
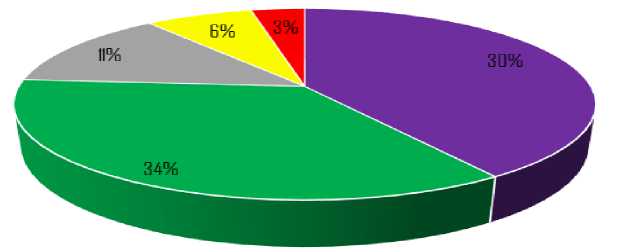
Рисунок 1. Частота встречаемости ДВС-синдрома в клинической практике
По имеющимся сведениям [6], к настоящему времени описано более 100 заболеваний и патологических состояний, при которых потенциально и с различной частотой может развиться ДВС-синдром.
Предрасполагающие факторы возникновения ДВС-синдрома. В клинической практике внезапный стресс, гиперкатехоламинемия, ожоги, травма, тяжелая инфекция, двусторонняя пневмония, острая дыхательная недостаточность, обширный инфаркт миокарда, церебральный инсульт, иммуновоспалительные заболевания и опухоли повышают риск ДВС-синдрома. Факторы коагуляции и их клиническое значение приведены в работе В. В. Никонова и соавт. [9]. Факторы свертывания крови представлены в Таблице 1.
Клиника ДВС-синдрома. Основу ДВС-синдрома составляют стимуляция коагуляционного процесса, активация тромбоцитарной агрессии и поражение эндотелия сосудистой стенки. В клинической картине доминируют тромбоэмболические и геморрагические проявления [4].
Таблица 1
ФАКТОРЫ СВЕРТЫВАНИЯ КРОВИ
Факторы
Фибриноген (I)
Протромбин (II)
Тканевой фактор (III)
Проакцелерин (V)
Проконвертин (VII)
Антигемофильный фактор (VIII)
Фактор Кристмана (IX)
Фактор Стюарта (X)
Предшественник плазменного тромбопластина (XI)
Фактор Хагемана (XII)
Фибринстабилизирующий фактор (XIII)
Прекалликреин
Высокомолекулярный кининоген
Как отмечают исследователи, ДВС-синдром проявляется в различных гемостазиологических формах, степенях тяжести и клинических проявлениях[ 9-11].
В клинической практике принято различать локальные и диссеминированные проявления ДВС-синдрома. К последним относятся нарушения функции почек, легких, печени, сердца и головного мозга. У пациентов с ДВС-синдромом наблюдаются гиперкреатининемия, повышение активности печеночных трансаминаз, нарушения кислотноосновного состояния и электролитного баланса [12].
В ряде случаев возникают острые эрозии, язвы и кровотечения из желудочнокишечного тракта [8].
Наиболее опасными являются интрапаренхиматозные кровоизлияния в головной мозг, надпочечники и легкие. При морфологическом исследовании у пациентов с ДВС-синдромом обнаруживаются дистрофия и/или некроз, кровоизлияния и полнокровие в сосудах надпочечников [13].
Надпочечники при ДВС-синдроме рассматриваются как мишень, что, в свою очередь, ведет к расстройству регуляции компенсаторно-приспособительных реакций организма и усложнению течения заболевания. В другой публикации описан случай пациента 58 лет, умершего от заражения новой коронавирусной инфекцией, осложненной пневмонией и ДВС-синдромом. При гистологическом исследовании у этого пациента обнаружены генерализованные гемореологические расстройства и участки некроза и кровоизлияний в надпочечниках [14].
ДВС-синдром многолик. Местные кровотечения обусловлены локальными повреждениями, которые связаны с общими нарушениями в системе фактора Хагемана. Как было отмечено ранее, у пациентов с ДВС-синдромом наблюдаются петехиальные кровоизлияния, гематомы, а также носовые и почечные кровотечения. Согласно опубликованным данным, кровотечения при ДВС-синдроме возникают на фоне гипоксии, активации кининовой системы, повреждения эндотелия и снижения числа тромбоцитов [15].
Гипокоагуляция при ДВС-синдроме связана с потреблением факторов свертывания, блокировкой фибриногена и тромбоцитов, образованием продуктов деградации фибрина, токсическим влиянием продуктов протеолиза и одновременным повышением проницаемости сосудистой стенки [9].
Классификация ДВС-синдрома. ДВС-синдром классифицируется по клиническому течению и скорости развития на острый, подострый и хронический [16, 17].
По стадиям развития выделяют: I стадия — гиперкоагуляция, II стадия — коагулопатия потребления, III стадия — резкое снижение в крови всех прокоагулянтов, вплоть до полного отсутствия фибриногена, и IV стадия — восстановительная. По фазам различают компенсированный и декомпенсированный ДВС-синдром. ДВС-синдром также делится на явный (overt) и неявный (non-overt). Следует отметить, что явный ДВС-синдром, как правило, имеет острый характер или отличается быстрым развитием, тогда как при неявном ДВС-синдроме присутствуют лабораторные паттерны заболевания или хроническое воспаление.
Некоторые исследователи выделяют следующие фенотипы ДВС-синдрома: фибринолитический (часто встречающийся в акушерской патологии, политравме и пластической хирургии), гипокоагуляционный, гиперкоагуляционный (тромботический) и бессимптомный [6, 18].
Важно отметить, что в процессе развития и прогрессирования ДВС-синдрома возможен переход одного фенотипа в другой. Клиницисты должны помнить, что ДВС-синдром всегда является вторичным, дозозависимым, индивидуальным и мультисистемным. Также существуют лабораторные фенотипы ДВС-синдрома: тромбозы (гипертромбинемия) и кровотечения (гиперфибринолиз).
Диагностика ДВС-синдрома. В ранней диагностике и оценке динамики развития ДВС-синдрома лабораторные исследования играют важную роль. Перечень лабораторных тестов, используемых при ДВС-синдроме, представлена в Таблице 2. Важно отметить, что лабораторные параметры, характерные для ДВС-синдрома, отличаются по чувствительности и специфичности [6].
Таблица 2
ЛАБОРАТОРНЫЕ КРИТЕРИИ ДВС-СИНДРОМА [11]
|
Показатели |
Референтные значения |
|
Протромбиновый индекс, % |
80-100 |
|
Активированное частичное тромбопластиновое время, сек |
38-55 |
|
Этаноловый тест, + |
0 |
|
Антитромбин III, % |
90-110 |
|
Коэффициент тромбоопасности |
0,7-1,4 |
|
Тромбоциты, х109/л |
180-320 |
|
Фибринолитическая активность, мин |
180-260 |
|
Плазминоген, мг/мин/л |
225-235 |
|
Коэффициент плазминообразования |
0,5-1,6 |
У пациентов с подозрением на ДВС-синдром исследуются тромбоциты, D-димер, антитромбин III, протеин С, антиплазмин, лактатдегидрогеназа, растворимые фибринмономерные комплексы, продукты деградации фибриногена и фибрина, а также тромбин-антитромбиновый комплекс [19].
Тромбоцитопения, то есть снижение числа тромбоцитов в периферической крови, встречается в 98% случаев ДВС-синдрома. При молниеносном течении ДВС-синдрома в анализе крови регистрируется крайне резкое снижение числа тромбоцитов (<25×109/л), вплоть до полного отсутствия. Однако нормальное или повышенное число тромбоцитов в периферической крови не исключает ДВС-синдром. Стоит отметить, что для хронической формы ДВС-синдрома характерно повышение числа тромбоцитов в периферической крови.
При подозрении на ДВС-синдром, особенно на стадии гиперкоагуляции, целесообразно исследовать уровень антитромбина III, так как он является эндогенным антикоагулянтом. Антитромбин III способен ингибировать плазменные факторы свертывания крови и кофакторы гепарина. Уровень антитромбина III ниже 80% рассматривается как фактор тромбогенности и отражает степень истощения антикоагулянтной системы. Сниженный сывороточный уровень антитромбина III свидетельствует о ДВС-синдроме, что связано с его потреблением для инактивации тромбина и активированных факторов свертывания [20, 21]. Важно помнить, что на фоне терапии ДВС-синдрома снижение уровня антитромбина III служит маркером неблагоприятного прогноза.
Другим важнейшим лабораторным маркером ДВС-синдрома является D-димер крови. Так, повышение концентрации D-димера крови при ДВС-синдроме свидетельствует о высокой тромбинемии и повышенном потреблении фибриногена [22].
Согласно данным литературы, при ДВС-синдроме отмечается снижение концентрации протеина С, антиплазмина, плазминогена и фибриногена [23].
Клиницисты должны помнить о сходстве между ДВС-синдромом и катастрофическим антифосфолипидным синдромом. Для последнего характерны образование микротромбов и тромбоцитопения [24].
Также следует учитывать возможность развития катастрофического антифосфолипидного синдрома в сочетании с ДВС-синдромом [24].
Генерализованные кровоизлияния со снижением числа тромбоцитов и низким уровнем фибриногена специфичны для ДВС-синдрома, что позволяет отличать его от катастрофического антифосфолипидного синдрома. Важно помнить, что ДВС-синдром у пациентов с новой коронавирусной инфекцией имеет более неблагоприятный фенотип [25]. Известно, что на ранних этапах развития ДВС-синдрома наблюдается сниженный уровень ингибитора активатора плазминогена-1 [26, 27], тогда как на продвинутых стадиях этот уровень повышается, что также является маркером неблагоприятного прогноза заболевания.
Клинический случай. О пациенте. Мужчина, 43 года, житель сельской местности, госпитализирован с жалобами на трудно контролируемые носовые кровотечения, изменение цвета мочи по типу «мясных помоев», появление подкожных кровоизлияний в местах контакта, мышечную слабость, головные боли и повышение артериального давления (АД).
Анамнез заболевания. Пациент связывает начало болезни с пережитым стрессом, который возникал во время ночных смен на животноводческой ферме, где он работал в одиночестве. Первым симптомом стали носовые кровотечения, продолжавшиеся около семи дней. Впоследствии добавились изменения цвета мочи (по типу «мясных помоев» и пива) и боли в поясничной области. Несмотря на ухудшение состояния, пациент не смог своевременно обратиться за медицинской помощью из-за невозможности оставить работу. Позже он посетил терапевта, ЛОР-врача и уролога. При обследовании гематологом выявлены анемия, лимфопения, лейкоцитоз, гипергликемия натощак, умеренное снижение экскреторной функции почек и протеинурия. Анализы на бруцеллёз, ВИЧ и вирусные гепатиты (В, С, D) оказались отрицательными. Ультразвуковое исследование (УЗИ) внутренних органов выявило наличие кровяных сгустков в мочевом пузыре. После повторного осмотра уролог исключил мочекаменную болезнь. Ранее у пациента не наблюдалось повышения АД, а результаты опроса по анкете Роуза оказались отрицательными.
Физикальная диагностика. При осмотре периферических (видимых) отёков не выявлено. Частота дыхательных движений (ЧДД) – 18 в минуту, сатурация кислорода в покое на атмосферном воздухе — 93%. Дыхание над лёгкими везикулярное, хрипы не выслушиваются. Тоны сердца сохранены, ритм правильный, частота сердечных сокращений (ЧСС) — 100 уд./мин, АД — 140/90 мм рт. ст. Живот мягкий, безболезненный; печень и селезёнка при пальпации не определяются. На коже лица, живота и конечностей наблюдаются корочки (Рисунок 2), а также локальные геморрагические высыпания, местами сливного характера.
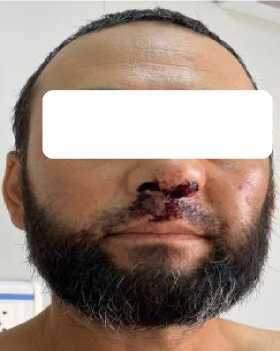
Рисунок 2. Объективные данные пациента А., 43 года
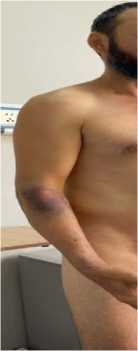
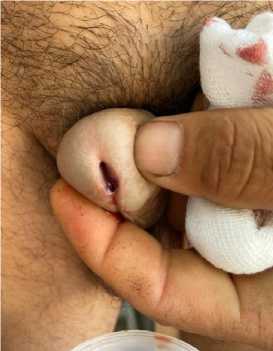
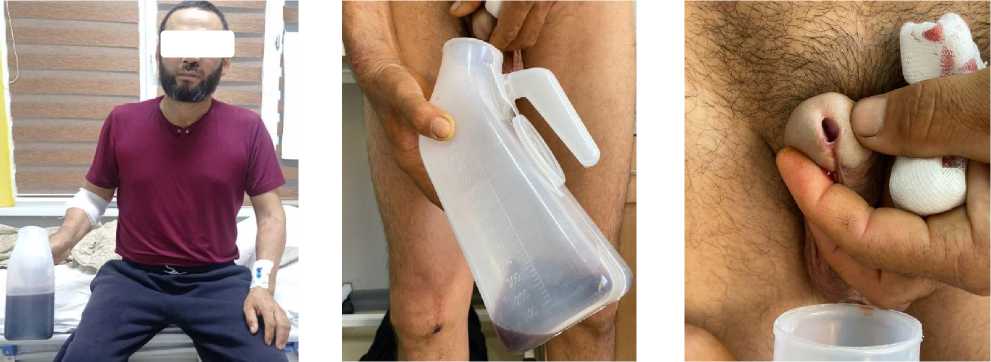
Рисунок 3. Ранний период пациента в стационаре (сохраняется гематурия)

Рисунок 4. Рецидив гематурии у пациента А., 43 года
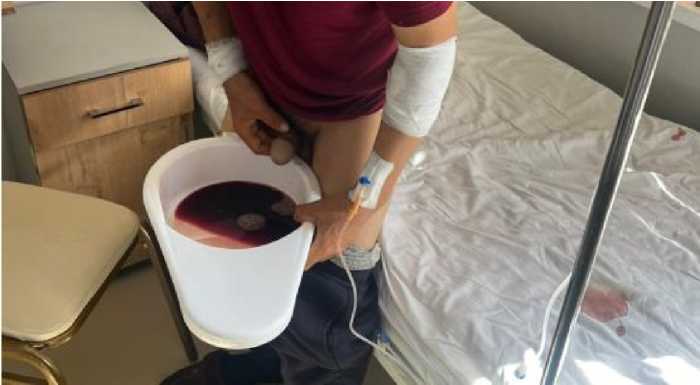
Рисунок 5. Рецидив гематурии в динамике
Результаты общеклинического обследования.
Антропометрические данные. Рост 172 см, вес 70,5 кг, индекс массы тела — 23,8 кг/м². Общий анализ крови (ОАК). Гемоглобин: 79 г/л (норма 130–160), в динамике — 69 г/л. Эритроциты: 2,70×10¹²/л (норма 4,0–5,5), в динамике — 2,29×10¹²/л. Гематокрит: 22,1% (норма 40–50%), в динамике — 17,8%. СОЭ: 55 мм/час, в динамике — 60 мм/час (норма 2– 15). Нейтрофилы: абсолютное значение — 7,37×10⁹/л (норма 2,04–5,8). Лимфоциты: 14% (норма 19–37%), абсолютное значение — 1,34×10⁹/л (норма 1,2–3,0). Моноциты: 0,85×10⁹/л (норма до 0,6). Общий анализ мочи. Протеинурия: 3 г/л. Кетоновые тела: 3,9 мг/дл. Эритроцитурия (Рисунок 3). Биохимический анализ крови. D-димер: 0,703 мг FEU/л (норма до 0,55). Иммуноглобулин E: 204 МЕ/мл (норма <87). Железо-связывающая способность: 2,0 мкмоль/л (норма 24,2–70,1). Тиреоидный профиль: снижение Т3 (0,377 нг/мл, норма 0,69– 2,15) и Т4 (39,4 нг/мл, норма 52–127). С-реактивный белок: 60,8 мг/л (норма до 5). Лактатдегидрогеназа: 303 МЕ/л (норма 125–220). Гамма-глутамилтранспептидаза: 101 Ед/л (норма 12–64). Креатинкиназа: 358 Ед/л (норма 30–200). Иммунологические исследования. Интерлейкин-6: 36,3 пг/мл (норма до 10). Антитела к антигенам H. Pylori IgG: 6,54 EIU (норма 0–30). Антитела IgG к цитомегаловирусу: 187,2 Ед/мл (норма до 6). Антитела к гельминтам (аскариды): КП = 1,34 (положительный результат). Минеральный обмен. Кальций: 2,08 ммоль/л (норма 2,11–2,55). Мочевая кислота: 123,5 мкмоль/л (норма 208,2– 428,4). Система свёртывания крови. Оценка свёртывающей способности не проведена (отсутствие сгустка). Антитромбин III: 125,8% (норма до 140). Заключение. Обследование выявило выраженную анемию, гипопротеинемию, активный воспалительный процесс (повышение СОЭ, С-реактивного белка и интерлейкина-6), дисфункцию щитовидной железы и нарушение свёртываемости крови. Пациент осмотрен гематологом и урологом для уточнения диагноза.
На электрокардиографии регистрируется диффузное нарушение процессов реполяризации. Эхокардиография. Аорта: диаметр восходящего отдела — 3,2 см, стенки уплотнены, контуры ровные. Аортальный клапан трёхстворчатый, створки не изменены, раскрытие полное, систолический градиент давления — 4,7 мм рт. ст., регургитация минимальная. Митральный клапан: фиброзное кольцо расширено, створки не изменены, раскрытие полное, диастолический градиент давления — 2,7 мм рт. ст., регургитация минимальная. Трёхстворчатый клапан: фиброзное кольцо в норме, створки не изменены, раскрытие полное, диастолический градиент давления — 2,2 мм рт. ст., регургитация минимальная. Легочная артерия: диаметр в норме, створки не изменены, ствол не расширен, систолический градиент давления — 4,5 мм рт. ст., регургитация минимальная. Систолическое давление в лёгочной артерии: 28 мм рт. ст. Левый желудочек (ЛЖ): Толщина межжелудочковой перегородки и задней стенки — 0,9 см. Конечный диастолический размер — 5,3 см, конечный систолический размер — 2,9 см. Фракция выброса (Simpson) — 65%. Ударный объём — 90 мл. Левое предсердие: размер — 4,0 см. Правый желудочек (ПЖ): диаметр — 2,2 см, толщина передней стенки — 0,4 см. Диастолическая функция ЛЖ: трансмитральное E/A = 1,20, время замедления пика E (DT) = 187 мс. Заключение: признаки атеросклеротического поражения аорты.
Ультразвуковое допплерографическое исследование сосудов конечностей. Вены правой и левой нижних конечностей: Глубокие и суральные вены: проходимы, сжимаемы на всём протяжении, кровоток фазный, синхронизирован с дыханием Подкожные вены: не расширены, проходимы, сжимаемы. Клапаны всех вен (включая притоки большой и малой подкожной вены): состоятельны. Признаков тромбоза не выявлено. Артерии правой и левой нижних конечностей: Комплекс интима-медиа — 1,1 мм. Контуры ровные, стенки утолщены, уплотнены. Кровоток магистрального типа, без признаков локальных и системных гемодинамических нарушений, прослеживается на всём протяжении до стоп. Заключение. Вены: глубокие и поверхностные вены проходимы, клапанный аппарат состоятелен, признаков тромбоза нет. Артерии: признаки атеросклероза без гемодинамических нарушений.
Ультразвуковое допплерографическое исследования прецеребральных сосудов. Правая общая сонная артерия (ОСА): Ход прямолинейный, проходимость сохранена на всём видимом протяжении, диаметр не увеличен. Толщина комплекса интима-медиа (ТКИМ) — 0,9 мм. Контуры ровные, стенки не уплотнены, не утолщены. Линейная скорость кровотока и спектр в норме. Правая внутренняя сонная артерия (ВСА): Ход прямолинейный, проходимость сохранена на всём видимом протяжении, диаметр не увеличен. ТКИМ — 0,9 мм. Контуры ровные, стенки не уплотнены, не утолщены. Линейная скорость кровотока и спектр не изменены. Правая наружная сонная артерия (НСА): Ход прямолинейный, проходимость сохранена на всём видимом протяжении, диаметр не увеличен. ТКИМ — 0,9 мм. Контуры ровные, стенки не уплотнены, не утолщены. Линейная скорость кровотока и спектр в норме. Правая позвоночная артерия: Диаметр равномерный до 2,4 мм, ход непрямолинейный между поперечными отростками шейных позвонков. Вход в костный канал на уровне поперечного отростка 6-го шейного позвонка. Линейная скорость кровотока в сегментах V1, V2, V3 — до 26 см/с, объёмная скорость кровотока — до 37 мл/мин. Левая общая сонная артерия (ОСА): Ход прямолинейный, проходимость сохранена на всём видимом протяжении, диаметр не увеличен. ТКИМ — 0,9 мм. Контуры ровные, стенки не уплотнены, не утолщены. Линейная скорость кровотока и спектр в норме. Левая внутренняя сонная артерия (ВСА): Ход прямолинейный, проходимость сохранена на всём видимом протяжении, диаметр не увеличен. ТКИМ — 0,9 мм. Контуры ровные, стенки не уплотнены, не утолщены. Линейная скорость кровотока и спектр не изменены. Левая наружная сонная артерия (НСА): Ход прямолинейный, проходимость сохранена на всём видимом протяжении, диаметр не увеличен. ТКИМ — 0,9 мм. Контуры ровные, стенки не уплотнены, не утолщены. Линейная скорость кровотока и спектр в норме. Левая позвоночная артерия: Диаметр равномерный до 4,3 мм, ход непрямолинейный между поперечными отростками шейных позвонков. Вход в костный канал на уровне поперечного отростка 6-го шейного позвонка. Линейная скорость кровотока в сегментах V1, V2, V3 — до 28 см/с, объёмная скорость кровотока – до 89 мл/мин. Заключение. Непрямолинейный ход позвоночных артерий между поперечными отростками шейных позвонков, что, вероятно, связано с остеохондрозом шейного отдела позвоночника. Гипоплазия правой позвоночной артерии. Снижение линейной скорости кровотока в правой позвоночной артерии, что приводит к уменьшению общего объёма крови в вертебро-базилярной области.
УЗИ исследование внутренних органов: слабо выраженное увеличение плотности печени, полип жёлчного пузыря, признаки хронического холецистита и панкреатита. Двусторонний нефрит. УЗИ почек: визуализация удовлетворительная, топография не изменена, физиологическая подвижность не нарушена. Эхогенность паренхимы обеих почек слегка повышенной акустической плотности, эхоструктура однородная, кортико-медуллярная дифференциация не выражена. УЗИ щитовидной железы: патологических изменений выявлено не было. УЗИ исследование органов малого таза: диффузные изменения предстательной железы.
По результатам общеклинических, анамнестических, инструментальных и лабораторных данных пациенту выставлен клинический диагноз : Диссеминированное внутрисосудистое свертывание (ДВС), острое течение, фаза гипокоагуляции, геморрагическая стадия. Острая тромботическая микроангиопатия (стрессовая) с поражением: почек (острое повреждение почек, RIFLE – F); сердца (миокардит, перикардит, сердечная недостаточность II функционального класса). Хронический пиелонефрит в фазе латентного воспаления.
Проведенное лечение. Гемостатическая терапия : транексамовая кислота — ингибитор фибринолиза. Дицинон — активатор образования тромбопластина. Конакион — препарат с коагуляционной и антигеморрагической активностью. Аминокапроновая кислота — ингибитор фибринолиза, предотвращает переход плазминогена в плазмин. Глюконат кальция — для восполнения дефицита кальция. Микроциркуляция и поддержка сердечно-сосудистой системы: Пентоксифиллин — ангиопротектор, улучшает микроциркуляцию. Панангин — восполнение дефицита калия и магния. Противовоспалительная и иммуномодулирующая терапия: Дексаметазон — синтетический глюкокортикостероид с низкой минералокортикоидной активностью. Антибактериальная терапия: антибиотики — цефалоспорины III поколения. Трансфузионная терапия: свежезамороженная плазма группы 0 (I). Эритроцитарная масса.
В период нахождения в стационаре у пациента параметры гемостаза были весьма неустойчивы с рецидивом и риском профузного кровотечения (Рисунок 4, 5).
Рисунок 6. Ранний период пациента в стационаре (переливание эритроцитарной массы)
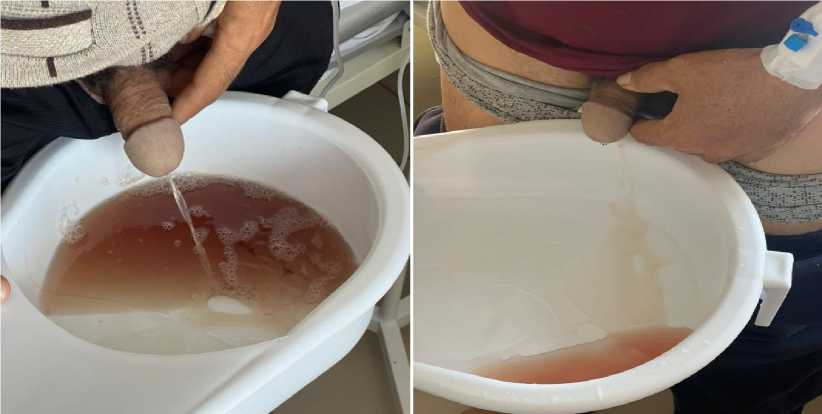
Рисунок 7. Ранний период пациента в стационаре (после трансфузии эритроцитарной массы)
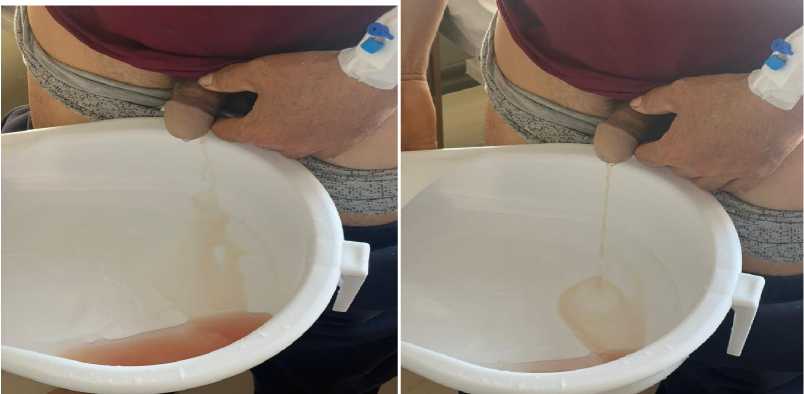
Рисунок 8. Ранний период пациента в стационаре (динамика макроскопии мочи)
На Рисунке 9 показана динамика азотовыделительной функции почек с момента поступления пациента в стационар.

Рисунок 9. Фильтрационная функция почек у пациента А., 43 лет. Примечание. 1 – исходно; 2 – в динамике; 3 – при выписке; ряд 1 – сывороточный креатинин; ряд 2 – расчетная скорость клубочковой фильтрации
Сывороточный цистатин С 0,79 мг/л (норма 0,31-0,79). СКФ, рассчитанная по цистатину С, составила 97,3 мл/мин. В динамике показатели периферического анализа крови и параметры свертывающей системы крови у пациента А., 43 года были следующими: ССК от 19.09.2024г: фибриноген 4,88 г/л (норма 2,00-4,00), АЧТВ 69,0 сек (норма 25-43). Протромбиновая время 17,7 сек (норма 10,7-17,5), ПТИ 70,6% (норма 70-130). МНО 1,41 (норма 0,85-1,25). ОАК от 19.09.2024г : Hb 69 г/л, эритроциты 2,29х1012/л, Ht 17,8%, тромбоциты 276х109/л, лейкоциты 10,07х109/л, нейтрофилы 75,8% (47-72), нейтрофилы 7,83х109/л (2,04-5,8), эозинофилы 2,0% (1-5), лимфоциты 12,9% (19-37), лимфоциты 1,30х109/л (1,2-3,0), моноциты 9,3% (до 11), моноциты 0,94х109/л (0,09-0,6), СОЭ 60 мм/час. ОАМ от 19.09.2024г : протеинурия — 1,16 г/л; кетоновые тела отсутствуют; глюкоза: реакция слабо положительная; эритроциты измененные и неизмененные в большом количестве (Рисунок 8).
ССК от 21.09.2024г : фибриноген 3,33 г/л (норма 2,00-4,00), АЧТВ 62,5 сек (норма 2543). Протромбиновая время 46,3 сек (норма 10,7-17,5), ПТИ 26,9% (норма 70-130). МНО 3,70 (норма 0,85-1,25). ОАК от 24.09.2024г : Hb 95 г/л, эритроциты 3,18х1012/л, Ht 24,7%, тромбоциты 417х109/л, лейкоциты 7,22х109/л, нейтрофилы 60,6% (47-72), нейтрофилы 4,37х109/л (2,04-5,8), эозинофилы 1,0% (1-5), лимфоциты 30,9% (19-37), лимфоциты 2,30х109/л (1,2-3,0), моноциты 7,5% (до 11), моноциты 0,54х109/л (0,09-0,6), СОЭ 55 мм/час. ССК от 24.09.2024 г: фибриноген 4,44г/л (норма 2,00-4,00), АЧТВ 64,0 сек (норма 25-43). Протромбиновая время 27,2 сек (норма 10,7-17,5), ПТИ 45,9% (норма 70-130). МНО 2,17 (норма 0,85-1,25). ССК от 26.09.2024г : фибриноген 4,21г/л (норма 2,00-4,00), АЧТВ 53,9 сек (норма 25-43). Протромбиновая время 16,1 сек (норма 10,7-17,5), ПТИ 77,6% (норма 70-130). МНО 1,28 (норма 0,85-1,25).
В динамике лечения ОАК от 27.09.2024г : Hb 103 г/л, эритроциты 3,40х1012/л, Ht 26,1%, тромбоциты 477х109/л, лейкоциты 14,1х109/л, нейтрофилы 75,6% (47-72), нейтрофилы 10,87х109/л (2,04-5,8), эозинофилы 1,0% (1-5), лимфоциты 18,7% (19-37), лимфоциты 2,65х109/л (1,2-3,0), моноциты 4,7% (до 11), моноциты 0,67х109/л (0,09-0,6), СОЭ 45 мм/час. ССК от 27.09.2024г : фибриноген 3,99г/л (норма 2,00-4,00), АЧТВ 57,2 сек (норма 25-43). Протромбиновая время 27,0 сек (норма 10,7-17,5), ПТИ 46,2% (норма 70-130). МНО 2,16 (норма 0,85-1,25). ССК от 28.09.2024г : фибриноген 3,60 г/л (норма 2,00-4,00), АЧТВ 34,3 сек (норма 25-43). Протромбиновая время 48,4 сек (норма 10,7-17,5), ПТИ 21,9% (норма 70-130). МНО 4,55 (норма 0,85-1,25). Агрегация тромбоцитов с АДФ 29,0 сек (норма 30,0-35,0). Концентрация сывороточного креатинина составила 75 мкмоль/л, активность печеночных трансаминаз и ферритина были в пределах референтных значений.
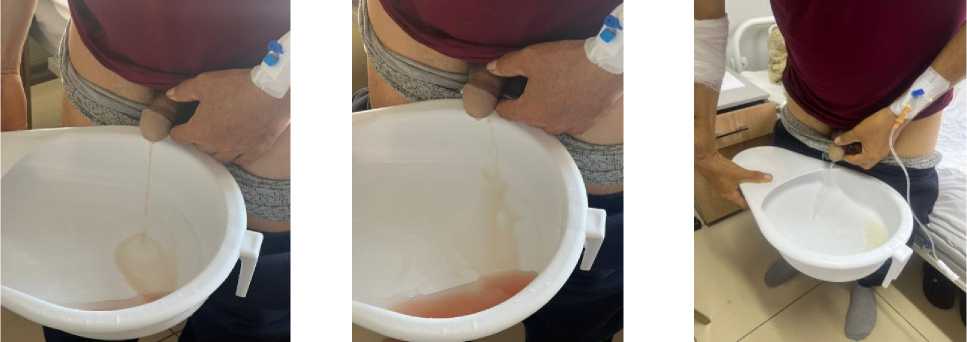
Рисунок 10. Внешний вид мочи пациента на фоне комплексной терапии в динамике
Содержание фермента ГГТ было высоким (105 U/l). СРБ 2,09 мг/л. ССК от 30.09.2024г : фибриноген 2,88 г/л (норма 2,00-4,00), АЧТВ 42,3 сек (норма 25-43). Протромбиновая время 56,9 сек (норма 10,7-17,5), ПТИ 21,9% (норма 70-130). МНО 4,55 (норма 0,85-1,25). ССК от 3.10.2024г : фибриноген 2,66 г/л (норма 2,00-4,00), АЧТВ 38,3 сек (норма 25-43). Протромбиновая время 24,7 сек (норма 10,7-17,5), ПТИ 50,6% (норма 70-130). МНО 1,97 (норма 0,85-1,25).
Перед выпиской из стационара пациенту выполнена проба мочи по методу Нечипоренко, где: лейкоциты 1750 в 1 мл (норма до 2000 клеток), эритроциты 750 в 1 мл (норма до 1000 клеток), цилиндры отсутствуют (Рисунок 11).

Рисунок 11. Цвет мочи пациента на фоне комплексной терапии в динамике
ОАК от 20.09.2024 г : Hb 81 г/л, эритроциты 2,69х1012/л, Ht 21,02%, тромбоциты 319х109/л, лейкоциты 9,73х109/л, нейтрофилы 75,0% (47-72), нейтрофилы 7,49х109/л (2,045,8), эозинофилы 2,0% (1-5), лимфоциты 15,1% (19-37), лимфоциты 1,47х109/л (1,2-3,0), моноциты 7,9% (до 11), моноциты 0,77х109/л (0,09-0,6), СОЭ 55 мм/час. ОАМ от 20.09.2024 г : обнаружены следы белка, кетоновые тела и глюкоза отсутствуют, эритроциты измененные 88 в п/з, эритроциты неизмененные отсутствуют в п/з. ОАК от 21.09.2024 г : Hb 87 г/л, эритроциты 2,88х1012/л, Ht 22,29%, тромбоциты 358х109/л, лейкоциты 11,47х109/л, нейтрофилы 76,2% (47-72), нейтрофилы 8,85х109/л (2,04-5,8), эозинофилы 1,0% (1-5), лимфоциты 15,2% (19-37), лимфоциты 1,74х109/л (1,2-3,0), моноциты 7,6% (до 11), моноциты 0,87х109/л (0,09-0,6), СОЭ 50 мм/час. ОАМ от 21.09.2024 г : протеинурия исчезла, кетоновые тела и глюкоза отсутствуют, эритроциты измененные отсутствуют, эритроциты неизмененные 55 в п/з. ОАК от 24.09.2024 г : Hb 95 г/л, эритроциты 3,18х1012/л, Ht 24,77%, тромбоциты 417х109/л, лейкоциты 7,22х109/л, нейтрофилы 60,6% (47-72), нейтрофилы 4,37х109/л (2,04-5,8), эозинофилы 1,0% (1-5), лимфоциты 30,9% (19-37), лимфоциты 2,30х109/л (1,2-3,0), моноциты 7,5% (до 11), моноциты 0,54х109/л (0,09-0,6), СОЭ 55 мм/час. ОАК от 27.09.2024г: Hb 103 г/л, эритроциты 3,40х1012/л, Ht 26,13%, тромбоциты 477х109/л, лейкоциты 14,19х109/л, нейтрофилы 75,6% (47-72), нейтрофилы 10,87х109/л (2,04-5,8), эозинофилы 1,0% (1-5), лимфоциты 18,7% (19-37), лимфоциты 2,65х109/л (1,2-3,0), моноциты 4,7% (до 11), моноциты 0,67х109/л (0,09-0,6), СОЭ 45 мм/час.
На фоне проводимой терапии общее состояние пациента стабилизировалось (Рисунок 12, 13), Больной выписан домой с рекомендациями продолжить прием глюкокортикоидов и препаратов железа.

Рисунок 12. Макроскопия мочи пациента на фоне комплексной терапии в динамике
В настоящее время концепция патогенеза и патогенетической терапии ДВС-синдрома и субклассов заболеваний, приводящих к развитию данного жизнеугрожающего патологического состояния, дополняется. Накопленные литературные данные и результаты отдельных клинических наблюдений существенно расширяют новые горизонты в течении и прогнозировании исходов ДВС-синдрома. Подытоживая данные литературы и собственного клинического случая необходимо отметить следующее. ДВС-синдром часто диагностируется на стадии гипокоагуляции и дебютирует с носовыми и десневыми кровотечениями, а также гематурией. У нашего пациента на фоне проводимой комплексной терапии с использованием гемостатических препаратов, свежезамороженной плазмы, эритроцитарной массы и глюкокортикоидов удалось приостановить жизнеугрожающую гипокоагуляцию, а также нормализовать картину периферической крови и мочи. Пациент выписан домой с улучшением и стабильной гемодинамикой.

Рисунок 13. Внешний вид пациента сзади и цвет мочи в момент выписки из стационара
Заключение
Внезапное начало ДВС-синдрома у пациента на фоне полного здоровья наступило в результате стресса и проявлялось упорной гипокоагуляцией с вовлечением в патологический процесс почек. Своевременное назначение комплексной патогенетической терапии дало положительный результат.
От пациента получено письменное информированное добровольное согласие на публикацию результатов обследования и лечения, а также его изображений в медицинском журнале, включая его электронную версию (дата подписания: 03.10.2024).
Исследование не имело спонсорской поддержки. Авторы несут полную ответственность за предоставление окончательной версии рукописи в печать.
Все авторы принимали участие в разработке концепции статьи и в написании рукописи. Окончательная версия рукописи была одобрена всеми авторами. Авторы не получали гонорар за статью.
Список литературы ДВС-синдром в практике терапевта: клинико-прогностические аспекты
- Valeriani E., Bartimoccia S., Pignatelli P., Pastori D. Aging and Antithrombotic Treatment // Antioxid Redox Signal. 2024. V. 1. №7-9. P. 542-556. https://doi.org/10.1089/ars.2023.0373
- Pan S. Y., Tao-Min Huang T., Lin Y. C., Liu H. T., Chou S. C., Lee C. Y., Chen C. C., Fu C. H., Chao C. C., Wu V. C. The effects of double-filtration plasmapheresis on coagulation profiles and the risk of bleeding // J Formos Med Assoc. 2024. V. 123. №8. P. 899-903. https://doi.org/10.1016/j.jfma.2024.02.006
- Costello R. A., Leslie S. W., Nehring S. M. Disseminated Intravascular Coagulation. 2024 // In: StatPearls.
- Баркаган З. С., Момот А. П. Современные аспекты патогенеза, диагностики и терапии ДВС-синдрома // Вестник гематологии. 2005. Т. 1. №.2. С. 5-14.
- Kawano N., Fukatsu M., Yamakawa K., Seki Y., Wada H., Okamoto K., Ikezoe T. A systematic review and meta-analysis of recombinant human soluble thrombomodulin for the treatment of DIC associated with hematological malignancies // Int J Hematol. 2024. V. 119. №4. P. 416-425. https://doi.org/10.1007/s12185-023-03704-w
- Илюкевич Г. В. Синдром диссеминированного внутрисосудистого свертывания крови (ДВС-синдром). Клиника, диагностика и интенсивная терапия. Минск, 2023. 68 с.
- Spero J. A., Lewis J. H., Hasiba U. Disseminated intravascular coagulation. Findings in 346 patients // Thromb Haemost. 1980. V. 43. №1. P. 28-33.
- Поносова В. О., Пронина И. В. Синдром диссеминированного внутрисосудистого свертывания // Международный студенческий научный вестник. 2020. №3. С. 49-49.
- Ніконов В. В., Соколов А. С., Курсов С. В., Кіношенко Є. І. Некоторые вопросы патологии гемостаза и ДВС-синдрома // Медицина неотложных состояний.2019. №1(96). С. 22-33. https://doi.org/10.22141/2224-0586.1.96.2019.158742
- Артюх Л. Ю., Соколова О. В., Яценко Е. В., Карелина Н. Р. ДВС-синдром у детей с ВПС: морфологическая картина изменений в микроциркуляторном русле // Forcipe. 2021. Т. 4. №2. С. 5-11.
- Илюкевич Г. В. Диссеминированное внутрисосудистое свертывание крови (ДВС-синдром) в экстренной медицине // Экстренная медицина. 2015. №3. С. 72-91.
- Марченко А. И., Ярема В. И., Королюк Г. М., Неклюдова П. С., Лазечко М. И., Конопля А. Г., Николаев Н. М. Исследование физических свойств крови и изменение коагуляционного звена гемостаза, ДВС-синдром // Хирург. 2016. №6. С. 30-35.
- Гудкович М. Б. Морфологическая оценка течения синдрома диссеминнированного внутрисосудистого свертывания при сепсисе // Итоговая конференция военно-научного общества курсантов, студентов и слушателей Военно-медицинской академии имени С.М. Кирова. 2023. С. 149-153.
- Романова Л. П., Альпидовская О. В. Клинический случай развития диссеминированного внутрисосудистого свертывания и синдрома уотерхауса-фридериксена после инфицирования SARS-COV-2 // Профилактическая медицина. 2023. Т. 26. №9. С. 98-101.
- Момот А. П., Мамаев А. Н. Современные аспекты патогенеза, диагностики и терапии ДВС-синдрома // Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2008. Т. 1. №1. С. 63-71.
- Воробьев А. И., Васильев С. А., Городецкий В. М., Шевелев А. А., Горгидзе Л. А., Кременецкая О. С., Шкловский-Корди Н. Е. Гиперкоагуляционный синдром: классификация, патогенез, диагностика, терапия // Гематология и трансфузиология. 2016. Т. 61. №3. С. 116-122.
- Куликов А. В., Шифман Е. М., Буланов А. Ю., Заболотских И. Б., Синьков С. В. Интенсивная терапия острых нарушений гемостаза в акушерстве (ДВС-синдром). Клинические рекомендации (протоколы лечения) // Анестезиология и реаниматология. 2017. Т. 62. №5. С. 399-406.
- Wada T., Gando S. Phenotypes of Disseminated Intravascular Coagulation // Thromb Haemost. 2024. V. 124. №3. P. 81-191. https://doi.org/10.1055/a-2165-1142
- Алексеева Л. А., Рагимов А. А. ДВС-синдром. М., 2010.
- Скворцов В. В., Мабудзаде Ч. К. Тромбофилия, обусловленная врожденной недостаточностью антитромбина III. Этиология, патогенез, диагностика и терапевтические подходы // Поликлиника.2018. №4. С. 30-32.
- Воробьева Н. А. Роль антитромбина в диагностике и интенсивной терапии острого ДВС-синдрома (обзор литературы и данные реальной клинической практики) // Атеротромбоз. 2017. №2. С. 53-69.
- Маджуга А. В., Сомонова О. В., Елизарова А. Л., Свиридова С. П., Зубрихина Г. Н. О клинической значимости Д-димера в диагностике и лечении тромбоэмболических осложнений и ДВС-синдрома у онкологических больных // Анестезиология и реаниматология. 2005. №5. С. 55-57.
- Баркаган З. С., Момот А. П. Основы диагностики нарушений гемостаза.М., 1999.
- Клименко А. А., Гаффарова А. С., Демидова Н. А. Катастрофический антифосфолипидный синдром: современные аспекты патогенеза, диагностики и лечения // Современная ревматология. 2023. Т. 17. №3. С. 7-15. https://doi.org/10.14412/1996-7012-2023-3-7-15
- Губкин А. В., Шабуров Р. И., Черёмушкин С. В., Латыпов Р. С., Рыбина О. В., Атаулаханов Ф. И. Особенности диагностики и лечения ДВС-синдрома у пациентов, инфицированных вирусом COVID-19 // Гематология. Трансфузиология. Восточная Европа. 2021. Т. 7. №1. С. 90-97.
- Мингалимов М. А., Григорьева К. Н., Третьякова М. В., Элалами И., Султангаджиева Х. Г., Бицадзе В. О., Хизроева Д. Х., Макацария А. Д. Синдром диссеминированного внутрисосудистого свертывания в перинатальной медицине // Акушерство, гинекология и репродукция. 2020. Т. 14. №1. С. 56–68. https://doi.org/10.17749/2313-7347.2020.14.1.56-68.
- Раимжанов А. Р., Раимжанов А. А. Синдром внутрисосудистого свертывания крови при COVID-19 и его лечение // Вестник КГМА им. И. К. Ахунбаева. 2021. Т. 4. №1. С. 138-149.


