Дыхание митохондрий нейронов головного мозга крыс при церебральной ишемии различной степени тяжести
Автор: Бонь Е.И., Максимович Н.Е., Дремза И.К., Носович М.А., Храповицкая К.А.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 2, 2022 года.
Бесплатный доступ
Выяснение механизмов развития энергодефицита при ишемическом повреждении целесообразно для детализации патогенеза и оценки соотношения процессов повреждения и компенсации при данной патологии. Цель. Изучение показателей дыхания митохондрий гомогенатов головного мозга крыс при его тотальной и субтотальной ишемии. Материалы и методы. Эксперименты выполнены на 88 самцах беспородных белых крыс массой 260±20 г с соблюдением требований Директивы Европейского парламента и Совета Европейского союза № 2010/63/EU от 22.09.2010 о защите животных, использующихся для научных целей. Результаты. В группе СИГМ продолжительностью 1 ч, по сравнению с контрольной группой, в присутствии малата/глутамата V2 увеличилась на 24 (18; 27) % (р0,05). В присутствии малата/глутамата при 1-часовой СИГМ показатели митохондриального дыхания V1, V2, V3 и V4 были больше, чем при 1-часовой ТИГМ, на 89 (82; 93), 58 (55; 63), 24 (21; 29) и 32 (27; 37) % соответственно (р
Митохондрии, ишемия, нейроны, дыхание
Короткий адрес: https://sciup.org/14124532
IDR: 14124532 | УДК: 616.831.31-005.4-092.913:618.33 | DOI: 10.34014/2227-1848-2022-2-128-138
Текст научной статьи Дыхание митохондрий нейронов головного мозга крыс при церебральной ишемии различной степени тяжести
Введение. Энергообмен в клетке связан с митохондриями, которые играют важную роль в процессах жизнедеятельности, участвуя не только в образовании АТФ, но и в хранении и передаче наследственной информации, апоптозе и пластических процессах [1–3].
Митохондрии – весьма мобильные и пластичные органеллы, которые регулярно изменяют собственную конфигурацию, обладают способностью к слиянию и последующему разделению. Передвижение митохондрий в цитоплазме связано с микротрубочками, что определяет их ориентацию и распределение в клетке. В некоторых клетках митохондрии образуют длинные подвижные филаменты или цепочки, а в других – фиксированы вблизи мест потребления АТФ [4, 5].
Нейроны нуждаются в постоянном поступлении АТФ для их стабильности и поддержания уровня ионов калия К+ внутри клетки, а ионов натрия и кальция – снаружи. В покое головной мозг потребляет до 20 % получаемого организмом кислорода. В нормальных условиях эффективное биологическое окисление является основным источником богатых энергией фосфатных соединений, необходимых для обновления структур, соответствующей функциональной активности клеток [4].
Выяснение механизмов развития энергодефицита при ишемическом повреждении целесообразно для детализации патогенеза и оценки соотношения процессов повреждения и компенсации при данной патологии.
Церебральная ишемия является тяжелым заболеванием, которое занимает лидирующие позиции в структуре заболеваемости и смертности как в Российской Федерации, так и во всем мире. Острые нарушения мозгового кровообращения являются одной из основных причин инвалидизации и потери трудоспособности людей. Церебральная ишемия приводит к тяжелой дисфункции нейронов головного мозга. Таким образом, возрастает актуальность поиска новых путей патогенетической терапии данного заболевания. В связи с этим необходимо выяснить энергетическую функцию митохондрий при церебральной ишемии различной степени тяжести.
В настоящей работе в сравнительном аспекте впервые изучены первый и второй комплекс дыхательной цепи митохондрий при церебральной ишемии различной степени тяжести (субтотальной и тотальной).
Цель исследования. Изучение показателей дыхания митохондрий гомогенатов головного мозга крыс при его тотальной и субтотальной ишемии.
Материалы и методы. Эксперименты выполнены на 88 самцах беспородных белых крыс массой 260±20 г с соблюдением требований Директивы Европейского парламента и Совета Европейского союза № 2010/63/EU от 22.09.2010 о защите животных, использующихся для научных целей.
Моделирование ишемии головного мозга (ИГМ) осуществляли в условиях внутривенного тиопенталового наркоза (40–50 мг/кг).
В иследованиях использованы модели тотальной (ТИГМ) и субтотальной (СИГМ) ишемии головного мозга.
ТИГМ моделировали путем декапитации животных, СИГМ – путем одномоментной перевязки обеих общих сонных артерий (ОСА). Забор материала для изучения тканевого дыхания митохондрий осуществляли спустя 1 ч и 24 ч после декапитации или перевязки ОСА.
Контрольную группу составили ложно оперированные крысы аналогичных пола и веса.
Для исследования митохондриального дыхания головной мозг извлекали на холоде (0–4 ºС), осушали фильтровальной бумагой, взвешивали и гомогенизировали в среде выде- ления, содержащей 0,32 М сахарозы, 10 mМ Трис-HCl, 1 mМ ЭДТА, рН 7,4 (в соотношении 1:10), используя гомогенизатор Поттера – Эвельгейма с тефлоновым пестиком [6, 7].
Митохондрии изолировали методом дифференциального центрифугирования. Ядер-ную фракцию отделяли центрифугированием при 600 g в течение 10 мин (4 ºС). Полученный супернатант центрифугировали при 8500 g в течение 10 мин (4 ºС), митохондриальный осадок дважды промывали в среде выделения, ресуспендировали до концентрации белка 35–40 мг/мл в среде выделения и хранили в короткой пробирке на льду. Концентрацию белка определяли по методу Лоури.
Для изучения митохондриального дыхания концентрированную суспензию митохондрий вносили в термостатируемую герметичную полярографическую ячейку со средой инкубации в количестве, обеспечивающем конечную концентрацию белка в ячейке 1 мг/мл. Инкубационная среда для регистрации дыхания митохондрий включала 0,17 М сахарозы, 40 mM KCl, 10 mМ Трис-HCl, 5 mМ KH2PO4, 8 mМ KHСO3, 0,1 mМ ЭДТА, рН 7,4.
Принцип работы полярографической ячейки объемом 3,0 мл основан на регистрации поглощения кислорода митохондриями с помощью встроенного электрода Кларка при температуре 25 ºС (рис. 1).
Регистрацию изменений напряжения кислорода (pO2) в суспензии митохондрий осуществляли с помощью электронного регистратора КСП-4.
Калибровку электрода Кларка проводили путем последовательного продувания через ячейку воздуха (pO2 воздуха) и газообразного азота (pO2=0 мм рт. ст.).
После регистрации скорости базального (эндогенного) дыхания при отсутствии субстрата в суспензию митохондрий поочередно вводили субстраты дыхания (малат (2 mМ)/ глутамат (5 mМ) или сукцинат (5 mМ)), а затем АДФ в количестве 200 нмоль/мл. По полученным полярограммам рассчитывали скорость дыхания митохондрий в разных метаболических состояниях и коэффициенты, характеризующие сопряжение процессов окисления и фосфорилирования.
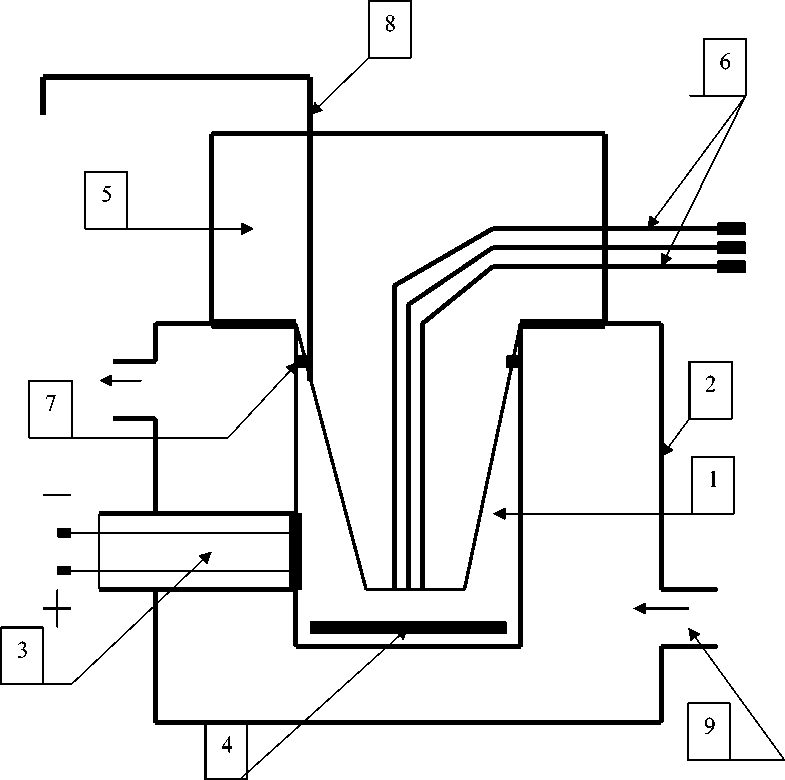
Рис. 1. Полярографическая ячейка для исследования респираторной активности митохондрий:
1 – ячейка; 2 – термостатируемая камера; 3 – электрод Кларка; 4 – магнитная мешалка;
5 – герметизирующая пробка; 6 – каналы для дозированного анаэробного введения субстратов и АДФ;
7 – уплотнительное кольцо; 8 – канал для выведения воздуха и избытка жидкости;
9 – штуцер для подключения к ультратермостату
-
Fig. 1. Polarographic cell for studying the respiratory mitochondria activity:
-
1 – cell; 2 – thermostatically controlled chamber; 3 – Clarke electrode; 4 – magnetic stirrer; 5 – sealing plug;
-
6 – channels for dosed anaerobic administration of substrates and ADP; 7 – sealing ring;
-
8 – channel for removing air and excess liquid; 9 – fitting for connection to an ultra-thermostat
Регистрировали следующие показатели дыхания митохондрий: V1 – скорость базального дыхания, V2 – скорость субстратзависи-мого дыхания, V3 – скорость дыхания, сопряженного с фосфорилированием (после внесения АДФ), V4 – скорость дыхания после завершения фосфорилирования добавленного АДФ. Определяли показатели, характеризующие сопряжение процессов окисления и фосфорилирования в митохондриях: коэффициент акцепторного контроля (АК=V3/V2), коэффициент дыхательного контроля (ДК=V3/V4) и коэффициент фосфорилирования (АДФ/О).
Использование растворов малата/глута-мата и сукцината позволяет оценить степень функциональной активности цепи переноса электронов (ЦПЭ) в митохондриях в целом, а в особенности – I и II комплексов ЦПЭ [8, 9].
Для предотвращения систематической ошибки измерений образцы головного мозга контрольной и опытных групп животных изучали в одинаковых условиях.
В результате исследований получены количественные непрерывные данные. Так как в эксперименте использованы малые выборки, которые имели ненормальное распределение, анализ проводили методами непараметрической статистики с помощью лицензионной компьютерной программы Statistica 10.0 для Windows (StatSoft, Inc., США). Данные представлены в виде Me (LQ; UQ), где Me – медиана, LQ – значение нижнего квартиля; UQ – значение верхнего квартиля. Различия между группами считали достоверными при р<0,05 (тест Краскелла – Уоллиса с поправкой Бон-ферони) [10].
Результаты и обсуждение. По сравнению с контролем при 1-часовой ТИГМ в присутствии малата/глутамата, характеризующего состояние I (НАДН-дегидрогеназного) комплекса цепи переноса электронов, V1 уменьшилась на 65 % (р<0,05), V2 – на 41 % (р<0,05), V3 – на 25 % (р<0,05), а коэффициент фосфорилирования – на 78 % (р<0,05). Остальные показатели (V4, коэффициент акцепторного контроля и коэффициент дыхательного контроля) не изменялись (табл. 1).
Таблица 1
Table 1
Показатели дыхания митохондриальной фракции гомогенатов головного мозга крыс при тотальной церебральной ишемии в присутствии малата/глутамата и сукцината,Ме (LQ; UQ)
Respiration indices of the mitochondrial fraction of rat brain homogenates in total cerebral ischemia using malate/glutamate and succinate, Me (LQ; UQ)
|
Группы Group |
V1 (нг ат О/(мин×мг белка)) (atomic O (ng) /min×protein (mg) |
V2 (нг ат О/(мин×мг белка)) (atomic O (ng) /min×protein (mg) |
V3 (нг ат О/(мин×мг белка)) (atomic O (ng) /min×protein (mg) |
V4 (нг ат О/(мин×мг белка)) (atomic O (ng) /min×protein (mg) |
Коэффициент акцепторного контроля Acceptor control ratio |
Коэффициент дыхательного контроля Respiratory control ratio |
Коэффициент фосфо-рилирова-ния Phosphoryla tion coefficient |
|
Малат/глутамат Malate/glutamate |
|||||||
|
Контроль |
18 |
27 |
51 |
31 |
2,0 |
1,6 |
2,0 |
|
Control |
(14; 19) |
(26; 27) |
(48; 56) |
(27; 34) |
(1,8; 3,0) |
(1,6; 1,7) |
(1,9; 2,1) |
|
ТИГМ 1 ч |
6 |
16 |
38 |
26 |
2,3 |
1,6 |
0,5 |
|
1-hour TCI |
(4; 9)* |
(11; 19)* |
(32; 39)* |
(18; 30) |
(1,7; 3,5) |
(1,5; 1,8) |
(0,4; 0,6)* |
|
ТИГМ 1 сут 24-hour TCI |
2 |
14 |
28 |
22 |
1,8 |
1,0 |
0,0 |
|
(2; 5)* |
(11; 19)* |
(18; 36)* |
(18; 27) |
(1,7; 1,9) |
(1,0; 1,2)*+ |
(0,0; 0,0)* |
|
|
Сукцинат Succinate |
|||||||
|
Контроль |
17 |
34 |
66 |
38 |
2,0 |
1,8 |
1,9 |
|
Control |
(15; 17) |
(28; 36) |
(65; 68) |
(36; 40) |
(1,9; 2,3) |
(1,7; 1,9) |
(1,8; 1,9) |
|
ТИГМ 1 ч |
9 |
14 |
26 |
26 |
1,6 |
1,0 |
0,0 |
|
1-hour TCI |
(6; 12)* |
(9; 17)* |
(15; 32)* |
(15; 30)* |
(1,2; 1,9) |
(1,0; 1,0)* |
(0,0; 0,0)* |
|
ТИГМ 1 сут 24-hour TCI |
2 |
12 |
13 |
13 |
1,2 |
1,0 |
0,0 |
|
(1; 3)*+ |
(9; 14)* |
(11; 16)* |
(11; 16)* |
(1,1; 1,3)* |
(1,0; 1,0)* |
(0,0; 0,0)* |
|
Примечание. * – р<0,05 по сравнению с группой контроля, + – р<0,05 по сравнению с 1-часовой ТИГМ.
Note. * – p<0.05 compared with the control group, + – p<0.05 compared with 1-hour TCI (TCI – total cerebral ischemia).
В присутствии сукцината, отражающего работу II комплекса (сукцинатдегидроге-назного) цепи переноса электронов, установлено уменьшение показателей энергообмена по сравнению с контролем: V1 – на 44 % (р<0,05), V2 – на 60 % (р<0,05), V3 – на 59 % (р<0,05), V4 – на 32 % (р<0,05).
Коэффициент дыхательного контроля уменьшился на 45 % (р<0,05), коэффициент фосфорилирования при 1-часовой ТИГМ равнялся нулю. Коэффициент акцепторного контроля не изменялся (р>0,05).
Уменьшение скорости базального дыхания было более выражено при использовании сукцината, чем при использовании малата/глута-мата (на 21 %, р<0,05), что свидетельствует о большем повреждении II комплекса (сукцинат-дегидрогеназного) ЦПЭ при ТИГМ. Различий между другими показателями не было (р>0,05).
В условиях 1-суточной ТИГМ в присутствии малата/глутамата V1 уменьшилась на 90 % (р<0,05), V2 – на 46 % (р<0,05), V3 – на 45 % (р<0,05), коэффициент дыхательного контроля снизился на 35 % (р<0,05). Показатель V4 и коэффициент акцепторного кон- троля не изменялись (р>0,05). Коэффициент фосфорилирования (AДФ/О) при использовании как сукцината, так и малата/глутамата при 1-суточной ТИГМ, как и при 1-часовой ТИГМ, равнялся нулю. По сравнению с 1-часовой ТИГМ коэффициент дыхательного контроля при 1-суточной ТИГМ был меньше на 41 % (р<0,05). Различий по остальным показателям не отмечалось (табл. 1).
В присутствии сукцината при 1-суточной ТИГМ по сравнению с контролем было отмечено уменьшение V1 – на 90 %, (р<0,05), V2 – на 65 % (р<0,05), V3 – на 78 % (р<0,05), V4 – на 67 % (р<0,05). Коэффициенты дыхательного и акцепторного контроля уменьшились на 45 и 40 % соответсвенно (р<0,05), а коэффициент фосфорилирования равнялся нулю (р<0,05). Кроме того, в присутствии сукцината при 1-суточной ТИГМ по сравнению с 1-часовой ТИГМ показатель V1 был меньше на 80 % (р<0,05).
Изменения митохондриального дыхания по отношению к уровню контроля при использовании обоих субстратов были равнозначны (р>0,05).
Таблица 2
Table 2
Показатели дыхания митохондриальной фракции гомогенатов головного мозга крыс при субтотальной церебральной ишемии в присутствии малата/глутамата и сукцината, Ме (LQ; UQ)
Respiration indices of the mitochondrial fraction of rat brain homogenates in subtotal cerebral ischemia using malate/glutamate and succinate, Me (LQ; UQ)
|
Группы Group |
V1 (нг ат О/(мин×мг белка)) (atomic O (ng) /min×pro-tein (mg) |
V2 (нг ат О/(мин×мг белка)) (atomic O (ng) /min×pro-tein (mg) |
V3 (нг ат О/(мин×мг белка)) (atomic O (ng) /min×pro-tein (mg) |
V4 (нг ат О/(мин×мг белка)) (atomic O (ng) /min×pro-tein (mg) |
Коэффициент акцепторного контроля Acceptor control ratio |
Коэффициент дыхательного контроля Respiratory control ratio |
Коэффициент фосфорилирования Phosphoryla tion coefficient |
|
Малат/глутамат Malate/glutamate |
|||||||
|
Контроль |
18 |
27 |
51 |
31 |
2,0 |
1,6 |
2,0 |
|
Control |
(14; 19) |
(26; 27) |
(48; 56) |
(27; 34) |
(1,8; 3,0) |
(1,6; 1,7) |
(1,9; 2,1) |
|
СИГМ 1 ч |
18 |
36 |
50 |
32 |
1,5 |
1,4 |
1,5 |
|
1-hour SCI |
(18; 27) |
(35; 38)* |
(48; 51) |
(30; 37) |
(1,3; 1,5)* |
(1,3; 1,6) |
(1,4; 1,5)* |
|
СИГМ 1 сут |
6 |
14 |
27 |
21 |
1,1 |
1,4 |
1,4 |
|
24-hour SCI |
(1; 6)*+ |
(6; 24)*+ |
(8; 42)*+ |
(7; 22)*+ |
(0,9; 1,3)* |
(1,2; 1,5)* |
(0,6; 1,6)* |
|
Группы Group |
V1 (нг ат О/(мин×мг белка)) (atomic O (ng) /min×pro-tein (mg) |
V2 (нг ат О/(мин×мг белка)) (atomic O (ng) /min×pro-tein (mg) |
V3 (нг ат О/(мин×мг белка)) (atomic O (ng) /min×pro-tein (mg) |
V4 (нг ат О/(мин×мг белка)) (atomic O (ng) /min×pro-tein (mg) |
Коэффициент акцепторного контроля Acceptor control ratio |
Коэффициент дыхательного контроля Respiratory control ratio |
Коэффициент фосфорилирования Phosphoryla tion coefficient |
|
Сукцинат Succinate |
|||||||
|
Контроль |
17 |
34 |
66 |
38 |
2,0 |
1,8 |
1,9 |
|
Control |
(15; 17) |
(28; 36) |
(65; 68) |
(36; 40) |
(1,9; 2,1) |
(1,7; 1,9) |
(1,8; 1,9) |
|
СИГМ 1 ч |
27 |
39 |
50 |
40 |
1,3 |
1,4 |
1,2 |
|
1-hour SCI |
(19; 27)* |
(37; 42)* |
(48; 54)* |
(37; 41) |
(1,2; 1,3)* |
(1,2; 1,4)* |
(1,1; 1,2)* |
|
СИГМ 1 сут |
9 |
13 |
23 |
23 |
1,3 |
1,0 |
0,0 |
|
24-hour SCI |
(3; 14)*+ |
(10; 20)*+ |
(20; 39)*+ |
(20; 37) |
(1,2; 1,3)* |
(1,0; 1,5)* |
(0,0; 0,2)*+ |
Примечание. * – p<0,05 по сравнению с группой контроля, + – р<0,05 по сравнению с 1-часовой СИГМ.
Note. * – p<0.05 – compared with the control group, + – p<0.05 compared with 1-hour SCI (SCI – subtotal cerebral ischemia).
В группе 1-часовой СИГМ, по сравнению с группой контроля, в присутствии мала-та/глутамата V2 увеличилась на 24 % (р<0,05), а коэффициенты акцепторного контроля и фосфорилирования уменьшились на 25 % (р<0,05). Остальные показатели (V1, V3, V4, коэффициент дыхательного контроля) не изменялись (р>0,05).
В присутствии малата/глутамата при 1-часовой СИГМ показатели митохондриального дыхания V1, V2, V3 и V4 были больше, чем при 1-часовой ТИГМ, на 89, 58, 24 и 32 % соответственно (р<0,05). Коэффициент дыхательного контроля не отличался (р>0,05), в то время как коэффициент акцепторного контроля был меньше на 34 % (р<0,05), а коэффициент фосфорилирования – больше на 66 % (р<0,05). Уменьшение коэффициента фосфорилирования при СИГМ было менее значительным – на 53 % (р<0,05).
В присутствии сукцината при 1-часовой СИГМ по сравнению с контролем отмечено увеличение V1 на 38 % (р<0,05), V2 на 13 % (р<0,05), V3 на 26 % (р<0,05). Эти изменения свидетельствуют о значительном разобщении окисления и фосфорилирования. Скорость дыхания после завершения фосфорилирования добавленного АДФ (V4) не изменялась (р>0,05). При этом коэффициент акцепторного контроля, коэффициент дыхательного контроля и коэффициент фосфорилирования уменьшились на 35, 20 и 36 % соответственно (р<0,05), что свидетельствует о снижениии выработки энергии.
По сравнению с 1-часовой ТИГМ при 1-часовой СИГМ в присутствии сукцината V1, V2, V3 и V4 были больше на 67, 64, 46 и 35 % соответственно (р<0,05). Коэффициент дыхательного контроля был выше на 30 % (р<0,05). При использовании сукцината уменьшение коэффициента дыхательного контроля было менее выражно при СИГМ (на 10 %, р<0,05).
При использовании сукцината коэффициент фосфорилирования был меньше, чем при использовании малата/глутамата, на 11 % (р<0,05). Остальные показатели не отличались (р>0,05).
Увеличение показателей V1 и V2 и уменьшение коэффициента фосфорилирования свидетельствуют о том, что перенос протонов происходит, минуя АТФ-синтазный комлекс. Ферменты митохондриального матрикса и цитохромы при данной модели ИГМ еще не имеют ярко выраженных повреждений, о чем свидетельствуют высокие скорости V1 и V2, однако уменьшение коэффициентов акцепторного контроля, дыхательного контроля и фосфорилирования указывает на разобщение процессов окисления и фосфорилирования и снижение выработки АТФ при СИГМ. Более выраженные нарушения при использовании сукцината свидетельствуют о большем повреждении сукцинатдегидрогеназного комплекса ЦПЭ.
В присутствии малата/глутамата при 1 -суточной СИГМ, по сравнению с 1-суточной ТИГМ, V1 была больше на 66 % (р<0,05), V2, V3, V4 достоверно не отличались (р>0,05). Коэффициент акцепторного контроля при ТИГМ был больше на 64 % (p<0,05), коэффициент дыхательного контроля - меньше на 29 % (p>0,05). Коэффициент фосфорилирования при 1-суточной СИГМ достоверно отличался (р<0,05) от коэффициента фосфорилирования при 1-суточной ТИГМ. В условиях суточной СИГМ в присутствии сукцината отмечалось уменьшение V1 на 47 % (р<0,05), V2 на 62 % (р<0,05), V3 на 64 % (р<0,05), что вы-раженнее, чем при 1-часовой СИГМ на 67, 66 и 55 % соответственно (р<0,05). Коэффициент акцепторного контроля и коэффициент дыхательного контроля уменьшились на 35 и 44 % соответственно (р<0,05). Коэффициент фосфорилирования при 1-суточной СИГМ, как и при 1-суточной ТИГМ, был равен нулю.
Скорость базального дыхания при 1-суточной СИГМ в присутствии сукцината была больше, чем при ТИГМ, на 43 % (р<0,05), а в присутствии малата/глутамата - на 67 % (р<0,05).
Использование при 1-суточной СИГМ в качестве субстрата смеси малата с глутаматом показало аналогичные изменения показателей митохондриального дыхания, что и при использовании сукцината, за исключением более высокого значения коэффициента фосфорилирования - 1,4 (р<0,05).
Уменьшение показателей V1, V2, и V3 при 1-суточной СИГМ является следствием снижения содержания кислорода для митохондриального дыхания. Угнетение энергетических процессов было более выраженным, чем при 1-часовой СИГМ, что отражает крайне низкий коэффициент фосфорилирования.
Изменение показателей V1, V2 и V3 при 1-часовой СИГМ и 1-часовой ТИГМ было разнонаправленным. Их увеличение при СИГМ связано с разобщением окисления и фосфорилирования, в то время как уменьшение при ТИГМ - с недостатком субстратов для митохондриального дыхания.
Таким образом, при ишемии головного мозга происходит повреждение внутренней митохондриальной мембраны за счет активации процессов свободнорадикального окисления [4]. Повреждение внутренней митохондриальной мембраны в свою очередь приводит к повышению ее проницаемости и снижению уровня протонного градиента из-за перехода протонов по градиенту концентрации через образующиеся неспецифические поры в митохондриальный матрикс [11, 12]. В результате снижается эффективность синтеза АТФ, а для поддержания межмембранного потенциала в этих условиях требуется больше субстратов и кислорода [13-15].
Наиболее выраженное уменьшение показателей дыхания митохондриальной фракции гомогенатов головного мозга происходит при его тотальной ишемии вследствие полного прекращения кровоснабжения нейронов головного мозга. При данном способе моделирования церебральной ишемии характерно появление гиперхромных сморщенных нейронов с перицеллюлярным отеком. В их цитоплазме происходит деструкция органелл, распад нейрофибрилл и нейропиля, что свидетельствует об их низкой функциональной активности. Одномоментная субтотальная ишемия также приводит к тяжелым необратимым повреждениям нейронов: на морфологическом уровне это проявляется значительным увеличением количества гиперхромных сморщенных нейронов. Их преобладание в популяции нейронов в группе СИГМ соответствует ингибированию дыхания митохондриальной фракции гомогенатов головного мозга.
При церебральной ишемии происходят значительные ультраструктурные нарушения нейронов, при этом отмечается набухание митохондрий и разрушение их крист. Полученные нами данные об угнетении работы первого и второго комплексов дыхательной цепи митохондрий согласуются с результатами других авторов, проводивших электронномикроскопические исследования нейронов. Согласно литературным данным при церебральной ишемии отмечается угнетение активности ключевых ферментов дыхательной цепи митохондрий, в т.ч. и АТФ-азы [16].
Наблюдается также увеличение активности лактатдегидрогеназы и уменьшение активности сукцинатдегидрогеназы, поставляющей электроны в дыхательную цепь митохондрий, что указывает на нарушение процессов энергообразования в ишемизированном мозге. В таких условиях аэробного расщепления глюкозы не происходит, что приводит к тяжелому энергодефициту. Известно, что при низком уровне АТФ в клетке протекает процесс программированной гибели по механизму апоптоза [17–19].
Заключение. Таким образом, полученные данные способствуют детализации патогенеза ишемии головного мозга в целом и формирующегося при ней энергодефицита в частности, что может послужить фундаментальной базой для дальнейшей разработки методов профилактики и коррекции данной патологии.
Список литературы Дыхание митохондрий нейронов головного мозга крыс при церебральной ишемии различной степени тяжести
- Syed Suhail Andrabi, Suhel Parvez, Heena Tabassum. Ischemic stroke and mitochondria: mechanisms and targets. Protoplasm. 2020; 257: 335-343.
- Non Miyata, Osamu Kuge. Topology of phosphatidylserine synthase 1 in the endoplasmic reticulum membrane. Protein Sci. 2021; 30: 2346-2353.
- Hackenbrock C.R. Lateral diffusion and electron transfer in the mitochondrial inner membrane. Trends Biochemistry. 1981; 15: 151-154.
- Fabian Büttner, Christian Cordes, Frank Gerlach, Axel Heimann, BeatAlessandri, Ulrich Luxemburger, Ozlem Türeci, Thomas Hankeln, Oliver Kempski, Thorsten Burmester. Genomic response of the rat brain to global ischemia and reperfusion. Brain Research. 2009; 1252: 1-14.
- Baertling F. NDUFA9 point mutations cause a variable mitochondrial complex I assembly defect. Clinical Genet. 2018; 93: 111-118.
- Барковский Е.В., Бокуть С.Б., Бородинский А.Н., Буко В.У., Дорошенко Е.М., ДроздовА.С., Смирнов В.Ю. Современные проблемы биохимии. Методы исследований. Минск: Вышэйшая школа; 2013. 491.
- Maksimovich N. Ye., Bon L.I., DremzaI.K. Structural and functional features of mitochondria and methods of their study in experiment. MEDICUS. 2019; 5: 8-18.
- Brand M.D., Murphy M.P. Control of electron flux through the respiratory chain in mitochondria and cells. Biological Review. 1987; 62: 141-193.
- Non Miyata, Osamu Kuge. Topology of phosphatidylserine synthase 1 in the endoplasmic reticulum membrane. Protein Sci. 2021; 30: 2346-2353.
- Батин Н.В. Компьютерный статистический анализ данных: учеб.-метод. пособие. Минск; 2008. 160.
- Hoffmann C. The effect of differentiation and TGFß on mitochondrial respiration and mitochondrial enzyme abundance in cultured primary human skeletal muscle cells. Science Report. 2018; 8: 737-740.
- HolvoetP. Low Cytochrome Oxidase 1 Links Mitochondrial Dysfunction to Atherosclerosis in Mice and Pigs. PLoS One. 2017; 12: 307-312.
- Klinyerberg M. Principles of carrier catalysis elucidated by comparing two similar membrane transloca-tors from mitochondria, the ADP/ATP carrier and the uncoupling protein. New York Academic Science. 1985; 456: 279-288.
- LeonardK., Haiker H., Weiss H. Three-dimensional structure of NADH: ubiquinone reductase (complex I) from Neurospora mitochondria determined by electron microscopy of membrane crystals. Мокга^ Biology. 1987; 194: 277-286.
- Johanna Vilhjalmsdottir, Ingrid Albertsson, Margareta R A Blomberg, Pia Adelroth, Peter Brzezinski. Proton transfer in uncoupled variants of cytochrome c oxidase. Febs Letters. 2020; 594 (5): 813-822.
- Семченко В.В., Степанов С.С., Алексеева Г.В. Постаноксическая энцефалопатия. Омск; 1999. 466.
- Лукьянова Л.Д., Дудченко А.М. Регуляторная роль митохондриальной дисфункции при гипоксии и ее взаимодействие с транскрипционной активностью. Вестник РАМН. 2007; 2: 3-13.
- Пескин А.В. Взаимодействие активного кислорода с ДНК (обзор). Биохимия. 1997; 62 (12): 1571-1578.
- Guo M.F., Yu J.Z., Ma C.G. Mechanisms related to neuron injury and death in cerebral hypoxic ischaemia. Folia Neuropathol. 2011; 49 (2): 78-87.


