E. coli как модельный организм для анализа протеазочувствительности в надмолекулярных структурах
Автор: Иванова Эвилина Алексеевна, Вафина Гюльнар Хамидовна, Тропынина Татьяна Сергеевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биотехнология
Статья в выпуске: 5-3 т.13, 2011 года.
Бесплатный доступ
В статье представлен экспериментальный анализ локализации Арг-Х протеазо-чувствительных зон на разных уровнях структурной укладки нуклеоида прокариотической клетки в периоды ее активного роста, замедления и стационарной фаз на примере популяции бактериальных клеток E. coli. Показано, что в протеоме бактериальных клеток система Арг-X протеазо-чувствительности активно функционирует в стационарной фазе роста бактерий.
Нуклеоид, внутриклеточный протеолиз
Короткий адрес: https://sciup.org/148200444
IDR: 148200444 | УДК: 579.222:579.24:579.842.11
Текст научной статьи E. coli как модельный организм для анализа протеазочувствительности в надмолекулярных структурах
Понимание биологических процессов достигается значительно более легко с помощью модельных организмов. Изучение тонких молекулярных и надмолекулярных структур изменило общее представление о прокариотической клетке. В настоящее время фундаментальные и прикладные исследования биологических объектов осуществляются на трех уровнях: in vitro , in vivo , in silico . Находясь в тесном взаимодействии, эти методы позволяют получить наиболее объективную картину процессов, происходящих в живой клетке. На сегодняшний день Escherichia coli – это самый хорошо изученный организм. Однако для E. coli остаются неясными: способы «укладки» нитей ДНК в нуклеоиде, молекулярный механизм процесса цитокенеза или септации, функции 60% генов. По сути дела, клеточный уровень организации жизнедеятельности можно рассматривать с позиции хорошо организованного «сообщества» молекул, надмолекулярных структур, постоянно взаимодействующих друг с другом и окружающей средой. По мнению А. Бюл-лера [1], надмолекулярные описания формообразовательн ых процесссов цен ны тем, что в них уже интегрированы взаимодействия многих макромолекул, вдоль линейных структур которых могут передвигаться сигналы за счёт ассоциации и диссоциации молекул. В этом отношении, в качестве одноклеточного прокариотического объекта исследования наиболее универсальным модельным организмом является E. coli – кишечная бактерия, которая имеет короткий жизненный цикл, небольшие размеры, недорогие условия культивирования и достаточно простое строение.
Системный подход в биохимических исследованиях заключается в том, чтобы рассматривать организм как целостную систему в её развитии. В иерархии структурных уровней в биологических системах биохимики исследуют нижние уровни, которые выполняют команды, поступающие из более высоких уровней организации.
Важность изучения структурных уровней, соот-
ветствующих биомакромолекулам и надмолекулярным комплексам, состоит в том, что они реализуют роль стандартных блоков, выполняющих элементарные функции и регулируемых по базовым регуляторным механизмам [2]. В этом плане представляет интерес анализ гистона IV – аргининбога-того биополимера, молекула которого практически вся активна, эволюционно консервативна в эукариотическом мире, и облигатно взаимодействует как с ДНК, так и с другими гистонами и негисто-нами [3, 4].
Надмолекулярные структуры – это динамические ансамбли, сборка которых контролируется внутриклеточными условиями, где важную роль в пространственной организации ускорения процесса сборки играют специальные белки шапе-ронины. Некоторые из них выполняют протеолитические функции [5]. Протеолитический процессинг, происходящий в геномных структурах клетки, четко отражает одну из особенностей динамической организации живой системы. В связи с этим возникает необходимость рассмотрения его в рамках системного подхода.
В настоящее время широкое распространение приобретает концепция биохимической универсальности белковой биорегуляции. Первоначальное расщепление белка несет в себе определенную специфичность. Протеолитическая система это не набор хаотических реакций, а сложная, но высокоупорядоченная система со специфическим для каждой ткани набором протеолитических ферментов. Филогенетически она древнее гормональной или нервной систем, ответственных за функционирование организма в целом. Ограниченный протеолиз можно связать и с образованием активных пептидов на определенных этапах онтогенеза клетки. В связи с этим, в постгеномных технологиях возникло новое направление – пептидомика [6]. Есть мнение, что информация внутри клетки может сообщаться морфогенами – веществами, по-видимому, пептидной природы, которые способны активировать или репрессировать гены [3].
В настоящее время одним из важнейших направлений системной биологии является функциональная геномика и протеомика. Протеомика – это наука о белках и их взаимодействиях. Целью данной работы был экспериментальный анализ локализации Арг-Х протеазочувствительных сайтов в надмолеку-лярных структурах прокариотических клеток штамма E. coli как возможных зон ремоделирования функциональной системы организма в процессе жизнедеятельности бактерии.
МАТЕРИАЛ И МЕТОДЫ
В качестве объекта исследования использовался штамм E. coli JC-158 [7] (Hfr PO1, thi, serA, lacI22, relA1) (любезно предоставленный нашими коллегами И.В. Ступак и Е.Э. Ступак). Важным этапом микробиологической работы явилось получение чистой синхронной культуры микро-организмов, состоящей из абсолютно идентичных клеток. Для этого клетки E. coli JC-158 выращивали на богатой питательной среде LB (Лурия-Бертани) [8] при 370С, 160 об/мин до остановки роста популяции клеток, собирали центрифугированием и промывали трис-буфером. Первая проба была взята через 50 минут после начала инкубирования. В процессе динамически развивающейся популяции через каждые 20 минут были отобраны пробы бактериальных клеток, которые фиксировались в глицерине по методу [9]. Далее из проб были выделены препаративные количества надмолекулярных структур: бактериоплазма (Бп), структуры непрочносвязанные с клеточным остатком (Нс-I), структуры прочносвязанные с клеточным остатком (Нс-II), клеточный остаток (КО) по способу, подробно описанному в работах [9, 10]. Количество белка в полученных фракциях определяли методом Бредфорд в нашей модификации [11]. Арг-Х активность оценивали по расщеплению Арг-Х связей в аргининбо-гатом белке – протамине – Salmine-A-I («Merk») (молекула которого состоит из 33 аминокислот: 22-х молекул Арг, 4-х молекул Сер, 3-х молекул Про, по 2 молекулы Глу и Вал) во всех вышеперечисленных фракциях [11]. Активность протеолиза выражали в нмоль аргинина с-1 мг-1белка на клетку.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Проведен экспериментальный анализ локализации Арг-Х протеазочувствительных зон на разных надмолекулярных уровнях структурной укладки прокариотической клетки в периоды ее активного роста, замедления и стационарной фаз на примере популяции бактериальных клеток E. coli. (рис. а). Из литературы известно, что минимальное разнообразие морфологических дифференцирующих признаков у микроорганизмов при большом разнообразии функциональных характеристик сделало последнее основными фенотипическими дескрипторами. Малые размеры организмов сильно затрудняют проводить исследование этих функциональных характеристик в одном организме, то есть в одной клетке. В связи с этим, исследования в микробиологии проводятся на уровне культуральных методов. Эти методы подразумевают получение лабораторной культуры микроорганизмов некоего устойчивого сообщества, которое удается поддерживать в искусственных условиях, поставляя все необходимые для жизнедеятельности питательные субстраты. Важнейшим этапом микробиологической работы является получение чистой культуры микроорганизмов, состоящей из абсолютно идентичных клеток, что способствует описанию их как одного организма. На исследовании чистых культур построена вся микробиология ХХ в. Однако в последние 20 лет идеология, основанная на культуральном подходе, подверглась серьёзным испытаниям [12]. В настоящее время широкое распространение получают базы данных нуклеотидных последовательностей микроорганизмов, однако это ни в коем случае не означает отрицание культуральных методов – до сих пор это един-ственная возможность получить препаративные количества ДНК и белковых компонентов одного организма. В нашем эксперименте (рис. а) в активной фазе роста, при достаточном количестве питательных веществ в среде, клетки бактерий рас-тут с наивысшей скоростью. Это период от 50 до 190 мин. При постепенном исчерпании необходимых питательных веществ и накоплении продуктов метаболизма скорость роста бактерий снижается (фаза замедления роста, это период от 190 до 330 мин. Затем рост бактерий переходит к его остановке – культура входит в стационарную фазу, это период от 330 до 430 мин. Считают, что при переходе бактерий в стационарную фазу запускается программа дифференциации, приводящая к тому, что клетки становятся метаболически менее активными и более устойчивыми к стрессовым факторам [13]. Многие функции, индуцируемые при входе культуры в стационарную фазу и при лимитировании питательных веществ, активируются [13]. В этих условиях экспрессия большинства бактериальных генов существенно уменьшается. Однако происходит индукция экспрессии большого количества других генов и стимулируется синтез специфических белков, прежде всего тех, которые обеспечивают устойчивость бактерий к различным неблагоприятным условиям [13]. Понимание механизмов регуляции экспрессии соответствующих генов чрезвычайно важно для биотехнологии. Таким образом, жизненный цикл бактерий включает периоды активного роста, чередующиеся с периодами замедления и прекращения роста (рис.,а). В природных условиях бактерии редко находятся в условиях изобилия, позволяющих экспоненциальный рост [13]. Короткие периоды быстрого роста сменяются длительными периодами голодания, клетки подвергаются воздействию различных факторов, неблагоприятных для их жизнедеятельности. В этих условиях бактерии вынуждены приспосаб-ливаться в течение продолжительного времени и возвращаться в экспоненциальную фазу, когда влияние голода и других неблагоприятных воздейс-твий будет снято [13]. Этот период также характеризуется проявлением молекулярных механизмов адаптации микроорганизмов к стрессу. В условия стресса, вследствие нарушения энергетического и конструктивного обмена микробы становятся еще более устойчивыми и, следовательно, увеличивается их болезнетворный фактор [14]. В клетках бактерий хромосома уложена в виде компактной структуры, связанной с мембраной. Такой ДНК-мембранный комплекс обеспечивает структурную укладку хромосомы, ее репликацию и сегрегацию [15]. Авторы цитируемой работы, путем мягкого лизиса клеток бактерий неионными детергентами в присутствии 1 М NaCl, выделили нуклеоид, ассоциированный с мембранным материалом [15]. Морфология релаксированного бактериального нуклеоида напоминает морфологию нуклеоида эволюционно ранней эукариотической клетки за тем исключением, что последний имеет большее количество отходящих от центра петель [15].
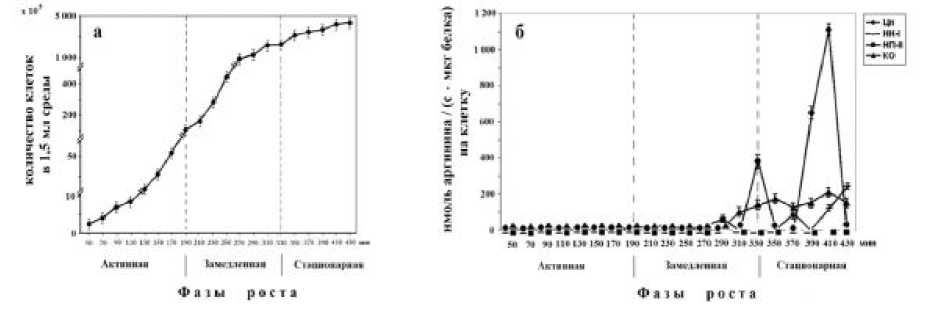
Рис. Динамика увеличения плотности популяции (а) и активность Арг-X -протеолиза (б) в надмолекулярных структурах - фракциях клеток E. coli в течение их жизненного цикла; Цп - цитоплазма (0,14 М NaCl); НС-I - надмолекулярные структуры непрочносвязанные с КО (0,35 М NaCl); НС-II - надмолекулярные структуры прочносвязанные с КО (2 М NaCl); КО - клеточный остаток (6 М GuHCl+B-меркаптоэтанол).
На рис.,б представлены особенности пространственно-временной Арг-Х протеазо-чувствительности надмолекулярных структур бактериальных клеток E. coli. Наши данные показывают, что при переходе в стационарную фазу роста в цитоплазме клеток происходит нарастающий циклический всплеск Арг-Х протеолиза. В ряде работ показано, что при переходе бактерий в стационарную фазу роста в клетках происходит компак-тизация ДНК в результате качественного и количественного изменения состава белков нуклеоида [13]. При замедлении и прекращении роста клетки E. coli претерпевают существенные морфофизиологические изменения. Изменяется форма клеток: если в период быстрого роста они имеют палочковидную форму, то при замедлении роста они становятся намного меньше и почти сферическими, что является следствием нескольких делений клеток без увеличения клеточной массы. Считают, что резкое уменьшение размера клеток может способствовать выживанию бактерий в результате увеличения их количества. Цитоплазма клеток конденсируется, объем периплазмы увеличивается [13]. Скорость протеолиза клеточных белков также увеличивается в несколько раз при голодании клеток в стационарной фазе роста, аминокислоты, освобождаемые в результате протеолиза белков, используются для синтеза новых белков [13], а также полиаминов, пептидов, содействующих пролиферации и в некоторых случаях ингибирующих апоптоз. Вполне возможно, что в этот период образуются и биогенные амины, например, из аргинина - агматин, в определенной дозе обладающий ядовитыми свойствами. Глобальные изменения в экспрессии генов при переходе клеток в стационарную фазу роста происходят на каждой стадии экспрессии генов и включают изменения конформации нуклеоида, аппарата транскрипции и трансляции. Хромосомная ДНК E. coli связана с 10 основными видами структурных белков, образуя нуклеоид. Эти белки в настоящее время часто называют нуклео-идными, они играют важную роль в регуляции таких необходимых для клетки процессов, как репликация, рекомбинация и транскрипция [13]. При переходе культуры в стационарную фазу происходят топологические изменения в хромосоме голодающих клеток, коррелирующее с уменьшением общего уровня экспрессии генов бактерий в этих условиях. Нуклеоид становится более компактным вследствие изменения состава и количественного содержания связанных с ДНК белков. Модуляция нуклеоида играет существенную роль в сохранении ДНК в клетках, находящихся в условиях голодания и исчерпания источника энергии, а также в репрессии большинства бактериальных генов. В связи с тем, что бактериальный нуклеоид экспериментально выделяется в присутствии 1 М NaCl, а выявленная Арг-Х протеазочувствительность локализуется в надмолекулярных структурах цитоплазмы стационарной фазы роста E. coli (рис,б; 320, 390-410 мин), то мы предполагаем, что в этот период происходят существенные изменения в ремоделировании инициации и регуляции трансляционной системы. Такое предположение исходит из того, что транскрипционная и трансляционная системы находятся нераздельно в бактериальной клетке. В ряде работ отмечаются существенные различия на стадии терминации трансляции у эукариот и про- кариот [16]. На рис.,б (310-430 мин) также показано, что переход бактериальных клеток в стационарную фазу сопровождается проявлением слабого, но непрерывного Арг-Х протеолиза на уровне надмолекулярных структур клеточного остатка (КО). По-видимому, часть бактериальных клеток полностью деградирует. Вопрос о том, какие молекулярные механизмы обеспечивают выполнение программы дифференциации клеток в условиях замедления и прекращения роста, активацию (индукцию) экспрессии большого количества генов при снижении общего уровня экспрессии бактериальных генов, остается недостаточно изученным. Ранее в лаборатории Ф. Липмана в Рокфеллеровском институте Мирко Белянским было показано, что короткие пептидные цепи, входящие в состав специфического компонента клеточных стенок бактерий – пептидогликана, синтезируются без участия рибосом. До этого считалось, что всегда синтез пептидных связей, характерных для белков и пептидов, осуществляется только с участием рибосом. Поэтому против работы М. Белянского выступил резко генетик М. Дельбрюк. Однако, позднее нерибосомальный синтез коротких пептидных цепей был многократно подтвержден [17]. Данные нашей работы показывают, что возможен путь образования пептидных структур за счет протеолиза. В свою работу мы ввели анализ функционирования прокариотической клетки на уровне её надмолекулярной организации.
Таким образом, в прокариотической клетке E. coli Arg-X протеазочувствительность к экзогенному субстрату протамину проявляется наиболее активно циклически в цитоплазме в период замедления и перехода к остановке роста популяции. Возможно, это период формирования какого-то определенного сигнала, когда отдельные бактериальные клетки начинают погибать, а ее элементы снова используются для продолжения или поддержания жизнедеятельности, которая требует новых ферментов и на другом надмолекулярном уровне организации, что отражается на циклах фракций непрочно- и прочносвязанных с клеточным остатком. По данным И.А. Хмель [13], при переходе клеток бактерий в стационарную фазу роста происходят глобальные изменения клеточной физиологии и метаболизма. В клетках активируются процессы, направленные на выживание бактерий в неблагоприятных условиях среды: в результате формируются клетки с повышенной резистентностью к большому количеству стрессовых факторов как результат развития общего стрессового ответа бактерии.
Список литературы E. coli как модельный организм для анализа протеазочувствительности в надмолекулярных структурах
- Albrecht-Buhler G. In defense of "nonmolecular" cell biology//Int. Rev. of Cytology. 1990. V. 120. Р. 191-241.
- Курганов Б.И., Любарев А.Е. Проблемы биохимической организации//Биохимия. 1991. Т. 56. № 1. С. 19-32.
- Волькенштейн М.В. Биополимеры и эволюция//Молекулярная биология. 1985. Т. 19. № 1. С. 55-65.
- Иванова Э.А. Модификация гистонов у растений и ее физиологическое значение: Автореф. дис. …канд. биол. наук. М.: ИФР АН СССР, 1977. 22 с.
- Ellis R. Molecular chaperones: the plant connection//Science. 1990. V. 250. № 4983. P. 954-959.
- Карелин А.А., Иванов В.Т. Пептидомика -новое направление постгеномных технологий//Вестник РАН. 2005. Т. 75. № 2. С.139-149.
- Myrphy D.B., Pembroke J.T. Transfer of the IncJ plasmid R391 to recombination deficient E. coli K12: evidence that R391 behaves as a conjugal transposon//FEMS Microbiology Letters. 1995. V. 134. P. 153-158.
- Маниатис Т., Фрич Э., Сэмбрук Дж. Методы генетической инженерии. Молекулярное клонирование. М.: Мир, 1984. С. 84.
- Иванова Э.А., Вафина Г.Х. Способ выделения растительных клеточных ядер//А.с. 1701747, МКИ С12 N9/50. Опубл. 01.09.91. Бюл. № 48.
- Иванова Э.А., Вафина Г.Х., Тропынина Т.С. Способ получения фракции из клеток Е. соli, обладающей протеолитической активностью//Патент № 2410428. МПК С12N 9\16; C12P 1\04. Опубл. 27.01.2011. Бюл. № 3.
- Иванова Э.А., Вафина Г.Х. Способ получения ядерных фракций, обладающих протеиназной и ингибирующей активностью//А.с. 1733471, МКИ С12 N9/50. Опубл. 15.01.92. Бюл. №18.
- Бонч-Осмоловская Е.А., Раввин Н.В. Анализ полных геномов -очередной этап в развитии микробиологии.//Вестник РАН. 2010. Т. 80. № 11. С. 977-984.
- Хмель И.А. Регуляция экспрессии бактериальных генов в отсутствие активного роста клеток//Генетика. 2 0 0 5. Т. 4 1. № 9. С.1183-1202.
- Ткаченко А.Г. Бактерии и стресс//Наука Урала. 2010. № 5. С. 4 -5.
- Hiraga S., Ogura T., Niki H., Ichinose Ch., Mori H. Positioning of replicated chromosomes in Escherichia coli//J. Bacteriol. 1990. V. 172. № 1. P. 31-39.
- Киселев Л. Л. Терминация белкового синтеза уэукариот и прокариот существенно различается//Молекулярная биология. 1999. Т. 33. № 6. С. 1054-1062.
- Кулаев И.С. У истоков молекулярной биологии//Вестник РАН. 2010. Т. 80. № 1. С. 69-78.


