Единственный желудочек сердца в сочетании с транспозицией магистральных сосудов в практике врача: клинический случай
Автор: Муркамилов И.Т., Айтбаев К.А., Юсупов Ф.А., Райимжанов З.Р., Юсупова З.Ф., Юсупова Т.Ф., Хакимов Ш.Ш., Солижонов Ж.И.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 11 т.10, 2024 года.
Бесплатный доступ
Самым уязвимым периодом в отношении формирования врождённых пороков развития органов считаются 3-4 недели беременности. Именно в этот период происходит формирование и межжелудочковой перегородки. Воздействие тератогенных факторов на плод или генетические мутации на начальных этапах эмбриогенеза могут привести к развитию единственного желудочка сердца, что считается тяжелым врожденным пороком. В статье представлено описание клинического случая единственного желудочка сердца у пациента 19 лет, осложненного кардиоренальным синдромом.
Единственный желудочек сердца, эритроцитоз, почки, гипоксия, цитокины, протеинурия
Короткий адрес: https://sciup.org/14131585
IDR: 14131585 | УДК: 616.12 | DOI: 10.33619/2414-2948/108/34
Текст научной статьи Единственный желудочек сердца в сочетании с транспозицией магистральных сосудов в практике врача: клинический случай
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616.12
Единственный желудочек сердца (ЕЖС) характеризуется отсутствием перегородки между желудочками сердца [1].
В медицинском лексиконе ЕЖС обозначается как врождённый порок сердца «цианотического типа», «единственный желудочек с рудиментарной выводной камерой», «одножелудочковое сердце», «трехкамерное сердце с двумя предсердиями», «примитивный желудочек» [2, 3].
Ведущим признаком ЕЖС является сообщение обоих предсердий через митральный и трёхстворчатый клапаны с общим желудочком. При этом типе аномалии строение сердца трёхкамерное. Закладка сердца человека начинается с 3-4 недели беременности и характеризуется парным скоплением мезенхимных клеток в задней части головного отдела эмбрионального щитка под висцеральным листком мезодермы [4].
Процесс формирования межжелудочковой перегородки также происходит на 3–4 неделях беременности. По современным данным, пороки развития органов возникают в эмбриогенезе на 30–56 дни беременности [5].
Под влиянием тератогенных факторов, либо генетической мутации межжелудочковая перегородка формируется либо не до конца с образованием в ней дефекта, либо не формируется вовсе с развитием общей желудочковой камеры в трехкамерном сердце. Как показывают результаты научно-исследовательских работ, известно более 200 вариантов врождённых пороков сердца [6, 7].
Основными причинами рождения детей с врождёнными пороками сердца являются хромосомные нарушения; мутация одного гена; внешние факторы (алкоголизм, перенесённые во время беременности вирусные инфекции, приём лекарственных препаратов и т.д.). Исследования показывают, что частота ЕЖС составляет около 0,13 на 1000 новорожденных, а в структуре всех ВПС — 1,7% [8, 9].
ЕЖС значительно чаще встречается у лиц мужского пола по сравнению с женским полом. В настоящее время выделяют несколько типов ЕЖС (Таблица 1).
По отдельным сообщениям, примерно 75% больных с ЕЖС погибают на первом году жизни, средняя продолжительность жизни больных 6,7 лет [8]. К тому же у лиц с ЕЖС старших возрастных групп имеется множество сопутствующих заболеваний [10].
Таблица 1
АНАТОМИЧЕСКАЯ КЛАССИФИКАЦИЯ ЕДИНСТВЕННОГО ЖЕЛУДОЧКА СЕРДЦА
|
Тип Частота встречаемости |
Характеристика |
|
А тип 74% |
Единый желудочек сердца представлен миокардом левого желудочка. Приточный отдел правого желудочка отсутствует, но имеется небольшая рудиментарная камера выводного тракта - выпускник. Он представляет собой гладкостенную камеру, расположенную на передней поверхности сердца, от которой отходят оба (или один) магистральных сосуда. Полость единственного желудочка пересекается развитым мышечным тяжем, ограничивающим вход в выпускник. Тяж, вероятно, следует считать неправильно расположенной межжелудочковой перегородкой, так как в толще его проходит пучок Гиса. Этот тип обусловлен врожденным пороком развития желудочковой петли сердца: единый левый желудочковый синус, вследствие отсутствия правого желудочкового синуса. |
|
В тип 5% |
Весь миокард имеет строение правого желудочка. Выпускника нет. Это обусловлено единым правым желудочковым синусом вследствие отсутствия левого желудочкового синуса. |
|
С тип 7% |
Миокард имеет строение как левого так и правого желудочка, но межжелудочковая перегородка отсутствует или имеется ее рудимент. Этот тип порока обусловлен отсутствием или рудиментарным развитием синусовой части желудочковой перегородки. |
|
Д тип 10% |
Не имеет дифференцировки миокарда, нет ни выпускника, ни межжелудочковой перегородки. Характеризуется отсутствием, как правого, так и левого желудочкового синуса и межжелудочковой перегородки. |
При ЕЖС происходит смешивание артериальной и венозной крови. В аорте и лёгочной артерии, отходящих непосредственно от желудочка — одинаковое давление, что приводит к развитию лёгочной гипертензии. Как отмечено в работе Е. Г. Скородумовой с соавторами, в зависимости от варианта расположения магистральных артерий выделяют несколько типов. Так, тип I характеризуется нормальным расположением магистральных артерий; тип II-D – транспозиционным расположением магистральных артерий и тип III- L – транспозиционным расположением магистральных артерий [11].
Описание клинического случая
Пациент, 19 лет, находится под наблюдением кардиолога на кафедре факультетской терапии КГМА им. И.К. Ахунбаева с диагнозом: Врожденный порок сердца. Транспозиция магистральных сосудов. Единственный желудочек сердца. Рестриктивный дефект межжелудочковой перегородки. Аневризма легочной артерии. Легочная гипертензия. Хроническая сердечная недостаточность, функциональный класс II-III по NYHA (New York Heart Association). Вторичный эритроцитоз. Хронический кардиоренальный синдром (II тип). Хроническая болезнь почек С1 А1. Белково-энергетическая недостаточность I степени.
Жалобы: умеренная одышка при ходьбе и физической нагрузке, мышечная слабость.
Anamnesis morbi: с детства установлен врожденный порок сердца. Транспозиция магистральных сосудов. Единственный желудочек сердца (Рисунок 1, 2).
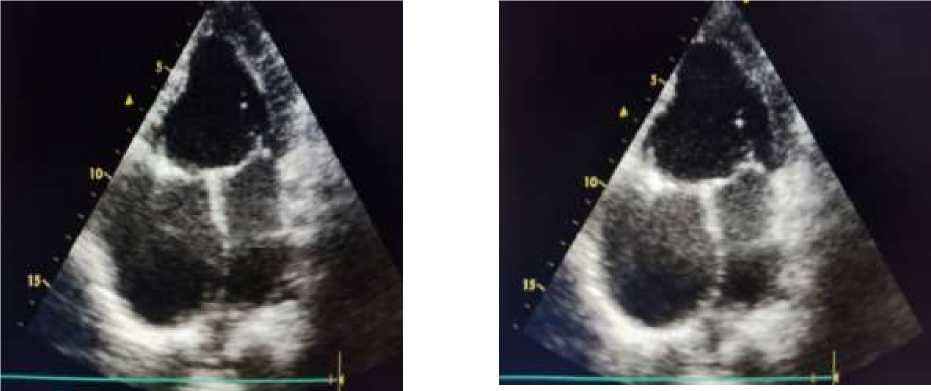
Рисунок 1. Единственный желудочек сердца. Парастернальная позиция по длинной оси, правое и левое предсердия, межпредсердная перегородка, митральный клапан, единственный желудочек
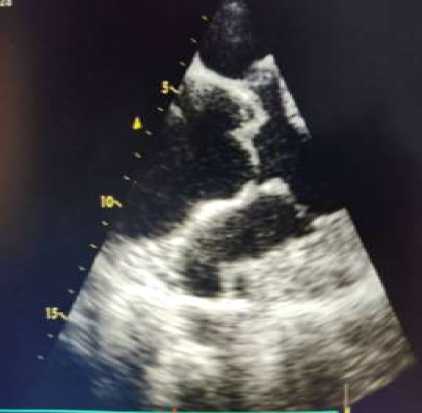
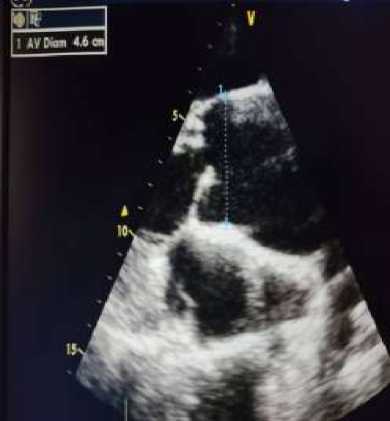
Рисунок 2. Единственный желудочек сердца. Левое и правое предсердия, единственный желудочек, атриовентрикулярные клапаны
В оперативной коррекции порока сердца больному было отказано. Наблюдался у терапевта по месту жительства. Принимает ингибиторы ангиотензинпревращающего фермента (каптоприл). В 2020 году, при плановом обследовании, в клиническом анализе мочи были выявлены протеинурия (белок в утренней порции мочи 4,26 г/л) и гематурия (эритроциты более 20-30 в п/з). Осмотрен урологом и нефрологом, установлен синдром — хроническая болезнь почек. Хронический кардиоренальный синдром (II тип). Белковоэнергетическая недостаточность I степени. Объективно: рост 155 см, вес 43 кг, индекс массы тела (ИМТ) 18 кг/м2, астенического телосложения, умеренного питания, кожные покровы нормальной окраски, сухие. Акроцианоз губ, который выражен больше при физической нагрузке и имеет голубой оттенок, пальцы по типу «барабанных палочек» (Рисунок 3, 4), положительный симптом часовых стекол (Рисунок 4), периферических (видимых) отеков нет.
Сердечный толчок разлитой, приподнимающийся, границы сердца расширены в обе стороны, систолическое дрожание на верхушке. При аускультации: II тон над легочной артерией усилен (легочная гипертензия или левопозиция аорты), слабо расщеплен, пансистолический шум (прохождение крови через выпускник) определяется в сочетании с III тоном и мезодиастолическим шумом вдоль левого края грудины и на верхушке. На верхушке выслушивается систолический шум недостаточности митрального клапана, в третьем межреберье слева имеется грубый систолический шум типа изгнания. Печень — у края правой реберной дуги. Селезенка и почки не пальпируются.

Рисунок 3. Пальцы в виде барабанных палочек (пальцы Гиппократа).
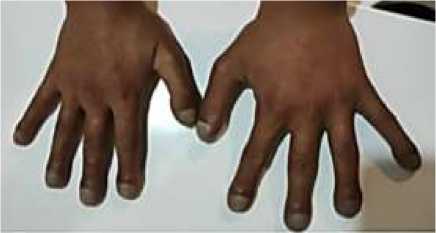
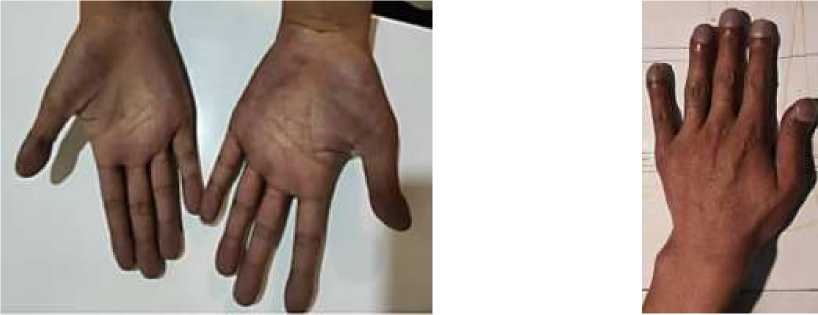
Рисунок 4. Синюшность кистей рук и кончиков пальцев.
Из Таблицы 2 видно, что концентрация гемоглобина, гематокрита и число эритроцитов периферической крови значительно превышают норму. Стоит заметить, что эритроцитарные индексы (MCV, MCH, MCHC), а также диапазон распределения эритроцитов были в пределах референсных значений. Повышение уровня Д-димера крови не выявлялось (Таблица 3). В биохимическом анализе крови (Таблица 3) отмечалось двукратное повышение содержание мочевой кислоты сыворотки крови (16,0 мг/дл при норме 3,5-7,2 мг/дл). Примечательно, что уровни электролитов сыворотки крови были оптимальными.
Как следует из Таблицы 3, отмечается дисбаланс в цитокиновом статусе пациента: содержание фактора некроза опухоли-альфа завышено (10,414 пг/мл при норме до 6 пг/мл), а уровни интерлейкина — 6 (9,797 пг/мл при норме до 10 пг/мл) и VEGF крови (651,28 пг/мл при норме 10-700 пг/мл) имеют тенденцию к подъёму.
Скорость клубочковой фильтрации (СКФ), оцененная по формуле CKD-EPI с использованием креатинина крови показал гиперфильтрацию (137 мл/мин/1,73 м2). В то же время расчет скорости клубочковой фильтрации по методике Хоуке на основе цистатина С крови, напротив, продемонстрировал снижение фильтрационной функции почек (расчетная СКФ = 49 мл/мин/1,73 м2).
Как видно из Таблицы 3, у нашего пациента с ЕЖС обнаружена протеинурия (утренней порции мочи общий белок 1,51 г/л). Здесь нужно подчеркнуть, что в последние шесть месяцев у пациента наблюдалась протеинурия (утренней порции мочи общий белок 4,31 г/л). С помощью эхокардиографии (3D-, M-режим, цветное допплеровское сканирование) была выявлена картина ЕЖС (Рисунок 1).
Диаметры аорты (восходящая), а также левого предсердия превышали нормативные показатели. Конечный диастолический и конечный систолический размеры ЕЖС были увеличенными, составляя 6,8 см и 4,5 см, соответственно. Наблюдался подъем давления в легочной артерии (42 мм рт. ст.).
Таблица 2
ЛАБОРАТОРНЫЕ АНАЛИЗЫ ПАЦИЕНТА ПРИ ПЛАНОВОМ ОБСЛЕДОВАНИИ
|
Показатель |
Значение |
Референтные значения |
|
|
Эритроциты, х 1012/л |
>7,1 |
4.3-5.7 |
|
|
Гемоглобин, г/л |
237 |
131-172 |
|
|
Гематокрит, % |
66,1 |
39-49 |
|
|
Тромбоциты, х 109/л |
156 |
159-376 |
|
|
Лейкоциты, х 109/л |
9,836 |
4 - 11 |
|
|
Эритроцитарные индексы периферической крови |
|||
|
Средний объем эритроцитов (MCV), фл |
93 |
80-99 |
|
|
Среднее содержание гемоглобина в эритроците (MCH), пг |
33 |
27-34 |
|
|
Средняя концентрация гемоглобина в эритроците (MCHC), г/дл |
35,8 |
32-37 |
|
|
Диапазон распределения эритроцитов (RDW), % |
13,5 |
11,5-14,5 |
|
|
Лейкоцитарные индексы периферической крови |
|||
|
Нейтрофилы (%N), % |
43,92 |
47-72 |
|
|
Нейтрофилы (NEU), x109/л |
4,222 |
2,04-5,8 |
|
|
Эозинофилы (E%), % |
0,1592 |
1-5 |
|
|
Эозинофилы (EOS), x109/л |
0,0172 |
0,2-0,3 |
|
|
Базофилы (%B) |
0,029 |
0-1 |
|
|
Базофилы (BASO), x109/л |
0,012 |
0-0,065 |
|
|
Лимфоциты (%L), % |
47,17 |
19-37 |
|
|
Лимфоциты (LYM), x109/л |
4,639 |
1,2-3,0 |
|
|
Моноциты (%M) |
8,72 |
3-11 |
|
|
Моноциты (MONO#), x109/л |
0,477 |
0,09-0,6 |
|
|
Скорость оседания эритроцитов, мм/ч (по Вестергрену) |
5 |
2-15 |
|
|
Таблица 3 БИОХИМИЧЕСКИЕ АНАЛИЗЫ ПАЦИЕНТА ПРИ ПЛАНОВОМ ОБСЛЕДОВАНИИ |
|||
|
Показатель |
Значение Референтные значения |
||
|
Глюкоза, ммоль/л |
5,5 |
3,8-5,82 |
|
|
Общий белок, г/л |
73 |
64-83 |
|
|
Альбумин, г/л |
32 |
33-50 |
|
|
Мочевая кислота, мг/дл |
16,0 |
3,5-7,2 |
|
|
Магний, ммоль/л |
0,92 |
0,73-1,06 |
|
|
Калий, ммоль/л |
4,3 |
3,4-5,5 |
|
|
Кальций, ммоль/л |
2,11 |
2,11-2,55 |
|
|
Натрий, ммоль/л |
137 |
136-145 |
|
|
Неорганический фосфор, ммоль/л |
1,35 |
0,87-1,45 |
|
|
Хлор, ммоль/л |
101 |
95-110 |
|
Бюллетень науки и практики / Bulletin of Science and Practice Т. 10. №11 2024
|
Показатель |
Значение |
Референтные значения |
|
С-реактивный белок количественный, мг/л |
4,76 |
до 5 |
|
Реакция Вассермана/Rapid Plasma Reagin |
отриц |
отриц |
|
Фолиевая кислота, нг/мл |
4,2 |
3,1-20,5 |
|
Аланинаминотрансфераза, Ед/л |
15,3 |
0-20 |
|
Аспартатаминотрансфераза, Ед/л |
28,8 |
0-20 |
|
Липидный профиль |
||
|
Общий холестерин (ХС), ммоль/л |
4,4 |
до 5,17 |
|
ХС липопротеинов высокой плотности, ммоль/л |
1,3 |
от 1,2 |
|
ХС липопротеинов низкой плотности, ммоль/л |
2,1 |
2,6-3,34 |
|
Триглицериды, ммоль/л |
1,0 |
до 1,7 |
|
Гемостазиограмма |
||
|
Протромбиновый индекс по Квику,% |
105 |
95-105 |
|
Активированное частичное тромбопластиновое время, сек |
31,7 |
21-35 |
|
Протромбиновое время, сек |
34,6 |
14-20 |
|
Международное нормализованное отношение, ед |
1,84 |
0,81-1,25 |
|
Фибриноген, г/л |
3,12 |
1,8-3,5 |
|
Д-димер, мг FEU/л |
0,434 |
0-0,55 |
|
Цитокиновый профиль |
||
|
Интерлейкин-10, пг/мл |
4,464 |
до 30 |
|
Интерлейкин-6, пг/мл |
9,797 |
до 10 |
|
Фактор некроза опухоли-альфа (TNF-α), пг/мл |
10,414 |
до 6 |
|
Фактор роста эндотелия сосудов (VEGF), пг/мл |
651,28 |
10-700 |
|
Функциональное состояние почек |
||
|
Креатинин, мкмоль/л |
62,1 |
62-115 |
|
Цистатин С, мг/л |
1,61 |
0,31-0,79 |
|
Гомоцистеин, мкмоль/л |
14,42 |
5,46-16,2 |
|
Мочевина, ммоль/л |
5,7 |
2,5-8,3 |
|
Расчетная скорость клубочковой фильтрации, |
137 мл/мин/1,73м2 по креатинину |
|
|
Расчетная скорость клубочковой фильтрации |
49 мл/мин/1,73м2, по цистатину С |
|
|
Клиренс креатинина по формуле Кокрофта-Голта, |
131 мл/мин/1,73м2 |
|
|
Канальцевая реабсорбция, |
99% |
|
|
Проба Реберга-Паульса-Тареева, |
104,3 |
мл/мин/1,73м2 |
|
Протеинурия в разовой утренней моче, |
1,51 г/л |
|
|
Анализ мочи по «Литос» системе, протеинурия, |
2,1 г/л |
|
|
Обсуждение Одно из ведущих мест среди врождённых пороков развития занимают врождённые пороки сердца. Частота врождённых пороков сердца составляет от 2,4 до 14,2 на 1000 новорождённых [6-8]. Весьма важным является своевременная диагностика врождённых пороков сердца и проведение соответствующей хирургической коррекции. Если своевременное лечение не проводится, то на 1 году жизни погибает примерно 55% детей с врождёнными пороками сердца, а до 5-летнего возраста — 85% [8, 10]. Согласно классификации врожденных пороков сердца ЕЖС относится к порокам |
||
«цианотического типа» [8].
В настоящее время хирургическая коррекция анатомического дефекта, лечение недостаточности кровообращения, купирование и профилактика осложнений при врожденных пороках сердца всё ещё продолжают оставаться предметом активного изучения. Лица с врожденными пороками сердца в возрасте старше 18 лет — это, как правило, пациенты, которые в детстве по тем или иным причинам не были прооперированы. В представленном случае ЕЖС у пациента осложнился присоединением хронического кардиоренального синдрома. Раннее выявление поражения почек при врожденных пороках сердца очень важно для оценки риска, выработки стратегии и тактики ведения пациентов, поскольку почки участвуют в метаболических процессах, регуляции гуморальной системы, процессах микроциркуляции, а также подвержены острым и хроническим воздействиям при различных заболеваниях и влияют на формирование и прогрессирование сердечнососудистой патологии. Даже небольшое снижение функции почек значительно усугубляет течение сердечно-сосудистых заболеваний. Нужно сказать, что у нашего пациента с ЕЖС протеинурия сочеталась с повышением уровня провоспалительных цитокинов крови (TNF-α = 10,414 пг/мл). В исследованиях последних лет продемонстрировано прямое повреждающее действие TNF-α на структуру клубочков и эндотелий сосудов почек. Провоспалительные цитокины могут индуцировать тканевое воспаление и, как следствие, нефрофиброз [12].
По-видимому, гиперпродукция TNF-α сопровождается повышением продукции ангиогенных факторов роста, таких как VEGF (табл.3). С другой стороны, TNF-α принимает активное участие в развитии иммунного ответа, запускает пролиферацию Т- и В-лимфоцитов, активирует макрофаги [13].
Хронические эффекты повышенного уровня TNF-α у лиц с врожденными пороками сердца проявляются в виде дефицита массы тела, что и отмечено в нашем наблюдении (показатель ИМТ у пациента равнялся 18 кг/м2). Вместе с тем, уровень TNF-α коррелирует с вероятностью наступления неблагоприятного исхода при врожденных пороках сердца. В нашем случае с ЕЖС, данные эхокардиографического исследования свидетельствуют об увеличении давления в легочной артерии (Таблица 4).
Таблица 4
КОЛИЧЕСТВЕННЫЕ ПОКАЗАТЕЛИ ЭХОКГ ИССЛЕДОВАНИЯ
|
Показатель |
Значение |
Референтные значения |
|
Аорта в восходящем отделе, см |
5,6 |
2,0-4,0 |
|
Левое предсердие, см |
5,3 |
1,9-4,0 |
|
Конечный диастолический размер желудочка, см |
6,8 |
4,0-5,5 |
|
Конечный систолический размер желудочка, см |
4,5 |
2,5-3,8 |
|
Конечный диастолический объем желудочка, мл |
241 |
59-157 |
|
Конечный систолический объем желудочка, мл |
91 |
18-68 |
|
Ударный объем желудочка, мл |
150 |
44-100 |
|
Фракция выброса желудочка, % (Simpson) |
62 |
|
|
Межжелудочковая перегородка, см |
0,9 |
0,6-1,0 |
|
Толщина задней стенки желудочка, см |
0,9 |
0,6-1,0 |
|
Легочная артерия, см |
1,5 |
<2,5 |
|
Систолическая экскурсия кольца трёхстворчатого клапана, см |
2,7 |
>1,7 |
|
Систолическое легочное артериальное давление, мм рт. ст. |
42 |
Системное воспаление, представленное повышенными уровнями TNF-α, вызывает пролиферацию гладкомышечных клеток, усиливает апоптоз эндотелия и, тем самым, приводит к структурно-функциональным изменениям сосудов [14].
У лиц с врожденными пороками сердца, как правило, развивается воспалительный процесс, связанный с инфильтрацией макрофагов и моноцитов в почках. Что, в свою очередь, становится источником повышения числа целого ряда медиаторов воспаления, таких как интерлейкин-6 и TNF-α. В ряде работ установлено, что TNF-α и интерлейкин-6 оказывают прямое повреждающее действие на структуру и функцию почек путем пролиферации эндотелиальных клеток клубочка и увеличения продукции коллагена IV типа, приводя к формированию гломерулосклероза и развитию протеинурии даже при нормальном уровне артериального давления [15].
Интересно отметить, что в нашем наблюдении у пациента с ЕЖС отмечались повышенные уровни мочевой кислоты крови (16,0 мг/дл). В доступной литературе мы не нашли подобных изменений в показателях пуринового обмена при ЕЖС. Повреждающее действие избыточного содержание мочевой кислоты на эндотелий сосудов общеизвестно. Гиперурикемия непосредственно увеличивает проницаемость базальной мембраны клубочков, что способствует нарастанию протеинурии [16].
В условиях гиперурикемии наблюдается спазм преимущественно выносящей артериолы клубочков и это обусловливает повышение внутриклубочкового давления, а также увеличение градиента почечного транскапиллярного давления. Известно, что спазм клубочковых артерий может приводить к перераспределению крови в почке: увеличивается шунтирование ее в сосуды почечных пирамид, что ведет к частичной ишемии структур почечной коры [16]. Таким образом, ЕЖС приводит к прогрессивному повреждению почек через множество механизмов. В результате указанных изменений наблюдается усиление процессов фильтрации — гиперфильтрация, и увеличение поступления альбуминов в первичную мочу. Стоит подчеркнуть, что у пациента 19 лет с ЕЖС скорость клубочковой фильтрации, оцененная по формуле CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) [17], показал гиперфильтрацию (расчетная СКФ = 137 мл/мин/1,73м2), тогда как, расчет фильтрационной функции почек с использованием цистатина С крови по методике Хоуке [18] продемонстрировал снижение ренальной функции (расчетная СКФ = 49 мл/мин/1,73м2).
Еще несколько лет назад, для ранней диагностики нефропатий у лиц с высоким риском развития хронической болезни почек в программу диагностического обследования, помимо общепринятых показателей, было рекомендовано включение определения уровня цистатина С крови [19].
Так как, в отличие от креатинина концентрация цистатина С сыворотки крови практически не зависит от массы тела, характера питания. Стабильные уровни цистатина С в сыворотке крови определяются, прежде всего, ренальными функциями. Поэтому научные исследования последних лет у лиц с пороками сердца в направлении изучения биомаркеров формирования хронической болезни почек проводятся с оценкой уровня показателей цистатина С в сыворотке крови и мочи [20].
Перспективным направлением патогенетической профилактики и лечения хронического кардиоренального синдрома при ЕЖС является междисциплинарный подход, в рамках которого особый интерес представляют такие ключевые компоненты не гемодинамических факторов, как гиперцитокинемия и гиперурикемия, оказывающие разносторонние патофизиологические эффекты, способные приводить к развитию и прогрессированию хронической болезни почек.
Заключение
В представленном клиническом случае описан единственный желудочек сердца у пациента 19 лет, который, вследствие отсутствия хирургической коррекции анатомического дефекта сердца в детском возрасте, осложнился хроническим кардиоренальным синдромом II типа. Факторами, способствующими кардиальной и ренальной патологии, явились гиперцитокинемия, гиперурикемия и протеинурия. В этой связи, у пациентов с врожденными пороками сердца «цианотического типа», наряду с регулярной оценкой интракардиальной гемодинамики, необходимо мониторировать концентрацию мочевой кислоты и TNF-α, а также протеинурию.
Список литературы Единственный желудочек сердца в сочетании с транспозицией магистральных сосудов в практике врача: клинический случай
- Кэмма А. Д., Люшера Т. Ф., Серруиса П. В. Болезни сердца и сосудов: руководство Европейского общества кардиологов. М.: ГЭОТАР-Медиа, 2011. 1437 с.
- Князова Г. Ж. Единственный желудочек сердца (случай из клинической практики) // Клиническая медицина Казахстана. 2011. №3, 4 (22, 23). С. 106-108.
- Van Praagh R., Van Praagh S., Vlad P., Keith J. D. Diagnosis of the anatomic types of single or common ventricle // American Journal of Cardiology. 1965. V. 15. №3. P. 345-366. https://doi.org/10.1016/0002-9149(65)90329-2
- Гурин А. М. Структурно-функциональные особенности сердченой мышечной ткани человека // Современные наукоемкие технологии. 2009. №11. С. 28-40.
- Heaton J., Heller D. Single Ventricle // StatPearls. StatPearls Publishing, 2023.
- Ослопов В. Н., Макаров М. А., Хабибуллина Р. Т., Афанасьева Т. Ю. Случай единственного двухприточного желудочка сердца с транспозицией магистральных сосудов // Казанский медицинский журнал. 2012. Т. 93. №1. С. 142-144.
- Самигуллина Д. Н., Цибулькин Н. А. Врождённая аномалия сердца "единственный желудочек": структурно-функциональная диагностика в повседневной практике // Казанский медицинский журнал. 2016. Т. 97. №2. С. 295-299. https://doi.org/10.17750/KMJ2016-295
- Бокерия Л. А. Клинические рекомендации по ведению детей с врожденными пороками сердца. М., 2014. 342 с.
- Jacobs M. L., Mayer Jr J. E. Congenital heart surgery nomenclature and database project: single ventricle // The Annals of thoracic surgery. 2000. V. 69. №3. P. 197-204. https://doi.org/10.1016/s0003-4975(99)01245-x
- Спринджук М. В. Нарушение функции печени, поджелудочной железы и почек после операции Фонтена // Российский кардиологический журнал. 2008. №2. С. 82-85.
- Скородумова Е. Г., Скородумова Е. А., Костенко В. А., Шуленина Ю. Б., Гайворонский И. В., Ильина В. А., Федоров А. Н. Клинический случай тромбоэмболии мелких ветвей легочной артерии на фоне единственного желудочка сердца ID-типа с развитием кава-кавальных венозных коллатералей // Кардиология. 2019. Т. 59. №7S. С. 53-60. https://doi.org/10.18087/cardio.2664
- Black L. M., Lever J. M., Agarwal A. Renal inflammation and fibrosis: a double-edged sword // Journal of Histochemistry & Cytochemistry. 2019. V. 67. №9. P. 663-681. https://doi.org/10.1369/0022155419852932
- Liu P., Zhang Z., Li Y. Relevance of the pyroptosis-related inflammasome pathway in the pathogenesis of diabetic kidney disease // Frontiers in immunology. 2021. V. 12. P. 603416. https://doi.org/10.3389/fimmu.2021.603416
- Rabinovitch M., Guignabert C., Humbert M., Nicolls M. R. Inflammation and immunity in the pathogenesis of pulmonary arterial hypertension // Circulation research. 2014. V. 115. №1. P. 165-175. https://doi.org/10.1161/CIRCRESAHA.113.301141
- Papafragkaki D. K., Tolis G. Obesity and renal disease: a possible role of leptin // Hormones. 2005. V. 4. №2. P. 90-95.
- Asakawa S., Shibata S., Morimoto C., Shiraishi T., Nakamura T., Tamura Y., Uchida S. Podocyte injury and albuminuria in experimental hyperuricemic model rats // Oxidative Medicine and Cellular Longevity. 2017. V. 2017. №1. P. 3759153. https://doi.org/10.1155/2017/3759153
- Levey A. S., Stevens L. A., Schmid C. H., Zhang Y., Castro III A. F., Feldman H. I., CKDEPI A new equation to estimate glomerular filtration rate //Annals of internal medicine. 2009. V. 150. №9. P. 604-612. https://doi.org/10.7326/0003-4819-150-9-200905050-00006
- Hoek F. J., Kemperman F. A. W., Krediet R. T. A comparison between cystatin C, plasma creatinine and the Cockcroft and Gault formula for the estimation of glomerular filtration rate // Nephrology Dialysis Transplantation. 2003. V. 18. №10. P. 2024-2031. https://doi.org/10.1093/ndt/gfg349
- Inker L. A., Schmid C. H., Tighiouart H., Eckfeldt J. H., Feldman H. I., Greene T., Levey A. S. Estimating glomerular filtration rate from serum creatinine and cystatin C // New England Journal of Medicine. 2012. V. 367. №1. P. 20-29. https://doi.org/10.1056/NEJMoa1114248
- Kee Y. K., Han S. Y., Kang D. H., Noh J. W., Jeong K. H., Kim G. H., Kim B. S. Comparison of different types of oral adsorbent therapy in patients with chronic kidney disease: a multicenter, randomized, phase IV clinical trial // Yonsei Medical Journal. 2020. V. 62. №1. P. 41. https://doi.org/10.3349/ymj.2021.62.1.41


