Фактор фон виллебранда как показатель эндотелиальной дисфункции сосудов щитовидной железы при двигательных нагрузках
Автор: Безденежных А.В., Гришина Н.И.
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.29, 2021 года.
Бесплатный доступ
Изучение структурно-функциональных особенностей щитовидной железы является предметом интереса как для клиницистов, так и для представителей фундаментальной медицинской науки, что связано с распространенностью заболеваний этого органа. Одной из причин нарушения тиреоидного статуса является эндотелиальная дисфункция, вызванная стрессом или физическими нагрузками. Под влиянием мышечной деятельности в сосудистом русле щитовидной железы происходит расширение просвета сосудов, набухание базальной мембраны с дистрофическими изменениями эндотелиоцитов, нарушения гемоциркуляции по типу перивенулярных и перикапиллярных геморрагий, степень этих изменений связана с параметрами двигательных нагрузок. Одним из критериев оценки эндотелиальной дисфункции сосудов может служить оценка активности фактора фон Виллебранда. Не существует единой точки зрения на использование плазматической (системой) или тканевой (местной) фракции фактора для оценки состояния сосудистого русла. Цель исследования - оценка состояния сосудистого русла щитовидной железы собак при различных видах двигательной активности с использованием иммуногистохимического метода определения внутристеночной фракции фактора фон Виллебранда. Объектом измерений стали поперечные срезы различных топографических зон центральной части правой доли органа у 16 контрольных и 67 экспериментальных собак-самцов, получавших однократные и многократные мышечные нагрузки при динамическом контроле частоты сердечных сокращений. Во всех анализируемых звеньях сосудистого русла выявлялась реакция с антителами к фактору в эндотелиальном слое, субэндотелиальном пространстве и лишь в единичных наблюдениях - в мышечном слое сосудов. Показано, что физические нагрузки оказывали влияние на выраженность экспрессии фактора сосудистой стенки щитовидной железы, при этом однократные тренировки в большей степени вызывали разнонаправленную реакцию артерий и вен в центре, эффекты многократных локализовались в микроциркуляторном русле преимущественно на периферии. При анализе полученных результатов показано, что более информативным критерием оценки являются не абсолютные значения экспрессии фактора, зависящие от вида сосудов, а коэффициент отношения площади иммуногистохимической реакции к площади стенки сосуда, отражающий избирательную активность эндотелия и определяющийся кратностью и длительностью воздействия.
Щитовидная железа, фактор виллебранда, иммуногистохимия, сосуды, двигательная активность
Короткий адрес: https://sciup.org/143178428
IDR: 143178428 | DOI: 10.20340/mv-mn.2021.29(3).537
Текст научной статьи Фактор фон виллебранда как показатель эндотелиальной дисфункции сосудов щитовидной железы при двигательных нагрузках
Безденежных А.В., Гришина Н.И. Фактор фон Виллебранда как показатель эндотелиальной дисфункции сосудов щитовидной железы при двигательных нагрузках. Морфологические ведомости. 2021;29(3):537. (3).537
Bezdenezhnykh AV, Grishina NI. The Willebrand factor as an indicator of endothelial dysfunction of the thyroid vessels under motor loads. Morfologicheskie Vedomosti - Morphological newsletter. 2021;29(3):537. (3).537
Введение. Актуальность изучения сосудистого русла щитовидной железы (далее - ЩЖ) не вызывает сомнений, что связано с распространенностью заболеваний органа, одним из способов формирования эутириоидного статуса органа является двигательная активность [1]. Под влиянием мышечной деятельности в сосудистом русле ЩЖ происходят внутрисосудистые (расширение просвета сосудов), сосудистые (набухание базальной мембраны с дистрофическими изменениями эндотелиоцитов) и внесосудистые изменения (нарушения гемоциркуляции по типу перивенулярных и перикапиллярных геморрагий) [2-3], степень этих изменений связана с параметрами двигательных нагрузок. Критерием оценки состояния сосудов органа может служить фактор фон Виллебранда (далее - фВ) определяемый имунногистохимическим (далее -ИГХ) методом.
ФВ – многофункциональный муль-тимерный гликопротеин плазмы крови, являющийся биомаркером сосудистого повреждения в тканях ЩЖ [4]. Выделяют две фракции фВ: тканевой (местный), который синтезируется эндотелиоцитами и хранится в тельцах Вайбеля-Паладе [5], и плазматический (системный), синтезирующийся мегакариоцитами костного мозга, который локализуется в α-гранулах тромбоцитов [6]. Системный фВ постоянно циркулирует в плазме крови в небольшом количестве в ответ на сосудистую травму он связывается с тромбоцитами или субэндотелиальными элементами мембраны. Тканевой фВ в участке повреждения сосуда объединяется с фактором свертывания крови VIII [7].
Ряд авторов считают, что в качестве маркера эндотелиальной дисфункции более целесообразно использовать плазматическую фракцию фВ, поскольку состояние экстраваскулярной иммунореактивности линейно не коррелирует с выраженностью гистологических признаков повреждения сосудов [8]. Другие исследователи считают более объективным критерием реакцию тканевого (внутристеночного) фВ, так как эндотелиоциты с признаками экзоцитоза более объективно отражают локальные адаптационные изменения сосудистого русла [9].
Цель исследования - о ценить состояние сосудистого русла ЩЖ собак в ответ на различные виды двигательной активности на основании иммуногистохимического анализа внутристеночной фракции фВ.
Материалы и методы исследования. Животные (собаки-самцы возраста от 1,5 до 2-х лет) содержались в виварии на стандартном рационе питания сроком не менее одного месяца, при этом фиксировалась продолжительность светового дня, температура окружающей среды. Контрольная группа представлена 16 животными, средняя частота сердечных сокращений (далее - ЧСС в группе составляла 125±6,92 уд/мин).
Экспериментальные группы получали однократные и многократные нагрузки (бег на ленте тредмила со скоростью 15 км/час) при динамическом контроле ЧСС. Однократные нагрузки представлены тремя видами воздействий: 1) тренирующего характера – 8 животных, время бега 27,76±4,67 мин, ЧСС 205±10,15 уд/мин; 2) стартового характера – 11 собак, время бега 8,25±0,73 мин при ЧСС 201±13,47 уд/мин; 3) предельными нагрузками – 12 животных 73,14±14,97 мин, ЧСС 191±6,41 уд/мин. Многократные воздействия были в виде циклов тренировок, каждый из которых состоял из тренирующих индивидуально дозированных двигательных нагрузок и стартовых нагрузок и представлены тремя группами. Первая группа (12 животных) – общее количество нагрузок цикла 23,25±0,66 – среднее время бега время бега при тренировке 45,64±1,83 мин, ЧСС 169±1,85 уд/мин. Во второй группе (10 собак) – общее количество нагрузок 55,50±2,45 моделировали последовательно три цикла воздействий – среднее время бега 64,02±3,4 мин при ЧСС 168±2,35 уд/мин. В третьей группе у 11 животных формировали четыре цикла (общее количество нагрузок 70,54±2,52), время бега составило 71,3±2,56 мин при средней ЧСС 173,59±2,56 уд/мин.
Исследования на животных проведены в соответствии с приказами Минвуза СССР № 742 от 13.11.84 «Об утверждении правил проведения работ с использованием экспериментальных животных» и № 48 от 23.01.85 «О контроле за проведением работ с использованием экспериментальных животных», положениями Европейской Конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (1986). Проведение исследования одобрено решением локального этического комитета № 313 от 21.12.18. Взятие материала осуществляли под внутривенным общим комбинированным наркозом (2% ромитар, золетил-50) и управляемым внешним дыханием в стандартное время суток – 10-12 часов дня.
Исследования проводили на поперечном срезе центральной части правой доли ЩЖ, материал фиксировали в 10% нейтральном формалине с последующей спиртовой проводкой по стандартной гистологической методике и заливкой в па-рафин-целлоидиновые блоки. Для иммуногистохимического анализа эндотелия сосудистого русла, согласно рекомендациям [10], использовали поликлональные антитела (FLEX Polyclonal Rabbit Anti-Human Von Willebrand Factor, Ready-to-Use Unconjugated, Dako Omnis, Швеция). Па-рафин-целлоидиновые серийные срезы ЩЖ толщиной 3 мкм на предметных стеклах, обработанных L-полизином (Германия) очищали от парафина в ксилоле и спиртах. Для удаления целлоидина использовалась дополнительная обработка в этоксиэтан-этаноле 1:1 и 100% этаноле по 15 мин. Для блокирования эндогенной пероксидазы срезы помещали на 10 мин в 3% раствор Н2O2. Идентификация антигенов к фВ требовала предварительной обработки 0,1% трипсином с 0,1% кальцием хлоридом на фосфатно-солевом (далее – PBS) буфере с pH=7,6 в течение 1 мин. После обработки предметные стекла помещали в буфер PBS (рН=7,6) с добавлением 0,05% твина-20. Затем срезы обрабатывались бычьим сывороточным альбумином, чтобы предотвратить окрашивание фона, а затем инкубировали в течение 1 часа с первичными антителами при комнатной температуре в увлажненной камере. Предметные стекла промывали в течение 3-4 мин в PBS и инкубировали 20 мин с биотинилированными связанными антителами и 30 мин с метящим реагентом пероксидазы сопряженным со стрептавидином (LSAB+Detection System DAKO, Швеция). После промывания пероксидазная метка была обнаружена с помощью 3,3 диаминобензидина (далее -DAB) в течение 13 мин, контрастно окрашена гематоксилином Майера и препарат заключен в бальзам. DAB давал коричневую окраску выявляемых структур. Негативный контроль проводили, используя идентичную методику, но при этом не включая первичное антитело и не добавляя стрептави-дин-биотиновый комплекс.
Оценивали площадь эндотелия сосудов ЩЖ, позитивного к фВ (мкм2) не менее чем в 40 полях зрения (окуляр ×10, объектив ×40) с помощью C-Mount адаптера камеры DS-Fi1 микроскопа Nikon ECLIPSE 90i+DIH-M при перемещении по всей площади среза. Характеристика сосудистого русла включала оценку качественных признаков: наполненность эритроцитами (признаки гиперемии), экспрессию фВ относительно стенки сосуда (внутрисосудистая и внутристеночная локализация), топографическое расположение сосудов на срезе относительно геометрического центра (центр, периферия, промежуточная зона) [11], дифференцировку вида сосудов (артерии, вены, сосуды микроциркуляторного русла, рис. 1). Объектом количественных измерений являлась внутристеночная фракция фВ. Для ее идентификации на оцифрованных срезах в графическом редакторе GIMP 2.10.221 выделялся сосуд и удалялось внутрисосудистое содержимое. В программе ImageJ после геометрической (с разрешением 0,09 мкм/пиксел изображения, 2560х1920 пикселов) и фотометрической калибровки проводили измерения абсолютных значений: площади, занимаемые сосудом (Sv, мкм2), стенкой сосуда с иммунологической реакцией фВ+ (SfwB, мкм2), длины эндотелия (Perim, мкм). Рассчитывали относительную площадь (SfwB/Sv), проводили оценку нормальности распределения, и в связи с ее отсутствием для каждой выборки вычисляли медиану (Мe) и квартили (Q1, Q3), проводили сравнение показателей исследуемых групп при помощи непараметрического U-критерий Манна — Уитни и корреляции
Спирмена, достоверными считали различия при уровне p<0,05.
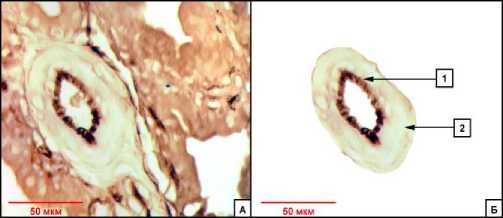
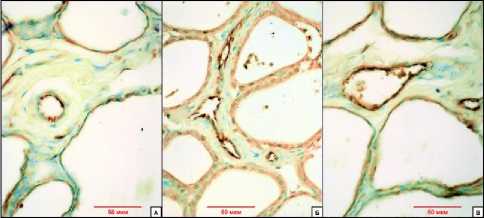
Рис. 1. Артериола ЩЖ у животного контрольной группы при оценке ИГХ-реакции на фВ до (А) и после обработки (Б) в графическом редакторе. Обозначения: 1 - эндотелий интимы с позитивной реакцией на фВ, 2 - стенка сосуда. Окр.: гематоксилином. Ув.: ×400.
Результаты исследования и обсуждение. Локальная экспрессия фВ+ является универсальным показателем эндотелиальной дисфункции [3, 9] однако при физических нагрузках как правило изучаются титры антител в плазме крови (внутрисосудистая фракция) [4, 12]. Исходя из цели исследования, мы исследовали внутристеночную фракцию фВ. Во всех анализируемых звеньях сосудистого русла нами выявлена экспрессия с антителами к фВ в эндотелиальном слое, субэндотелиальном пространстве и лишь в единичных наблюдениях - в мышечном слое сосудов. Мы не обнаружили ее в адвентиции и периваскулярной соединительной ткани. Это положение справедливо лишь в отношении крупных сосудов (артерий и вен), в сосудах микроциркуляторного русла (далее - МЦР) она наблюдалась в том числе в экстраваскулярном пространстве и внеклеточном матриксе (рис. 2).
ИГХ-окрашивание с использованием антител к внутристеночной фракции фВ+ в контрольной группе в артериях встречалась в 23,51%, в сосудах МЦР 21,12%, в венах 55,38%. При однократных тренирующих двигательных нагрузках реакция к фВ в артериях составила 19,8%, в МЦР - 26,96%, в венах 53,24%. При стартовых нагрузках возрастала в артериях до 24,08% и в МЦР до 34,97%, в венах уменьшалась до 40,95%. При воздействии нагрузок предельного характера она снижалась
Рис. 2. ИГХ-реакция на фВ в сосудах ЩЖ у животных экспериментальных групп. Обозначения: А - артериола, Б - сосуды микроциркуляции, В - венула. Окр.: гематоксилином. Ув.: ×400 .
в артериях до 17,33%, но увеличивалась в МЦР до 24,16% и в венах до 58,51%. При многократных нагрузках 1 и 2 группы реакция к фВ+ снижалась в артериях соответственно до 17,27% и до 5,53%, в венах до 44,78% и 47,99%, напротив, в МЦР увеличивалась до 37,95% и 46,48%. В группе многократных нагрузок № 3 реакция к фВ снижалась в артериях до 16,95%, но повышалась в сосудах МЦР до 25,54% и в венах до 57,51%.
Таким образом, бег животных оказывал влияние на выраженность экспрессии фВ сосудистой стенки ЩЖ, при этом однократные тренировки в большей степени вызывали разнонаправленную реакцию артерий и вен в центре среза, а многократные локализовались в МЦР преимущественно на периферии и при этом крупные сосуды затрагивались в меньшей степени.
В ЩЖ всех исследуемых групп фВ чаще всего выявлялся в стенке вен (51%), в сосудах МЦР (31%) и реже - в артериях (18%). При однократных и многократных воздействиях вовлечены сосуды МЦР. Площадь реакции фВ+ в МЦР увеличена во всех экспериментальных группах и не зависит от продолжительности бега. Реакция фВ в артериальном русле достигает максимальных значений в группе с однократными стартовыми нагрузками (минимальное время бега), у остальных экспериментальных групп она была ниже, чем в контроле. В венозной части сосудистого русла бóльшие значения реакции фВ характерны для однократных предельных нагрузок и многократных с самым продолжительным бегом, для остальных экспериментальных групп она была ниже, чем в контроле. Уровень тиреоидных гормонов и концентрация внутрисосудистой фракции фВ согласно исследованию ряда авторов [13-14] оказывают влияние на локальный кровоток провоцируя венозную тромбоэмболию.
Таблица 1
Площадь стенки сосудов щитовидной железы с иммуногистохимической реакцией к фактору Виллебранда (мкм2) и отношение площади реакции к площади сосудов при различных режимах двигательной активности, Me(Q1–Q3)
|
Группы |
Площадь |
Отношение площади реакции к площади сосудов |
|
Контроль (n=16) |
2497 (1080-5109) |
0,18 (0,11-0,26) |
|
Тренирующие нагрузки (n=8) |
1929 (806-4262) ## |
0,14 (0,08-0,24) # |
|
Стартовые нагрузки (n=12) |
1319 (562-3247) # |
0,24 (0,13-0,41) #* |
|
Предельные нагрузки (n=14) |
1699 (806-4058) # |
0,11 (0,06-0,18) # |
|
Многократные 1 (n=12) |
957 (411-2569) # |
0,17 (0,08-0,34)* |
|
Многократные 2 (n=10) |
1041 (361-3414) # |
0,17 (0,06-0,36) |
|
Многократные 3 (n=11) |
1823 (695-4389) # |
0,18 (0,10-0,29) |
Список литературы Фактор фон виллебранда как показатель эндотелиальной дисфункции сосудов щитовидной железы при двигательных нагрузках
- Bezdenezhnyh AV, Radaev AA, Fedotov VD, Miroshnichenko VV. Harakteristika follikulyarnyh tirocitov shchitovidnoj zhelezy pri razlichnyh rezhimah dvigatel'noj aktivnosti. Sovremennye problemy nauki i obrazovaniya. 2018;4. In Russian. URL: http://www.science-education.ru/ru/article/view?id=27883 (10.09.2018)
- Gragnano F, Sperlongano S, Golia E, Natale F, Bianchi R, Crisci M, Fimiani F, Pariggiano I, Diana V, Carbone A, Cesaro A, Concilio C, Limongelli G, Russo M, Calabro P. The role of von Willebrand factor in vascular inflammation: from pathogenesis to targeted therapy. Mediators of Inflammation. 2017;5620314:13. https://doi.org/10.1155/2017/5620314
- Chernova EV. Faktor Villebranda. Vestnik Severo-Zapadnogo gosudarstvennogo medicinskogo universiteta imeni I.I. Mechnikova. 2018;10(4):73-80. In Russian. https://doi.org/10.17816/mechnikov201810473-80
- Krogh AKH, Legind P, Kjelgaard-Hansen M, Bochsen L, Kristensen AT. Exercise induced hypercoagulability, increased von Willebrand factor and decreased thyroid hormone concentrations in sled dogs. Acta Veterinaria Scandinavica. 2014;56:11. https://doi.org/10.1186/1751-0147-56-11
- Suhorukova EG, Kirik OV, Korzhevskij DE. Vyyavlenie telec Vejbelya-Palade pri pomoshchi immunocitohimicheskoj reakcii na faktor Willebranda i konfokal'noj lazernoj mikroskopii. Morfologija. 2018;1(153):71-75. In Russian
- Gurina OYu, Gurin YaV, Pavlovich ER, Cyplenkova VG. Izuchenie specificheskih telets Vejbelya-Palade v endoteliocitah pri reparativnom angiogeneze. Voprosy morfologii XXI veka. Vyp. 2. Sbornik nauchnyh trudov, posvyashchennyj 80-letiyu so dnya rozhdeniya Alekseya Andreevicha Klishova. Pod redakciej R.K. Danilova, S.V. Kostyukevicha, I.A. Odincovoj. Saint-Petersburg, 2010. S. 104-107. In Russian
- Kiouptsi K, Reinhardt C. Physiological Roles of the von Willebrand Factor-Factor VIII Interaction. In: Hoeger U, Harris J (eds). Vertebrate and Invertebrate Respiratory Proteins, Lipoproteins and other Body Fluid Proteins. Subcellular Biochemistry. Cham.: Springer, 2020. P. 94. https://doi.org/10.1007/978-3-030-41769-7_18
- Brott DA, Katein A, Thomas H, Lawton M, Montgomery RR, Richardson RJ, Louden CS. Evaluation of von Willebrand Factor and von Willebrand Factor Propeptide in Models of Vascular Endothelial Cell Activation, Perturbation, and/or Injury. Toxicologic Pathology. 2014;42(4):672-683. https://doi.org/10.1177/0192623313518664
- Chumasov EI, Petrova ES, Korzhevskij DE. Strukturnye i funkcionalnye osobennosti endoteliya sosudov serdca polovozrelyh krys po dannym immunogistohimicheskogo issledovaniya. Regionarnoe krovoobrashchenie i mikrocirkulyaciya. 2019;18(2):70-77. In Russian https://doi.org/10.24884/1682-6655-2019-18-2-70-77
- Korzhevskij DE, Kirik OV, Karpenko MN. Teoreticheskie osnovy i prakticheskoe primenenie metodov immunogistohimii: rukovodstvo. S-Pb: SpecLit, 2014. 119s. In Russian
- Bezdenezhnyh AV, Petrova NI. Metodika topicheskoj diagnostiki morfologicheskih parametrov shchitovidnoj zhelezy. Morfologija. 2000;4(114):91-94. In Russian
- Van Loon JE, Sonneveld MAH, Praet SFE, de Maat MPM, Leebeek FWG. Performance related factors are the main determinants of the von Willebrand factor response to exhaustive physical exercise. PLOS ONE. 2014;9(3):1-8. https://doi.org/10.1371/journal.pone.0091687
- Bano A, Chaker L, de Maat MPM, Atiq F, Kavousi M, Franco OH, Mattace-Raso FUS, Leebeek FWG, Peeters RP. Thyroid Function and Cardiovascular Disease: The Mediating Role of Coagulation Factors, The Journal of Clinical Endocrinology & Metabolism. 2019;104(8):3203-3212. https://doi.org/10.1210/jc.2019-00072
- Elbers LPB, Fliers E, Cannegieter SC. The influence of thyroid function on the coagulation system and its clinical consequences. Journal of thrombosis and haemostasis. 2018;16:634-645. https://doi.org/10.1111/jth.13970
- Kalinin RE, Suchkov IA, Korotkova NV, Mzhavanadze ND. Izuchenie molekulyarnyh mekhanizmov endotelial'noj disfunkcii in vitro. Geny i kletki. 2019;14(1):22-32. In Russian. https://doi.org/10.23868/201903003


