Факторы прогноза в хирургическом лечении метастазов колоректального рака в легких
Автор: Ахмедов Бахром Бахтиерович, Давыдов Михаил Михайлович, Федянин Михаил Юрьевич, Алиев Вячеслав Афандиевич, Гордеев Сергей Сергеевич, Дадыев Ислам Артурович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 2 т.17, 2018 года.
Бесплатный доступ
Основываясь на данных мировой медицинской литературы и результатах отечественных исследователей, можно сделать вывод, что достоверно влияют на прогноз выживаемости больных колоректальным раком с метастатическим поражением легких радикальность выполненной операции, количество метастазов и величина DFI (интервал с момента излечения первичной опухоли до появления легочных метастазов). Поражение внутригрудных лимфатических узлов в сочетании с легочными метастазами, повышение уровня РЭА >10 нг/мл считаются крайне неблагоприятными прогностическими фактороми. В изученных нами статьях размер первичной опухоли, одностороннее или двустороннее распределение легочных метастазов не являлись прогностическими факторами выживаемости, однако некоторые авторы считают двустороннее поражение и распространение первичной опухоли T3-4 прогностически неблагоприятными признаками. Ключевыми факторами для проведения хирургического лечения легочных метастазов являются функциональная переносимость операции, выполнение радикального объема вмешательства, отсутствие других проявлений заболевания.
Колоректальный рак, метастазы в легкие
Короткий адрес: https://sciup.org/140254177
IDR: 140254177 | УДК: 616.351-006.6-033.2:616.24-089-037 | DOI: 10.21294/1814-4861-2018-17-2-60-70
Текст обзорной статьи Факторы прогноза в хирургическом лечении метастазов колоректального рака в легких
Описание первого случая хирургического ле‑ чения легочных метастазов датируется 1882 г., когда Weinlechner провел резекцию двух вторич‑ ных образований в легком, найденных в процессе резекции саркомы грудной стенки [1]. Blalock в 1944 г. сообщил об успешном удалении легоч‑ ных метастазов, обусловленных колоректальным раком (КРР) [2]. Несмотря на отдельные успехи, большинство хирургов не выполняли удаление метастазов из легкого, так как развитие метастазов в легких обычно рассматривалось как генерализа‑ ция процесса, что служило поводом для отказа в специализированной помощи.
Но тем не менее хирургия метастазов продол‑ жала развиваться, число сообщений о хирургиче‑ ском лечении метастазов в легких увеличивалось. В 1991 г. был создан Международный реестр по метастазам в легких (IRLM). В 1997 г. были опу‑ бликованы отдаленные результаты лечения 5206 пациентов европейских и американских клиник с метастазами в легких различных опухолей [3].
На сегодняшний день в нашей стране и в мире количество операций по поводу метастазов КРР в легких неуклонно растет, расширяются показания к хирургическому вмешательству и изучаются факторы прогноза, непосредственно влияющие на продолжительность жизни. Однако до сих пор не существует единого мнения относительно крите‑ риев отбора больных, показаний к повторным ре‑ зекциям солитарных и множественных метастазов и оптимального объема операции.
Методы диагностикии критерии отбора больных
Возможность хирургического лечения метаста‑ зов в легких определена двумя существенными факторами – степенью распространенности бо‑ лезни и хирургической переносимостью. Только 1–8 % пациентов с метастазами КРР в легких могут перенести их радикальное хирургиче‑ ское удаление. Оценка распространенности заболевания является одним из самых важных
моментов при планировании хирургического лечения легочных метастазов и включает в себя: состояние первичной опухоли (резектабельна или уже удалена), наличие внелегочных метастазов (с оценкой потенциальной резектабельности) и определение возможности выполнения радикаль‑ ной операции.
Возможность выполнения радикальной опера‑ ции является основным условием для резекции легочных метастазов. В связи с этим крайне важно знать количество и анатомическую локализацию очагов в легких. Чувствительность традиционной рентгеновской, компьютерной томографии (КТ) приближается к 90 %, но количество ошибок при использовании данных методов остается высоким – 11 % [4–7]. Применение спиральной компьютерной томографии (СКТ) имеет значительное преимуще‑ ство по сравнению с традиционной рентгеногра‑ фией и компьютерной томографией, увеличивая количество получаемой информации и уменьшая процент диагностических ошибок [5, 8–11]. Так, чувствительность СКТ составляет около 98 %, специфичность – около 82,5 % [12–18].
Оценка хирургической переносимости – слож‑ ный индивидуализированный процесс, вклю‑ чающий исследование функционального статуса пациента, выявление сопутствующих патологий и определение объема резекции легкого [19–21]. Хотя обычно объем резекции легкого незначите‑ лен, в некоторых случаях объем вмешательства может расшириться до лоб‑ или билобэктомии или пациенту могут потребоваться двухсторонние или повторные операции. Эти факторы должны быть учтены во время предоперационной оценки, чтобы предсказать дыхательный функциональ‑ ный статус после операции. Смертность после удаления метастазов в легких в основном связана с сердечно‑сосудистой недостаточностью или респираторными осложнениями, таким образом, необходимо проводить тщательную оценку этих систем до операции.
Прогностические факторы
N.R. Thomford et al. [22] заложили основу для хирургического лечения легочных метастазов, ими были описаны клинические факторы, наличие которых влияет на прогноз пациентов и опреде‑ ляет показания для хирургических вмешательств. Были сформированы так называемые Thomford’s criteria: 1) general status capable of undergoing lung surgery, 2) controlled primary lesion, 3) no metasta‑ sis in organs other than the lungs, or if present, such metastasis could be controlled by surgery or other treatments, and 4) pulmonary metastasis that can be completely removed. Авторами выделено несколько прогностических факторов выживания с разной степенью доказательности. Однако такой подход определяет лишь общий принцип отбора больных на хирургическое удаление метастазов в легких и ни в коей мере не учитывает органопринадлеж‑ ность опухоли.
Данные Международного реестра по метаста‑ зам в легких (International Registry of Lung Metasta‑ ses, 1997), основанные на многофакторном анализе отдаленных результатов лечения 5206 больных, подтвердили высокую прогностическую значи‑ мость трех основных факторов: радикальность выполненной операции, количество метастазов и величина DFI (интервал с момента излечения первичной опухоли до появления легочных мета‑ стазов). Однако они выявили и влияние органопри‑ надлежности метастазов в легких на выживаемость пациентов после радикальных вмешательств. Лучшие результаты были получены среди паци‑ ентов с герминогенными опухолями и опухолью Вильмса, худшие – при метастазах меланомы. И хотя данное исследование проводилось с учётом прогностических групп и факторов риска, итоговая прогностическая модель не учитывала органную принадлежность опухоли, в связи с чем необходимо изучение факторов риска прогрессирования/смер‑ ти после удаления метастазов в легких в отдель‑ ных онкологических нозологических единицах. В исследовании Kanemitsu et al. [23], включившем данные 313 пациентов с метастазами КРР, была создана номограмма для определения прогноза течения болезни, учитывающая дооперационный уровень РЭА, количество метастазов в легких, по‑ ражение лимфоузлов корня легкого и средостения, гистологическое строение первичной опухоли (муцинозный или низкодифференцированный рак) и наличие внелегочных проявлений болезни. Такие факторы, как (DFI), одно‑ или двухстороннее поражение , стадия первичной опухоли, метастазы в печени или рецидивирующие метастазы, также могут уменьшать выживаемость, но они не вошли в заключительную прогностическую модель.
Ретроспективное исследование, выполненное на базе НМИЦ онкологии им. Н.Н. Блохина, с вклю‑ чением 112 пациентов, показало, что прогноз у больных КРР с синхронными метастазами в легких лучше в группе с изолированным поражением лег‑ ких (2‑летняя общая выживаемость – 63,0 и 37,5 % соответственно; р=0,055) и при удалении первич‑ ной опухоли (2‑летняя общая выживаемость – 21,0 и 52,5 % соответственно; р=0,004). Полное циторедуктивное хирургическое лечение может обеспечить долгосрочную выживаемость у данной категории пациентов [24].
Поражение внутригрудных лимфатических узлов
Поражение внутригрудных лимфоузлов в соче‑ тании с легочными метастазами считается крайне неблагоприятным прогностическим фактором [14, 25, 26]. Частота поражения внутригрудных лимфоузлов у пациентов с метастазами КРР в легких составляет от 12 до 19,2 % [26]. В ряде исследований показано, что наличие поражённых лимфоузлов в корне лёгкого и средостении являет‑ ся плохим прогностическим признаком с 5‑летней выживаемостью, равной 0–19 % [27–30]. Однако по данным G. Veronesi et al. (2007), среди 127 па‑ циентов, большинство из которых (54 %) имели метастазы рака толстой кишки, 5‑летняя общая выживаемость составила 48 %, а при интактных внутригрудных лимфоузлах – 60 %. При наличии поражённых бронхопульмональных и корневых лимфоузлов выживаемость снижалась до 17 %, при поражении медиастинальных лимфоузлов пятилетний рубеж не пережил ни один пациент [31]. Эти данные были подтверждены в недавно опубликованном метаанализе [26, 32].
Раково-эмбриональный антиген
Доказана прогностическая значимость уровня РЭА в сыворотке крови у больных с метастазами КРР. Повышение уровня РЭА >10 нг/мл свидетель‑ ствует о неблагоприятном прогнозе [26]. В работе M. Inoue et al. у больных с РЭA, равным 5–10 нг/мл, 5‑летняя общая выживаемость составила 18,9 %, у больных с нормальными уровнями РЭA – 59,3 % [28]. По данным M. Higashiyama, у пациентов с нормальным уровнем РЭА 5‑летняя выживаемость составила 60 %, тогда как выживаемость в группе с высоким уровнем РЭА – 18 % [33].
Интервал с момента излечения первичной опухоли до появления легочных метастазов (DFI)
Опираясь на репрезентативный клинический материал Международного регистра по легочным метастазам, Pastorino et al. (1997) показали, что при интервале времени без признаков болезни (DFI) менее 36 мес 5‑летняя выживаемость составила 33 %, более 36 мес – 45 % (р<0,05) [34, 35]. Эти результаты исследования были подтверждены O. Rena et al. [36]. В данной работе среди больных с DFI 0–11, 12–35 и >36 мес показатели 5‑летней выживаемости составили 22,6, 38,6 и 55 % соот‑ ветственно. DeMatteo et al. ввели понятие DFI‑2 – интервал между первым и вторым появлением метастазов. Авторы подтвердили улучшение вы‑ живаемости у больных с метахронным выявлением печеночных и легочных метастазов в сравнении с пациентами, у которых такие метастазы были вы‑ явлены синхронно [37].
Таким образом, влияние параметра DFI на выжи‑ ваемость изучалось практически во всех крупных исследованиях, и этот показатель был выделен как независимый прогностический фактор.
Количество и размер метастазов
По данным Международного регистра мета‑ стазов в легких, 5‑летняя выживаемость больных при солитарном поражении составляет 43 %, при множественном поражении – 27 %. В недавнем исследовании Onaitis et al. [38] сообщили о значи‑ тельно худшей выживаемости и увеличении числа рецидивов при наличии трех или более метастазов, особенно когда DFI составлял меньше 1 года.
Имеется несколько исследований, где размер метастазов рассматривался как прогностический фактор. Только в двух из них [39, 40] сообщили о значительной корреляции между размером опухо‑ ли и 5‑летней выживаемостью, которая составила 11 % у больных с метастазами более чем 3,75 см. Что касается одно‑ и двухстороннего поражения, то в 12 кооперированных исследованиях, включающих 886 пациентов, двустороннее поражение имело место в 263 случаях. Эти исследования не смогли доказать того, что одностороннее или двусторон‑ нее распределение легочных метастазов являет‑ ся прогностическим фактором выживаемости. Однако ряд авторов считают, что двустороннее поражение является неблагоприятным прогности‑ ческим фактором.
Стадия первичной опухоли
В исследованиях по хирургическому лечению легочных метастазов КРР стадия первичной опу‑ холи редко рассматривается как фактор прогноза. Лишь немногие из исследователей сообщают о влиянии этого фактора на выживание. Мelloni et al. [41] наблюдали лучший прогноз при Т1–Т2 стадии по сравнению с T3–T4, в этих группах 5‑летняя вы‑ живаемость составила 63 и 34 % соответственно. Эти результаты аналогичны данным Inoue et al. [27], которые использовали стадирование по Dukes и сообщили, что 5‑летние показатели выживае‑ мости составили 68,7 % для стадии А первичной опухоли по сравнению с 32,8 % для стадий ВD. Считается, что анатомическое расположение пер‑ вичной опухоли также может повлиять на прогноз. Так, несколько исследований продемонстрировали тенденцию к снижению выживаемости при мета‑ стазах рака прямой кишки по сравнению с мета‑ стазами рака ободочной кишки [42, 43].
Синхронные/метахронные метастазы
Печень и легкие являются наиболее распро‑ страненными местами метастазирования КРР. Приблизительно у 5–10 % пациентов с КРР раз‑ виваются метастазы в этих органах [26], из которых 6,9–30,8 % являются синхронными с первичной опухолью. В ряде крупных исследований не было сообщений о прогностической значимости син‑ хронности/метахронности метастазов [44–46], однако Kobayashi et al. [47] получили 5‑летнюю выживаемость 22 % у пациентов с синхронными метастазами по сравнению с 50 % у пациентов с метахронным появлением метастазов. G. Miller et al. (2007) считают, что одномоментное выяв‑ ление метастазов в печени и легком при DFI <1 года является неблагоприятным прогностическим фактором [48].
Рецидив метастазов в легких
Имеются противоречивые данные об эффектив‑ ности повторной операции при рецидивах метаста‑ зов КРР в легких. Welter et al. [30] сообщают, что число метастазов, имеющихся при первой опера‑ ции, является наиболее важным определяющим фактором общей выживаемости. Японская группа ученых [49] сообщила о снижении выживаемости при проведении двух и более операций, тогда как Kim et al. [39] показали, что выживаемость за пе‑ риод 5 лет не отличается у пациентов, прошедших одну или несколько легочных резекций. Пока не накоплен достаточный опыт для определения про‑ гностической роли метастатического рецидива в легких и необходимы дальнейшие исследования, чтобы выделить группу пациентов, которым по‑ казано хирургическое лечение.
Патогистологические прогностические факторы
Современные иммуногистохимические и молекулярно‑биологические исследования выяв‑ ляют новые прогностические факторы, которые также могут помочь в отборе пациентов, воспри‑ имчивых к таргетной терапии, в настоящее время эти исследования находятся на ранних стадиях.
Молекулярный профиль агрессивного коло‑ ректального рака с высокой метастатической активностью включает гиперэкспрессию белков генов TP53, K-RAS, DCC и NM23 [50, 51], повы‑ шение активности протеолитических ферментов (металлопротеиназы 2 и 9 и катепсина В), молекул адгезии, а также высокий уровень проангиогенных факторов. Последнее приводит к пролиферации эндотелиальных клеток и формированию высокой микрососудистой плотности. В настоящее время нет точного прогностического иммуногистохи‑ мического маркера, но многие из них могут быть информативными (Е‑кадгерин; транскрипционный фактор (CDX2); Cathepsin B; сосудистый фактор эндотелиального роста (VEGF); эпидермальный фактор роста (EGFR); р53 (расположенный на хромосоме 17р); K‑Ras и т. д.)
Хирургическое лечение
Учитывая, что некоторые метастазы имеют чет‑ кую устойчивость ко всем видам консервативной терапии, хирургическое лечение на сегодняшний день является полностью оправданным и нередко единственным эффективным методом лечения. Основной целью хирургического лечения является выполнение радикального вмешательства. Ради‑ кальность операции является общепризнанным прогностическим фактором, и это единственное, чем мы можем действительно влиять на вы‑ живаемость этих пациентов. При радикальном хирургическом лечении больных с метастазами 5‑летняя выживаемость составляет от 30 до 63 % [2, 52–56], 10‑летняя – 18 %. С другой стороны, медиана выживаемости после нерадикального хирургического вмешательства составляет всего от 9 до 15 мес [57–59].
Критерии отбора пациентовдля резекции легочных метастазов
По мнению ряда авторов и нашему опыту, для отбора больных раком толстой кишки с метаста‑ зами в легкие на хирургического лечение следует руководствоваться следующими критериями [29, 60]:
-
1. Отсутствие признаков рецидива первичной опухоли или ее резектабельный характер при син‑ хронных метастазах.
-
2. Отсутствие экстраторакальных метастазов либо при их наличии они являются операбельными.
-
3. Возможность достижения радикально‑ сти (R0) при хирургическом лечении легочных метастазов.
-
4. Объем хирургического вмешательства дол‑ жен быть функционально переносим пациентом.
Хирургическое лечение одиночного метастаза, особенно если это образование периферическое, не является технически сложным, функционально переносимо и считается благоприятным прогно‑ стическим фактором. Показания к хирургическому удалению двусторонних, множественных метаста‑ зов и повторным операциям по поводу рецидива являются дискутабельными. При неоперабельных случаях или если нельзя достичь радикальности (R0), возможны альтернативные методы лечения для локального воздействия на метастазы, такие как стереотактическая лучевая терапия, радиоча‑ стотная абляция или криотерапия.
Хирургический доступ
Хирургический доступ должен отвечать не‑ скольким основным требованиям:
-
1) обеспечивать полноценную ревизию;
-
2) предоставлять возможность выполнения радикальной операции;
-
3) быть наименее травматичным.
Информация, получаемая с помощью КТ и СКТ, становится все более подробной и точной, но недавние исследования подчеркивают, что эти методы по‑прежнему демонстрируют недостаточ‑ ную чувствительность к очагам менее 10 мм [6]. В связи с этим ручная пальпация легкого оста‑ ется последним этапом диагностики легочных метастазов.
Несколько факторов определяют выбор хирур‑ гического доступа – число, размер и анатомиче‑ ское расположение метастазов в легком, наличие метастатических лимфатических узлов, а также функциональный статус пациента и личный опыт хирургической бригады. Независимо от предпо‑ чтения у каждого подхода есть свои преимущества и недостатки. Мы решили проанализировать до‑ ступы, учитывая возможность визуализации мета‑ таблица 1
возможные хирургические доступы при операциях по поводу метастазов в легкие
|
Хирургический доступ |
Визуализация метастазов |
Возможность пальпация легкого |
Боль |
Ослож СДО |
нения ХО |
|
Боковая торако‑ томия |
Отличная |
Отличная |
Тяжелая |
+ + |
+ |
|
Стернотомия |
Оптимальная (кроме задних отделов) |
Отличная |
Умеренная |
+ |
+ |
|
Торакоскопия |
Средне‑оптимальная (если очаг периферический) |
Нет |
Легкая |
+ |
|
|
VATS |
Оптимальная |
Средняя |
Умеренная, легкая |
+ |
+ |
Примечание: СДО – сердечно‑дыхательные осложнения, ХО – хирургические осложнения.
стазов, пальпации легкого, тяжесть операционной травмы и осложнения (табл. 1).
Классическая боковая торакотомия является более предпочтительным доступом при односто‑ ронних поражениях. Она позволяет полноценно провести ревизию, оценить паренхиматозное по‑ ражение и состояние лимфоузлов корня легкого и средостения. При двухстороннем поражении выбор должен быть сделан между последователь‑ ными или одномоментными торакотомными до‑ ступами, иногда используется стернотомия.
Стернотомия, пик популярности которой был в 1980‑х, позволяет одновременную произвести ревизию обоих легких и потому показана для двусторонних поражений. Послеоперационный период после стернотомии менее сложный, чем после двухсторонней торакотомии, операция менее болезненная и функционально менее агрессивная. Однако недостаток стернотомного доступа заклю‑ чается в затруднённых ревизии и оперировании в задних отделах легких, особенно в нижней доле левого легкого.
Торакоскопия – также обоснованный хирурги‑ ческий доступ, и его результаты с точки зрения выживания подобны открытой хирургии [26, 48, 61, 62]. Она обеспечивает все априорные преиму‑ щества мини‑инвазивной хирургии: меньше боли [63], меньше страдает функция легкого [62], меньшая тяжесть хирургической травмы со сни‑ жением частоты послеоперационных осложнений, меньший срок пребывания в стационаре и лучшие эстетические результаты. При торакоскопии легоч‑ ные спайки развиваются реже, что имеет значение при повторных хирургических вмешательствах по поводу рецидива или с диагностической целью.
Для периферических поражений, меньших, чем 1 см, но больше 5 мм, расположенных на висце‑ ральной плевре, рекомендовано использование КТ с управляющими маячками; частота осложнений этой процедуры очень низкая. Интраоперацион‑ ный ультразвук может также помочь выявить не выявленные до операции узелки в легком. Однако ясно, что ручная пальпация ткани легкого обеспе‑ чивает большую эффективность. В этом отноше‑ нии VATS с дополнительной мини‑торакотомией дает преимущество, так как объединяет VATS и открытую хирургию, этот метод предпочтителен для большинства периферических метастазов. Однако есть сторонники подхода VATS для лечения фактически всех легочных метастазов [64], так как всегда есть возможность в случае сомнения перейти к открытой операции.
Американские хирурги Cerfolio et al. [65] предложили выбор доступа в зависимости от количества, размеров и локализаций метастазов (табл. 2).
Выбор операционного доступа и особенно применение мини‑инвазивных подходов будут пе‑ риодически предметом споров, пока не наберется больше опыта. Например, Roth [66], а позже и Na‑ kajima [64] опубликовали свои результаты, которые показали, что операционный доступ не влияет на общую выживаемость.
Объем резекции
Целью хирургического лечения является до‑ стижение радикальности (R0) при сохранении адекватного объема легочной паренхимы. Таким образом, объем резекции зависит от размера и ло‑ кализации метастазов. С учетом этого все операции таблица 2
Модели распространения легочных метастазов и предлагаемый операционный подход
|
Характеристика метастазов |
Операционный доступ |
|
|
VATS |
Торакотомия |
|
|
Число |
1–3 |
>3 |
|
Размер |
<1,5 см |
>4 см |
|
Локализация |
Периферические очаги |
Центральные очаги |
|
Пораженная доля |
Верхняя, средняя |
Нижняя |
Примечание: VATS – торакоскопия с параллельной визуализацией.
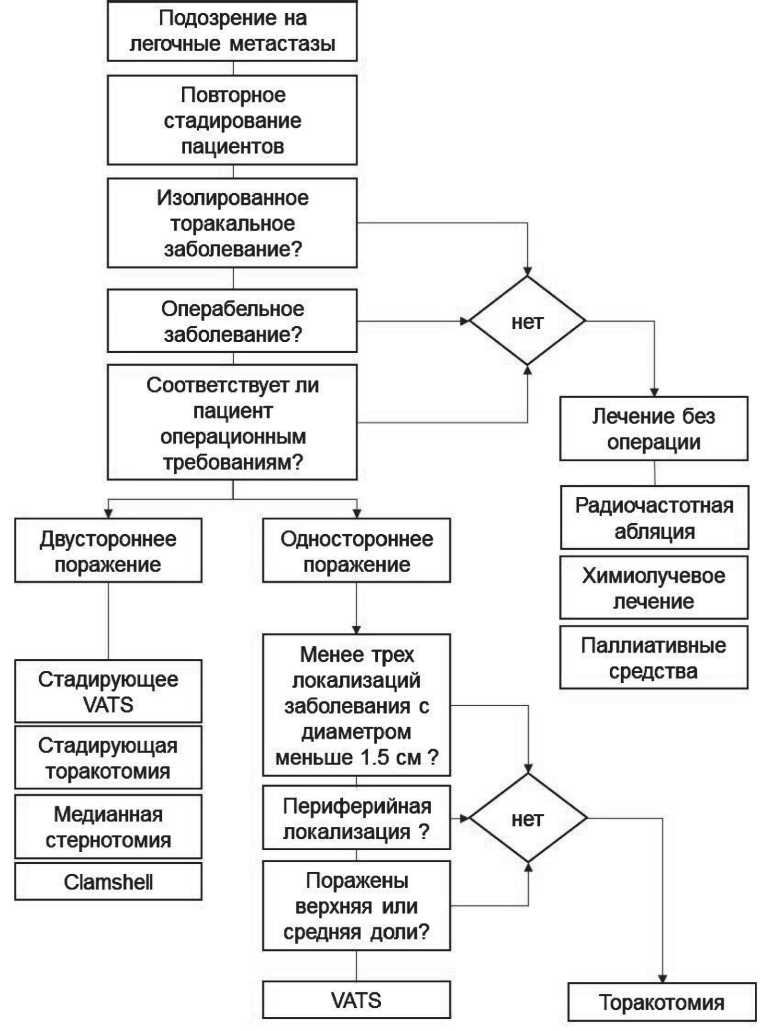
Рис. 1. Лечебно-диагностический алгоритм при подозрении на легочные метастазы
по поводу метастазов в легкие можно разделить на 3 категории: атипичные резекции легких, анато‑ мичные резекции и комбинированные операции. Около 70 % больных выполняются атипичные резекции легких [57, 67]. В случае больших или центрально расположенных метастазов или мно‑ жественных метастазов в одной доле, а также когда есть сомнение относительно происхождения по‑ ражения (вторая первичная опухоль или метастаз), требуется выполнение анатомической резекции (сегментэктомия, лобэктомия, пневмонэктомия). Анатомические резекции могут также использо‑ ваться у пациентов с поражением лимфатических узлов (N1). Пульмонэктомию нужно рассматри‑ вать как крайнюю меру, с учетом переносимости этого вмешательства. Аналогично и расширенно‑ комбинированные операции применяются тогда, когда возможности других методов лечения исчер‑ паны и хирургический метод остается единствен‑ ной возможностью продления жизни.
Повторные операции
По данным Международного реестра по мета‑ стазам в легких после удаления метастазов у 53 % больных констатируют рецидив метастазов в легких. При изолированном поражении легочной паренхимы возможно выполнение повторных вмешательств. Однако такие операции остаются прерогативой специализированных стационаров, в которых ведутся научные исследования по этой проблеме. Повторные резекции, как правило, выполняются в сложных условиях выраженного спаечного процесса, нарушения топографо‑ анатомических взаимоотношений элементов корня легкого и структур средостения. Данные клиниче‑ ских наблюдений показывают, что при рецидивных метастазах лечебная тактика также зависит от их чувствительности к лекарственному лечению. При появлении новых рецидивных метастазов повтор‑ ные операции являются методом выбора и должны быть неотъемлемым компонентом комплексного лечения [68].
Заключение
Хирургическое лечение легочных метастазов КРР дает реальное преимущество в выживае‑ мости только для тщательно отобранных групп пациентов. Мы предлагаем свой подход к лечению больных с легочными метастазами КРР (рис 1). Продление и улучшение качества жизни у этой тяжелой категории пациентов, считавшихся до недавнего времени подлежащими лишь симптома‑ тической терапии, является актуальной проблемой современной клинической онкологии.
Список литературы Факторы прогноза в хирургическом лечении метастазов колоректального рака в легких
- Weinlechner J. Tumoren an der brustwand und deren behnadlung resection der rippeneroffnung der brusthohle und partielle entfernung der lunge. Wien Med Wochenschr 1882; 32: 589-591.
- Berney C.R., Yang J.L., Fisher R.J., Russell P.J., Crowe P.J. Overexpression of nm23 protein assessed by color video image analysis in metastatic colorectal cancer: correlation with reduced patient survival. World J Surg. 1998 May; 22 (5): 484-90.
- Shiono S., Ishii G., Nagai K., Murata Y., Tsuta K., Nitadori J., Kodama T., Ochiai A. Immunohistochemical prognostic factors in resected colorectal lung metastases using tissue microarray analysis. Eur J Surg Oncol. 2006 Apr; 32 (3): 308-9.
- Тюрин И.Е. Компьютерная томография органов грудной полости. СПб., 2003. 371.
- Choi Y.J., Park S.H., Lee S.S., Choi E.K., Yu C.S., Kim H.C., Kim J.C. CT Colonography for Follow-Up After Surgery for Colorectal Cancer. Am J Roentgenol. 2007; 189: 283-289. DOI: 10.2214/AJR.07.2305


