Факторы риска летальности и несостоятельности кавопульмональной гемодинамики у пациентов, перенесших формирование двунаправленного кавопульмонального анастомоза
Автор: Ничай Наталия Романовна, Горбатых Юрий Николаевич, Сойнов Илья Александрович, Горбатых Артем Викторович, Войтов Алексей Викторович, Новикова Марина Альбертовна, Иванов Сергей Николаевич, Богачев-Прокофьев Александр Владимирович
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Врожденные пороки сердца
Статья в выпуске: 3 т.19, 2015 года.
Бесплатный доступ
Цель Оценка госпитальной летальности и выживаемости пациентов после формирования двунаправленного кавопульмонального анастомоза (ДКПА) и выявление факторов риска неблагоприятного исхода в этой группе пациентов. Материал и методы Проведен ретроспективный анализ клинических данных 130 пациентов, которым за период с 2003 по 2013 г. был сформирован ДКПА. Возраст пациентов на момент операции составил Ме 16 мес. (нижняя/верхняя квартиль - 9/27 мес.). Результаты Госпитальная летальность после ДКПА была 10,7%. По результатам многофакторного логистического регрессионного анализа, возраст пациента (ОШ 0,79; 95% ДИ 0,62-0,99; р = 0,05), степень атриовентрикулярной регургитации (ОШ 1,27; 95% ДИ 1,01-1,61; р = 0,04) и длительность искусственного кровообращения (ИК) (ОШ 1,33; 95% ДИ 1,03-1,72; р = 0,03) явились предикторами летального исхода на госпитальном этапе. Выживаемость пациентов после формирования ДКПА в течение 1 года составила 86,3%, 3 лет - 85,1%, 10 лет - 83,4%. Свобода от неблагоприятного исхода (летальный исход; демонтаж ДКПА; невозможность выполнения операции Фонтена) была 83,3 и 76,3% в течение 1- и 5-летнего периодов наблюдения. Многофакторный анализ рисков неблагоприятного исхода выявил, что подъем давления в ДКПА (ОР 1,11; 95% ДИ 1,00-1,22; р = 0,04), снижение насыщения крови кислородом в послеоперационном периоде (ОР 0,90; 95% ДИ 0,84-0,97; р
Единственный желудочек сердца, двунаправленный кавопульмональный анастомоз, факторы риска
Короткий адрес: https://sciup.org/142140683
IDR: 142140683 | УДК: 616.126.4-007-053.1
Текст научной статьи Факторы риска летальности и несостоятельности кавопульмональной гемодинамики у пациентов, перенесших формирование двунаправленного кавопульмонального анастомоза
У пациентов с унивентрикулярной гемодинамикой в большинстве кардиохирургических клиник двунаправленный кавопульмональный анастомоз (ДКПА) используют как стандартную промежуточную паллиативную процедуру, предшествующую операции Фонтена [1–5].
Направляя поток крови из верхней полой вены (ВПВ) непосредственно в легочное русло и увеличивая эффективный легочный кровоток, ДКПА не только обеспечивает прирост насыщения крови кислородом и снижение объемной нагрузки на
|
Таблица 1 Предоперационная характеристика пациентов |
|
|
Параметр |
верхняя квартиль) |
|
Возраст (мес.) |
16 (9/27) |
|
Пол, n мужской/женский (%) |
70/60 (53,8/46,2) |
|
Sт, м2 |
0,42 (0,36/0,50) |
|
Диагноз, n (%) |
|
|
Двуприточный левый ЕЖС |
29 (22,3) |
|
Двуприточный правый ЕЖС |
14 (10,8) |
|
Атрезия трикуспидального клапана |
41 (31,5) |
|
Атрезия митрального клапана |
6 (4,6) |
|
АВК, несбалансированная форма |
17 (13,1) |
|
Синдром гетеротаксии |
4 (3,1) |
|
Другие формы |
19 (14,6) |
|
Тип доминантного желудочка, n (%) |
|
|
Левый |
87 (66,9) |
|
Правый |
28 (21,5) |
|
Общий (смешанный) |
15 (11,5) |
|
Насыщение крови кислородом, % |
77 (68/83) |
|
Уровень гемоглобина, г/л |
167 (149/182) |
|
ФВ системного желудочка, % |
71 (64/77) |
|
Регургитация на системном АВ-клапане, |
ст. (%) |
|
0 |
34 (26,2) |
|
I |
51 (39,2) |
|
II |
37 (28,5) |
|
III |
7 (5,4) |
|
Среднее давление в ЛА, мм рт. ст. |
12 (10/15) |
|
Общелегочное сопротивление, ед. Вуда |
2,9 (1,5/3,5) |
|
Транспульмональный |
6 (4/9) |
|
градиент, мм рт. ст. |
|
Sт – площадь поверхности тела; ЕЖС – единственный желудочек сердца; АВК – атриовентрикулярная коммуникация; ФВ – фракция выброса; АВ-клапан – атриовентрикулярный клапан; ЛА – легочная артерия системный желудочек, но и улучшает клинические результаты и выживаемость пациентов [6]. ДКПА, как промежуточная паллиативная процедура, позволяет устранить сопутствующие анатомические проблемы: регургитацию на атриовентрикулярных клапанах (АВ-клапанах), рестриктивное межпредсердное сообщение, обструкцию системного кровотока на различных уровнях, аномалии системного и легочного венозного возврата на этапе, предшествующем завершению унивентрикулярной коррекции.
Двунаправленный кавопульмональный анастомоз обеспечивает адаптацию гемодинамики и функции системного желудочка, что является важным шагом к Фонтен-циркуляции, поэтому именно с этого периода следует начинать анализ выживаемости пациентов с единственным желудочком сердца (ЕЖС) [3].
Цель исследования: оценить госпитальную летальность и выживаемость пациентов, перенесших формирование ДКПА, выявить основные факторы риска неблагоприятного исхода в этой группе пациентов.
Материал и методы
Проведен ретроспективный анализ клинических данных 130 пациентов с ЕЖС, которым с марта 2003 г. по декабрь 2013 г. был сформирован ДКПА. Предоперационная характеристика пациентов представлена в табл. 1.
К другим формам ЕЖС отнесены: корригированная транспозиция магистральных сосудов (КТМС) с большим дефектом межжелудочковой перегородки (ДМЖП) и стредлингом хорд АВ-клапанов (n = 4); транспозиция магистральных сосудов (ТМС) с большим некомметированным ДМЖП и стенозом выходного отдела левого желудочка (n = 2); двойное отхождение магистральных сосудов от правого желудочка с большим некомметированным ДМЖП (n = 1); полная форма атриовентрикулярной коммуникации с большим ДМЖП и стредлингом хорд АВ-клапана (n = 1); атрезия легочной артерии (АЛА) с интактной межжелудочковой перегородкой (n = 6); аномалия Эбштейна (тип C) (n = 2); множественные ДМЖП (n = 2); КТМС с гипоплазией обоих желудочков (n = 1).
Часть пациентов перед формированием ДКПА перенесла предшествующие паллиативные вмешательства в объеме суживания ствола легочной артерии (n = 22), наложения системно-легочного анастомоза (n = 32), в ряде случаев в сочетании с пластикой легочных артерий (n = 3) или расширением межпредсердного сообщения (n = 6). В 3 случаях выполнено гибридное вмешательство: процедура Рашкинда с последующим формированием системно-легочного шунта. Одному пациенту с аномалией Эбштейна (тип С) на этапе, предшествующем ДКПА, выполнена процедура Starnes. По поводу субаортальной обструкции в двух случаях создан анастомоз Damus-Kaye-Stansel (DKS-анастомоз). Коррекция коарктации аорты потребовалась двум пациентам.
Предоперационная катетеризация сердца, ангиокардиография для оценки развития легочного русла и внутрисердечной анатомии проведены в 87,7% случаев (n = 114), остальным пациентам выполнено МСКТ сердца и магистральных сосудов с контрастированием. Однако измерение прямого давления в легочных артериях и расчет сопротивления сосудов малого круга кровообращения удалось выполнить лишь у 61,5% пациентов (n = 80) в связи с анатомическими особеннос- тями порока или высокой вероятностью получения недостоверных данных. Эхокардиографическая оценка функционального состояния системного желудочка и АВ-клапанов была стандартной процедурой для всех пациентов.
Формирование ДКПА и перфузионное обеспечение (искусственное кровообращение, ИК) с бикаваль-ной канюляцией проводили в соответствии со стандартным протоколом, принятым в ННИИПК им. акад. Е.Н. Мешалкина Минздрава России. Всем пациентам для мониторинга кавопульмонального давления рутинно устанавливался центральный венозный катетер в пра-вую/левую внутреннюю яремную вену и удалялся на вторые-третьи сутки послеоперационного периода.
В 112 случаях создан правосторонний ДКПА. У 13 пациентов в связи с хорошо развитой добавочной левой ВПВ сформирован двусторонний ДКПА. В 2 случаях добавочная ВПВ была коммуникантной и лигированной. У 5 пациентов диагностирована единственная левая ВПВ, в связи с чем создан левосторонний кавопульмональный анастомоз.
Во всех случаях ДКПА формировался в условиях параллельного ИК. Однако ряду пациентов дополнительно требовалась внутрисердечная коррекция с окклюзией аорты (n = 53, 40,8%). Четырем пациентам создан DKS-анастомоз, в одном случае расширен некоммитированный рестриктивный ДМЖП, пластика системного АВ-клапана потребовалась в 12 случаях, процедура Starnes – в одном, протезирование системного АВ-кла-пана в связи с невозможностью пластической коррекции – в одном, перемещение коллектора аномально дренирующихся легочных вен (супракардиальная форма) в полость единого предсердия выполнено трем пациентам.
В 58 случаях ствол легочной артерии лигирован или пересечен при формировании ДКПА, в 32 – удалены ранее наложенные системно-легочные анастомозы. Однако у ряда пациентов (n = 50) был сохранен антеградный ток крови через нативный ствол легочной артерии (n = 45) или сформирован системно-легочный анастомоз (n = 5).
Статистический анализ
Данные проанализированы с использованием пакета прикладных программ Statistica10.0. С учетом распределения переменных непрерывные значения выражались как медиана и межквартильный интервал (Ме, нижняя/ верхняя квартиль). Категориальные переменные представлены в виде чисел и частот (%).
Таблица 2 Характеристика операционной тактики
|
Процедура |
n (%) |
|
Тип кавопульмонального анастомоза: |
|
|
Правосторонний |
112 (86,2) |
|
Левосторонний |
5 (3,8) |
|
Двусторонний |
13 (10) |
|
Продолжительность ИК, мин |
73 (48/102) |
|
Продолжительность пережатия аорты, мин |
16 (8/27) |
|
Дополнительные процедуры: |
|
|
DKS-анастомоз |
4 |
|
Расширение рестриктивного ДМЖП |
1 |
|
Пересечение / лигирование СЛА |
58 (20/38) |
|
Суживание СЛА |
23 |
|
Пластика легочных артерий |
28 |
|
Наложение системно-легочного шунта |
5 |
|
Эмболизация БАЛК |
7 |
|
Лигирование системно-легочного шунта |
32 |
|
Расширение межпредсердного |
39 |
|
сообщения |
|
|
Пластика системного АВ-клапана |
12 |
|
Ушивание несистемного АВ-клапана |
2 |
|
Протезирование системного АВ-клапана |
1 |
|
с расширением коллектора легочных вен |
|
|
Перемещение коллектора легочных |
1 |
|
вен в полость единого предсердия |
|
|
Лигирование добавочной ВПВ |
1 |
|
Пластика дуги и перешейка аорты |
1 |
|
Имплантация ЭКС |
1 |
|
Дополнительный источник легочного кровотока: |
|
|
Нативный СЛА |
45 (34,6) |
|
Системно-легочный анастомоз |
5 (3,8) |
|
Нет |
80 (61,5) |
ИК – искусственное кровообращение; DKS-анастомоз – анастомоз Damus-Kaye-Stansel; ДМЖП – дефект межжелудочковой перегородки; СЛА – ствол легочной артерии; БАЛК – большая аортолегочная коллатераль; АВ-клапан – атриовентрикулярный клапан; ВПВ – верхняя полая вена; ЭКС – электрокардиостимулятор
Для выявления предикторов госпитальной летальности проведен однофакторный и многофакторный логистический регрессионный анализ. Для оценки выживаемости после формирования ДКПА, свободы от развития неблагоприятного исхода (летальный исход; демонтаж ДКПА; определение пациента как неподходящего кандидата для процедуры Фонтена) и выявления предикторов тромбоза ДКПА выполнен регрессионный анализ Кокса. Значения факторов риска выражены в виде отношения шансов (ОШ) и отношения рисков (ОР) с 95% доверительным интервалом (ДИ). Переменные со значением р<0,05 считались статистически значимыми. Выживаемость пациентов после формирования ДКПА и свобода от тромбоза каво-
Таблица 3 Послеоперационная характеристика пациентов
|
Параметр |
Ме (нижняя/ верхняя квартиль) |
|
Среднее давление в системе КПТ, мм рт. ст. |
14 (12/16) |
|
Насыщение крови кислородом, % |
84 (80/88) |
|
Продолжительность ИВЛ, ч |
6 (4/11) |
|
Время нахождения в послеоперационной палате реанимации, дней |
2 (1/4) |
|
Длительность плевральных эффузий, дней |
4 (3/5) |
|
Госпитальный период, дней |
13 (10/18) |
|
Осложнения госпитального периода, n (%) |
|
|
Синдром ВПВ |
23 (17,7) |
|
Экссудативный перикардит |
8 (6,1) |
|
Длительные плевральные эффузии (более 10 сут.) |
7 (5,4) |
|
Инфекционные осложнения |
10 (7,7) |
|
Поражения ЦНС |
6 (4,6) |
|
Нарушения ритма сердца |
3 (2,3) |
КПТ – кавопульмональный тракт; ИВЛ – искусственная вентиляция легких; ВПВ – верхняя полая вена; ЦНС – центральная нервная система пульмонального соединения представлены графически с использованием метода Каплана – Майера.
Результаты
Госпитальная летальность после формирования ДКПА составила 10,7% (n = 14). Причиной развития ле- тального исхода явились инфекционные осложнения (n = 6), тромбоз кавопульмонального анастомоза (n = 5), прогрессирующая сердечная недостаточность (n = 3).
Демонтаж ДКПА в раннем послеоперационном периоде выполнен 9 пациентам (6,9%): из них в 5 случаях интраоперационно, в 4 – во временном промежутке от 3 суток до 1 месяца послеоперационного периода. У 5 пациентов причиной дисфункции ДКПА явился тромбоз кавопульмонального тракта, у 1 – резидуальный стеноз легочных вен, у 3 – рост давления в кавопульмональной системе.
Двум пациентам в связи с деформацией кавопульмонального анастомоза выполнен демонтаж ДКПА с повторным его формированием. При этом одному пациенту процедуру дополнили пластикой легочных артерий с формированием дополнительного источника легочного кровотока (ДИЛК) (модифицированного подключично-легочного анастомоза сосудистым протезом 4 мм). В табл. 3 представлены основные характеристики течения послеоперационного периода.
Объем наблюдения в послеоперационном периоде составил 92,3%. В периоде наблюдения потеряны 10 пациентов, 4 из которых – иностранные граждане (рис. 1).
Медиана периода наблюдения составила 46 мес. (нижняя квартиль – 22 мес., верхняя квартиль – 78 мес.). Межэтапная смертность была 2,6%: в периоде наблюдения умерли 3 пациента во временном промежутке от
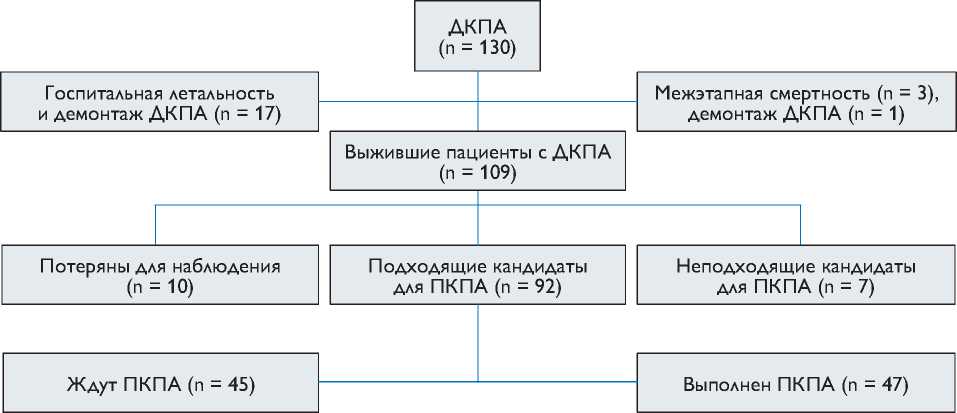
Рис. 1. Схема движения пациентов внутри когорты: ДКПА – двунаправленный кавопульмональный анастомоз; ПКПА – полный кавопульмональный анастомоз

987654321 ,,,,,,,,, 1000000000
% ,хишвижыв ялод яанвитялуму
0,0 0 1 2 3 4 5 6 7 8 9 10 11 12
Период наблюдения, лет n 120 96 77 59 50 37 27 18 9 5 3
Рис. 2. Выживаемость пациентов с ЕЖС после формирования ДКПА (метод Каплана – Майера)
1 месяца до 4 лет с момента выписки из стационара. В 2 случаях больные умерли дома в результате внезапной сердечной смерти. У 1 пациента резко прогрессировали явления сердечной недостаточности с падением фракции выброса системного желудочка до 22% на фоне перенесенной острой вирусной инфекции. Выживаемость пациентов после формирования ДКПА в течение 1 года составила 86,3±3,2%, 3 лет – 85,1±3,4%, 10 лет – 83,4±3,7% (рис. 2).
Через 2 мес. после операции 1 пациенту выполнен демонтаж ДКПА в связи с несостоятельностью кавопульмональной гемодинамики. У 5 пациентов при повторном исследовании диагностировано высокое среднее давление в системе ДКПА (от 18 до 22 мм рт. ст.) и сопротивление сосудов МКК (от 4,8 до 6,2 ед. Вуда), в связи с чем они отнесены в группу неподходящих кандидатов для операции Фонтена и в данный момент времени получают терапию, направленную на снижение этих параметров. У 3 пациентов при повторном обследовании выявлены тромбозы легочного русла: 1 пациент умер, 2 расценены как неподходящие кандидаты для полного кавопульмонального соединения.
Таким образом, тромбоз кавопульмонального тракта на различных уровнях выявлен у 8 пациентов (6,1%), при этом в 3 случаях он диагностирован во временном промежутке до 7 суток послеоперационного периода, в 2 – от 1 до 1,5 мес., в 3 – в отдаленном послеоперационном периоде (от 2 до 4 лет). У 5 пациентов обнаружен тромбоз левой легочной артерии, у 3 – правой легочной артерии, у 1 – ВПВ с распространением в левую брахиоцефальную вену.
Свобода от тромбоза кавопульмональной системы составила в течение 1 месяца 97,4±1,5%, 1 года – 95,5±1,9%, 3- и 10-летнего периодов наблюдения – 94,2±2,3 и 90,5±3,4% (рис. 3).
Свобода от неблагоприятного исхода (летальный исход; демонтаж ДКПА; определение пациента как неподходящего кандидата для операции Фонтена) была 83,3±3,4 и 76,3±4,4% в течение 1- и 5-летнего периодов наблюдения.
Полный кавопульмональный анастомоз выполнен в 47,5% случаев (n = 47). Во всех случаях сформирован экстракардиальный фенестрированный ПКПА с использованием сосудистого протеза из политетрафторэтилена (GoreTex; W.L. Gore and Associates, Flagstaff, Arizona, USA) 18 или 20 мм. Возраст на момент ПКПА составил от 1 года 11 мес. до 17 лет (Ме 52 мес., нижняя квартиль 46 мес., верхняя квартиль 82 мес.). Период между ДКПА и ПКПА составлял от 7 мес. до 11 лет (Ме 36 мес., нижняя квартиль 24 мес., верхняя квартиль 52 мес.). Более 50% всех ПКПА сформировано за период до 3 лет. Однако в 4 случаях ПКПА было выполнено спустя 8 лет и более после формирования ДКПА. К настоящему моменту еще 44 пациента (45,5%) ожидают выполнения операции Фонтена.
Однофакторный регрессионный анализ показал, что более ранний возраст, малый вес пациента, высокая степень регургитации на системном АВ-клапане, продолжительное ИК и низкое насыщение крови кислородом в послеоперационном периоде – предикторы госпитальной летальности. Возраст менее 6 мес. увеличивал вероятность летального исхода на госпитальном этапе (ОШ 7,5; 95% ДИ 2,0–28,1; р = 0,0045). Многофак-
987654321 ,,,,,,,, 00000000
% ,ытрогок йещбо то вотнеицап яло
0,0 0 1 2 3 4 5 6 7 8 9 10 11 12
Временной период, лет n 120 96 77 58 47 35 25 17 12 8 4 3
Рис. 3. Свобода от тромбоза кавопульмонального тракта (метод Каплана – Майера)
торный регрессионный анализ выявил прямую достоверную связь госпитальной смертности со степенью АВ-регургитации (ОШ 1,27; 95% ДИ 1,01–1,61; р = 0,04) и длительностью ИК (ОШ 1,33; 95% ДИ 1,03–1,72; р = 0,03) и обратную связь с возрастом пациента на момент формирования ДКПА (ОШ 0,79; 95% ДИ 0,62–0,99; р = 0,05).
Оценка риска неблагоприятного исхода продемонстрировала, что подъем давления в системе ДКПА выше 14 мм рт. ст. на каждый 1 мм рт. ст. увеличивает риск на 11% (р = 0,04), снижение насыщения крови кислородом на 1% от 84% – на 10%, а наличие признаков тромбоза кавопульмонального тракта (на различных уровнях) – в 4,5 раза. Такие показатели, как возраст пациента менее 6 мес. и продолжительность ИК, были значимыми только в однофакторном анализе (табл. 4). Выявление предикторов тромбоза в системе ДКПА определило возраст менее 6 мес. и продолжительность ИК основными прогностическими признаками (р<0,01).
Обсуждение
Одноцентровое ретроспективное исследование было сфокусировано на оценке госпитальной летальности и выживаемости пациентов, перенесших формирование ДКПА, а также на выявлении основных факторов риска неблагоприятного исхода в этой группе пациентов. Результаты формирования кавопульмонального анастомоза характеризуются широким диапазоном показателей уровня летальности как на госпитальном этапе (от 0,7 до 15% [3, 4, 7, 8]), так и в межэтапном периоде (от 6 до 17% [4, 8–10]). При этом общий уро- вень смертности после ДКПА в различных когортах пациентов колеблется от 16 до 33% [3, 6].
В нашем исследовании на госпитальном этапе умерли 14 детей (10,7%), в межэтапном периоде – 3 (2,6%) и 1 пациент после операции Фонтена. Таким образом, общая летальность среди пациентов, перенесших ДКПА, составила 13,8%. Проведенный анализ факторов госпитальной смертности показал, что основными предикторами явились ранний возраст пациента, большая степень недостаточности системного АВ-клапана, длительный ИК. Вес пациента и послеоперационное насыщение крови кислородом были значимыми только в однофакторном анализе.
Такие факторы риска ранней смертности, как ранний возраст, малый вес ребенка [4, 9], более чем умеренная регургитация на системном АВ-клапане [9, 11] и продолжительное ИК [4, 7], были продемонстрированы и в других клинических исследованиях.
Несмотря на достаточно большое количество работ, оценивающих влияние возраста на исход ДКПА [9, 11–14], точные временные рамки выполнения промежуточного этапа гемодинамической коррекции остаются спорными. Сторонники концепции «тикающих часов» считают, что Фонтен-циркуляция имеет ограниченный срок службы, поэтому инициализация гемодинамики Фонтена (ПКПА) должна быть отложена у ряда пациентов [15]. Однако данному мнению противопоставляется теория «ранней объемной разгрузки», сторонники которой стремятся как можно раньше выполнить ДКПА [9, 12].
Тем не менее некоторые авторы указывают на то, что осложненное течение послеоперационного пери-
Таблица 4 Анализ факторов риска
|
Однофакторный анализ |
Многофакторный анализ |
|||
|
Предиктор |
ОШ (95% ДИ) |
р |
ОШ (95% ДИ) |
р |
|
Госпитальная летальность |
||||
|
Возраст |
0,88 (0,80–0,97) |
<0,01 |
0,79 (0,62–0,99) |
0,05 |
|
Вес |
0,55 (0,38–0,80) |
<0,01 |
0,64 |
|
|
АВ-регургитация |
2,28 (1,04–4,99) |
0,03 |
1,27 (1,01–1,61) |
0,04 |
|
Продолжительность ИК |
1,01 (1,00–1,03) |
<0,01 |
1,33 (1,03–1,72) |
0,03 |
|
Сатурация в п/о периоде |
0,88 (0,81–0,96) |
<0,01 |
0,45 |
|
|
Неблагоприятный исход |
||||
|
Возраст <6 мес. |
2,88 (1,07–7,78) |
0,04 |
0,12 |
|
|
ИК |
1,01 (1,00–1,02) |
<0,01 |
0,41 |
|
|
Среднее рКПТ (п/о период) |
1,19 (1,08–1,31) |
<0,01 |
1,11 (1,00–1,22) |
0,04 |
|
Сатурация в п/о периоде |
0,87 (0,82–0,93) |
<0,01 |
0,90 (0,84–0,97) |
<0,01 |
|
Тромбоз КПТ |
6,64 (2,88–15,3) |
<0,01 |
4,55 (1,89–10,9) |
<0,01 |
|
АВ-регургитация |
1,33 (1,03–1,72) |
0,20 |
||
|
Тромбоз кавопульмон |
ального тракта |
|||
|
Возраст <6 мес. |
7,98 (1,84–34,7) |
<0,01 |
17,3 (3,25–92,2) |
<0,01 |
|
Продолжительность ИК |
1,01 (1,00–1,03) |
<0,01 |
1,02 (1,01–1,03) |
<0,01 |
ОШ – отношение шансов; ОР – отношение рисков; 95% ДИ – 95% доверительный интервал; АВ-регургитация – регургитация на системном атриовентрикулярном клапане; ИК – искусственное кровообращение; окклюзия Ао – окклюзия аорты; п/о период – послеоперационный период; рКПТ – давление в кавопульмональном тракте
ода может нивелировать потенциальные преимущества более раннего ДКПА [13, 14]. O. Petrucci с соавт. показали, что в группе пациентов, перенесших ДКПА в возрасте до 3 мес., послеоперационный период прошел менее успешно, о чем свидетельствуют длительность нахождения в послеоперационной палате реанимации и продолжительность ИВЛ и госпитализации в целом [11]. K.G. Friedman с соавт. отмечают, что у пациентов, подвергшихся раннему ДКПА (ранее 3-месячного возраста), частота неблагоприятных исходов достигает 70% из-за выраженных гемодинамических нарушений. В этой группе пациентов 6-месячная летальность составила 40%, в то время как в более старшей группе имела место 10% смертность в течение 5-летнего периода наблюдения [9]. В нашей когорте пациентов выживаемость после формирования ДКПА в течение 1 года наблюдения составила 86,3%, 3 лет – 85,1%, 10 лет – 83,4%. Свобода от неблагоприятного исхода – 83,3 и 76,3% в течение 1- и 5-летнего периода.
Полученные нами результаты соответствуют описанным ранее [10], однако имеющиеся данные варьируют в различных когортах пациентов. A.M. Tan с соавт. продемонстрировали 90,7 и 88,7% общей выживаемости пациентов, перенесших ДКПА, в течение 10- и 15-летнего периода наблюдения [8]. Но авторы отмечают, что 10-летняя выживаемость пациентов, подходящих для выполнения процедуры Фонтена, была 99,2%, в то время как для неподходящих кандидатов – 67,4%. Q. Chen с коллегами выявили, что при сохраненном ДИЛК свобода от развития летального исхода в 5- и 10-летнем периодах наблюдения достигает 96%, в то время как при изолированном ДКПА – 88 и 82% [5].
Основными предикторами неблагоприятного исхода (летальный исход, демонтаж ДКПА, невозможность выполнения операции Фонтена) в нашей когорте пациентов явились повышенное среднее давление в системе ДКПА, низкий уровень насыщения крови кислородом в послеоперационном периоде и тромбоз кавопульмонального тракта. O. Honjo с коллегами также отнесли высокое послеоперационное ЦВД (р = 0,05), низкую сатурацию (р = 0,01), тромбоз системы ДКПА (р = 0,02) к факторам риска смертности и трансплантации сердца [16].
Тромботические осложнения послеоперационного периода ДКПА существенно увеличивают вероятность летального исхода [17]. В нашей группе пациентов вероятность возрастала в 4,5 раза при наличии признаков тромбоза в системе ДКПА. Хотя период после формирования верхнего кавопульмонального анастомоза считается менее опасным в отношении тромботических осложнений по сравнению с первичной паллиативной процедурой и ПКПА [17, 18], риск тромбоза на этом этапе остается существенным. С.
Manlhiot с коллегами описывают свободу от тромботических осложнений у пациентов после ДКПА лишь в 66% случаев в течение 3,5-летнего периода наблюдения. При этом авторы продемонстрировали высокий риск развития ранних тромботических осложнений, который снижается в течение периода наблюдения, но в последующем увеличивается к моменту формирования ПКПА [17]. По результатам нашего анализа, свобода от тромбоза кавопульмонального тракта составила 97% в течение 1 месяца наблюдения, 95,5% – в течение 1 года, 94 и 90,5% в 3- и 10-летнем периодах наблюдения соответственно.
В некоторых исследованиях одним из основных показателей, влияющих на выживаемость после ДКПА, является АВ-регургитация [11, 19, 20]. В нашей когорте пациентов степень недостаточности на системном АВ-клапане увеличивала риск развития летального исхода на госпитальном этапе по результатам как однофакторного, так и многофакторного анализа. Однако мы не выявили достоверного влияния этого параметра на частоту развития неблагоприятного исхода в периоде наблюдения (р = 0,20).
Несмотря на то что в некоторых работах не выявлено связи времени выполнения ДКПА с выживаемостью [11] и частотой развития неблагоприятного исхода [7], ряд авторов определяют младший возраст пациента как прогностически неблагоприятный признак смерти или трансплантации сердца в периоде наблюдения [9, 21]. В проведенном нами исследовании более молодой возраст был не только ассоциирован с госпитальной летальностью, но и являлся независимым фактором риска неблагоприятного исхода в однофакторном анализе.
Хотя удовлетворительные результаты формирования ДКПА у пациентов младше 6 мес. были описаны [6, 11, 12], мы, как и наши японские коллеги [20], склонны выполнять промежуточный этап гемодинамической коррекции в более старшем возрасте. Это обусловлено, с одной стороны, большими размерами сосудов, с другой, зрелостью легочной ткани и, следовательно, меньшей предрасположенностью к развитию участков внутрилегочного шунтирования после ДКПА и ИК-индуцированных осложнений [13]. Полученные нами результаты подтверждают эту точку зрения. Возраст менее 6 мес. и продолжительное ИК явились прогностическими признаками осложненного течения послеоперационного периода с тромбозом кавопульмонального тракта.
Меньший диаметр сосудов у маленьких пациентов увеличивает риск деформаций в месте кавопульмональ- ного анастомоза или канюляции ВПВ. Даже незначительная резидуальная обструкция сосуда при низкоскоростном ламинарном потоке может привести к стазу крови и образованию тромба на этом уровне. Повреждение эндотелия наряду с длительным внутрисосудистым нахождением инородного тела (венозной канюли) также является провоцирующим фактором тромбоза. Продолжительность ИК отражает степень гемодинамических нарушений, потребовавших большего временного промежутка для их устранения, и может быть расценена как показатель анатомической сложности порока, требующего более ранней хирургической коррекции.
Также ряд клинических исследований показывает, что пациенты с ЕЖС более раннего возраста, в том числе перенесшие ДКПА, предрасположены к изменениям как уровня про- и антикоагуляционных факторов [22, 23], так и реактивности тромбоцитов [24], провоцирующей развитие послеоперационных тромбозов. Наряду с ранним возрастом, малым весом пациента и небольшими размерами сосудов [16] к факторам риска тромбоза ДКПА также относят подъем венозного давления и наличие центральной венозной линии. В исследовании мы не выявили достоверной связи уровня давления в кавопульмональном тракте с частотой тромбозов в системе ДКПА (р = 0,32).
Во всех случаях для мониторинга кавопульмонального давления устанавливался центральный венозный катетер в правую/левую внутреннюю яремную вену и удалялся на вторые-третьи сутки послеоперационного периода, мы не включили этот параметр в анализ, хотя и не отрицаем его возможное влияние на образование тромба. Однако M. Trezzi с соавт. отметили, что в их исследовании наличие центрального венозного катетера в ВПВ не было фактором риска тромбоза центральной вены у пациентов, перенесших ДКПА [25].
Ограничения исследования
Одноцентровое ретроспективное исследование имеет ограничения: возраст пациентов менее 6 мес. и отсутствие 100% предоперационных данных об уровне давления в легочных артериях и сопротивлении сосудов МКК. Оценка этих параметров в большинстве случаев была неосуществима из-за анатомических особенностей порока или высокой вероятности получения недостоверных данных: прежде всего это относится к пациентам, у которых системно-легочный анастомоз являлся единственным источником легочного кровотока, и тем, кому для выполнения процедуры исполь- зование ИВЛ с подачей кислорода было необходимым условием. Тем не менее отсутствие этих параметров в 100% случаев не позволило выявить связи исходного давления в легочных артериях и сопротивления сосудов МКК с частотой развития летального исхода, тромбоза ДКПА или несостоятельности кавопульмональной гемодинамики.
Заключение
Результаты проведенного одноцентрового ретроспективного исследования еще раз продемонстрировали, что выполнение ДКПА в возрасте младше 6 мес. ассоциировано с увеличением риска госпитальной летальности, неблагоприятного исхода и тромбоза кавопульмонального соединения. Другими не менее важными параметрами, влияющими на выживаемость и возможность в последующем перейти к полной кавопульмональной гемодинамике, являются подъем среднего давления в ДКПА, снижение уровня насыщения крови кислородом и признаки тромбоза кавопульмональной системы в послеоперационном периоде.
Список литературы Факторы риска летальности и несостоятельности кавопульмональной гемодинамики у пациентов, перенесших формирование двунаправленного кавопульмонального анастомоза
- Горбатых Ю.Н., Ничай Н.Р., Зайцев Г.С., Латыпов А.К., Новикова М.А., Жалнина Е.В., Синельников Ю.С., Струнин О.В. Гемодинамическая коррекция унивентрикулярных пороков сердца: роль дополнительных источников легочного кровотока//Патология кровообращения и кардиохирургия. 2012. № 2. C. 21-6.
- Синельников Ю.С., Горбатых Ю.Н., Сойнов И.А., Кшановская М.С., Иванцов С.М., Чащин О.В., Матюшов В.Н., Зубрицкий А.В. Эффективность различных вариантов суживания легочной артерии у пациентов с унивентрикулярными пороками//Патология кровообращения и кардиохирургия. 2013. № 2. C. 5-9.
- Wolff D., van Melle J.P., Ebles T., Hillege H., van Slooten Y.J., Berger R.M.F. Trends in mortality (1975-2011) after one-and two-stage Fontan surgery, including bidirectional Glenn through Fontan completion//Eur. J. Cardiothorac. Surg. 2014. Vol. 45. P. 602-9.
- François K., Vandekerckhove K., De Groote K., Panzer J., De Wolf D., De Wilde H., Bové T. Current outcomes of the bi-directional cavopulmonary anastomosis in single ventricle patients: analysis of risk factors for morbidity and mortality, and suitability for Fontan completion//Cardiol. Young. 2015. Feb 23. P. 1-10. doi: 10.1017/S1047951115000153
- Chen Q., Tulloh R., Caputo M., Stoica S., Kia M., Parry A.J. Does the persistence of pulsatile antegrade pulmonary blood flow following bidirectional Glenn procedure affect long term outcome?//Eur. J. Cardiothorac. Surg. 2015. Vol. 47. № 1. P. 154-8.
- Lee J.R., Choi J.S., Kang C.H., Bea E.J., Kim Y.J., Rho J.R. Surgical results of patients with a functional single ventricle//Eur. J. Cardiothorac. Surg. 2003. Vol. 24. P. 716-722.
- Kogon B.E., Plattner C., Leong T., Simsic J., Kirshbom P.M., Kanter K.R. The bidirectional Glenn operation: a risk factor analysis for morbidity and mortality//J. Thorac. Cardiovasc. Surg. 2008. Vol. 136. P. 1237-42.
- Tan A.M., Iyengar A.J., Donath S., Bullock A.M., Wheaton G., Grigg L., Brizard C.P., d’Udekem Y. Fontan completion rate and outcomes after bidirectional cavo-pulmonary shunt//Eur. J. Cardiothorac. Surg. 2010. Vol. 38. № 1. P. 59-65.
- Friedman K.G., Salvin J.W., Wypij D., Gurmu Y., Bacha E.A., Brown D.W., Laussen P.C., Scheurer M.A. Risk factors for failed staged palliation after bidirectional Glenn in infants who have undergone stage one palliation//Eur. J. Cardiothorac. Surg. 2011. Vol. 40. № 4. P. 1000-6.
- Alsoufi B., Manlhiot C., Awan A., Alfadley F., Al-Ahmadi M., Al-Wadei A., McCrindle B.W., Al-Halees Z. Current outcomes of the Glenn bidirectional cavopulmonary connection for single ventricle palliation//Eur. J. Cardiothorac. Surg. 2012. Vol. 42. P. 42-9.
- Petrucci O., Khoury P.R., Manning P.B., Eghtersade P. Outcomes of the bidirectional Glenn procedure in patients less than 3 months of age//J. Thorac. Cardiovasc. Surg. 2010. Vol. 139. P. 526-8.
- Cleuziou J., Schreiber C., Cornelsen J.K., Hörer J., Eicken A., Lange R. Bidirectional cavopulmonary connection without additional pulmonary blood flow in patients below the age of 6 months//Eur. J. Cardiothorac. Surg. 2008. Vol. 34. P. 556-562.
- Anderson J.B., Beekman R.H. 3rd, Border W.L., Kalkwarf H.J., Khoury P.R., Uzark K., Eghtesady P., Marino B.S. Lower weight-for-age z score adversely affects hospital length of stay after the bidirectional Glenn procedure in 100 infants with a single ventricle//J. Thorac. Cardiovasc. Surg. 2009. Vol. 138. № 2. P. 397-404.
- Cnota J.F., Allen K.R., Colan S., Covitz W., Graham E.M., Hehir D.A., Levine J.C., Margossian R., McCrindle B.W., Minich L.L., Natarajan S., Richmond M.E., Hsu D.T. Superior cavopulmonary anastomosis timing and outcomes in infants with single ventricle//J. Thorac. Cardiovasc. Surg. 2013. Vol. 145. № 5. P. 1288-1296.
- d’Udekem Y., Xu M.Y., Konstantinov I.E. The optimal age at Fontan procedure and the ‘ticking clock’ theory: do we have an answer?//Eur. J. Cardiothorac. Surg. 2011. Vol. 39. P. 144.
- Honjo O., Tran K.C.D., Hua Z., Sapra P., Alghamdi A.A., Russell J.L., Caldarone C.A., Van Arsdell G.S. Impact of evolving strategy on clinical outcomes and central pulmonary artery growth in patients with bilateral superior vena cava undergoing a bilateral bidirectional cavopulmonary shunt//J. Thorac. Cardiovasc. Surg. 2010. Vol. 140. P. 522-8.
- Manlhiot C., Brandao L.R., Kwok J., Kegel S., Menjak I.B., Carew C.L., Chan A.K., Schwartz S.M., Sivarajan V.B., Caldarone C.A., Van Arsdell G.S., McCrindle B.W. Thrombotic complications and thromboprophylaxis across all three stages of single ventricle heart palliation//J. Pediatr. 2012. Vol. 161. № 3. P. 513-9.
- Monagle P., Chan A., Goldenberg N.A., Ichord R.N., Journeycake J.M., Nowak-Gottl U., Vesely S.K. Antithrombotic therapy in neonates and children: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (9th Edition)//Chest. 2012. Vol. 141 (2) (Suppl). P. e737S-e801S.
- Scheurer M.A., Hill E.G., Vasuki N., Maurer S., Graham E.M., Bandisode V., Shirali G.S., Atz A.A., Bradley S.M. Survival after bidirectional cavopulmonary anastomosis: Analysis of preoperative risk factors//J. Thorac. Cardiovasc. Surg. 2007. Vol. 134. P. 82-9.
- Tanoue Y., Kado H., Boku N., Tatewaki H., Nakano T., Fukae K., Masuda M., Tominaga R. Three hundred and thirty-three experiences with the bidirectional Glenn procedure in a single institute//Interact. Cardiovasc. Thorac. Surg. 2007. Vol. 6. P. 97-101.
- Gérelli S., Boulitrop C., Van Steenberghe M., Maldonado D., Bojan M., Raisky O., Sidi D., Vouhe P.R. Bidirectional cavopulmonary shunt with additional pulmonary blood flow: a failed or successful strategy?//Eur. J. Cardiothorac. Surg. 2012. Vol. 42. P. 513-9.
- Odegard K.C., McGowan F.X., DiNardo J.A., Castro R.A., Zurakowski D., Connor C.M., Hansen D.D., Neufeld E.J., del Nido P.J., Laussen P.C. Coagulation factor abnormalities in patients with single ventricle physiology precede the Fontan operation//J. Thorac. Cardiovasc. Surg. 2002. Vol. 123. P. 459-65.
- Emani S., Zurakowski D., Baird C.W., Pigula F.A., Trenor C. III, Emani S.M. Hypercoagulability markers predict thrombosis in single ventricle neonates undergoing cardiac surgery//Ann. Thorac. Surg. 2013. Vol. 96. P. 651-6.
- Ravn H.B., Hjortdal V.E., Stenbog E.V., Emmertsen K., Kromann O., Pedersen J., Sorensen K.E. Increased platelet reactivity and significant changes in coagulation markers after cavopulmonary connection//Heart. 2001. Vol. 85. P. 61-5.
- Trezzi M., Bradley S.M., Bandisode V., Baker H., Kavarana M.N. Prior innominate vein occlusion does not preclude successful bidirectional superior cavopulmonary connection//Ann. Torac. Surg. 2015. Vol. 100. P. 162-6.


