Факторы риска неблагоприятного исхода у новорожденных, оперированных по поводу врожденной патологии дуги аорты
Автор: Хубулава Г.Г., Наумов А.Б., Марченко С.П., Чупаева О.Ю., Кулемин Е.С., Сазонов А.Б.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 2 т.19, 2024 года.
Бесплатный доступ
Обоснование: Благоприятный исход хирургического лечения зависит от многих составляющих, например, от степени выраженности сердечной патологии, своевременности диагностики и хирургического лечения, наличия и степени значимости дополнительных факторов, сформировавшихся анте- или постнатально. Именно эти детерминанты, по мнению исследователей и аналитиков, лимитируют желаемое снижение кардиохирургической летальности у младенцев. Сочетание ВПС с факторами риска предопределяет быструю декомпенсацию состояния и неблагоприятный прогноз, независимо от нозологической формы ВПС и сложности вмешательства. Большое количество факторов риска выявляется при обструктивных поражениях аорты и выводного тракта левого желудочка. Внедрение дифференцированного подхода к терапии новорожденных с факторами риска до и после операций на сердце, а также новых алгоритмов ведения данной категории пациентов заметно снижает как общую летальность, так и риск развития основных послеоперационных осложнений. Профилактика факторов риска и своевременная терапия являются важной составляющей в успехе и качестве оказания специализированной помощи новорожденным с ВПС и их выживаемости после кардиохирургических вмешательств. Цель: Выявить факторы риска неблагоприятного исхода у новорожденных детей, оперированных по поводу врожденной патологии дуги аорты. Методы: Выполнен ретроспективный анализ результатов оперативного лечения 79 пациентов с врожденной патологией дуги аорты, прооперированных в Перинатальном центре СПбГПМУ МЗ РФ за трехлетний период и оценка эффективности проведенной терапии по данным историй болезни. У всех пациентов проводилось обследование, включающее изучение акушерско-гинекологического анамнеза, анамнеза жизни и заболевания с оценкой имеющихся жалоб после рождения и изменения их с течением времени. Полученные клинические, эхокардиографические и лабораторные показатели анализировались и сравнивались. Для хирургической коррекции врожденной патологии дуги аорты применялись следующие методы оперативных вмешательств: резекция коарктации с пластикой дуги аорты нативными тканями, резекция коарктации аорты с наложением расширенного анастамоза «конец в конец», гибридное вмешательство (наложение бенда на ветви легочной артерии и стента в ОАП). Оценивались результаты проведенных оперативных методов лечения и осложнения. Результаты: Выраженную связь с неблагоприятным исходом имели такие факторы, как: развитие синдрома малого сердечного выброса до операции, экстренный характер вмешательства, сниженная фракция выброса левого желудочка (менее 35%), повышение ЧСС. Признаками средней значимости, имевшими связь с неблагоприятным исходом хирургического лечения, оказались следующие клинико-гемодинамические дооперационные показатели: повышение ЧДД, снижение КДИ ЛЖ и диастолического давления на нижних конечностях. Слабо выраженную связь с летальным исходом имели низкие антропометрические данные, снижение систолического давления на нижних конечностях. Заключение: Наиболее значимыми дооперационными факторами неблагоприятного исхода у новорожденных с врожденной патологией дуги аорты, оперированных с применением искусственного кровообращения, являются: увеличение ЧСС и снижение ФВ ЛЖ. Низкие антропометрические показатели ребенка (масса, рост, площадь поверхности тела) также оказывают влияние на исход. Индекс конечно-диастолического размера левого желудочка, как фактор, отражающий его анатомически детерминированную способность производить системный поток крови, имеет значение при выборе варианта оперативного вмешательства.
Новорожденные, врождённый порок сердца, коарктация аорты, гипоплазия дуги аорты
Короткий адрес: https://sciup.org/140307045
IDR: 140307045 | DOI: 10.25881/20728255_2024_19_2_11
Текст научной статьи Факторы риска неблагоприятного исхода у новорожденных, оперированных по поводу врожденной патологии дуги аорты

Обоснование
В России в настоящее время ежегодно рождается около 12 тыс. детей с врожденными пороками сердца (ВПС). 25–30% из них имеют выраженные анатомические изменения в строении сердца. ВПС являются одной из ведущих причин смертности среди новорожденных и грудных детей [1]. Без оказания хирургической помощи в первые 6 месяцев жизни летальность от ВПС достигает 60% [2; 3]. Потребность в оказании кардиохирургической помощи новорожденным увеличивается с каждым годом. Наиболее сложную группу среди новорожденных составляют дети с критическими и поздно диагностированными ВПС [4; 5]. У таких пациентов имеется снижение фракции выброса левого желудочка, не выявленные сопутствующие аномалии сердца. Большинство детей поступает в тяжелом состоянии. Части детей требуется выполнение операций после перенесенной транспортировки на фоне эпизодов снижения доставки кислорода и ИВЛ [6; 7]. К этим пациентам относятся дети с синдромом гипоплазии левых отделов сердца (СГЛОС), в составе которого имеется врожденная патология дуги аорты, в том числе предуктальная коарктация аорты. Кардиохирургические вмешательства в неонатологии сопряжены с риском неблагоприятного исхода. Успех кардиохирургической коррекции ВПС в периоде новорожденности зависит как от анатомических особенностей порока, так и от наличия дополнительных факторов риска, которые могут определять тяжесть состояния младенца и препятствовать своевременному выполнению операции[8; 9]. Риск неблагоприятного исхода у новорожденных может быть обусловлен, в том числе, антропометрическими данными пациентов, видом вмешательства, тяжестью общего состояния ребенка до операции[4; 8; 10]. В случаях критических ВПС проведение неотложного хирургического вмешательства требуется уже в периоде новорож-денности, порой даже в первые часы жизни. Благоприятный исход хирургического лечения зависит от многих составляющих, например, от степени выраженности сердечной патологии, своевременности диагностики и хирургического лечения, наличия и степени значимости дополнительных факторов, сформировавшихся анте- или постнатально [11–13]. Именно эти детерминанты, по мнению исследователей и аналитиков, лимитируют желаемое снижение кардиохирургической летальности у младенцев [14; 15]. Сочетание ВПС с факторами риска предопределяет быструю декомпенсацию состояния и неблагоприятный прогноз, независимо от нозологической формы ВПС и сложности вмешательства [16; 17]. Большое количество факторов риска выявляется при обструктивных поражениях аорты и выводного тракта левого желудочка. Внедрение дифференцированного подхода к терапии новорожденных с факторами риска до и после операций на сердце, а также новых алгоритмов ведения данной категории пациентов заметно снижает как общую летальность, так и риск развития основных послеоперационных осложнений. Профилактика факторов риска и своевременная терапия являются важной составляющей в успехе и качестве оказания специализированной помощи новорожденным с ВПС и их выживаемости после кардиохирургических вмешательств [9; 18; 19].
Цель исследования
Выявить факторы риска неблагоприятного исхода у новорожденных детей, оперированных по поводу врожденной патологии дуги аорты.
Методы
Дизайн исследования
В работе проведен ретроспективный анализ результатов оперативного лечения всех пациентов с врожденной патологией дуги аорты, прооперированных в Перинатальном центре ФБГОУ ВО СПбГПМУ Минздрава России за три года и оценка эффективности проведенной им терапии по данным историй болезни.
Критерии соответствия
В исследование были включены прооперированные дети с изолированной коарктацией аорты, коарктацией в сочетании с гипоплазией дуги аорты, ОАП, ДМЖП, ДМПП, КСА, а также коарктацией аорты в составе СГЛОС.
Критерием исключения из исследования являлось наличие у больного тяжелого сопутствующего врожденного порока сердца (АТК, ООАВК, ТАДЛВ, синдром Шона), помимо патологии дуги аорты, существенно влияющего на гемодинамику. Также, из исследования были исключены пациенты, имеющие в составе множественных врожденных пороков развития, помимо патологии дуги аорты, тяжелую экстракардиальную патологию, неблагоприятно влияющую на прогноз заболевания.
Условия проведения
Для решения поставленных задач выполнен комплексный анализ 79 случаев лечения пациентов с врожденной патологией дуги аорты в отделении анестезиологии и реанимации для детей с кардиохирургической патологией Перинатального центра ФБГОУ ВО СПбГПМУ Минздрава России. Возможность проведения исследования одобрена этическим комитетом ФГБВОУ ВО «Военно-медицинская академия имени С.М. Кирова» Минобороны России 29.06.2021 г.
Обследованы были дети со сроком гестации от 32-х до 40 недель на момент рождения. Наибольший процент пациентов составили новорожденные 38, 39 и 40 недель гестации — 22,8%, 38% и 17,7%, соответственно. Число детей, рожденных в сроке 32–37 недель гестации, в пределах 2,5–6,3%. Медиана массы тела пациентов в исследовании составила 3,45 кг, 25(Q1)–75(Q3): 3,0–4,0 кг. Минимальная масса тела детей на момент лечения была 1,5 кг. Медиана роста 55 см. Медиана площади поверхно-

сти тела 0,23 м2, 25(Q1)–75(Q3): 0,21–0,27 м2, минимальная BSA 0,13 м2.
Описание медицинского вмешательства
У всех пациентов, включенных в исследование (N = 79), проводилось обследование с изучением данных акушерско-гинекологического анамнеза, анамнеза жизни и заболевания с оценкой имеющихся жалоб после рождения и изменения их с течением времени. Полученные клинические, ЭхоКГ и лабораторные показатели анализировались и сравнивались. ЭхоКГ исследования у пациентов проводилось аппаратами для ультразвуковой диагностики «SanoScape S6» и «Philips iE-33». Параметры гемодинамики вычислялись с помощью формул. Для хирургической коррекции врожденной патологии дуги аорты применялись следующие методы оперативных вмешательств: резекция коарктации с пластикой дуги аорты нативными тканями, резекция коарктации аорты с наложением расширенного анастамоза «конец в конец», гибридное вмешательство (наложение бенда на ветви легочной артерии и постановка стента в ОАП). Оценивались результаты проведенных оперативных методов лечения и осложнения.
Было определено число паллиативных и радикальных оперативных вмешательств, экстренных и плановых операций, число операций, выполненных с применением ИК, операций с изолированной перфузией головного мозга (ГМ) (Таблица 1).
Анализ в подгруппах
В ходе исследования пациенты, оперированные по поводу врожденной патологии дуги аорты, по клиническим признакам были разделены на три основные подгруппы.
Первая подгруппа: «бессимптомная». В нее вошли младенцы с постдуктальной коарктацией аорты (коарктацией по взрослому типу). В данном случае успевают развиться коллатерали. Закрытие ОАП не ведет к гипоперфузии нижней половины туловища и ДН, поэтому клиники нет.
Вторая подгруппа: пациенты с признаками гипоперфузии в бассейне нисходящей аорты — эта ситуация возникает при наличии предуктальной коарктации аорты и ОАП. Имеется ОАП с R-L сбросом. Происходит его быстрое закрытие с развитием тяжелого нарушения гемодинамики в виде с-ма малого выброса (т.е. гипокинетический тип гемодинамики). Кровоток в нижней половине туловища нарушается (гипоперфузия — «обкрадывание» мезентериального и почечного кровотока), развивается тяжелая гипоксемия.
В третью подгруппу были включены пациенты с гиперволемией малого круга кровообращения, в частности с СГЛОС, нерестриктивным ДМЖП и коарктацией аорты. В этом случае имеется ОАП с R-L сбросом, который функционирует долго. На этом фоне развивается лево-
Табл. 1. Распределение пациентов по виду оперативных вмешательств
Пациентов этих подгрупп различали не только особенности клинических проявлений, но и характер течения заболевания и его исходы.
-
1. В подгруппе бессимптомных пациентов летальность составляла 0%, экстренных вмешательств не было, операции с ИК составили 73%, изолированная перфузия ГМ выполнена у 69,2% (18 пациентов), гибридных вмешательств не было. Все пациенты этой подгруппы поступили в стабильном состоянии на самостоятельном дыхании, низкая фракция выброса левого желудочка наблюдалась у 3 пациентов (11,5%), снижения толерантности к пище не наблюдалось. Частота дыхательных движений составила 67 в минуту (65:69; 62–73), ЧСС 160 в минуту (155:166; 147–172), КДИ ЛЖ 26 мл/м2 (21:36; 16–42), масса 4,35 кг (3,2:7,4; 2–11,7), ФВ ЛЖ 65% (65:65; 27–65).
-
2. Среди пациентов, клиническое состояние которых характеризовалось признаками гипоперфузии ниже перешейка аорты, летальность составляла 21% (7 пациентов), экстренные вмешательства были выполнены у 22 пациентов (66,7%), с ИК было прооперировано 24 пациента (72,7%), изолированная перфузия ГМ выполнена у 63,6% (21 пациент), гибридных вмешательств не было. Часть пациентов этой группы,9 человек (28,1%), поступило в отделение на фоне проводимой ИВЛ. У 19 детей (57,5%) были признаки системной гипоперфузии. Низкая фракция выброса наблюдалась у 6 пациентов (18,2%). Общее состояние осложнялось признаками пареза кишечника у 13 пациентов (39,4% случаев). Частота дыхательных движений 73 в минуту (68:78; 61–84), ЧСС 175 в минуту (164:181; 142–194), КДИ ЛЖ 18 мл/м2 (12:22; 9,3–38), масса 3,45 кг (3,0:3,6; 1,5–6,2). ФВ ЛЖ 65% (37:65; 22–65).
-
3. Среди пациентов, у которых ведущим проявлением заболевания была гиперволемия малого круга кровообращения, летальность составила 45% (9 пациентов) за счет пациентов с СГЛОС. Экстренные вмешательства были выполнены у 18 пациентов (90%), с ИК был прооперирован 1 пациент (5%), изолированная перфузия ГМ в этой категории пациентов не выполнялась. 25% младенцев этой группы (5 человек) поступило в отделение на фоне проводимой ИВЛ. У 10 детей (50%) отмечались признаки системной гипоперфузии. Низкая фракция выброса левого желу-

дочка наблюдалась у 5 больных (25%). Общее состояние осложнялось явлениями пареза кишечника у 9 пациентов (45%) случаев. Частота дыханий составила 72 в минуту (66:76; 57–83), ЧСС 168 в минуту(161:177;
150–192), КДИ ЛЖ 9,25 мл/м2 (8:14,3; 6,0–24,0), масса тела 3,18 кг (3,0:3,4; 1,9–4,5), ФВ ЛЖ 57% (36:65; 24–65).
Статистический анализ
Обработку материалов исследования проводили с использованием пакетов программ Microsoft Excel-2010, IBM SPSS Statistics-25 [20]. Показатели количественных признаков представлены в виде медианы (Ме), 25 (Q1) и 75 (Q3) квартилей, минимального (мин) и максимального (макс) значений. Для оценки статистической значимости различий частот применяли метод Пирсона с указанием коэффициента согласия χ 2. Корреляционный анализ проводили с помощью непараметрического метода Спирмена с указанием коэффициента R. Оценку различий числовых значений выполняли по методу Вилкоксо-
Табл. 2. Связь клинических параметров с летальным исходом
Результаты
Выраженную связь с неблагоприятным исходом имели следующие факторы: развитие синдрома малого сердечного выброса до операции, экстренный характер вмешательства, сниженная фракция выброса левого желудочка (менее 35%), потребность в ИВЛ с целью стабилизации состояния перед оперативным вмешательством, повышение ЧСС (Таблицы 2, 3).
Признаками средней значимости, имевшими связь с неблагоприятным исходом хирургического лечения, оказались следующие клинико-гемодинамические до-операционные показатели: повышение ЧДД, снижение КДИ ЛЖ и диастолического давления на нижних конечностях, антропометрические данные. Слабо выраженную связь с летальным исходом имело систолическое давление на нижних конечностях. Факторами, у которых не было выявлено связи с неблагоприятным исходами, были: систолическое давление на верхних конечностях, время ИК,
Табл. 3. Антропометрические, клинические и гемодинамические показатели пациентов
|
Ме |
Q1 |
Q3 |
Min |
Max |
Связь с летальным исходом, Х2\R (p) |
|
|
Масса, кг |
3,45 |
3,00 |
4,00 |
1,50 |
11,70 |
57\0.43 (0,001) |
|
Рост, см |
55,2 |
54,46 |
56,34 |
49,66 |
68,71 |
58\0,43 (0,001) |
|
ЧСС, в мин. |
166 |
160 |
176 |
142 |
194 |
51\0,50 (0,001) |
|
Возраст, дни |
20 |
6 |
55 |
1 |
278 |
37,2\-0,21(0,002) |
|
КДИ мл/м2 |
19 |
11 |
24 |
6 |
42 |
49,3\0,52 (0,001) |
|
АД на верхних конечностях, систолическое, мм рт. ст. |
79 |
72 |
83 |
52 |
91 |
3,2\0,12(0,09) |
|
АД_на верхних конечностях, диастолическое, мм рт. ст. |
42 |
38 |
48 |
25 |
72 |
12\-0,2 (0,06) |
|
АД_на нижних конечностях, систолическое, мм рт. ст. |
79 |
56 |
82 |
48 |
88 |
41\0,44 (0,001) |
|
АД_на нижних конечностях диастолическое, мм рт. ст. |
40 |
25 |
51 |
19 |
68 |
35\0,55 (0,001) |
|
Тахипноэ, ЧД в мин. |
69 |
66 |
76 |
57 |
84 |
39\0,44 (0,001) |
|
Время операции |
3:30 |
2:50 |
4:12 |
1:05 |
8:00 |
22\0,08 (0,5) |
|
Время ИК |
1:49 |
1:26 |
2:09 |
1:00 |
2:58 |
27\0,1 (0,5) |
|
Время пережатия аорты |
1:16 |
1:14 |
1:17 |
1:12 |
1:18 |
13\0,12(0,4) |
|
ФВ ЛЖ до операции, % |
65 |
37 |
65 |
22 |
65 |
44\0,51 (0,001) |
Табл. 4. Клинико-гемодинамические показатели в группах
|
Подгруппы для сравнения |
Бессимптомные, P1, n = 26 |
Гипоперфузия в бассейне нисходящего отдела аорты, P2, n = 33 |
Гиперволемия МКК, Р3, n = 20 |
|
Ме (Q1:Q3; Мин-Макс) |
Ме (Q1:Q3; Мин-Макс) |
Ме (Q1:Q3; Мин-Макс) |
|
|
КДИ, мл/м2 |
26 (21:36; 16-42) |
18 (12,6:22,8; 9,3 — 38) |
9,25(8:14,3;6-24) |
|
ФВ ЛЖ до операции, % |
65 (65:65; 27-65) |
65 (37:65; 22-65) |
57,5(36,5:65;24-65) |
|
ЧСС\ в мин. |
160,5 (155:166; 147-172) |
175 (164:181; 142-194) |
168(161:177,6;150-192) |
|
Тахипноэ\ ЧД в мин. |
67 (65:69; 62-73) |
73 (68:78; 61-84) |
72(66,5:76,5;57-83) |
|
АД сист на НК, мм рт. ст. |
80 (78:82; 73-86) |
57 (54:82; 48-88) |
68(53:81;48-88) |
Табл. 5. Сравнение клинико-гемодинамических показателей в группах
|
КДИ мл/м2 |
Сравнение подгрупп |
P1, P2, P3 |
P1, P2 |
P2, P3 |
P1, P3 |
|
Значения сравнения подгрупп |
Х2 = 115; р = 0,008 |
Z = -3; p = 0,001 |
Z = -3,6; p = 0,001 |
Z = -5; p = 0,001 |
|
|
ФВ ЛЖ до операции |
Сравнение подгрупп |
P1, P2, P3 |
P1, P2 |
P2, P3 |
P1, P3 |
|
Значения сравнения подгрупп |
Х2 = 33; р = 0,06 |
Z = -3,7; p = 0,001 |
Z = -5,4; p = 0,001 |
Z = -5; p = 0,001 |
|
|
ЧСС \ в мин. |
Сравнение подгрупп |
P1, P2, P3 |
P1, P2 |
P2,P3 |
P1, P3 |
|
Значения сравнения подгрупп |
Х2 = 92; р = 0,0 |
Z = -5,7; p = 0,001 |
Z = -0,7; p = 0,4 |
Z = -2,5; p = 0,01 |
|
|
Тахипноэ\ ЧД в мин. |
Сравнение подгрупп |
P1, P2, P3 |
P1, P2 |
P2, P3 |
P1, P3 |
|
Значения сравнения подгрупп |
Х2 = 57; р = 0,066 |
Z = -3,3; p = 0,001 |
Z = -0,8; p = 0,3 |
Z = -2,1; p = 0,03 |
|
|
АД систолическое на нижних конечностях, мм рт. ст. |
Сравнение подгрупп |
P1,P2,P3 |
P1, P2 |
P2, P3 |
P1, P3 |
|
Значения сравнения подгрупп |
Х2 = 57; р = 0,04 |
Z = -3,2; p = 0,001 |
Z = -0,8; p = 0,6 |
Z = -1,9; p = 0,05 |
время пережатия аорты. Применение методик изолированной перфузии ГМ и открытой грудины не оказало существенного влияния на течение послеоперационного периода и исходы хирургического лечения.
Летальность среди пациентов, оперированных в экстренном порядке, составила 40% (16 человек). Всего экстренно прооперированных детей 40, из них с ИК прооперировано 15 пациентов, гибридных процедур выполнено 18. Пациенты, оперированные на фоне синдрома малого сердечного выброса, составили 29 человек. Летальность среди них 15 пациентов (51%). В условиях ИК выполнено 14 вмешательств, экстренных 25 операций (86,5%).
Разделение пациентов в предоперационном периоде по вариантам клинико-гемодинамического течения заболевания (бессимптомные пациенты, больные с гипоперфузией в бассейне нисходящего отдела аорты, дети с гиперволемией малого круга кровообращения) в основном продиктовано симптоматикой, обусловленной анатомо-физиологическими особенностями патологии сердца (Таблицы 4, 5).
Каждый из этих вариантов течения существенно отличался друг от друга значениями летальности (при р менее 0,01) с учетом поправки Бонферони для трех групп. Например, вмешательства у бессимптомных пациентов в наших наблюдениях не сопровождались неблагоприятными исходами, а у больных с гипоперфузией в бассейне нисходящего отдела аорты, летальность достигала 21,2%. У пациентов с признаками гиперволемии малого круга кровообращения и право-левым шунтированием наблюдалась самая высокая летальность в послеоперационном периоде — 45%.
Табл. 6. Сравнение оперативных вмешательств в группах
|
Бессимптомные, n (%) |
Гипоперфузия в бассейне нисходящей аорты, n (%) |
Гиперволемия МКК, n (%) |
|
|
Плановое вмешательство |
26 (100) |
11 (33,3) |
2(10) |
|
Экстренное вмешательство |
0 (0) |
22 (66,7) |
18(90) |
|
Операция без ИК |
7 (26,9) |
9(27,3) |
19(95) |
|
Операция с ИК |
19 (73,1) |
24(72,7) |
1(5) |
Необходимо отметить, что признаки, характеризующие дооперационное состояние младенцев, существенно отличались между собой среди описанных выше клинических групп. Это касается основных, выявленных на предыдущих этапах анализа, маркеров: ЧСС, ЧДД, АД на нижних конечностях, фракции выброса ЛЖ и КДИ ЛЖ.
Указанные выше клинические варианты течения болезни так же существенно отличались между собой по частоте выполненных экстренных вмешательств (Х2 = 55,2; р = 0,01) и применению ИК (Х2 = 27,6; р = 0,04) (Таблица 6).
Обсуждение
В ходе анализа данных определены основные факторы, имеющие связь с неблагоприятным исходом оперативного вмешательства и отражающие выраженность тяжести состояния. В первую очередь, это клинические данные, определяющее необходимость экстренного вмешательства. Хорошо известно, что потребность в про-

ведении экстренного вмешательства увеличивает его риски не только в неонатологии и кардиохирургии [8; 10; 14]. Так же, как и необходимость выполнения срочного вмешательства у пациентов с выраженными системными гемодинамическими расстройствами или в состоянии шока [4; 6; 10]. Схожие данные были получены и в нашем исследовании. Применение ИК по-разному оценивается в литературе, в том числе, как дополнительный фактор риска. В нашем исследовании четкой связи с неблагоприятными исходами выявлено не было. (ОШ 1,0, при 95% ДИ 0,5–1,2, Х2 = 0,1, р = 0,6). Однако, в неонатальной кардиохирургии известен тот факт, что выполнение вмешательств с применением ИК сопряжено с большими рисками послеоперационных осложнений и неблагоприятных исходов по мере уменьшения массы тела пациентов.
Нами было выявлено, что масса, рост и площадь поверхности тела пациента может оказать влияние на конечные исходы. Анализ характеристических кривых (ROC-анализ) антропометрических данных обследованных пациентов подтверждает это обстоятельство. При оценке антропометрических данных пациентов, оперированных в условиях ИК, связь с исходами была достаточно выражена (AUС = 0,833, р = 0,009 и 95% ДИ = 0,689–0,978). Критическое значение массы тела для этой категории пациентов составило 3400 г, при чувствительности 80% и специфичности 72%. Для пациентов, оперированных по экстренным показаниям, критическое значение массы тела составило 2150 г (чувствительность 79%, специфичность76%). Снижение фракции выброса левого желудочка менее 35% показала увеличение специфичности к неблагоприятному исходу до 95%. Факт наличия сниженной фракции выброса ЛЖ менее 35% в этой категории пациентов увеличивал риск неблагоприятного исхода в 5,4 раза с 95% ДИ 1,2–25, при Х2 = 5 и р = 0,03.
Таким образом, сформировано мнение о том, что основными факторами, влияющими на исход оперативного вмешательства, являются сочетание клинического варианта течения порока, тяжесть состояния до оперативного вмешательства, потребность в выполнении экстренной операции и применении ИК.
ROC анализ частоты сердечных сокращений и исходов оперативного лечения среди пациентов, перенесших вмешательство в условиях ИК, показал увеличение частоты неблагоприятного исхода при увеличении критического значения ЧСС более 175 в минуту, при чувствительности 83% и специфичности 68% (AUС = 0,779, р = 0,03 и 95%ДИ = 0,55–0,99).
Для более точного определения вероятности исходов в зависимости от клинического состояния нами был выполнен последовательный анализ факторов, показавших прямую связь с неблагоприятным исходом.
С помощью логистической регрессии были получены данные, позволяющие утверждать, что построение оптимальной математической модели прогноза неблагоприятного исхода возможно при сочетании двух наиболее значимых факторов: частоты сердечных сокраще- ний и дооперационной фракции выброса левого желудочка. Включение в статистическую обработку других исследованных факторов (уровень лактата, тахипноэ) показало, что эти факторы значительно нивелируют мощность модели логистической регрессии и они были исключены из расчетов. В конечном итоге, модель показала достаточно высокую точность правильного предсказания в 91%, с чувствительностью 85%, специфичностью 78%, при р = 0,03. Компоненты модели включали основную константу, равную -29,0 при коэффициенте Вальда 3,4 и значимости р = 0,035. Коэффициент b1 для значения частоты сердечных сокращений составил 0,21, при значении параметра Вальда 4,1 и р = 0,045. В свою очередь коэффициент b2 для фракции выброса левого желудочка составил -0,12, при параметре Вальда 5,3 и р = 0,021.
В окончательном виде уравнение логистической регрессии имело такой вид: Модель №1 :
^(^ — 1 + e u^o + o.aix.-o.i’x,) ’ где: Х1 — частота сердечных сокращений, удары в минуту.; Х2 — фракция выброса левого желудочка, %.
Вычисляемый результат R(Y), отображаемый в процентах, в нашей работе мы назвали « модель вероятности операционного исхода » (МВОИ) . МВОИ, % = R(Y)*100%.
При выполненном корреляционном анализе среди пациентов, перенесших вмешательство в условиях ИК, выявлено, что неблагоприятные исходы находились в прямой зависимости (R = 0,58) от значений доопера-ционной вероятности по уравнению логистической регрессии, учитывающей показатели частоты сердечных сокращений и дооперационной фракции выброса (МВОИ), при χ 2= 32,2 и р = 0,001. Это так же было подтверждено результатами ROC анализа, в ходе которого была значительная площадь под кривой ( AUС = 0,958 с 95%ДИ = 0,896–1,0), при р = 0,001. Критическое значение для МВОИ было определено, как 58% ,при чувствительности 92% и специфичности 85%.
Графическое отображение расчетов вероятности неблагоприятного исхода при вмешательствах с ИК на основании уравнения представленной модели логистической регрессии (сочетание значений дооперационной фракции выброса ЛЖ и частоты сердечных сокращений), при четырех вариантах значений фракции выброса левого желудочка с указанием J-индекса (индекса Йодена) для МВОИ (Рис. 1), наглядно дает представление о безопасных значениях этих параметров. Совмещение перпендикуляра от значения частоты сердечных сокращений, расположенных на оси абсцисс, с кривой, соответствующей определенной фракции выброса левого желудочка, дает значение вероятности операционного исхода в процентах, отложенных по оси ординат.
Так, в клинической ситуации, решение о возможности выполнения экстренного вмешательства может быть принято на основании расчета предлагаемой «модели вероятности операционного исхода».
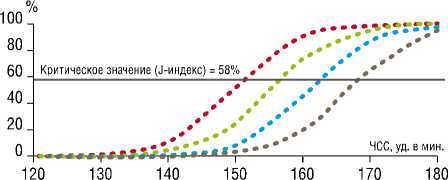
----ФВЛЖ = 20% ••••ФВЛЖ = 40%
••ФВЛЖ = 30% ••••ФВЛЖ = 50%
Рис. 1. Вероятность развития неблагоприятного исхода при вмешательстве с применением искусственного кровообращения при значениях ФВ ЛЖ и ЧСС до операции
Например: в ситуации, когда у пациента верифицирована систолическая дисфункция со снижением фракции выброса до 30%, а наихудший показатель ЧСС в течение суток составил 150 ударов в минуту, расчетный показатель вероятности операционного исхода будет составлять 25%, что существенно ниже критического значения (индекс Йодена =58%). Таким образом, выполнение вмешательства с точки зрения функционирования системы кровообращения можно считать безопасным.
В клинической ситуации с таким же значением фракции выброса ЛЖ, но с выраженными проявлениями тахикардии (ЧСС более 160 уд в мин), показатель вероятности плохого операционного исхода будет составлять 73%, что, в свою очередь, значительно превышает критический уровень в 58%. В данном случае, более безопасным вариантом оперативного лечения будет выбор в пользу вмешательства без применения ИК.
Заключение
Наиболее значимыми дооперационными факторами неблагоприятного исхода у новорожденных с разными анатомическими вариантами врожденной патологией дуги аорты, оперированных с применением ИК, являются: увеличение ЧСС и снижение ФВ ЛЖ. Низкие антропометрические показатели ребенка (масса, рост, площадь поверхности тела) также оказывают влияние на исход хирургических вмешательств у этих больных. Для более точного определения вероятности неблагоприятного исхода при выборе оперативного вмешательства с применением ИК целесообразно использовать сочетание клинических и инструментальных признаков (ЧСС и ФВ ЛЖ) в логистической модели (Рис. 1). КДИ ЛЖ, как фактор, отражающий анатомически детерминированную способность левого желудочка производить системный поток крови, может иметь значение при выборе варианта оперативного вмешательства. Однако, эта гипотеза требует дальнейшего исследования и подтверждения.
Список литературы Факторы риска неблагоприятного исхода у новорожденных, оперированных по поводу врожденной патологии дуги аорты
- Бокерия Л.А., Ступаков И.Н., Самородская И.В., Ботнарь Ю.М. Сердечно-сосудистые заболевания в Российской Федерации на рубеже веков: смертность, распространенность, факторы риска // Сердечно-сосудистые заболевания. Бюллетень НЦ ССХ им. А.Н. Бакулева РАМН. — 2007. — №5. — С.5-11.
- Бокерия Л.А., Туманян М.Р., Филаретова О.В., Абрамян М.А., Трунина И.И. Кардиохирургия новорожденных. Новые подходы к анализу результатов и факторов риска (современное состояние проблемы) // Сердечно-сосудистые заболевания. Бюллетень НЦ ССХ им. А.Н. Бакулева РАМН. — 2010. — №6. — С. 4-17.
- Szaflik K, Goreczny S. Predictors of Left Ventricular Outflow Tract Obstruction After Conventional Repair for Patients with interrupted aortic arch or coarctetion of the aorta,combined with ventricular septal defect: a single-center experience.Pediatr Cardiol. 2022; 3: 525-531.
- Boyd, et al. Improving diagnostic accuracy in neonates with left heart obstruction in a transport setting. J. Paediatr. ChildHealth. 2021; 57(1): 26-32.
- Сойнов И.А., Рзаева К.А., Горбатых Ю.Н. и др. Пятнадцатилетний опыт лечения коарктации аорты // Детские болезни сердца и сосудов. — 2023. — №20(2). — С.126-140. doi: 10.24022/1810-0686-2023-20-2-126-140.
- Бокерия Л.А. и др. Сердечно-сосудистая хирургия 2020. Болезни и врожденные аномалии системы кровообращения // НМИЦ ССХ им. А.Н.Бакулева Минздрава России. — 2021. — С.294.
- Li X, Li J, et al. Surgical repair of persistent fifth aortic arch coarctation and interrupted fourth aortic arch without cardiopulmonary bypass: a case report. Transl Pediatr. 2022; 2: 306-310. doi: 10.21037/tp-21-350.
- Трунина И.И. Гипотрофия, внутриутробные инфекции и синдромальная патология, как факторы риска неонатальной кардиохирургии // Детские болезни сердца и сосудов. — 2012. — №3. — С.23-30.
- Трунина И.И, Туманян М.Р., Шарыкин А.С., Филаретова О.В. Факторы риска, влияющие на выживаемость новорожденных после хирургической коррекции врожденных пороков сердца // Педиатрия. — 2017. — №96(1). — С.37-43.
- Derios L. Prenatal diagnosis of aortic coarctation: Prediction algorinm according to gestation age. Fetal Diagn Ther. 2021; 48: 819-828.
- Jadczak A, Respondek-Liberska M, Sokolowski L. Hypoplastic left heart syndrome with prenatally diagnosed foramen ovale restriction: diagnosis,management and outcome. J Matern Fetal Neonatal Med. 2022; 2: 291-298. doi: 10.1080\14767058.2020.1716717.
- Steiner I, Pisa M. Immediate results of percutaneous management of coarctation of the aorta: a 7-year single-centre experience. Int J Cardiol. 2021; 1: 103-106.
- Lloyd D, van Poppel M, All E. Analysis of 3-Dimensional Arch Anatomy, Vascular Flow, and Postnatal Outcome in Cases of Suspected Coarctation of the aorta using fetal cardiac magnetic resonance imaging .Circ Cardiovasc Imaging. 2021; 7: 131-140.
- Коарктация аорты. Федеральные клинические рекомендации. — 2019. — С.27.
- Марченко С.П., Хубулава Г.Г., Наумов А.Б. и др. Патофизиологические принципы и подходы к оценке гемодинамики // Педиатр. — 2014. — №5(4). — С.110-115.
- Colguit J, Loar R. Left heart hypoplasia in the fetus: Echocardiographic predictors of outcome. Prenat Diagn. 2022; 4: 447-460. doi: 10.1002/pd.6101.
- Бедин А.В., Абрамян М.А., Шамрин Ю.Н. и др. Результаты хирургической коррекции коарктации аорты в сочетании с гипоплазией дуги аорты доступом из левосторонней торакотомии. // Детские болезни сердца и сосудов. — 2023. — №20(1). — С.5-16. doi: 10.24022\1810-0686-2023-20-1-5-16.
- Григорьянц Т.Р., Ким А.И., Григорьян А.М. Двухэтапное устранение коарктации аорты у новорожденного в критическом состоянии // Детские болезни сердца и сосудов. — 2021. — Т.18. — №2. — С.147-152. doi: 10.24022/1810-0686-2021-18-2-147-152.
- Рзаева К. А., Сойнов И. А., Горбатых А.В. Критическая коарктация аорты. Возможности диагностики и хирургической коррекции коарктации аорты у новорожденных // Патология кровообращения и кардиохирургия. — 2020. — Т.24. — №2. — С.46-62. doi: 10.21688/1681-3472-2020-2-46-62.
- Унгуряну Т.Н., Гржибовский А.М. Краткие рекомендации по описанию, статистическому анализу и представлению данных в научных публикациях // Экология человека. — 2011. — №55. — С.55-60.
- 21.Unal I. Defining an optimal cut-point value in ROC analysis: An alternative approach. Comput.Math. Methods Med. 2017; 1: 1-14. doi: 10.1155.2017.3762651.


