Факторы риска возврата митральной недостаточности после аортокоронарного шунтирования и реконструкции митрального клапана у пациентов с ишемической кардиомиопатией
Автор: Карева Ю.Е., Эфендиев В.У., Рахмонов Сардор Собирович, Чернявский А.М., Лукинов В.Л.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Ишемическая болезнь сердца
Статья в выпуске: 2 т.23, 2019 года.
Бесплатный доступ
Цель Выявить факторы риска рецидива митральной недостаточности в группах изолированного аортокоронарного шунтирования и аортокоронарного шунтирования в сочетании с коррекцией умеренной митральной недостаточности. Методы Проведено одноцентровое проспективное рандомизированное исследование, в которое вошли 76 пациентов с ишемической кардиомиопатией (фракция выброса левого желудочка менее 35%) и умеренной митральной недостаточностью. Пациенты рандомизированы на две группы: изолированное аортокоронарное шунтирование и аортокоронарное шунтирование с пластикой митрального клапана. Возраст пациентов составил 57,5 ± 8,6 (от 30 до 75) года. Для коррекции митральной недостаточности в группе аортокоронарного шунтирования с пластикой митрального клапана применялась изолированная аннулопластика жестким кольцом «МедИнж» размером 26-30 мм. Результаты Изолированное аортокоронарное шунтирование или аортокоронарное шунтирование в сочетании с пластикой митрального клапана у пациентов с ишемической кардиомиопатией не приводит к статистически значимому снижению митральной недостаточности в отдаленном периоде по сравнению с исходными показателями. Однако через год после операции степень митральной недостаточности после сочетанной операции ниже исходных значений, в отличие от изолированного коронарного шунтирования. В периоде наблюдения до 36 мес. степень митральной недостаточности после изолированного коронарного шунтирования соответствует исходным значениям. Выявление предикторов прогрессирования ишемической митральной недостаточности при ишемической кардиомиопатии позволило определить пороговые значения эффективности пластики митрального клапана, а оценка эхокардиографических предикторов для аннулопластики до операции помогает выбрать тактику хирургического лечения пациентов с ишемической кардиомиопатией и умеренной митральной недостаточностью. Выводы Коррекция ишемической митральной недостаточности у пациентов с ишемической кардиомиопатией не увеличивает количество осложнений в раннем послеоперационном периоде по сравнению с группой изолированного аортокоронарного шунтирования (р = 0,015). У пациентов с ишемической кардиомиопатией и умеренной митральной недостаточностью после изолированного аортокоронарного шунтирования прогрессирование митральной регургитации (митральная регургитация 3-й степени, исходно 0%, через 12 мес. 31%, через 36 мес. 71%; р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Аортокоронарное шунтирование, ишемическая кардиомиопатия, ишемическая митральная недостаточность
Короткий адрес: https://sciup.org/142230693
IDR: 142230693 | DOI: 10.21688/1681-3472-2019-2-31-42
Текст научной статьи Факторы риска возврата митральной недостаточности после аортокоронарного шунтирования и реконструкции митрального клапана у пациентов с ишемической кардиомиопатией
Карева Ю.Е., Эфендиев В.У., Рахмонов С.С., Чернявский А.М., Лукинов В.Л. Факторы риска возврата митральной недостаточности после аортокоронарного шунтирования и реконструкции митрального клапана у пациентов с ишемической кардиомиопатией. Патология кровообращения и кардиохирургия. 2019;23(2):31-42. 1681-3472-2019-2-31-42
Митральная недостаточность (МН) является неблагоприятным фактором отдаленного прогноза у пациентов с ишемической дисфункцией левого желудочка [1, 2]. Она усугубляет течение сердечной недостаточности, увеличивает частоту развития фибрилляции предсердий, а также внезапной смерти [3, 4]. Прогрессирование недостаточности митрального клапана при ишемической дисфункции миокарда обусловлено как постинфарктным ремоделированием, то есть увеличением объема левого желудочка и нарушением геометрии, так и дисфункцией клапанного аппарата и папиллярных мышц [5– 8]. Вследствие этих изменений, коррекция МН анну-лопластическим кольцом не устраняет всех причин недостаточности [9]. Несмотря на то что процесс развития митральной дисфункции хорошо изучен, нет единого мнения по поводу коррекции данной патологии, особенно при ишемической кардиомиопатии. С одной стороны, изолированная реваскуляризация миокарда имеет лучший ранний прогноз вследствие меньшей частоты периоперационных событий и 30-дневной летальности, однако не корригирует МН, а следовательно, не останавливает дальнейшее ремоделирование сердца, не влияет на функциональный статус пациентов и прогноз жизни в отдаленном периоде. С другой стороны, дополнительная реконструкция митрального клапана — более травматич- ная и продолжительная процедура с более высоким риском ранних осложнений. Кроме того, вопрос обоснованности данного вмешательства при незначительной и умеренной ишемической митральной недостаточности остается спорным [10–12].
Цель исследования — выявить факторы риска рецидива митральной недостаточности в двух группах (изолированное аортокоронарное шунтирование и аортокоронарное шунтирование в сочетании с коррекцией умеренной митральной недостаточности).
Методы
Проведено одноцентровое проспективное рандомизированное исследование, в которое вошло 76 пациентов с ишемической кардиомиопатией (фракция выброса левого желудочка (ФВ ЛЖ) менее 35%) и умеренной МН. Пациенты, удовлетворяющие следующим критериям, включены в исследование: возраст более 18 лет, умеренная ишемическая МН, гемодинамически значимое поражение коронарных артерий, ФВ ЛЖ менее 35%. Критерии исключения: гемодинамически значимые структурные изменения клапанов, острые коронарные события, тяжелая сопутствующая патология с ожидаемой продолжительностью жизни менее 5 лет.
Эхокардиографические критерии умеренной ишемической митральной недостаточности представлены в табл. 1.
Таблица 1 Эхокардиографические параметры умеренной ишемической митральной недостаточности
|
Показатель |
Изолированное аортокоронарное шунтирование, МЕД [ИКИ] |
Аортокоронарное шунтирование с пластикой митрального клапана, МЕД [ИКИ] |
Разница, МЕД [95% ДИ] |
U-критерий Манна – Уитни, p |
|
Эффективная площадь регургитирующего отверстия, см2 |
0,3 [0,25; 0,32] |
0,3 [0,27; 0,35] |
0 [ - 0,02; 0,03] |
0,790 |
|
S МР / S ЛП, % |
30 [24,25; 35,75] |
35 [25,5; 37,0] |
2 [0; 5] |
0,110 |
|
S натяжения створок МК, см2 |
1,75 [1,52; 1,87] |
1,8 [1,5; 2,0] |
0 [ - 0,1; 0,2] |
0,710 |
|
Глубина коаптации, мм |
7 [6; 8] |
8 [7; 9] |
1 [0; 2] |
0,088 |
|
Длина коаптации, мм |
2,5 [2; 3] |
3 [2; 3] |
0 [0; 1] |
0,635 |
|
МПД, диастола, мм |
46,5 [38; 50] |
47 [37,25; 52,00] |
0 [ - 3; 4] |
0,819 |
|
ПАД, мм |
55 [50,25; 56,75] |
52 [46; 57] |
- 2 [ - 5; 1] |
0,196 |
|
Диаметр ФК МК, мм |
37 [35,25; 39,75] |
37 [35; 39] |
- 1 [ - 2; 1] |
0,389 |
Примечание. МЕД — медиана; ИКИ — интерквартильный интервал; ДИ — доверительный интервал; S МР / S ЛП — соотношение площади струи регургитации к площади левого предсердия; МК — митральный клапан; МПД — межпапиллярная дистанция; ПАД — папилло-аннулярная дистанция; ФК — фиброзное кольцо
Для оценки необходимого размера выборки использовалось приложение G*Power 3.1. Размер выборки рассчитывался по superiority дизайну c предположением о выживаемости у пациентов групп АКШ с пластикой МК и изолированного АКШ, равной 60 и 30% соответственно, и superiority margin, равной 0%, на основании результатов исследования по выживаемости пациентов с умеренной МН [13]. В исследовании F. Grigioni и соавт. получены статистически значимые различия в выживаемости у пациентов с умеренной МН и без нее: 62 и 29% соответственно. Если исходить из этих данных, планируемое количество пациентов в обеих группах составило 70 человек, что будет достаточно для получения статистически значимых различий в отдаленной выживаемости с вероятностью ошибки первого и второго рода 0,05 и 0,20 соответственно. С учетом возможности 10% случаев незаконченных наблюдений по причинам потери пациентов на разных этапах наблюдения, общий размер выборки составил 77 пациентов. Пациенты рандомизированы в две группы лечения: изолированное АКШ (контрольная) и АКШ с пластикой МК (исследуемая). Исходно, перед выпиской, через 1 год, 3 года и 5 лет после операции проводились следующие обследования: общий осмотр, эхокардиография и тест 6-минутной ходьбы.
Все операции выполнялись с использованием искусственного кровообращения с канюляцией восходящей аорты и правого предсердия (в группе изолированного АКШ) или раздельной канюляцией полых вен (в группе АКШ с пластикой МК). Для защиты миокарда во время окклюзии аорты применялся «Кустодиол» (доза 20 мл/кг массы тела больного). В 95% случаев реваскуляризацию выполняли с помощью маммарной артерии для шунтирования передней нисходящей артерии, у 4 (5%) пациентов вообще не применяли артериальные кондуиты из-за плохого качества, в 6 (7%) случаях использовали обе маммарные и лучевую артерии. Коррекция митральной недостаточности выполнялась ригидным кольцом «МедИнж» размером от 26 до 30 мм.
Статистический анализ
Малый размер исследуемых групп не позволил провести проверку эмпирических распределений непрерывных данных на согласие с законом нормального распределения с ошибкой второго рода меньше 20%. Формальная проверка нормальности критерием Шапиро – Уилка выявила 22 (48%) нормально распределенных показателя из 47 проверяемых. По этим причинам для сравнения непрерывных показателей использовался непараметрический U-критерий Манна – Уитни.
Дескриптивные характеристики представлены в виде среднее ± стандартное отклонение для нормально распределенных данных (при описании в тексте), медиана [первый квартиль; третий квартиль] для ненормально распределенных данных при описании в тексте и для всех непрерывных данных в таблицах; количество, процент [95% ДИ] для бинарных данных с вычислением границ ДИ по формуле Вильсона, для категориальных данных приведены количество и процент пациентов в каждой категории.
Для проверки тождественности распределений непрерывных показателей в группах АКШ и АКШ с пластикой МК использовался непарный U-критерий Манна – Уитни, рассчитывался сдвиг распределений с построением 95% доверительного интервала, внутри групп в разных временных точках сравнение непрерывных данных проводилось парным U-критерием Манна – Уитни. Сравнение бинарных и категориальных показателей в разных группах выполнялось точным двусторонним критерием Фишера, для сравнения показателей в разных временных точках внутри групп применялся критерий Мак-Немара.
Сравнение выживаемости между группами проводилось логарифмическим ранговым критерием с построением кривых выживаемости Каплана – Майера и вычислением отношения рисков c помощью модели пропорциональных рисков Кокса.
С помощью логистической регрессии выявлялись значимые предикторы риска возврата митральной недостаточности. Построением однофакторных моделей определялись отдельные предикторы. Перед построением многофакторных моделей выявлялись коллинеарные коварианты путем формального расчета коэффициентов корреляции Пирсона. Из исходных многофакторных моделей, включающих некоррелируемые коварианты с достигнутым уровнем значимости p<0,300 в однофакторных моделях, методами прямого и обратного шага (для двойного контроля) по информационному критерию Акаике строились оптимальные модели многофакторной логистической регрессии.
Модели прямого и обратного шага совпадали. Среди выявленных многофакторной логистической регрессией совместных предикторов риска возврата МН путем полного перебора обнаружились критические значения.
Проверка статистических гипотез проводилась при критическом уровне значимости р = 0,05, то есть различие считалось статистически значимым при p<0,05. Нижняя граница доказательной мощности равна 80%.
Статистические расчеты осуществлялись в свободно распространяемой программе RStudio
(version 1.1.463, © 2009-2018 RStudio, Inc., США) на языке статистического программирования R: A language and environment for statistical computing (R Foundation for Statistical Computing, Вена, Австрия. URL .
Результаты
Возраст пациентов составил 57,5 ± 8,6 (от 30 до 75) года, мужчин — 90%. Основные демографические данные пациентов продемонстрированы в табл. 2.
Таблица 2 Демографические данные пациентов
|
Показатель |
Изолированное аортокоронарное шунтирование, МЕД [ИКИ] |
Аортокоронарное шунтирование с пластикой митрального клапана, МЕД [ИКИ] |
Разница, МЕД [95% ДИ] |
U-критерий Манна – Уитни, p |
|
Мужчины, % [95% ДИ] |
34,89 [76; 96] |
30,79 [64; 89] |
0,4 [0,1; 1,9] |
0,346 |
|
Женщины, % [95% ДИ] |
4,11 [4; 24] |
8,21 [11; 36] |
2,2 [0,5; 11,2] |
0,346 |
|
Возраст, лет, МЕД [ИКИ] |
56 [53,0; 63,5] |
58 [51,00; 64,75] |
0 [ - 4; 4] |
0,913 |
|
ХПН, % [95% ДИ] |
2,5 [1; 17] |
7,18 [9; 33] |
4 [0,7; 42,2] |
0,153 |
|
Инфаркт миокарда, % [95% ДИ] |
36,95 [83; 99] |
36,95 [83; 99] |
1 [0,1; 14,5] |
>0,999 |
|
Гипертоническая болезнь, % [95% ДИ] |
28,74 [58; 85] |
29,76 [61; 87] |
1,1 [0,4; 3,7] |
>0,999 |
|
Сахарный диабет, % [95% ДИ] |
8,21 [11; 36] |
7,18 [9; 33] |
0,8 [0,2; 3,1] |
>0,999 |
|
Фибрилляция предсердий, % [95% ДИ] |
6,16 [7; 30] |
10,26 [15; 42] |
1,9 [0,5; 7,2] |
0,399 |
|
Инсульт, % [95% ДИ] |
2,5 [1; 17] |
3,8 [3; 21] |
1,5 [0,2; 19,4] |
>0,999 |
|
ФК ХСН по классификации NYHA, n (%) |
0 |
0 |
– |
>0,999 |
|
II |
5 (13,2) |
4 (10,5) |
1,3 [0,3; 7,1] |
>0,999 |
|
III |
22 (57,9) |
25 (65,8) |
0,7 [0,3; 2,0] |
0,637 |
|
IV |
11 (28,9) |
9 (23,7) |
0,7 [0,3; 2,0] |
0,795 |
|
ФК стенокардии по Канадской Без сте-классификации, n (%) нокардии |
8 (21) |
8 (21) |
1,0 [0,3; 3,5] |
>0,999 |
|
I |
4 (10,5) |
5 (13) |
0,8 [0,1; 4,0] |
>0,999 |
|
II |
12 (31,5) |
12 (31,5) |
1,0 [0,3; 2,9] |
>0,999 |
|
III |
11 (29) |
11 (29) |
1,0 [0,3; 3,0] |
>0,999 |
|
IV |
3 (7,9) |
2 (5,2) |
1,5 [0,2; 19,4] |
>0,999 |
Примечание. ХПН — хроническая почечная недостаточность; ФК ХСН — функциональный класс хронической сердечной недостаточности; NYHA — Нью-Йоркская ассоциация сердца (англ. New York Heart Assosiation). Сравнение возраста проводилось непарным U-критерием Манна – Уитни с вычислением сдвига распределений [95% ДИ сдвига], все остальные показатели сравнивались точным двусторонним критерием Фишера с вычислением отношения шансов [95% ДИ ОШ]
Окклюзии аорты при изолированном АКШ была 48 ± 18 мин, а в исследуемой группе — 131 ± 29 мин (р<0,001). Средний срок нахождения больных в блоке реанимации составил от 2 до 7 дней. Все осложнения периоперационного периода в двух группах оценивались по комбинированной точке. По данному показателю разницы между группами не выявлено; так, в группе изолированного КШ осложнения возникли у 17 (44,7%) пациентов, а в группе КШ с пластикой МК — у 16 (42,1%, р>0,999). Госпитальная летальность в группе КШ была 2 (5,3%) случая, в группе АКШ с пластикой МК — 4 (10,5%). Основная причина ранней летальности — острая сердечная недостаточность. За трехлетний период наблюдения отмечены следующие осложнения: острое нарушение мозгового кровообращения, внезапная сердечная смерть, прогрессирующая сердечная недостаточность, дисфункция митрального клапана (отрыв опорного кольца) после аннулопластики МК (табл. 3). При этом в группе изолированного КШ осложнений было достоверно больше (19 (52,7%) против 8 (23,5%), р = 0,015). Из специфических осложнений в группе комбинированного лечения отмечен отрыв аннулопласти-чекого кольца у 4 пациентов (11,7%), что привело к усугублению МН (р = 0,051). Структура осложнений в двух группах отображена в табл. 3.
Анализ выживаемости при каждом виде хирургического лечения показал статистически значимую разницу, так пятилетняя выживаемость после
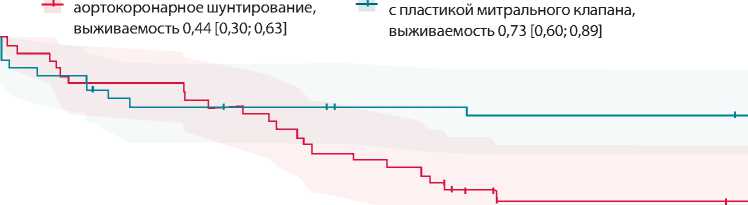
АКШ оказалась 44 [30; 63] %, а в группе АКШ с пластикой МК — 73 [60; 89] % (лог-ранк тест, р = 0,037) (рис. 1). Интересно, что за два первых года после операции значимых различий между группами нет (через 1 и 2 года после операции выживаемость 84 и 78% в группе пластики МК, 84 и 71% в группе изолированного АКШ). К третьему году после операции выживаемость в группах статистически значимо отличалась. Анализ выживаемости по модели Кокса продемонстрировал в 0,5 раза меньший риск смерти после сочетанной операции по сравнению с риском летальности в группе изолированного аортокоронарного шунтирования (ОР 0,46 [0,22; 0,97], р = 0,037).
Динамика клинико-функционального статуса пациентов двух групп в отдаленном периоде
В исследуемых группах подавляющее количество пациентов страдали стенокардией напряжения на уровне II и III функционального класса, через год наблюдения получено значимое уменьшение выраженности стенокардии, при этом у части пациентов симптомы полностью купированы, а у 80% стенокардия стала соответствовать I функциональному классу. Кроме этого, отмечено повышение переносимости физической нагрузки по результатам теста 6-минутной ходьбы в двух группах. Так, среднее расстояние возросло с 280 до 420 м через 12 мес. в группе АКШ (парный U-критерий Манна – Уитни, р = 0,010) и с 303 до 510 м в группе сочетанного лече-
Таблица 3 Осложнение в отдаленном послеоперационном периоде
|
Осложнение |
Изолированное аортокоронарное шунтирование, % [95% ДИ] |
Аортокоронарное шунтирование с пластикой митрального клапана, %, [95% ДИ] |
Аортокоронарное шунтирование / аортокоронарное шунтирование с пластикой митрального клапана, OP |
U-критерий Манна – Уитни, p |
|
ОНМК |
4,11 [4; 25] |
0,0 [0; 10] |
8,5 [0,48; 152,01] |
0,115 |
|
ВСС |
4,11 [4; 25] |
1,3 [0,5; 15,0] |
3,78 [0,44; 32,13] |
0,358 |
|
СН |
11,31 [18; 47] |
5,15 [6; 30] |
2,08 [0,81; 5,36] |
0,157 |
|
ОК |
0,0 [0; 10] |
4,12 [4,67; 26,62] |
– |
0,051 |
|
Комбинированная точка |
19,53 [37; 68] |
8,24 [12; 40] |
2,24 [1,14; 4,43] |
0,015* |
Примечание. ОНМК — острое нарушение мозгового кровообращения; ВСС — внезапная сердечная смерть; СН — сердечная недостаточность; ОК — отрыв аннулопластического кольца; ОР — отношение рисков; * статистически значимые различия
s
о
Группы статистически значимо различаются по лог-ранк тесту, р = 0,037
Изолированное
Аортокоронарное шунтирование
О
Время, мес.
|
0 |
12 |
24 Пациенты, нахо |
36 ящиеся под риском |
48 |
60 |
|
|
£ — |
38 |
32 |
26 |
29 |
11 |
11 |
|
38 |
28 |
27 |
25 |
24 |
24 |
|
|
0 |
12 |
24 |
36 |
48 |
60 |
Время, мес.
Рис. 1. Выживаемость пациентов с умеренной ишемической митральной недостаточностью и ишемической кардиомиопатией в зависимости от вида операции ния (парный U-критерий Манна – Уитни, р<0,001). Данные показатели соотносятся с положительной динамикой течения сердечной недостаточности и улучшением насосной функции сердца. Сократимость левого желудочка в группе сочетанного лечения улучшилась с 31,5 [24,75; 34,00] до 33 [28; 38] % через год после операции и оставалась выше исходных показателей до трех лет после операции (парный U-критерий Манна – Уитни, р<0,001). В отношении группы АКШ также отмечено улучшение сократимости ЛЖ в ближайшие сроки после операции, но далее сократимость вновь статистически значимо снижалась (через год после операции ФВ ЛЖ изменилась с 31,5 [27,75; 34,00] до 33 [27,00; 37,25] %, парный U-критерий Манна – Уитни, р = 0,020), а через три года после операции вновь вернулась к 30 [24; 32] %, что не имело статистически значимой разницы в сравнении с исходными данными (парный U-критерий Манна – Уитни, р = 0,230). Таким образом, оба метода лечения статистически значимо улучшали сократимость левого желудочка в первый год после операции, но через три года наблюдался возврат ФВ ЛЖ до исходных значений соответственно возврату клиники сердечной недостаточности.
Динамика ишемической митральной недостаточности
Проведена оценка динамики МН в зависимости от метода лечения (рис. 2, 3). Критериями оценки выраженности МН были эффективная площадь регургитации, процент регургитирующей струи, ширина отверстия регургитации. Исходно МН в обеих группах соответствовала второй степени и не различалась между группами.
Анализ данных показал, что АКШ не приводило к уменьшению степени МН после операции и в первый год наблюдения, при этом закономерно, что после реконструкции МК отмечалось уменьшение МН до 0-1 степени, то есть имелась прямая зависимость от метода лечения (критерий Мак-Не-мара, р<0,001). Так, в первый год после операции снижение МН как минимум на 1 степень, получено 100% пациентов после реконструкции МК и только у 28% пациентов после АКШ, при этом у 31% пациентов МН прогрессировала. Интересно, что через 3 года наблюдения выявлено увеличение МН в обеих
Митральная недоста- Тест Мак-Немара,
До операции, % точность, степень p<0,001
12 мес. после операции, %
36 мес. по-Тест Мак-Немара, сле опе- p<0,001
рации, %
Всего
38,100
32,100
21,100
Рис. 2. Динамика митральной недостаточности в группе аортокоронарного шунтирования
Митральная недоста- Тест Мак-Немара,
До операции, % точность, степень p<0,001
12 мес. после операции, %
Тест Мак-Немара, p<0,001
36 мес. после операции, %
Всего
38,100
29,100
24,100
Рис. 3. Динамика митральной недостаточности в группе аортокоронарного шунтирования с пластикой митрального клапана группах. Так, через 3 года после пластики МК пациенты имели положительную динамику в 47%, возврат МН 2-й степени — в 32% случаев и более 2-й степени — в 21% случаев, в то время как после изолированного коронарного шунтирования МН оставалась без динамики через 1 год и 3 года. Тем не менее через 3 года после сочетанной операции МН статистически значимо была меньше, чем в группе изолированного АКШ (точный двусторонний критерий Фишера, р<0,001).
С целью выявления факторов прогрессирования МН в отдаленном периоде изучены доопе- рационные эхокардиографические показатели (табл. 4). Анализу поверглись данные пациентов, у которых МН прогрессировала через 1 и 3 года после операции. Проведена однофакторная логистическая регрессия и установлено, что предикторами возврата МН были объемные показатели ЛЖ (конечные диастолический и систолический индексы, конечные диастолический и систолический объемы) в обеих группах (табл. 5). При проведении многофакторной регрессии выявлено, что наряду с конечным систолическим индексом, значимыми предикторами возврата МН являлись показатели
Таблица 4 Дооперационные значения ковариантов риска прогрессирования митральной недостаточности
|
Коварианты |
Изолированное аортокоронарное шунтирование |
Аортокоронарное шунтирование с пластикой митрального клапана |
Разница |
p |
Все пациенты |
|
КДИ, мл/м2 |
106,9 [97,4; 119,6] |
99,8 [88,2; 127,5] |
-4,4 [-15,2; 7,3] |
0,411 |
103,8 [92,0; 123,7] |
|
КСИ, мл/м2 |
74,4 [67,3; 85,6] |
71,1 [58,4; 92,7] |
-3,1 [-11,7; 6,1] |
0,466 |
73,9 [65,2; 87,0] |
|
КДО, мл |
211,4 [192,3; 234,5] |
199,5 [165; 250] |
-9 [-33,5; 16,0] |
0,451 |
208,2 [179,8; 241,0] |
|
КСО, мл |
148 [133,3; 162,0] |
147 [111,0; 175,3] |
-5 [-24; 14] |
0,557 |
148 [123,5; 171,0] |
|
ФВ, % |
31 [27,00; 33,75] |
30,5 [23,25; 34,00] |
0 [-3; 2] |
0,707 |
31 [24; 34] |
|
S МР / S ЛП |
30 [24,25; 35,75] |
35 [25,5; 37,0] |
2 [0; 5] |
0,110 |
32 [25,00; 36,25] |
|
ЭРО, см2 |
0,31 [0,27; 0,34] |
0,3 [0,27; 0,35] |
0 [-0,02; 0,03] |
0,790 |
0,305 [0,27; 0,34] |
|
Диаметр ФК МК, мм |
37 [35,25; 39,75] |
37 [35; 39] |
-1 [-2; 1] |
0,389 |
37 [35; 39] |
|
S натяжения створок, см2 |
1,75 [1,52; 1,87] |
1,8 [1,5; 2,0] |
0 [-0,1; 0,2] |
0,710 |
1,8 [1,5; 2,0] |
|
МПД, диастола, мм |
46,5 [38; 50] |
47 [37,25; 52,00] |
0 [-3; 4] |
0,819 |
46,5 [38,00; 51,25] |
|
ПАД, мм |
55 [50,25; 56,75] |
52 [46; 57] |
-2 [-5; 1] |
0,196 |
54,5 [48,75; 57,00] |
|
Глубина коаптации, мм |
7 [6; 8] |
8 [7; 9] |
1 [0; 2] |
0,088 |
8 [6; 9] |
|
1 Тип дисфункции, n (%) |
15 (40) |
15 (40) |
>0,999 |
30 (40) |
|
|
2 |
23 (60) |
23 (60) |
46 (60) |
||
|
Правое предсердие |
5,85 [5,24; 6,20] |
5,85 [4,78; 6,30] |
-0,1 [-0,5; 0,3] |
0,603 |
5,85 [4,97; 6,30] |
|
Длина коаптации, мм |
2,5 [2; 3] |
3 [2; 3] |
0 [0; 1] |
0,635 |
3 [2; 3] |
|
Диастолическая 1 |
19 (50) |
10 (26) |
0,054 |
29 (38) |
|
|
дисфункция ЛЖ 2 |
; 11 (29) |
21 (55) |
32 (42) |
||
|
исходно, n (%) 3 |
8 (21) |
7 (19) |
15 (20) |
||
|
Левое предсердие |
5,2 [4,85; 5,68] |
5,57 [5,30; 5,88] |
0,3 [0,00; 0,58] |
0,033* |
5,4 [5,08; 5,77] |
|
Давление в ЛА, мм рт. ст. |
39,5 [35,00; 49,75] |
42,5 [38,00; 55,75] |
3 [-2; 7] |
0,255 |
42 [35,75; 53,25] |
|
1 |
0 (0) |
1 (3) |
1 (1) |
||
|
Трикуспидальная 2 |
19 (51) |
20 (54) |
0,613 |
39 (3) |
|
|
регургитация, n (%) 3 |
16 (43) |
16 (43) |
32 (43) |
||
|
4 |
2 (6) |
0 (0) |
2 (3) |
Примечание. КДИ — конечный диастолический индекс; КСИ — конечный систолический индекс; КДО — конечный диастолический объем; КСО — конечный систолический объем; ФВ — фракция выброса; S МР / S ЛП — соотношение площади митральной регургитации к площади левого предсердия; ЭРО — эффективное отверстие регургитации; ФК МК — фиброзное кольцо митрального клапана; МПД — межпапиллярная дистанция; ПАД — папилло-аннулярная дистанция; ЛЖ — левый желудочек; ЛА — легочная артерия. Сравнение типа дисфункции, исходной диастолической дисфункции ЛЖ и трикуспидальной регургитации проводилось точным двусторонним критерием Фишера, сравнение остальных ковариантов проводилось непарным U-критерием Манна – Уитни с вычислением сдвига распределений и сдвига 95% доверительного интервала геометрии МК (межпапиллярная дистанция, папилло-аннулярная дистанция, глубина коаптации створок) (табл. 6).
Также установлено, что возврат МН при систолической дисфункции миокарда напрямую связан с ишемическим ремоделированием полостей сердца, особенно левого желудочка. Особую предикторную роль играли такие показатели, как индексы объемных показателей ЛЖ, сократимость ЛЖ и рестриктивный тип дисфункции, то есть функциональная анатомия МК при ишемической кардиомиопатии в основном зависит от геометрии и функции базальных отделов ЛЖ (базального ремоделирования).
Также мы оценили критические значения показателей возврата МН, которые позволили разработать алгоритм оперативного лечения таких пациентов. Так, установлено, что реконструкция митрального клапана целесообразна у пациентов со следующими значениями ЛЖ: конечный систолический индекс менее 70 мл/м2, ФВ более 30%, эффективное отверстие регургитации менее 0,3 см2, межпапиллярная дистанция менее 45 мм, папиллоаннулярная дистанция менее 55 мм, глубина коаптации менее 7 мм, не рестриктивный тип диастолической дисфункции, давление в легочной артерии менее 45 мм рт. ст.
Обсуждение
Уже давно реконструкция митрального клапана кольцом в дополнение к реваскуляризации миокарда является эффективным способом лечения митральной недостаточности [14]. Однако это утверждение не совсем применимо в отношении когорты больных с умеренной митральной недостаточно-
Таблица 5 Модель однофакторной логистической регрессии риска прогрессирования митральной недостаточности в отдаленный период
|
Коварианты |
Отношение шансов есть / нет митральная регургитация |
Отношение шансов [95% доверительный интервал] |
p |
|
КДИ |
1,042 |
[1,003; 1,097] |
0,05 |
|
КСИ |
1,049 |
[1,006; 1,109] |
0,04 |
|
КДО |
1,021 |
[1,005; 1,047] |
0,03 |
|
КСО |
1,025 |
[1,005; 1,055] |
0,03 |
|
ФВ |
0,885 |
[0,746; 1,030] |
0,12 |
|
S МР / S ЛП |
1,052 |
[0,901; 1,253] |
0,52 |
|
ЭРО |
0,187 |
[0,00; 33929,04] |
0,84 |
|
Диаметр ФК МК |
1,094 |
[0,837; 1,465] |
0,51 |
|
S натяжения створок |
0,441 |
[0,038; 4,226] |
0,48 |
|
МПД, диастола |
1,033 |
[0,943; 1,145] |
0,48 |
|
ПАД |
0,965 |
[0,862; 1,074] |
0,51 |
|
Глубина коаптации |
1,009 |
[0,630; 1,629] |
0,96 |
|
Тип дисфункции |
1,285 |
[0,241; 7,208] |
0,76 |
|
Правое предсердие |
0,752 |
[0,267; 2,009] |
0,57 |
|
Длина коаптации |
0,941 |
[0,422; 2,064] |
0,87 |
|
Диастолическая дисфункция |
1,308 |
[0,383; 4,805] |
0,66 |
|
ЛЖ исходно |
|||
|
Левое предсердие |
1,864 |
[0,450; 9,351] |
0,40 |
|
Давление в ЛА |
0,991 |
[0,918; 1,066] |
0,80 |
|
Трикуспидальная регургитация |
0,484 |
[0,085; 2,249] |
0,36 |
Примечание. КДИ — конечный диастолический индекс; КСИ — конечный систолический индекс; КДО — конечный диастолический объем; КСО — конечный систолический объем; ФВ — фракция выброса; S МР / S ЛП — соотношение площади митральной регургитации к площади левого предсердия, ЭРО — эффективное отверстие регургитации; ФК МК — фиброзное кольцо митрального клапана; МПД — межпапиллярная дистанция; ПАД — папилло-аннулярная дистанция; ЛЖ — левый желудочек; ЛА — легочная артерия
Таблица 6 Модель однофакторной логистической регрессии риска прогрессирования митральной недостаточности в отдаленный период
|
Коварианты |
Отношение шансов есть / нет митральная регургитация |
Отношение шансов [95% доверительный интервал] |
p |
|
КСИ |
1,043 |
[0,929; 1,206] |
0,04 |
|
ФВ |
0,845 |
[0,529; 1,173] |
0,06 |
|
ЭРО |
+∞ |
[0; +∞] |
0,16 |
|
МПД, диастола |
1,223 |
[0,905; 1,822] |
0,05 |
|
ПАД |
0,680 |
[0,293; 1,170] |
0,07 |
|
Глубина коаптации |
0,891 |
[0,226; 5,182] |
0,05 |
|
Диастолическая дисфункция ЛЖ |
1,166 |
[0,152; 8,664] |
0,04 |
|
Давление в ЛА |
0,990 |
[0,876; 1,140] |
0,06 |
|
Трикуспидальная регургитация |
4,784 |
[0,424; 215,478] |
0,17 |
Примечание. КСИ — конечный систолический индекс; ФВ — фракция выброса; ЭРО — эффективное отверстие регургитации; МПД — межпапиллярная дистанция; ПАД — папилло-аннулярная дистанция; ЛЖ — левый желудочек; ЛА — легочная артерия; +∞ — значения больше 106
стью и ишемической кардиомиопатией: результаты изолированного АКШ и АКШ в сочетании с коррекцией МН у таких пациентов не удовлетворительные [14, 15]. Так, при изолированной реваскуляризации митральная недостаточность прогрессирует, а при коррекции остается опасность возврата МН [16, 17]. Неудовлетворительные результаты пластики МН можно объяснить сложным и многофакторным механизмом ее формирования, а также ишемическим ремоделированием левого желудочка. В то же время расширение объема операции за счет дополнительного вмешательства на МК увеличивает количество периоперационных осложнений и летальности.
По результатам метаанализа (2014 г.), в который вошло всего 4 из 119 проспективных рандомизированных исследований, обнаружено, что комбинация реваскуляризации миокарда с реконструкцией митрального клапана уменьшает частоту возврата МН в среднеотдаленном периоде наблюдения, но не влияет на геометрию и насосную функцию ЛЖ, а также течение сердечной недостаточности. Схожие результаты продемонстрированы и в более раннем метаанализе, доказавшем, что реконструкция митрального клапана в комбинации с реваскуляризацией миокарда достоверно не влияет на сердечную недостаточность, сократимость и раннюю летальность [16]. Однако есть и другие исследования с противоположными результатами [18, 19]. В исследовании R. De Simone изолированное АКШ обеспечило более высокую выживаемость. В дру- гой работе [19] также не выявлено преимущества пластики МК в отношении прогноза выживаемости до 8 лет наблюдения, однако доказано достоверное уменьшение риска прогрессирования МН. Противоречивые результаты объяснялись разнородностью включенных больных, особенностями лечения и длительностью наблюдения. Так, детальный анализ подгрупп в работе 2014 г. показал, что разница в выраженности прогрессирования МН возрастала при увеличении срока наблюдения.
Заключение
Согласно результатам нашей работы, как изолированная реваскуляризация миокарда, так и сочетанная реконструкция митрального клапана и АКШ при ишемической кардиомиопатии не способствовала улучшению МН в отдаленном периоде. При этом степень МН через 1 год после сочетанного вмешательства (АКШ с пластикой МК) меньше предоперационных показателей, в отличие от изолированного КШ, а через 3 года после изолированного АКШ митральная недостаточность соответствовала дооперационным значениям. Определение факторов возврата МН при ишемической кардиомиопатии помогло выявить предельные значения эффективности пластики МК, а оценка исходных эхокардиографических предикторов для аннулопластики позволяла выбрать стратегию оперативного лечения пациентов с этой тяжелой патологией.
Список литературы Факторы риска возврата митральной недостаточности после аортокоронарного шунтирования и реконструкции митрального клапана у пациентов с ишемической кардиомиопатией
- Trichon B.H., Felker G.M., Shaw L.K., Cabell C.H., O'Connor C.M. Relation of frequency and severity of mitral regurgitation to survival among patients with left ventricular systolic dysfunction and heart failure. Am J Cardiol. 2003; 91(5): 538-43. PMID: 12615256. (02)03301-5 DOI: 10.1016/s0002-9149
- Unger P., Magne J., Dedobbeleer C., Lancellotti P. Ischemic mitral regurgitation: not only a bystander. Curr Cardiol Rep. 2012; 14(2): 180-9. PMID: 22203438. -y DOI: 10.1007/s11886-011-0241
- Grigioni F., Avierinos J.F., Ling L.H., Scott C.G., Bailey K.R., Taiik A.J., Frye R.L., Enriquez-Sarano M. Atrial fibrillation complicating the course of degenerative mitral regurgitation: determinants and long-term outcome. J Am Coll Cardiol. 2002; 40(1): 84-92. PMID: 12103260. (02)01922-8 DOI: 10.1016/s0735-1097
- Grigioni F., Enriquez-Sarano M., Ling L.H., Bailey K.R., Seward J.B., Taiik A.J., Frye R.L. Sudden death in mitral regurgitation due to flail leaflet. J Am Coll Cardiol. 1999; 34(7): 2078-85. PMID: 10588227. (99)00474-x DOI: 10.1016/s07351097
- Marchenko A., Cherniavsky A., Volokitina T., Alsov, S., Karaskov A. Left ventricular dimension and shape after postinfarction aneurysm repair. Eur J Cardiothorac Surg. 2005; 27(3): 475-80. DOI: 10.1016/j.eicts.2004.12.025


