Факторы, влияющие на агрессивное течение туберкулезной инфекции (обзор)
Автор: Джагаева З.К., Басиева О.З.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Фтизиатрия
Статья в выпуске: 2 т.21, 2025 года.
Бесплатный доступ
Цель: определить, какие биологические механизмы наиболее существенно влияют на агрессивное течение туберкулеза, включая связь между метаболическими нарушениями, иммунным ответом и устойчивостью Mycobacterium tuberculosis к лекарствам, с учетом современных научных представлений о патогенезе болезни. Методика написания обзора. Основой исследования послужили материалы из российских и международных баз данных, включая PubMed, Scopus, eLibrary и др. Из первоначально отобранных 213 публикаций выбраны 43 наиболее релевантные работы за 2019–2024 гг. Заключение. Прогрессирование агрессивных форм туберкулеза зависит от сложного взаимодействия между метаболическими расстройствами, нарушениями иммунного ответа и развитием устойчивости M. tuberculosis к лекарственным препаратам. Эти процессы, усиливающие друг друга, играют центральную роль в усугублении заболевания, что подчеркивает необходимость внедрения комплексных стратегий для более эффективного лечения и профилактики.
Туберкулез, легкие, патогенез, агрессивные формы, иммунитет
Короткий адрес: https://sciup.org/149148500
IDR: 149148500 | УДК: 616.24–002 | DOI: 10.15275/ssmj2102180
Текст научной статьи Факторы, влияющие на агрессивное течение туберкулезной инфекции (обзор)
EDN: OMRWZS
общий показатель заболеваемости составил 29,6 на 100 тыс. населения, что немного ниже по сравнению с предыдущими годами (в 2022 г. — 31,1 на 100 тыс. населения). Заболеваемость среди детей (0– 17 лет) в 2023 г. осталась на уровне 7,6 на 100 тыс. населения, то есть не изменилась по сравнению с уровнем 2022 г. Однако сохраняется риск распространения заболевания из-за миграции и высокой первичной (ПЛУ) лекарственной устойчивости (ЛУ) возбудителя.
Агрессивные формы туберкулеза, особенно в условиях ПЛУ возбудителя, представляют собой значительный клинический вызов. ПЛУ, при которой Mycobacterium tuberculosis изначально нечувствительна к основным противотуберкулезным препаратам, возникает без предшествующего лечения,
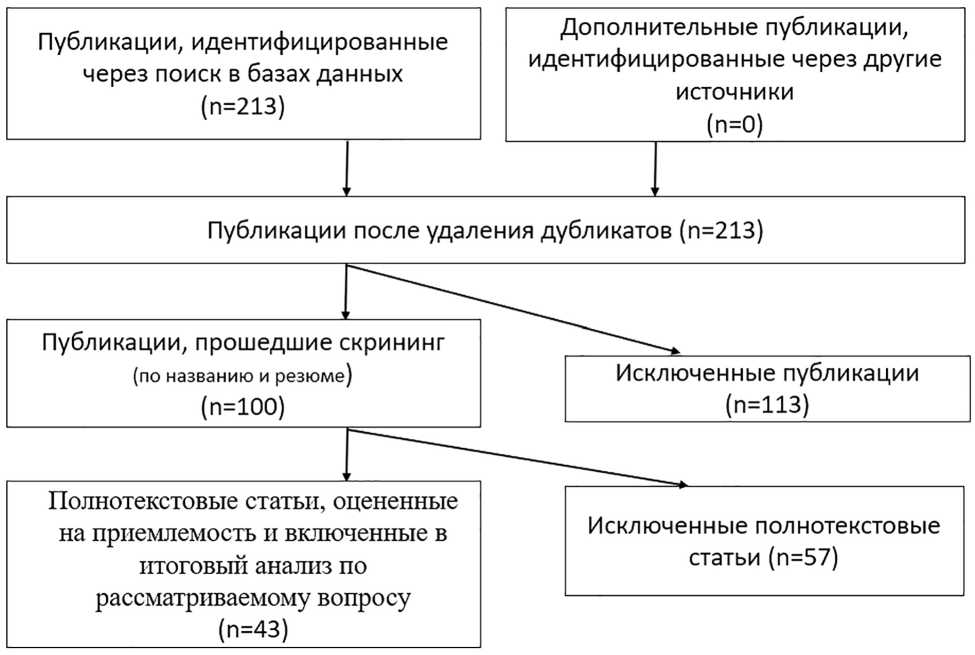
Схема отбора источников по методике PRISMA
что делает эту проблему еще более угрожающей в эпидемиологических масштабах [1]. Клиническая сложность множественной ЛУ (МЛУ) проявляется не только в ускоренном разрушении легочной ткани, но и в прогрессирующем поражении других систем организма, таких как кости и лимфатическая система, что ведет к системным осложнениям и значительному ухудшению состояния пациентов [2]. Современные исследования демонстрируют тесную связь между агрессивными формами туберкулеза и ответом иммунной системы, который усиливается устойчивостью M. tuberculosis к препаратам 1-й линии [3, 4]. Это приводит к значительному снижению терапевтической эффективности, провоцируя повторное развитие болезни и ее дальнейшее распространение среди населения.
В настоящем исследовании акцент сделан на изучении основных биологических механизмов, участвующих в прогрессировании туберкулеза, охватывая морфологические, биохимические и физиологические изменения. Данный анализ способствует более глубокому пониманию патогенеза агрессивных форм инфекции и поиску эффективных терапевтических подходов для их контроля и сдерживания эпидемиологической угрозы. Параметры, такие как метаболические отклонения, иммунные реакции и биохимические процессы (в том числе оксидативный стресс и активность матриксных металлопротеиназ — ММП), были выбраны для анализа, поскольку они являются основными механизмами, определяющими развитие агрессивных форм туберкулеза. Эти элементы были отобраны на основании новейших научных данных, которые подчеркивают их критическую роль в прогрессировании заболевания и формировании устойчивости возбудителя к терапии.
Цель — определить, какие биологические механизмы наиболее существенно влияют на агрессивное течение туберкулеза, включая связь между метаболическими нарушениями, иммунным ответом и устойчивостью M. tuberculosis к лекарствам, с учетом современных научных представлений о патогенезе болезни.
Исследование сосредотачивается на осмыслении патогенеза заболевания через морфологические, биохимические и физиологические аспекты, что, в свою очередь, позволяет глубже понять механизмы разрушения тканей, формирование каверн (полостей в легочной ткани) и метаболические адаптации бактерий в условиях гипоксии. Это знание важно для разработки более эффективных терапевтических подходов в клинической практике, направленных на борьбу с агрессивными формами туберкулеза.
Методика написания систематического обзора. Для написания систематического обзора использовались базы данных PubMed, Scopus, eLibrary, Web of Science и Google Scholar. Авторами применены поисковые запросы с ключевыми словами, связанными с агрессивными формами туберкулеза, такими как «Mycobacterium tuberculosis», «лекарственная устойчивость», «патогенез» и др. Поиск охватывал статьи на русском и английском языках. Из 213 найденных источников отобраны 43, опубликованные в рецензируемых журналах с 2019 по 2024 г., соответствующие цели исследования, согласно методологии PRISMA (Preferred reporting items for systematic reviews and meta-analyses — «Предпочтительные элементы отчетности для систематических обзоров и метаанализов») (рисунок). В качестве критериев включения рассматривались статьи, в которых описывались механизмы агрессивных форм туберкулеза, включая исследования, направленные на изучение ЛУ возбудителя, а также биохимических и морфологических изменений в тканях. Статьи, не соответствующие данным критериям, были исключены из обзора.
Патогенез и вирулентность M. tuberculosis в прогрессировании туберкулеза. Открытая более века назад Робертом Кохом в 1882 г. M. tuberculosis продолжает оставаться в фокусе многочисленных исследований. Она представляет собой аэробный микроорганизм, неспособный к подвижности и образованию спор, но вызывающий затяжные хронические заболевания. Ее клеточная структура, состоящая из специфических липидных, белковых и углеводных компонентов, наделяет бактерию исключительной устойчивостью к воздействию кислот и спиртов [5]. Инфекция начинает развиваться с вдыхания микобактерий, которые оседают на поверхности альвеол, где подвергаются атаке макрофагов. Однако, несмотря на захват, бактерии остаются живыми, поскольку производят факторы, такие как ESAT-6 (early secreted antigenic target) и CFP-10 (culture filtrate protein), препятствующие нормальной работе клеточных механизмов фагоцитоза, что способствует их выживанию и дальнейшему размножению внутри макрофагов [6]. Цитокины, секретируемые активированными макрофагами, такие как интерферон-γ (ИФН-γ), инициируют процесс формирования гранулем — специфических очагов воспаления, где микобактерии остаются изолированными. В структуру гранулем входят макрофаги, Т-лимфоциты, а также гигантские клетки Лангханса [7]. Однако, несмотря на их образование, бактерии могут сохранять жизнеспособность в течение длительного времени, находясь в латентном состоянии. Стадия латентного туберкулеза может длиться годами без проявления клинических симптомов. Тем не менее снижение иммунной защиты организма, вызванное, например, ВИЧ-инфекцией, недостаточным питанием или возрастными изменениями, может способствовать реактивации бактерий. В результате разрушения гранулем бактерии высвобождаются и начинают распространяться по организму, приводя к повреждению легочной ткани и образованию каверн, что значительно осложняет течение заболевания [8]. Распространение микобактерий через кровеносные и лимфатические сосуды увеличивает вероятность внелегочных форм туберкулеза, поражающих такие органы, как кости, почки, мозговые оболочки и другие жизненно важные системы. M. tuberculosis проявляет значительную агрессивность в определенных случаях, что во многом связано с его способностью к быстрой репликации и высокой адаптивности в человеческом организме. Важным фактором, способствующим такому поведению, является стремительная скорость деления патогена, которая ускоряет разрушение тканей легких и других органов, пораженных инфекцией. Эта особенность увеличивает вирулентность микобактерий и приводит к более сложным и тяжелым клиническим проявлениям, требующим незамедлительных лечебных вмешательств. В новейших исследованиях подчеркивается, что одна из причин интенсивного размножения — способность M. tuberculosis уклоняться от иммунного ответа организма [9]. У микобактерии выявлены специфические генетические механизмы, блокирующие фагоцитоз макрофагами, что обеспечивает эффективную репликацию микобактерий внутри клеток. Это, в свою очередь, вызывает выраженное усиление воспалительных реакций и ускоренное разрушение тканей [10]. Кроме того, выявлена четкая корреляция между скоростью размножения возбудителя и тяжестью клинических проявлений, включая формирование каверн и развитие генерализованных форм заболевания. Внимание исследователей также сосредоточено на ПЛУ возбудителя, что усложняет терапевтические подходы и снижает эффективность стандартных схем лечения.
МЛУ существенно снижает эффективность традиционных схем терапии, ускоряя репликацию микобактерий и заставляя клиницистов применять более интенсивные методы лечения. Согласно исследованиям, микобактерии, устойчивые к таким препаратам, как рифампицин и изониазид, показывают вдвое более высокие темпы размножения по сравнению с чувствительными штаммами, что напрямую отражается на быстроте прогрессирования заболевания [11]. Кроме того, агрессивность этих микобактерий усиливается благодаря активации специфических метаболических путей, которые поддерживают репликацию в условиях кислородной недостаточности, типичной для гранулематозных процессов при туберкулезе. Интересно, что гипоксия не только не замедляет размножение M. tuberculosis , но активирует гены, ответственные за адаптацию и выживание патогенов в изменяющейся среде макрофагов, что делает инфекцию еще более устойчивой и сложной для лечения [12]. Затруднение ранней диагностики агрессивных форм туберкулеза обусловлено тем, что изменения в легочной ткани, как правило, фиксируются на поздних стадиях болезни. Используемые визуализационные методы, в частности компьютерная томография, позволяют выявить прогрессирование заболевания только тогда, когда бактериальная нагрузка на организм достигает максимума. На момент появления выраженных клинических симптомов уровень размножения микобактерий уже требует применения комбинированных терапевтических стратегий, что значительно усложняет лечение и увеличивает вероятность рецидивов, а также повышает риск формирования ЛУ. Современные исследования подчеркивают острую необходимость разработки инновационных терапевтических подходов, которые были бы направлены не только на подавление размножения бактерий, но и на разрушение их защитных механизмов. Такой подход позволит повысить эффективность лечения, минимизировать устойчивость к антибиотикам и снизить риск дальнейшего распространения инфекции.
Морфологические процессы при агрессивном течении туберкулеза. Агрессивное течение туберкулеза связано с развитием сложных морфологических изменений, оказывающих значительное влияние на патогенез заболевания. Одним из ключевых механизмов этого процесса является гранулематозное воспаление — ответ организма, направленный на локализацию инфекции [13]. Гранулемы, образующиеся из макрофагов, лимфоцитов, гигантских клеток Лангханса и эпителиоидных клеток, играют двойственную роль: с одной стороны, они препятствуют дальнейшему распространению M. tuberculosis , а с другой — могут вызывать разрушение легочной ткани [14]. Таким образом, процесс, призванный ограничить инфекцию, парадоксально способствует разрушению тканей, что характерно для агрессивных форм туберкулеза.
Одной из наиболее значимых морфологических особенностей при агрессивных формах туберкулеза является казеозный некроз, локализующийся в центральной части гранулем [15, 16]. Данный процесс обусловлен гибелью клеток, что ведет к формированию некротических масс и дальнейшему разрушению тканей. Казеозный некроз представляет собой основу для образования каверн, которые часто достигают значительных размеров и могут сообщаться с бронхами. Эти полости значительно усугубляют течение заболевания, создавая благоприятные условия для распространения инфекции и повышения риска передачи возбудителя, что превращает кавернозный туберкулез в одну из наиболее опасных форм болезни [17, 18]. Наряду с деструкцией тканей организм инициирует компенсаторные процессы, направленные на ограничение патологического процесса через формирование фиброзной ткани [19]. Этот процесс приводит к замещению поврежденных участков легочной ткани плотной соединительной тканью, что снижает эластичность легких и нарушает нормальный газообмен. Итогом этих изменений становится прогрессирующая дыхательная недостаточность, особенно характерная для запущенных стадий агрессивного туберкулеза, когда компенсаторные возможности организма оказываются исчерпанными.
Постоянное воспаление и деструкция тканей способствуют нарастанию оксидативного стресса, который усугубляет уже существующие повреждения. Активное накопление реактивных форм кислорода и азота приводит не только к деструктивным изменениям клеточных структур, но и усиливает некротические процессы, создавая условия для активного размножения патогенов [20]. Эти процессы нарушают целостность тканей и способствуют прогрессирующему повреждению, что делает восстановление еще более затруднительным. При агрессивных формах туберкулеза наблюдается значительное увеличение лимфоидной инфильтрации, что свидетельствует об активном ответе иммунной системы на инфекцию [21]. Лимфоциты, принимающие участие в регуляции иммунного ответа, играют важную роль в формировании гранулем, а также в усилении воспалительных реакций. Тем не менее чрезмерная активность иммунных клеток, сопровождающаяся избыточной продукцией цитокинов, таких как ИФН-γ и фактор некроза опухоли α (ФНО-α), нередко приводит к гипервоспалению [22, 23]. Это состояние не только усиливает воспалительный процесс, но и способствует повреждению тканей, что может значительно ухудшать клиническое течение заболевания, усиливая его деструктивные последствия.
Одним из морфологических последствий агрессивного туберкулеза становится эмпиема плевры — патологическое состояние, при котором в плевральной полости происходит скопление гнойного экссудата [24]. Данное явление сопровождается выраженной воспалительной реакцией, приводящей к образованию плотных фибринозных наложений на плевральных листках. В свою очередь, подобные изменения значительно ограничивают подвижность легких, что способствует развитию дыхательной недостаточности и ухудшению общего состояния пациента. В отличие от эмпиемы плевры, которая, как правило, развивается на поздних стадиях болезни и представляет собой одно из ее серьезных осложнений, казеозная пневмония приводит к разрушению легочной ткани, что существенно ухудшает прогноз состояния пациента. Это состояние часто сопровождается целым рядом осложнений, таких как дыхательная недостаточность, фиброз или абсцессы. Эмпиема, несмотря на свою значимость, обычно возникает в результате поздних инфекционных процессов и в более запущенной стадии заболевания. Помимо этого, туберкулезный лимфоаденит, проявляющийся увеличением и воспалением лимфатических узлов, служит одним из ключевых признаков системного распространения инфекции [25]. Это осложнение свидетельствует о вовлечении в процесс множественных органов и систем, что еще больше усложняет терапевтические мероприятия, требующие более агрессивного и комплексного подхода к лечению пациента. При диссеминированных формах туберкулеза происходит активное распространение возбудителя по организму через кровеносную и лимфатическую системы, что приводит к появлению множественных очагов инфекции в различных органах [26]. Настоящий процесс провоцирует развитие новых воспалительных зон, каждая из которых оказывает разрушительное влияние на функции пораженных органов. Системный характер инфекции приводит к серьезным дисфункциям, что, при отсутствии своевременного лечения, нередко заканчивается летальным исходом, поскольку организм не справляется со множественными воспалительными процессами, вызванными размножением бактерий.
Физиологические и иммунные механизмы агрессивного течения туберкулеза. Иммунная система, сталкиваясь с возбудителем M. tuberculosis , задействует сложные защитные механизмы, которые на определенных этапах могут стать разрушительными для организма. Изначально макрофаги поглощают бактерии, запуская каскад иммунных реакций [27]. Цитокины, такие как ИФН-γ и ФНО-α, играют важную роль, активируя макрофаги и стимулируя образование гранулем, ограничивающих распространение бактерий [28], однако при агрессивном развитии туберкулеза баланс цитокинов нарушается, что приводит к чрезмерному воспалению и разрушению тканей. Возникает явление, известное как цито-киновый шторм, когда высокая концентрация этих молекул усиливает воспалительные процессы, ускоряя развитие казеозного некроза, который разрушает легочную ткань [29]. Сложность, связанная с агрессивным течением туберкулеза, заключается в том, что организм не способен полностью ликвидировать микобактерии, находящиеся внутри макрофагов. M. tuberculosis производит определенные вирулентные факторы, включая ESAT-6 и CFP-10, которые препятствуют естественным механизмам фагоцитоза, блокируя слияние фагосом с лизосомами [30, 31]. Это позволяет патогену не только избегать уничтожения иммунной системой, но и продолжать активно размножаться в клетках, что значительно осложняет течение заболевания и усиливает воспалительные процессы.
Генетические факторы играют важную роль как в характеристиках M. tuberculosis, так и в реакциях организма хозяина, влияя на прогрессирование агрессивных форм туберкулеза [32, 33]. В частности, штаммы бактерий, обладающие устойчивостью к препаратам рифампицина и изониазида, демонстрируют ускоренные темпы размножения, что напрямую связано с более тяжелым течением болезни и выраженными клиническими проявлениями [34]. Одновременно генетические особенности хозяина, например, полиморфизмы генов, регулирующих выработку цитокинов ФНО-α и ИФН-γ, оказывают значительное влияние на развитие тяжелых форм заболевания, предрасполагая к усилению воспалительных реакций и агрессивным проявлениям инфекции [35]. Эти генетические вариации приводят к повышенной восприимчивости к агрессивным формам туберкулеза и требуют индивидуального подхода в лечении пациента.
Приспособление M. tuberculosis к защитным механизмам организма хозяина основано на ряде сложных адаптивных процессов [36]. Одним из ключевых факторов выживания бактерий является их способность задействовать специфические метаболические пути, позволяющие использовать жирные кислоты и холестерин в качестве источников энергии. Это метаболическое преимущество позволяет патогенам сохранять высокую скорость размножения даже в условиях дефицита питательных веществ и кислорода, что характерно для гранулематозных структур. В данных условиях бактерии эффективно избегают воздействий традиционной терапии, что значительно усложняет лечение. Современные исследования подчеркивают важность разработки терапевтических стратегий, направленных на прерывание этих метаболических путей, с целью ограничить способность M. tuberculosis к репликации и улучшить исходы терапии.
Биохимические процессы при агрессивном течении туберкулеза. Интенсивное развитие туберкулеза характеризуется активным размножением M. tuberculosis , что сопровождается сложными биохимическими процессами, которые играют ключевую роль в патогенезе заболевания. Одним из доминирующих механизмов является оксидативный стресс, обусловленный усиленной активностью макрофагов, продуцирующих реактивные формы кислорода и азота [37]. Эти молекулы оказывают деструктивное воздействие на клеточные мембраны, белковые структуры и ДНК, что приводит к их повреждению и последующему некрозу тканей. В результате воспалительный процесс усиливается, провоцируя дальнейшее разрушение тканей легких и усугубляя течение заболевания.
Уникальная структура клеточной стенки микобактерий, и в частности присутствие миколовых кислот, представляет собой один из ключевых факторов, который необходимо учитывать при анализе биохимических механизмов агрессивного туберкулеза. Эти липидные компоненты формируют прочный барьер, защищающий патоген от действия фагоцитарной активности макрофагов и антимикробных препаратов [38]. Такая защита позволяет M. tuberculosis не только избегать разрушения, но и поддерживать жизнеспособность в условиях постоянного воспаления. Данные липиды не только повышают устойчивость бактерий, но и провоцируют выработку воспалительных цитокинов ИФН-γ и ФНО-α, стимулирующих воспалительный процесс, что способствует быстрому развитию некротических изменений и формированию каверн [39].
В агрессивных формах туберкулеза ключевую роль в прогрессировании деструктивных процессов играет активация ММП. Эти ферменты ответственны за разрушение внеклеточного матрикса, что ведет к ускоренной деградации легочной ткани. Исследования показывают, что чем выше уровень активности ММП, тем более выражены деструктивные изменения, такие как образование каверн [40]. Макрофаги, активируемые микобактериями, начинают избыточно продуцировать эти ферменты, что приводит к разрушению внеклеточных структур и прогрессированию патологии. Патогенез осложняется тем, что M. tuberculosis приспосабливается к гипоксическим условиям, характерным для гранулематозных воспалений, продолжая выживать и размножаться даже в этих неблагоприятных условиях. Исследования показывают, что микобактерии в условиях гипоксии активируют уникальные метаболические механизмы, позволяющие использовать альтернативные энергетические субстраты — жирные кислоты и холестерин [41]. Эти процессы способствуют выживанию и продолжению репликации бактерий, даже при ограниченном доступе к питательным веществам. Подобная метаболическая адаптация значительно затрудняет стандартные методы терапии, делая их менее результативными [42]. В ответ на эти вызовы современные терапевтические подходы все чаще направлены на блокирование активности ММП, что замедляет разрушение внеклеточного матрикса и предотвращает формирование каверн в легких. Эти меры помогают сдерживать прогрессирование заболевания и улучшать прогноз для пациентов с агрессивными формами туберкулеза, предлагая более целенаправленное воздействие на ключевые патогенетические механизмы [43].
Одной из ключевых биохимических особенностей агрессивного течения туберкулеза выступает значительное нарушение обмена веществ в организме больного человека. Гиперкатаболизм, сопровождающийся ускоренным разрушением белковых структур и дисбалансом в метаболизме белков, способствует развитию хронической анемии и истощению энергетических резервов организма. Такие метаболические изменения серьезно осложняют общее состояние пациента, ослабляя его иммунный ответ и снижая способность к эффективному сопротивлению инфекции, что значительно затрудняет процесс лечения. Вследствие этих процессов больные агрессивными формами туберкулеза часто сталкиваются с выраженной потерей массы тела, что является следствием интенсивных воспалительных реакций и усиленного катаболизма, усугубляющих прогрессирование заболевания и осложняющих его терапию.
Таблица, приведенная далее, обобщает главные итоги проведенного исследования, демонстрируя их связь с заявленной целью. В ней содержатся ключевые выводы, которые были сформулированы на основании изучения биологических механизмов, оказывающих влияние на процессы, формирующие патогенез агрессивных форм туберкулеза.
Заключение. Проведенный анализ и систематизация представленного материала по агрессивным формам туберкулеза позволили расширить современное понимание ключевых процессов, лежащих в основе развития данного заболевания. Выявлено, что основными механизмами прогрессирования агрессивных форм туберкулеза являются как иммунные, так и метаболические нарушения. С учетом нарушений метаболических и иммунных процессов, а также биохимических изменений, сопровождающих агрессивное течение туберкулеза, возможные подходы к их коррекции должны быть комплексными и включать как фармакологическое, так и нефармакологическое воздействие. Что касается медикаментозного лечения пациента, оно может основываться на применении средств, таких как антиоксиданты и иммуномодуляторы, которые помогают восстановить баланс в иммунной системе, а также препаратов, способствующих нормализации обменных процессов и снижению уровня оксидативного стресса. Эти средства играют ключевую роль в поддержке иммунной активности организма и предотвращении дальнейшего прогрессирования заболевания, что,
Основные направления и результаты исследования агрессивного течения туберкулеза
|
Основные направления исследования |
Итоги исследования |
|
Обобщение актуальных знаний о биологических механизмах, лежащих в основе агрессивного течения туберкулеза и ЛУ возбудителя, с целью разработки более эффективных терапевтических стратегий |
Патогенез и вирулентность: установлены основные механизмы, обеспечивающие выживание M. tuberculosis , такие как блокировка фагоцитоза через ESAT-6 и CFP-10, а также образование гранулем с казеозным некрозом, приводящее к усиленному разрушению легочной ткани |
|
Детализированное исследование морфологических, биохимических и физиологических изменений, направленное на раскрытие механизмов разрушения тканей, образования каверн и приспособления бактерий к условиям гипоксии |
Морфологические трансформации: установлено, что казеозный некроз в сочетании с активацией ММП играет ключевую роль в формировании каверн, усугублении течения заболевания и расширении зоны инфицирования |
|
Обоснование важности внедрения современных терапевтических стратегий, ориентированных на сдерживание агрессивных форм туберкулеза |
Биохимические процессы: раскрыто значение оксидативного стресса и особенностей клеточной стенки микобактерий в их терапевтической устойчивости, а также изучены адаптивные стратегии бактерий в условиях гипоксии, предоставляющие перспективы для разработки новых методов лечения |
|
Акцент на клиническую значимость преодоления МЛУ, направленный на оптимизацию терапевтической эффективности |
Устойчивость к препаратам: установлена корреляция между МЛУ патогена и ускорением его размножения, что обостряет клиническое течение болезни и подчеркивает необходимость пересмотра стандартных подходов к лечению |
|
Исследование иммунных процессов: выявлены ключевые механизмы иммунного ответа, определяющие динамику прогрессирования заболевания |
Иммунологические аспекты: установлена значимость нарушений цитокинового баланса (ФНО-α, ИФН-γ) в инициации цитокинового шторма, усиливающего воспалительные процессы и тканевую деструкцию |
в свою очередь, может смягчить проявления осложнений. Кроме того, в рамках немедикаментозных вмешательств акцент делается на корректировку питания больного, направленную на восстановление нормального обмена веществ, а также на программу физической реабилитации, способствующую улучшению дыхательных функций и общему восстановлению организма. Психосоциальная поддержка пациентов в таких случаях не менее важна, что способствует повышению качества их жизни. Интеграция этих методов в общую стратегию лечения значительно усиливает терапевтический эффект и помогает достигнуть более стабильных результатов. Данное исследование подтверждает необходимость разработки инновационных терапевтических стратегий в клинической практике, направленных на устранение как ЛУ возбудителя, так и нарушений в иммунной системе и метаболизме носителя инфекции.
Для дальнейшего развития исследования на основе обобщения современных данных рекомендуется уточнить взаимосвязь между метаболическими изменениями, иммунным ответом и ЛУ M. tuberculosis . В частности, необходимо более детально изучить, каким образом метаболические отклонения влияют на иммунные реакции и их способность эффективно сдерживать инфекцию, а также то, каким образом эти процессы взаимодействуют с развитием анти-биотикоустойчивости возбудителя. Важно также рассмотреть влияние гипоксии и оксидативного стресса на баланс цитокинов и исследовать то, как эти изменения могут способствовать прогрессированию болезни. Расширение знаний в области этих взаимосвязей позволит точнее выявить ключевые механизмы, способствующие прогрессированию заболевания, и разработать на этой основе новые подходы к лечению, направленные на повышение эффективности терапии.
Вклад авторов. Авторы внесли равный вклад на всех этапах работы и написания статьи.


