Факторы, влияющие на общую выживаемость при протоковой аденокарциноме головки поджелудочной железы. Опыт одного центра
Автор: Кучин Д.М., Колесник Я.И., Торгомян Г.Г., Загайнов В.Е.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 1 т.11, 2021 года.
Бесплатный доступ
Цель. Определить ведущие факторы, оказывающие влияние на общую выживаемость (ОВ). Выделить когорту пациентов с наилучшим прогнозом заболевания. Материалы и методы. В ретроспективный анализ были включены 268 пациентов, 128 мужчин и 140 женщин средним возрастом 59±10,53 (от 30 до 83) лет. Для многофакторного анализа и анализа выживаемости отобраны больные, которым была выполнена гастропанкреатодуоденальная резекция (ГПДР) по поводу протоковой аденокарциномы головки поджелудочной железы. Результаты. В нашем исследовании показано, что на ОВ статистически значимо влияет морфологически подтвержденная инвазия опухоли в сосудистую стенку, которая выявилась лишь у 30 % больных, перенесших ГПДР с резекцией магистральных сосудов. Уровень онкомаркера CА19-9 более 500 ЕД/ л был выявлен в 32,3 % случаях и является фактором, достоверно ухудшающим ОВ. Пациенты с высокодифференцированной аденокарциномой имеют достоверно лучшие показатели выживаемости по сравнению с больными, у которых выявлена умеренно-или низкодифференцированная аденокарцинома (р = 0,014; медиана 26 месяцев, 95% ДИ 4,4-47,6 против медианы 17 месяцев, 95% ДИ 15-19, и медианы 13 месяцев, 95% ДИ 5-21). Кроме того, положительное влияние на отдаленные результаты оказывает применение адъювантной химиотерапии (ХТ) (р = 0,0001; медиана 26 месяцев, 95 % ДИ 21,7-30,3 против медианы 13 месяцев, 95% ДИ 11,3-14,7). Заключение. Высокая степень дифференцировки опухоли и применение ХТ в адъювантном режиме достоверно увеличивают ОВ пациентов. Низкая степень дифференцировки опухоли, уровень СА19-9 более 500 Ед/ мл и гистологически верифицированная инвазия опухоли в стенку магистральных сосудов достоверно ухудшают прогноз этих пациентов.
Панкреатодуоденальная резекция, протоковая аденокарцинома поджелудочной железы, общая выживаемость, многофакторный анализ
Короткий адрес: https://sciup.org/140257649
IDR: 140257649 | DOI: 10.18027/2224-5057-2021-11-1-20-28
Текст научной статьи Факторы, влияющие на общую выживаемость при протоковой аденокарциноме головки поджелудочной железы. Опыт одного центра
Протоковая аденокарцинома поджелудочной железы является самым распространенным гистологическим подтипом среди опухолей поджелудочной железы, в настоящее время оставаясь одной из ведущих причин летальных исходов от онкологических заболеваний во всем мире [1–3]. В последнее десятилетие послеоперационную летальность у этой группы больныхудалось снизить до 3%, а применение послеоперационной ХТ позволило увеличить общую 5-летнюю выживаемость после радикальной операции до 30% [4,5]. Однако около 50% пациентов после оперативного вмешательства не получают адъювантное лечение или получают его не в полном объеме, что связанно с развитием послеоперационных осложнений или неудовлетворительным общесоматическим статусом пациентов [6,7]. Общая 5-летняя выживаемость у группы пациентов с протоковой аденокарциномой головки поджелудочной железы остается низкой — менее 8% [4]. При первичном обращении резек-табельные опухоли регистрируются всего у 13,2%–21,2% пациентов, в остальных случаях диагностируются или метастатическое поражение, или местнораспространенная опухоль, не позволяющая выполнить радикальное оперативное вмешательство [8]. К тому же, выполнение радикальной операции и проведение послеоперационного лечения не позволяет излечить больных, и в большинстве случаев рецидив заболевания возникает через 1–2 года, а медиана выживаемости составляет всего 18 месяцев [9]. Понимание факторов риска рецидива заболевания и факторов, влияющих на ОВ, позволяет индивидуализировать лечение и определять его тактику [10].
МАТЕРИАЛЫ И МЕТОДЫ
В ретроспективном анализе было исследовано 268 пациентов, 128 мужчин и 140 женщин средним возрастом 59±10,53 (от 30 до 83) лет. Для анализа отобраны больные, которым была выполнена ГПДР по поводу протоковой аденокарциномы головки поджелудочной железы (согласно стандартам объема операции и периоперационному ведению) на базе клинической больницы №1 ФБУЗ ПОМЦ ФМБА России с 2007 по 2019 гг.
Цель работы — определить ведущие факторы, оказывающие влияние на ОВ, а также выделить когорту пациентов с наилучшим прогнозом заболевания.
Критерии включения пациентов: выполненная ГПДР, гистологически-верифицированная аденокарцинома головки поджелудочной железы. Критерии исключения: морфологическая конверсия диагноза, проведение неоадъювантной терапии. Наблюдение за пациентами осуществлялось посредством телефонных звонков и последующим осмотром каждые 3 месяца.
Выживаемость без признаков болезни не исследовалась ввиду невозможности отследить время прогрессии или рецидива у умерших пациентов, наблюдавшихся амбулаторно.
Исследование уровня СА19-9 оценивалось на момент госпитализации в предоперационном периоде, при уровне щелочной фосфатазы не более 250 Ед/л. Дифференцировка опухоли, границы резекции, периневральная и сосудистая инвазии определялись при патоморфологическом исследовании. Т -, N-и M-статусы устанавливались согласно 7-му пересмотру классификации TNM Союзом Международного контроля рака (UICC).
За осложнения были приняты II–IV типы осложнений по Clavien–Dindo.
В исследовании когорта пациентов, получавшая адъювантную ХТ, не была разделена на подгруппы, соответствующие проведенным режимам терапии, ввиду большого количества незавершенных курсов.
Для статистической обработки использовалcя пакет программного обеспечения IBM SPSS Statistics 24.0. Оценка распределения долей проводилась методами однофакторного дисперсионного анализа, критерия Х2 Пирсона и точного критерия Фишера. Первичным критерием оценки выживаемости установлена ОВ как промежуток в месяцах между датой хирургического лечения и смертью от любой причины. Цензурированы живые пациенты на момент контрольного осмотра. ОВ больных представлена в виде медианы, 95% доверительного интервала (ДИ), графически в виде кривых Каплана–Майера. Различия в выживаемости между группами определены лог-ранговым методом. Мультифакторный анализ выживаемости проведен способом логистической регрессии с расчетом отношения рисков (ОР). Введение факторов, оказавших значимое влияние на прогноз в однофакторных моделях, в многофакторную регрессионную модель осуществляли обратным пошаговым методом. Для удобства статистической обработки непрерывную переменную СА19-9, трансформировали в порядковую, с шагом, наиболее часто используемым в литературе, возраст пациентов — относительно медианы. Критический уровень достоверности принят за 0,05. Все сравнения были двусторонние.
РЕЗУЛЬТАТЫ
В период с 2007 по 2019 гг. на базе клинической больницы было выполнено 539 ГПДР, из них — 284 по поводу протоковой аденокарциномы головки поджелудочной железы. При формировании выборки были исключены пациенты, которым проводилась неоадъювантная химиотерапия. Таким образом, в исследование вошли 268 пациентов с протоковой аденокарциномой головки поджелудочной железы (128 мужчин и 140 женщин, средний возраст 59±10,53). Медиана ОВ этой группы составила 17 мес. (95% ДИ 15,0–19,0) (табл. 1).
С 2007 по 2014 ГПДР выполнялась в расширенном варианте (80 больных), а начиная с 2014 года всем пациентам выполнялась стандартная панкреатодуоденальная резекция (188 больных). При оценке ОВ нами не было отмечено статистически значимых отличий между данными группами (ОР =1,18, 95% ДИ 0,885–1,594, р =0,251). Также в нашем исследовании не было продемонстрированно разницы в медианах ОВ между группами пациентов с резекцией R0 и R1 (р =0,468, медиана 18 мес., 95% ДИ 15,2–20,8; против медианы 16 мес., 95% ДИ 11,8–20,1), (ОР =0,879, 95% ДИ 0,616–1,255, p =0,478). Изучать края резекции согласно международным рекомендациям в нашем центре начали с 2016 года [11,12].
В данной выборке пациентов резекция магистральных сосудов, в большинстве случаев вен, выполнялась в 42,5% случаях. При анализе выживаемости была выявлена статистически значимая разница в медиане между группами больных (р =0,03), которым выполнялась сосудистая резекция (медиана 15 мес., 95 % ДИ 12,3–17,7) и которым она не выполнялась (медиана 19 мес., 95% ДИ 16,0–22,0). Однако при дальнейшем исследовании было выявлено, что на ОВ статистически значимо влияет морфологически подтвержденная инвазия опухоли в сосудистую стенку, которая выявилась лишь у 30% больных перенесших ГПДР с резекцией магистральных сосудов. У остальных 70% пациентов, которым выполнялась реконструкция венозного русла, ОВ оказалась аналогична группе больных, которые не подвергались вмешательству на сосудах (рис. 1).
Также результаты выживаемости не зависели от типа резекции магистрального сосуда, применения синтетического протеза и протяженности резецируемых вен. (рис. 2). Периневральная инвазия была диагностирована
Таблица 1. Характеристика выборки пациентов
|
Фактор |
N |
% |
|
Возраст |
||
|
< 60 |
109 |
40.7 |
|
≥ 60 |
159 |
59.3 |
|
Пол |
||
|
Мужской |
128 |
47.8 |
|
Женский |
140 |
52.2 |
|
Лимфодиссекция |
||
|
D2 |
188 |
70.1 |
|
D3 |
80 |
29.9 |
|
Резекция сосудов |
||
|
Нет |
154 |
57.5 |
|
Да |
114 |
42.5 |
|
Типы резекций |
||
|
Тангенциальная резекция |
36 |
13.4 |
|
Циркулярная резекция |
61 |
22.8 |
|
Протезирование |
16 |
6 |
|
Инвазия в сосуды |
||
|
Нет |
233 |
86.9 |
|
Да |
35 |
13.1 |
|
Периневральная инвазия |
||
|
Нет |
171 |
63.8 |
|
Да |
97 |
36.2 |
|
Осложнения |
||
|
Нет |
221 |
82.5 |
|
Да |
47 |
17.5 |
|
Адъювантная ХТ |
||
|
Нет |
170 |
63.4 |
|
Да |
98 |
36.6 |
|
СА19-9 |
||
|
<37 Ед/мл |
54 |
30.7 |
|
37–500 Ед/мл |
65 |
37 |
|
>500 Ед/мл |
57 |
32.3 |
|
R статус |
||
|
R0 |
218 |
81.3 |
|
R1 |
50 |
18.7 |
|
N статус |
||
|
N0 |
165 |
61.6 |
|
N1 |
81 |
30.2 |
|
N2 |
22 |
8.2 |
|
G статус |
||
|
G1 |
46 |
17.2 |
|
G2 |
177 |
66 |
|
G3 |
45 |
16.8 |
N — количество, ХТ — химиотерапия
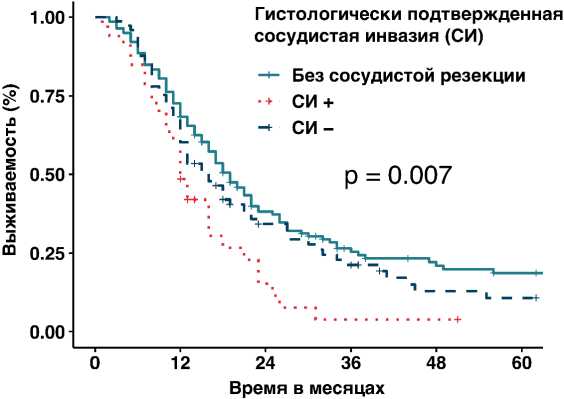
Рисунок 1. Влияние морфологически подтвержденной сосудистой инвазии на общую выживаемость.
р = 0.072
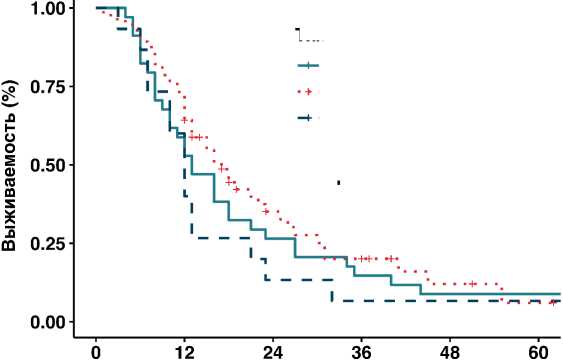
Время в месяцах
Рисунок 2. Влияние типа резекции на общую выживаемость.
Тип резекции Тангенциальная Циркулярная Протезирование
в 36,2% случаях, наличие которой не ухудшало прогноз у данной группы пациентов без статистической значимости (р =0,637; медиана 16 мес., 95% ДИ 14,3–19,7 против медианы 17 мес., 95% ДИ 14,4–19,6; ОР =1,074, 95% ДИ 0,793–1,455 р =0,645). Также нами не обнаружено влияния на ОВ метастатического поражения лимфатических узлов, которое было диагностировано у 36,3% больных (р =0,225, медиана 15 мес., 95% ДИ 11,8–18,2 против медианы 18 мес., 95% ДИ 15,1–20,8; ОР =1,19, 95% ДИ 0,89–1,6, р =0,236) среднее количество удаляемых лимфатических узлов при радикальной операции составило 23+3,45.
Развитие послеоперационных осложнений, в том числе III и IV групп по Clavien–Dindo, было отмечено у 17,5% больных, их ОВ была статистически незначимо меньше, по сравнению с пациентами, которые имели гладкий послеоперационный период (р =0,925, медиана 13 мес., 95% ДИ 9,8–16,2 против медианы 18 мес., 95% ДИ 14,9–19,1). Уровень онкомаркера CА19-9 более 500 ЕД/л был выявлен в 32,3% случаев, и он является фактором, достоверно ухудшающим
Таблица 2. Анализ выживаемости лог-ранговым методом
|
Фактор |
Медиана ОВ |
СО |
ДИ для СО |
p |
|
Возраст |
0,641 |
|||
|
< 60 |
17 |
1,58 |
13,9–20,1 |
|
|
≥ 60 |
17 |
1,38 |
14,3–19,7 |
|
|
Пол |
0,321 |
|||
|
Мужской |
18 |
2,50 |
13,1–22,9 |
|
|
Женский |
16 |
1,41 |
13,2–18,8 |
|
|
Лимфодиссекция |
0,240 |
|||
|
D2 |
17 |
1,18 |
14,7–19,4 |
|
|
D3 |
17 |
2,60 |
11,9–22,1 |
|
|
Резекция сосудов |
0,030 |
|||
|
Нет |
19 |
1,51 |
16–22 |
|
|
Да |
15 |
1,39 |
12,3–17,7 |
|
|
Типы резекций |
0,072 |
|||
|
Тангенциальная резекция |
13 |
2,04 |
9–17 |
|
|
Циркулярная резекция |
17 |
2,15 |
12,8–21,2 |
|
|
Протезирование |
12 |
1,26 |
9,5–14,5 |
|
|
Инвазия в сосуды |
0,003 |
|||
|
Нет |
18 |
1,31 |
15,4–20,6 |
|
|
Да |
12 |
0,92 |
10,2–13,8 |
|
|
Периневральная инвазия |
0,637 |
|||
|
Нет |
17 |
1,35 |
14,4–19,6 |
|
|
Да |
17 |
1,36 |
14,3–19,7 |
|
|
Осложнения |
0,925 |
|||
|
Нет |
18 |
1,06 |
15,9–20,1 |
|
|
Да |
13 |
1,58 |
9,9–16,1 |
|
|
Адъювантная ХТ |
< 0,0001 |
|||
|
Нет |
13 |
0,87 |
11,3–14,7 |
|
|
Да |
26 |
2,20 |
21,7–30,3 |
|
|
СА19-9 |
0,018 |
|||
|
<37 Ед/мл |
22 |
3,27 |
15,6–28,4 |
|
|
37–500 Ед/мл |
20 |
2,08 |
15,9–24,1 |
|
|
>500 Ед/мл |
12 |
1,19 |
9,7–14,3 |
|
|
R статус |
0,468 |
|||
|
R0 |
18 |
1,42 |
15,2–20,8 |
|
|
R1 |
16 |
2,12 |
11,8–20,1 |
|
|
N статус |
0,471 |
|||
|
N0 |
18 |
1,45 |
15,1–20,8 |
|
|
N1 |
16 |
1,91 |
12,2–19,7 |
|
|
N2 |
13 |
2,30 |
8,5–17,5 |
|
|
G статус |
0,014 |
|||
|
G1 |
26 |
11,03 |
4,4–47,6 |
|
|
G2 |
17 |
1 |
15–19 |
|
|
G3 |
13 |
4,08 |
5–21 |
|
ДИ — доверительный интервал, ОВ — общая выживаемость, N — количество, ХТ — химиотерапия, СО — стандартная ошибка
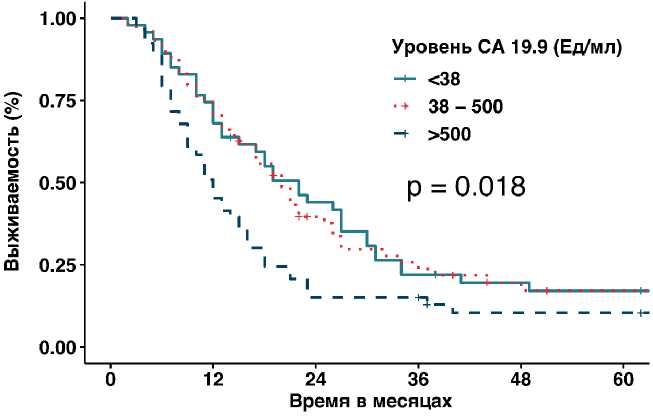
Рисунок 3. Влияние уровня СА19-9 на общую выживаемость.
ОВ, среди тех пациентов, у которых он был оценен (176 из 268, ОР =1,66, 95% ДИ 1,157–2,369, р =0,006) (рис. 3).
В нашем исследовании было продемонстрировано, что пациенты с высокодифференцированной аденокарциномой имели достоверно лучшие показатели выживаемости по сравнению с больными, у которых выявлена умеренно-или низкодифференцированная аденокарцинома (р =0,014; медиана 26 мес., 95% ДИ 4,4–47,6 против медианы 17 мес.,
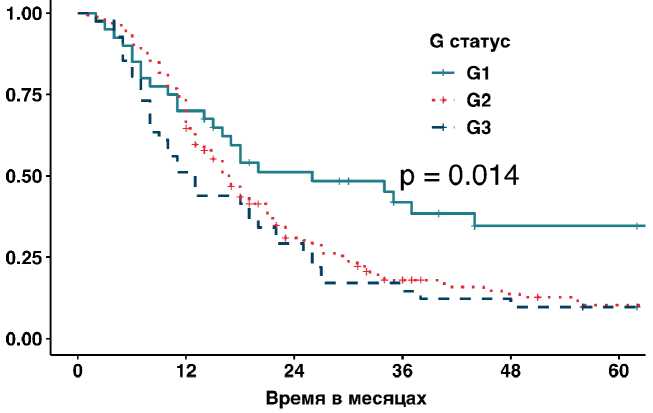
Рисунок 4. Влияние степени дифференцировки опухоли на общую выживаемость.
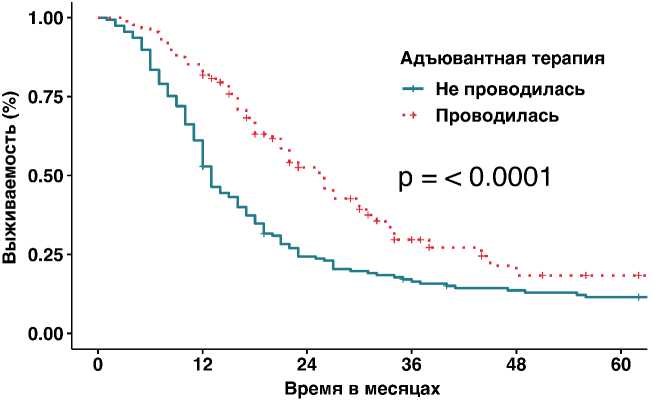
Рисунок 5. Влияние проведения адъювантной ХТ на общую выживаемость.
Таблица 3. Анализ факторов выживаемости методом регрессии Кокса
|
Факторы |
Однофакторный анализ |
Многофакторный анализ |
||||
|
ОР |
ДИ |
р |
ОР |
ДИ |
р |
|
|
Возраст |
1,069 |
0,802–1,425 |
0,648 |
|||
|
Пол |
1,159 |
0,867–1,526 |
0,332 |
|||
|
Лимфодиссекция |
1,188 |
0,885–1,594 |
0,251 |
|||
|
Резекция сосудов |
1,357 |
1,022–1,802 |
0,035 |
- |
- |
0,742 |
|
Тангенциальная резекция |
1,314 |
0,895–1,929 |
0,164 |
|||
|
Циркулярная резекция |
1,052 |
0,749–1,478 |
0,770 |
|||
|
Протезирование |
1,679 |
0,973–2,896 |
0,062 |
|||
|
Инвазия в сосуды |
1,788 |
1,199–2,667 |
0,004 |
1,681 |
1,035–2,729 |
0,036 |
|
Периневральная инвазия |
1,074 |
0,793–1,455 |
0,645 |
|||
|
Осложнения |
1,018 |
0,696–1,489 |
0,926 |
|||
|
Адъювантная ХТ |
0,554 |
0,406–0,757 |
< 0,0001 |
0,548 |
0,364–0,826 |
0,004 |
|
СА19-9 < 37 ед/мл |
0,814 |
0,562–1,181 |
0,279 |
|||
|
СА19-937–500 ед/мл |
0,776 |
0,543–1,110 |
0,165 |
|||
|
СА19-9 > 500 ед/мл |
1,656 |
1,157–2,369 |
0,006 |
1,444 |
0,998–2,090 |
0,051 |
|
R статус |
0,879 |
0,616–1,255 |
0,478 |
|||
|
N0 |
0,838 |
0,625–1,123 |
0,236 |
|||
|
N1 |
1,189 |
0,870–1,624 |
0,277 |
|||
|
N2 |
1,085 |
0,650–1,810 |
0,755 |
|||
|
G1 |
0,570 |
0,373–0,870 |
0,009 |
0,588 |
0,367–0,943 |
0,027 |
|
G2 |
1,164 |
0,859–1,578 |
0,327 |
|||
|
G3 |
1,355 |
0,946–1,939 |
0,097 |
|||
ДИ — доверительный интервал, ОР — отношение рисков, ОВ — общая выживаемость
95% ДИ 15–19, и медианы 13 мес., 95% ДИ 5–21). (рис. 4). Также положительное влияние на ОВ оказывает применение адъювантной ХТ, что позволяет увеличить медиану выживаемости в 2 раза по сравнению с группой пациентов, которые по разным причинам не смогли получить после операции дополнительное лечение (р =0,0001; медиана 26 мес., 95% ДИ 21,7–30,3 против медианы 13 мес., 95% ДИ 11,3–14,7, ОР = 0,55, 95 % ДИ 0,406–0,757, р =0,0001), (рис. 5, табл. 2).
При многофакторном анализе мы оценивали влияние различных факторов на ОВ. Из проанализированных данных можно сделать вывод о том, что проведение адъювантной ХТ (ОР =0,548, 95% ДИ 0,364–0,826, p =0,004), высокая дифференцировка опухоли (ОР =0,588, 95% ДИ 0,367–0,943, p =0,027) являются благоприятными факторами прогноза. Напротив, повышение уровня СА19-9 выше 500 ед/мл (ОР =1,444, 95% ДИ 0,998–2,090, p =0,051) и истинная сосудистая инвазия (ОР =1,681, 95% ДИ 1,035–2,729, p =0,036) достоверно снижают ОВ больных (табл. 3).
ОБСУЖДЕНИЕ
В данном исследовании продемонстрированы ретроспективные результаты лечения пациентов с аденокарциномой головки поджелудочной железы в рамках одного высокоспециализированного центра. В связи с тем, что анализ проводился за 13-летний период, схемы лечения данного заболевания менялись неоднократно. Часть пациентов получало только хирургическое лечение, другим в дополнение к операции проводилось химиотерапевтическое лечение.
Как и многие другие хирурги, мы пытались увеличить выживаемость пациентов применением расширенной панкреатодуоденальной резекции [13]. Но, к сожалению, расширение объема оперативного лечения не привело к достоверному увеличению продолжительности жизни. В настоящее время в нашем центре в большинстве случаев используется стандартная ГПДР. Также мы не получили достоверного влияния края резекции на ОВ, хотя большинство авторов считают это фактор одним из основных [14,15]. Однако в 2019 году вышла публикация Tummers и соавторов, в которой они отмечают, что наличие R1 резекции достоверно ухудшает прогноз ОВ лишь у больных, у которых были диагностированы метастазы в лимфатических узлах. Если же метастазы не были выявлены, то выживаемость больных с резекцией R0 и R1 достоверно не отличалась [16]. Мы также не обнаружили влияния метастатического поражения лимфатических узлов на ОВ. Аналогичные результаты получены и Imamura с соавторами, которые они опубликовали в 2019 году [17]. Однако другое исследование показывает, что наличие метастазов в лимфатических узлах достоверно ухудшает медиану выживаемости с 39 месяцев до 22 месяцев. При более глубоком анализе результатов данного исследования, обнаруживается, что у пациентов с метастатическим поражением двух и менее лимфатических узлов медиана выживаемости составила 35,5 месяцев, что достоверно не отличается от группы больных без метастазов. Медиана выживаемости пациентов с поражением трех и более лимфатических узлов составила 23 месяца. В представляемом нами анализе больных с поражением трех и более лимфатических узлов было 10% (N=9), и в связи с небольшим количеством этих пациентов достоверно оценить влияние этого фактора невозможно.
В нашем исследовании продемонстрированно отрицательное влияние морфологически подтвержденной инвазии в стенку магистральной вены на ОВ. Однако более чем в 70% случаев у пациентов, которым была выполнена резекция магистральных сосудов, инвазия не была подтверждена, и эти больные имели схожие сроки ОВ с пациентами без резекции сосудов. В 2016 году было опубликовано большое исследование, в которое вошли 406 пациентов перенесших ГПДР с резекцией магистральных сосудов. Ramacciato и соавторы [18] также продемонстрировали, что на ОВ влияет только морфологически доказанная сосудистая инвазия, которая ухудшает 5-летнюю выживаемость с 31 месяцев до 15 месяцев. Но в данной работе истинная сосудистая инвазия была подтверждена в 56,7% случаев, в других публикациях этот процент варьировал от 10% до 55% [19]. Несколько другие результаты опубликовали Prakash и соавторы в 2019 г. Они продемонстрировали отсутствие достоверной разницы в продолжительности жизни пациентов с морфологически подтвержденной сосудистой инвазией и без нее. Однако стоит обратить внимание на то, что хирургическое лечение выполнено всем пациентам после неоадъювантной терапии [20].
Imamura с соавторами в 2019 году опубликовали материалы своего исследования, в котором продемонстрировали, что на выживаемость влияет только подтвержденная предоперационной компьютерной томографией протяженность контакта опухоли с сосудистой стенкой (более 20 мм), а угол охвата не оказывает никакого влияния [17]. Вероятнее всего, у большинства пациентов с протяженным контактом опухоли с сосудами инвазия будет являться истинной. В настоящий момент точность определения вовлечения магистральных сосудов в опухолевый процесс с помощью КТ диагностики составляет около 80% [21]. Видимо, пациентам с истиной сосудистой инвазией (контакт опухоли с сосудистой стенкой по данным предоперационого КТ более 20 мм) показано проведение предоперационного лечения для улучшения ОВ.
Определение уровня онкомаркера СА19-9 является стандартным инструментом в диагностике и мониторинге протоковой аденокарциномы поджелудочной железы. Высокие значения СА19-9 при исходно резектабельных опухолях ассоциированы со снижением ОВ пациентов в послеоперационном периоде и, по мнению ряда авторов, являются показанием к проведению неоадъювантной ХТ [22]. По результатам других авторов, снижение уровня СА19-9 более, чем на 50% от исходного, при резектабельных опухолях поджелудочной железы после проведения неоадъювантной ХТ связано с увеличением выживаемости [23]. Снижение СА19-9 при неоперабельных или метастатических опухолях поджелудочной железы после проведения ХТ также свидетельствует о лучшей выживаемости пациентов [24]. Таким образом, уровень СА19-9 имеет прогностическое значение как на ранних, так и на поздних стадиях заболевания. В нашем исследовании выявлена закономерность, что при повышении уровня СА19-9 выше 500 ммоль/л достоверно ухудшается ОВ пациентов. Схожие данные получены у ряда зарубежных авторов [25].
Одним из факторов, достоверно влияющих на ОВ, в нашем исследовании стала высокая степень дифференцировки опухоли, при которой кумулятивная 3-летняя выживаемость составила 42%, 5-летняя — 34% против 18% и 10% в группе пациентов с низкой-и умеренной степенью дифференцировки, соответственно. Аналогичные данные были получены Kordosh и соавторами, на основании ретроспективного анализа более чем 70 тысяч пациентов с аденокарциномой поджелудочной железы [26]. М. Tanaka в 2019 г. опубликовал работу, в которой продемонстрировал, что больные с низкодифференцированной аденокарциномой имеют худшие результаты ОВ, и после радикального оперативного лечения и ХТ медиана выживаемости в этой группе пациентов не превышает 15 месяцев [27].
В нашем ретроспективном анализе продемонстрировано, что высокая степень дифференцировки опухоли и применение ХТ в адъювантном режиме достоверно увеличивают ОВ. Низкая степень дифференцировки опухоли, уровень СА19-9 более 500 Ед/мл и гистологически верифицированная инвазия опухоли в стенку магистральных сосудов достоверно ухудшают прогноз этих пациентов.
Учитывая результаты проведенного исследования, мы можем сделать вывод, что больные с низкой степенью дифференцировки опухоли, уровнем онкомаркера СА19-9 более 500 Ед/мл и подозрением на сосудистую инвазию (по данным предоперационного исследования) являются кандидатами на проведение неоадъювантного лечения даже при резектабельном статусе.
Список литературы Факторы, влияющие на общую выживаемость при протоковой аденокарциноме головки поджелудочной железы. Опыт одного центра
- Siegel R. L., Miller K. D., Jemal A. Cancer statistics, 2018 // CA: A Cancer Journal for Clinicians. 2018. Vol. 68, № 1. P. 7–30.
- Bray F. et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries// CA: A Cancer Journal for Clinicians. 2018. Vol. 68, № 6. P. 394–424.
- Allemani C. et al. Global surveillance of trends in cancer survival 2000–14 (CONCORD- 3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries//The Lancet. 2018. Vol. 391, № 10 125. P. 1023–1075.
- Strobel O. et al. Optimizing the outcomes of pancreatic cancer surgery// Nature Reviews Clinical Oncology. Springer US, 2019. Vol. 16, № 1. P. 11–26.
- Hackert T. et al. The TRIANGLE operation — radical surgery after neoadjuvant treatment for advanced pancreatic cancer: a single arm observational study// Hpb. International Hepato-Pancreato-Biliary Association Inc., 2017. Vol. 19, № 11. P. 1001–1007.
- Bilimoria K. Y. et al. Multimodality therapy for pancreatic cancer in the U. S.: Utilization, outcomes, and the effect of hospital volume// Cancer. 2007. Vol. 110, № 6. P. 1227–1234.
- Altman A. M. et al. Completion of Adjuvant Chemotherapy After Upfront Surgical Resection for Pancreatic Cancer Is Uncommon Yet Associated With Improved Survival// Annals of Surgical Oncology. Springer International Publishing, 2019. Vol. 26, № 12. P. 4108–4116.
- Huang L. et al. Resection of pancreatic cancer in Europe and USA: An international large-scale study highlighting large variations// Gut. 2019. Vol. 68, № 1. P. 130–139.
- Luberice K. et al. Has survival improved following resection for pancreatic adenocarcinoma? // American Journal of Surgery. Elsevier Ltd, 2017. Vol. 214, № 2. P. 341–346.
- Tian X. et al. Prognostic factors for disease-free survival in patients with pancreatic ductal adenocarcinoma after surgery// Journal of Pancreatology. 2019. Vol. 2, № 1. P. 22–27.
- National Comprehensive Cancer Network. Pancreatic Adenocarcinoma Version 2. 2021 — February 25, 2021 URL: https://www.nccn.org / professionals / physician_gls / pdf / pancreatic. pdf.
- Ducreux M. et al. Cancer of the pancreas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up//Annals of Oncology. 2015. Vol. 26, № Supplement 5. P. v56 — v68.
- Kuchin D.M. et al. Extensive gastropancreatoduodenal resections in the treatment of ductal carcinoma of the head of pancreas // Sovremennye Tehnologii v Medicine. 2012. Vol. 2012, № 3. P. 54–59.
- Gillen S. et al. Preoperative / neoadjuvant therapy in pancreatic cancer: A systematic review and meta-analysis of response and resection percentages// PLoS Medicine. 2010. Vol. 7, № 4. P. 1–15.
- Versteijne E. et al. Meta-analysis comparing upfront surgery with neoadjuvant treatment in patients with resectable or borderline resectable pancreatic cancer// British Journal of Surgery. 2018. Vol. 105, № 8. P. 946–958.
- Tummers W. S. et al. Impact of resection margin status on recurrence and survival in pancreatic cancer surgery// British
- Journal of Surgery. 2019. Vol. 106, № 8. P. 1055–1065.
- Imamura T. et al. Prognostic role of the length of tumour — vein contact at the portal — superior mesenteric vein in patients having surgery for pancreatic cancer// British Journal of Surgery. 2019. Vol. 106, № 12. P. 1649–1656.
- Ramacciato G. et al. Pancreatectomy with Mesenteric and Portal Vein Resection for Borderline Resectable Pancreatic Cancer: Multicenter Study of 406 Patients// Annals of Surgical Oncology. 2016. Vol. 23, № 6. P. 2028–2037.
- Yu X. Z. et al. Benefit from synchronous portal-superior mesenteric vein resection during pancreaticoduodenectomy for cancer: A meta-analysis// European Journal of Surgical Oncology. 2014. Vol. 40, № 4. P. 371–378.
- Prakash L. R. et al. Significance of Cancer Cells at the Vein Edge in Patients with Pancreatic Adenocarcinoma Following Pancreatectomy with Vein Resection// Journal of Gastrointestinal Surgery. Journal of Gastrointestinal Surgery, 2020. Vol. 24, № 2. P. 368–379.
- Kim M. et al. Prediction and clinical implications of portal vein / superior mesenteric vein invasion in patients with resected pancreatic head cancer: the significance of preoperative CT parameters// Clinical Radiology. The Royal College of Radiologists, 2018. Vol. 73, № 6. P. 564–573.
- Bergquist J. R. et al. Carbohydrate antigen 19–9 elevation in anatomically resectable, early stage pancreatic cancer is independently associated with decreased overall survival and an indication for neoadjuvant therapy: A national cancer database study// Journal of the American College of Surgeons. Elsevier Ltd, 2016. Vol. 223, № 1. P. 52–65.
- Reni M. et al. Selecting patients for resection after primary chemotherapy for non-metastatic pancreatic adenocarcinoma//Annals of Oncology. 2017. Vol. 28, № 11. P. 2786–2792.
- Haas M. et al. Prognostic value of CA19-9, CEA, CRP, LDH and bilirubin levels in locally advanced and metastatic pancreatic cancer: Results from a multicenter, pooled analysis of patients receiving palliative chemotherapy// Journal of Cancer Research and Clinical Oncology. 2013. Vol. 139, № 4. P. 681–689.
- Goh S. K. et al. Serum carbohydrate antigen 19–9 in pancreatic adenocarcinoma: a mini review for surgeons// ANZ Journal of Surgery. 2017. Vol. 87, № 12. P. 987–992.
- Kardosh A. et al. Long-Term Survivors of Pancreatic Cancer: A California Population-Based Study// Pancreas. 2018. Vol. 47, № 8. P. 958–966.
- Tanaka M. et al. Meta-analysis of recurrence pattern after resection for pancreatic cancer // British Journal of Surgery. 2019. Vol. 106, № 12. P. 1590–1601.


