Факультативно-анаэробные и аэробные бактерии - деструкторы органического вещества, выделенные из донных отложений содово-соленых озер Забайкалья и Монголии
Автор: Митыпоеа Т.Н., Козырева Л.П., Намсараев З.Б., Намсараев Б.Б.
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Микробиология
Статья в выпуске: 3, 2007 года.
Бесплатный доступ
Выделены и описаны факультативно-анаэробные и аэробные гало- и щелочно-желтые бактерии из донных отложений Забайкальского и Монголийского соленых и содовых озер. Изоляты обладают широкой метаболической активностью и играют важную роль в разрушении органического вещества в экосистеме содовых озер. Культуры, определенные молекулярно-генетическими методами, относятся к известным видам бактерий из экстремальной экосистемы и новых родов и видов.
Короткий адрес: https://sciup.org/148183705
IDR: 148183705
Текст научной статьи Факультативно-анаэробные и аэробные бактерии - деструкторы органического вещества, выделенные из донных отложений содово-соленых озер Забайкалья и Монголии
* Работа выполнена при поддержке грантов Президиума РАН «Происхождение и эволюция биосферы», Президиума СО РАН № 24, УрО и СО РАН «Микробные сообщества кстремальных экосистем» и Минобразования науки РНП. 2,1.1.4566,
Исследуемые озера Забайкалья и Монголии представая ют собой интерес в связи с наличием большого разнообразия микроорганизмов, относящихся к различным функциональным группам, среди которых важное место занимают гидролитические бактерии. В донных отложениях содовых озер аэробные и анаэробные бактерии осуществляют гидролиз высокомолекулярных биологических полимеров - белков, жиров, углеводов, целлюлозы, деструкцию летучих жирных кислот.
Целью данной работы было выделение и изучение представителей основных функциональных групп бактерий-деструкторов органического вещества.
Методы
Выделение культур аэробных органотрофных бактерий проводили на минеральной среде, описанной ранее (Митыпова и др., 2005) с добавлением пептона, дрожжевого экстракта (ДЭ) и глюкозы в суммарной концентрации 5% и на РПА. Значения pH и солености в средах культивирования устанавливали соотношениями NaHCO.i, Na 2СО3 и NaCI в соответствии с гидрохимией озер.
Выделение чистых культур включало три этапа: 1) получение накопительной культуры; 2) выделение чистой культуры из изолированных колоний на агаризованной среде; 3) очистка культуры от сопутствующих организмов путем многократного пересева с жидкой на агаризо-ванную среду с последующим выделением колоний. Чистоту культуры контролировали микроскопированием и по однородности колоний.Чистые культуры поддерживались на минеральной среде с дрожжевым экстрактом (ДЭ) (5г/л).
Морфотипы бактерий, размеры, подвижность и спорообразование изучали микроскопированием образцов с помощью светового микроскопа AxioStar Plus (Karl Zeiss) в фазовом контрасте и на окрашенных препаратах при 100-кратном увеличении объектива (общее увеличение 1000).
Эколого-физиологические, биохимические характеристики и ферментативную активность выделенных изолятов исследовали по стандартным методикам (Методы общей бактериологии, 1984)
Спорообразование у бактерий выявляли: 1) прогреванием до 80°С в течение 10 минут, и последующим посевом на питательную среду; 2) окрашиванием спор по методике Пешкова; 3) фотографированием старых культур.
Состав оснований ДНК определен на основании анализа кривых плавления ДНК в Институте микробиологии им. Виноградского РАН (г. Москва) Секвенирование генов I6S-PHK проведено в Институте биохимии и физиологии микроорганизмов РАН (г. Пущино) и Лимнологическом институте СО РАН (г. Иркутск).
Результаты
Из донных отложений и микробных матов содово-соленых озер Забайкалья и Монголии аэробно были выделены 50 культур бактерий-деструкторов органического вещества (ОВ). Детальные исследования были проведены с 32 изолятами. Отбор производился с учетом доминирующего роста и эколого-физиологических особенностей штаммов. В выборку было включено: 18 изолятов из оз. Соленое, 3 - Алгннское, 2 - Нухэ-Нур, 2 - Безымянное, 4 - Долон Давст Ну-ур и 3 - Хилганта.
Морфологическая характеристика культу. На агаризованных средах изоляты образовывали круглые, реже концентрические или амебовидные колонии от неокрашенных до пигментированных: светло-желтых, желтых, оранжевых и ярко-красных. Размеры колоний варьировали от 1 до 5-6 мм, за исключением штаммов Д4 и ХЗ, образующих колоний диаметром 12 и 17 мм, соответственно.
Края колоний в основном ровные, но у некоторых ветвистые и слегка волнистые. Профиль колоний изолятов выпуклый, или каплевидный и плоский, встречаются колонии вросшие в агар.
Клетки 18 изолятов представлены палочками, размеры которых варьируют в пределах от 0.29-0.43 х 1.43-1.7 мкм до 0.71-0.86 х 2.43-3.14 мкм; 4 - овальными клетками (0.71-1.14 х 1.141.86 мкм) и одного изолята (Л1К) - изогнутыми палочками 0.57 х 2.57-5 мкм. Клетки 9 изолятов являлись кокками диаметром от 0.76 до 1.29 мкм. У 12 культур выявлено спорообразование. Размеры спор составляют от 0.57 х 0.86 мкм до 0.86 х 1.14 мкм (рис.1).
Эколого-физиологическая .характеристика культур
По отношению к pH среды все органотрофы являются факультативными алкалофилами, среди сапрофитов преобладали алкалотолерантные бактерии (табл. 1).
Выделенные культуры росли на среде без NaCI, однако большинство культур хорошо росло при содержании NaCI от 5 и до 100 г/л, что позволяет отнести выделенные культуры к галото- лерантным. У некоторых изолятов наблюдался рост при концентрации NaCI до 200 г/л. В основном оптимум роста культур находился в пределах NaCI 15-75 г/л. По отношению к температуре выделенные микроорганизмы являлись мезофилами с оптимальным ростом в пределах 25-40°С, за исключением культуры А1, рост которой был отмечен до 55°С, проявляя термотолерантные свойства. Выделенные культуры по отношению к кислороду являются факультативно-анаэробными бактериями, за исключением строго аэробных культур Ski и Nu.
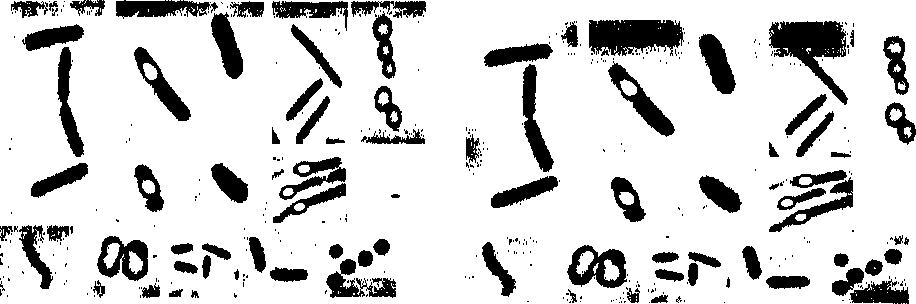
Н.о. - не определено
Рис. 1. Фотографии культур: а) Д2; б) ЦЗ; в) Sk 1; г) К5; д) 10а; е) 17п; ж) 34; з) и) Л1 К: к) Кб; л) Nu; м) Д1; н)
С4К линейка 5 мкм
Эколого-физиологические свойства культур
Таблица 1
|
Культура |
Пределы pH |
Оптимум pH |
Пределы NaCI,г/л |
Оптимум NaCI,г/л |
КОНтест |
М орфотип клеток |
Размеры клеток, мкм |
|
AI |
8.6-10 |
9 |
0-100 |
0 |
+ |
Палочки |
0,29 х 1,57-2,7 спора = 0,57 |
|
АЗ |
6,5-11 |
9-10 |
0-200 |
75 |
овальные палочки |
0,86-1 х 1Л4-1,7 споровые |
|
|
А4 |
8-11 |
9,5 |
0-200 |
30-100 |
+ |
Палочки |
0,71-0,86x2,43 |
|
Д1 |
6-10 |
8 |
0-100 |
30 |
+ |
Палочки |
0,43 х 2,14 |
|
Д2 |
5,5-10,5 |
8 |
0-140 |
30-50 |
— |
Палочки |
0,71 х3>3,5 споровые |
|
ДЗ |
7-9,5 |
8,8 |
0-75 |
30 |
- |
Палочки |
0,43 х 1,86-2 спора = 0,57 х 0,86 |
|
Д4 |
7-9,5 |
8,8 |
5-180 |
50 |
- |
Палочки |
0,57 х 1,7-2,85 споровые |
|
К1 |
7,5-10 |
8,7 |
5-180 |
75-100 |
- |
Палочки |
0,43 к 1,14-1,43 |
|
КЗ |
6,5-10,5 |
8.8 |
0-200 |
50 |
- |
Кокки |
d= 1,29 |
|
К4 |
7,5-10 |
8,8 |
0-180 |
100 |
Палочки |
0,43 х 1,43-1,7 |
|
|
К5 |
6,5-11,5 |
10 |
0-200 |
30-75 |
- |
Кокки |
d = 1-1,14 |
|
Кб |
5,8-11 |
8,5 |
0-200 |
75-100 |
+ |
овальные палочки |
0,71-0,86 х 1,43-1,86 |
|
К7 |
7,5-11 |
9,5 |
0-180 |
30 |
+ |
Кокки |
d= 1 |
|
К8 |
6,5-11 |
9 |
0-200 |
50-75 |
+ |
Кокки |
d =0,76- 0,86 |
|
XI |
7-9,5 |
8,7 |
0-100 |
5-50(15) |
— |
Палочки |
0,43 x 1,7 споровые |
|
ХЗ |
7-11 |
8,5-9,5 |
0-100 |
30 |
— |
Палочки |
0,43 x 1,43-2 J 4 споровые |
|
Х4 |
7,5-10 |
9 |
0-100 |
100 |
Кокки |
d = 0,86 |
|
|
17п |
7-10,5 |
8,8 |
0-100 |
75 |
+ |
овальные палочки |
0,86-1,14 x 1,86-3.43 |
|
2а |
7,5-10,5 |
9,2 |
0-160 |
50-75 |
Палочки |
0,57x2,71 спора = 0,71x1 |
|
8а |
7-10 |
9,3 |
0-100 |
15-50 |
овальные палочки |
М4х Ц57-1.86 споровые |
|
|
10а |
6-10,5 |
9,3 |
6-100 |
15-50 |
Палочки |
0,71 х 2,43 спора = 0,86 х 1,14 |
|
|
С1К |
7,5-10,5 |
8,6 |
Г 0-100 |
30-50 |
- |
Палочки |
0,71 х2,85 |
|
С2К |
6,5-9,5 |
7,5 |
0-200 |
30 |
Кокки |
4=1 |
|
|
С4К |
6-10 |
8-8,5 |
0-200 |
15 |
- |
Кокки |
d = 0,76-0,86 |
|
32 |
7,5-11 |
9,5-10 |
6-200 |
15-30 |
+ |
Кокки |
d = 0,86-1 |
|
34 |
7-10 |
8,5-9 |
0-100 |
50 |
4- |
Палочки |
0,57-3,6 спора = 1x1,14 |
|
SKI |
6,5-11 |
7,7 |
0-75 |
30 |
+ |
Палочки |
0,29-0,43 х 1,71-3,86 |
|
N2 |
6-10 |
8,5-9 |
0-100 |
0-50 |
- |
Кокки |
d=0,7 |
|
Nu |
6,5-10 |
7.6 |
0-7,5 |
0,5-1,5 |
+ |
Палочки |
0,4 0,5 х 1,1-1,7 |
Биохимическая характеристика культур. Культуры обладали широкой метаболической активностью и росли на всех протестированных субстратах: крахмале, пептоне, твине, ацетате, лактате, аминокислотах (аспарагине, цистеине и глутаминовой кислоте). Все культуры хорошо росли на среде с ДЭ в качестве единственного источника углерода и энергии, почти все изоляты росли на среде с пептоном, кроме одной - А1. 17 выделенных культур проявляли способность к фиксации молекулярного азота.
Сероводород из белок-содержащих субстратов образует только 11 культур. Изоляты используют для роста арабинозу, рамнозу, рафинозу, маннит, фруктозу, глюкозу, инозит, лактозу, сорбит и дульцит, слабый рост отмечен на ксилозе, сахарозе, маннозе, инозите. У всех культур рост отсутствовал на галактозе. Большинство изолятов газ и кислоту из сахаров не образуют, но у некоторых культур наблюдалось кислотообразование из протестированных углеводов.
Ферментативная активность культур. Определена ферментативная активность у выделенных культур. 18 изолятов проявили амилолитические свойства. Колонии амилолитических бактерий в диаметре составляют 1.5 - 4.0 мм. При этом минимальные зоны гидролиза крахмала составляют 1-2 мм; средние зоны - 4-5 мм и максимальную зону просветления проявил изолят 34-7 мм. Соотношения диаметра колонии к диаметру зоны гидролиза варьируют от 0,1 до 0,43. Казеиназной активностью обладают только 5 изолятов, хотя на среде с пептоном отмечен рост у всех изолятов, кроме изолята А1. Разжижать желатину способны только 5 культур. 6 изолятов проявили липазную активность с зоной гидролиза Твина 80 от 5 до 14 мм. Эндоцел-люлазной активностью обладают 3 изолята: Д2, XI и ХЗ. Каталазная активность выявлена у 21 изолята; оксидазная активность у 19. Генотипическая характеристика культур. Для 12 изолятов было определено процентное содержание ГЦ (гуанин+цитозин) в ДНК. Изоляты кластиро-вались в 3 группы по низкому, среднему и высокому содержанию ГЦ в ДНК. Низкий уровень ГЦ отмечен у изолятов Ski и XI (29,8 и 31,5 мол. % соответственно). Высокое содержание ГЦ отмечено у двух изолятов - Х4 (50,4 мол. %) и С2К (70,4 мол. %), Промежуточное положение занимали культуры с содержанием ГЦ в пределах от 36,1 до 44,4 мол. % (С4К, ДЗ, 34, КЗ, К4, ЦЗ,С1К, Nu).
Неполный сиквенс гена 16S рРНК у 6 изолятов для 4 показал сходство на уровне 98-100% с валидно описанными видами: 100 % сходство между штаммом К5 и Bacillus saliphilus, 99% сходства изолята 17п с Halomonas desiderata, 99 % сходства изолята Кб с Halomonas axialensis, и 98 % сходства изолята Д1 с Oceanbacillus iheyensis. Изоляты Nu и Ski показали сходство с близкородственными последовательностями на уровне 89 % (Hongiella mannitolivorans) и 92% (Algoriphagus sp.10.1), что позволяет отнести их к новым родам семейства Flexibactericeae, к группе Cytophaga-Flavobacterium-Bacteroides.
Таким образом, выделенные культуры микроорганизмов являются алкало- и галотолерант- нымн факультативно-анаэробными бактериями-деструкторами органического вещества, активно функционирующими в микробном сообществе содово-соленых озер Забайкалья и Монголии. Культуры, определенные с помощью молекулярно-генетических методов оказались как близкородственными с ранее известными обитателями экстремальных экосистем, так и представителями новых родов и видов.
Список литературы Факультативно-анаэробные и аэробные бактерии - деструкторы органического вещества, выделенные из донных отложений содово-соленых озер Забайкалья и Монголии
- Заварзин Г.А., Жилина Т.Н., Кевбрин В.В. Алкалофильное микробное сообщество и его функциональное разнообразие//Микробиология. -1999. -Т.68. -№5. -С. 579 -599.
- Методы общей бактериологии/под ред. Ф. Герхарда и др. -М.: Мир, 1984.-264 с.
- Митыпова Т.Н., Козырева Л.П., Намсараев Б.Б. Аэробные и анаэробные бактерии-деструкторы органического вещества в донных осадках содово-соленых озер Забайкалья//Вестник Бурятского университета. Сер. 2: Биология. Вып. 7,-Улан-Удэ: Изд-во БГУ, 2005.-С. 190-193


