Фармакоэкономическая эффективность мониторинга уровня выдыхаемого оксида азота для персонифицированного назначения базисной терапии атопической бронхиальной астмы у детей
Автор: Петров В.И., Шишиморов И.Н., Магницкая О.В., Пономарева Ю.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Фармакология
Статья в выпуске: 1 т.10, 2014 года.
Бесплатный доступ
Цель: оценить фармакоэкономическую целесообразность мониторинга уровня выдыхаемого оксида азота (FeNO) для оценки эффективности базисной терапии атопической бронхиальной астмы у детей. Материал и методы. Проведено 24-недельное проспективное сравнительное рандомизированное открытое исследование в параллельных группах. В исследование включены 70 детей с неконтролируемой атопической бронхиальной астмой и высоким уровнем FeNO (FeNO>50ppb). Оценивали сравнительную эффективность подбора базисной терапии на основании ежемесячного мониторинга FeNO и критериев контроля над астмой в соответствии с рекомендациями GINA (2011). Результаты. Коэффициент «затраты / эффективность» для достижения 1 постоянного 12-недельного контроля через 24 недели терапии в группе мониторирования FeNO составил 11433,26 руб., что было на 37,8% ниже соответствующего показателя в группе сравнения (18382,99 руб.). Заключение. Использование мониторинга оксида азота в выдыхаемом воздухе для персонифицированного подбора базисной терапии у детей с неконтролируемой атопической бронхиальной астмой позволяет сократить затраты на лечение и является экономически целесообразным.
Бронхиальная астма, дети, оксид азота в выдыхаемом воздухе, фармакоэкономика
Короткий адрес: https://sciup.org/14917915
IDR: 14917915
Текст научной статьи Фармакоэкономическая эффективность мониторинга уровня выдыхаемого оксида азота для персонифицированного назначения базисной терапии атопической бронхиальной астмы у детей
БА связывают с гетерогенностью самого заболевания и отсутствием персонифицированного подхода к терапии пациентов, который учитывал бы патогенетические особенности различных фенотипов БА [3].
В последних международных и российских рекомендациях критерием эффективности фармакотерапии БА является достижение стабильного контроля над заболеванием, который должен быть достигнут путем подбора адекватной базисной терапии [1, 4]. Предложено несколько способов оценки контроля БА: клиникоориентированные (опросники по оценке контроля БА — ACT, ACQ5 и др.), широко внедренные в практику, и биомаркерориентированные, которые в настоящий момент активно изучаются [4]. Выдыхаемый оксид азота (FeNO) является маркером воспаления дыхательных путей, уровень которого увеличивается в периоды неконтролируемой бронхиальной астмы и уменьшается во время адекватного по объему лечения противовоспалительными средствами [5]. Однако ряд исследований не продемонстрировали значимых преимуществ мониторинга FeNO перед другими способами оценки контроля БА [6–8]. При этом практически во все исследования включались пациенты без учета фенотипа БА. Так как уровень FeNO отражает выраженность эозинофильного воспаления, наиболее значимого повышения этого показателя следует ожидать у пациентов с фенотипом «атопической астмы» [9]. Следовательно, мониторинг FeNO может оказаться эффективным персонифицированным подходом к подбору базисной терапии у пациентов с указанным фенотипом БА.
Цель : оценить фармакоэкономическую эффективность персонифицированного подхода к подбору базисной терапии атопической бронхиальной астмы у детей с помощью мониторинга уровня выдыхаемого оксида азота (FeNO).
Материал и методы. Открытое рандомизированное сравнительное 24-недельное исследование в параллельных группах выполнено на клинической базе кафедры клинической фармакологии и интенсивной терапии ВолгГМУ и Волгоградского областного центрааллергологии и иммунологии, одобрено региональным независимым этическим комитетом. В исследование включили 70 детей от 6 до 18 лет (средний возраст 13,2±2,9 года , мальчи-ки/девочки 50/20) с верифицированным диагнозом «неконтролируемая бронхиальная астма» в соответствии с критериями GINA (2011). Все пациенты соответствовали дополнительным критериям включения в исследование:
-
1) подтвержденный атопический фенотип БА (общий IgE>100 ME/ml, положительные кожные пробы с аллергенами);
-
2) уровень FeNO>50 ppb у детей старше 12 лет и FeNO>45 ppb у детей младше 12 лет;
-
3) базисная терапия в постоянной дозе не менее 12 недель до рандомизации или отсутствие базисной терапии минимум 4 недели до рандомизации.
После стратификационной рандомизации пациенты были распределены по 2 группам в соответствии с исходной базисной терапией (табл. 1).
Таблица 1
Стратификация пациентов , включенных в исследование , с исходной базисной терапией
|
Количество человек |
Ступени терапии по GINA |
|||
|
1-я ступень |
2-я ступень |
3-я ступень |
||
|
Без базисной терапии |
ндИГКС или АЛТР |
ндИГКС/ ДДБА или сдИГКС |
||
|
1 группа/ 2 группа |
35/35 |
10/10 |
21/21 |
4/4 |
П р и м е ч а н и е : ндИГКС и cдИГКС — низкие и средние дозы ингаляционных глюкокортикостероидов; АЛТР — антогонисты анти-лейкотриеновых рецепторов; ндИГКС/ДДБА — комбинация низких доз ингаляционных глюкокортикостероидов и длительно действующих β2-агонистов.
Всем пациентам после рандомизации терапия была пересмотрена в направлении «step up», схема пересмотра терапии отражена в дизайне исследования (рисунок).
Родители всех участников исследования, подписавшие информированное согласие, регистрировали симптомы заболевания и потребность в бронхолитиках короткого действия в дневниках наблюдения ежедневно. Результаты анализировали во время плановых визитов каждые 4 недели терапии. При развитии обострения у пациента любой группы лечения его госпитализировали в областной аллергологический центр и назначали стандартную терапию обострения в соответствии с рекомендациями GINA (2011), после выписки базисная терапия пересматривалась в сторону увеличения.
Пациенты 2-й группы, у которых через 12 недель стартовой терапии тяжесть течения соответствовала критериям частично контролируемой или неконтролируемой астмы (ACQ5>0,75), переводились на следующую ступень базисной терапии до момента окончания наблюдения или развития обострения. У пациентов 1-й группы терапия пересматривалась на основании ежемесячных измерений оксида азота в выдыхаемом воздухе с помощью портативного анализатора NObreath (Bedfont Scientific Ltd), при значении FeNO>45 ppb (<12 лет) и FeNO>50 ppb (>12 лет) пациенты переводились на следующую ступень базисной терапии. Решение об уменьшении объема
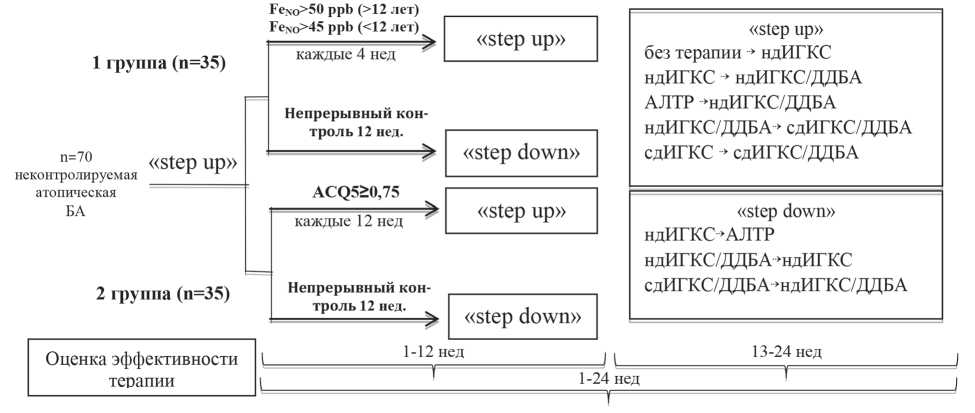
Рис. 1. Дизайн исследования
базисной терапии принималось на очередном визите после достижения пациентом постоянного контроля по критериям GINA в течение 12 недель.
Фармакоэкономическое исследование выполнено с использованием метода «затраты / эффективность». В качестве основных критериев эффективности использовали: достижение контроля БА (критерии GINA) через 12 и 24 недели терапии; долю пациентов, достигших постоянного 12 - недельного контроля; общее количество бессимптомных дней.
Оценивали только прямые затраты, которые включали в себя стоимость базисной терапии, средств симптомотической терапии, затраты на госпитализацию в связи с обострением и затраты на определение FeNO. Рассчитывали коэффициент «затраты / эффективность» (CER) по каждому критерию эффективности для каждого изучаемого подхода к подбору базисной фармакотерапии.
Информацию о затратах на лекарственную терапию получили из Государственного реестра предельных отпускных цен aspx.); стоимость 1 суток госпитализации в связи с обострением бронхиальной астмы — из Генерального тарифного соглашения в сфере обязательного медицинского страхования Волгоградской области от 29.03.2013 г. Стоимость одного определения FeNOс учетом цены прибора и стоимости его обслуживания, затрат на приобретение расходных материалов и проведение диагностической процедуры составила 237 руб. 25 коп. Показатели эффективности и затраты были пересчитаны на 100 пациентов.
Статистическую обработку всех результатов исследования проводили с помощью пакета программы Biostat. Для межгрупповых сравнений использовали критериий Манна — Уитни, критерий χ2, критерий Фишера. Статистически значимыми считались значения р<0,05.
Результаты . Затраты на лечение пациентов обеих групп представлены в табл. 2.
Суммарные затраты на лечение БА за 24 недели между сравниваемыми группами были сопоставимы и составили 522663,41 руб. и 524176,83 руб. в 1-й и 2-й группах соответственно. В структуре затрат преобладали расходы на базисную терапию: на их долю пришлось 52,5% (274328,32 руб.) в 1-й группе и 51,7% (270954 руб.) во 2-й. За первые 12 недель наблюдения расходы на данную статью были выше на 7,8% в 1-й группе (128479,44 руб. против 118514,32 руб.), а за последующие 12 недель во 2-й группе на 4,3% (152439,68 руб. против 145848,88 руб.). Максимальные различия между группами за 24 недели наблюдения были установлены по затратам на госпитализации для лечения обострений. За первые 12 недель терапии данные затраты во 2-й группе оказались в 9,5 раз выше, чем у пациентов 1-й группы (162368,57 руб. против 17091 руб.). За 24 недели затраты на госпитализации во 2-й группе были в 3 раза выше, чем у пациентов 1-й группы (250674,29 руб. против 79760 руб.).
В фармакоэкономическом анализе были также учтены дополнительные затраты, связанные с мониторингом FeNO у пациентов 1-й группы. Исходя из наших расчетов дополнительные затраты на ежемесячный мониторинг FeNO в ходе проведенного 24-недельного исследования составили 166075 руб. на 100 пациентов.
Общее количество бессимптомных дней в 1-й группе (3893/5880), где для коррекции терапии использовался мониторинг FeNO, через 24 недели терапии было достоверно (р<0,05) большим, чем в группе, где подбор терапии осуществлялся в соответствии с существующими национальными рекомендациями (3582/5880).
Доля пациентов, которые достигли контроля через 12 недель терапии, в 1 -й группе была статистически значимо (p<0,05) больше (31/35), чем в о 2 -й группе (16/35). Эта же тенденция сохранилась и к моменту окончания исследования: 28/35 и 20/35 в группах 1 и 2 соответственно, однако выявленные различия были недостоверными. Доля пациентов, достигших непрерывного 12-недельного контроля к моменту окончания исследования , была выше в группе 1 (16/35) по сравнению с группой 2 (10/35).
При расчете коэффициента CER (табл. 3) установлено, что в группе 1 для достижения одного случая контролируемого течения через 12 и 24 недели терапии потребовалось соответственно на 55,8 и 28,9% меньше затрат денежных средств, чем во 2-й группе. Затраты за 24 недели наблюдения на достижение одного непрерывного контроля БА в течение 12 недель в группе 1 также были меньше, чем в группе 2 (на 37,8%). Стоимость одного бессимптомного дня за 24 недели терапии была ниже в группе 1на 8%.
Обсуждение. Согласно результатам фармакоэкономических исследований, посвященных терапии БА, в структуре затрат на лечение данного заболевания существенную часть составляют расходы, связанные с госпитализациями по поводу обострений [10, 11]. Использование в нашем исследовании мониторинга FeNO позволило сократить данную статью расходов за счет уменьшения количества госпитализаций. Несмотря на то, что общие затраты за 24 недели терапии были сопоставимы в обеих группах, затратная эффективность в группе мониторинга FeNO была выше по всем оцениваемым критериям эффективности.
Заключение. Использование мониторинга оксида азота в выдыхаемом воздухе для персонифици-
Таблица 2
Затраты на лечение детей с неконтролируемой бронхиальной астмой в течение 12 и 24 недель при использовании различных подходов к подбору базисной терапии, руб/100 пациентов
|
Виды затрат |
1 -я группа (Мониторинг Fe NO ) |
2 -я группа (Критерии GINA) |
||||
|
1–12 нед |
13–24 нед |
1–24 нед |
1–12 нед |
13–24 нед |
1–24 нед |
|
|
Базисная терапия |
128479,44 |
145848,88 |
274328,32 |
118514,32 |
152439,68 |
270954,00 |
|
Симптоматическая терапия |
1744,46 |
755,63 |
2500,09 |
1643,00 |
905,54 |
2548,54 |
|
Госпитализация |
17091,43 |
62668,57 |
79760,00 |
162368,57 |
88305,71 |
250674,29 |
|
Мониторинг FeNO |
94900,00 |
71175,00 |
166075,00 |
0,00 |
0,00 |
0,00 |
|
ИТОГО |
242215,33 |
280448,08 |
522663,41 |
282525,89 |
241650,94 |
524176,83 |
Таблица 3
Коэффициент CER (руб/ед. эффективности) для различных подходов к мониторингу эффективности базисной терапии
Список литературы Фармакоэкономическая эффективность мониторинга уровня выдыхаемого оксида азота для персонифицированного назначения базисной терапии атопической бронхиальной астмы у детей
- The national program "Children bronchial asthma: strategy of treatment and prevention". Moscow: Original-maket, 2008; 184 p. (Национальная программа «Бронхиальная астма у детей: стратегия лечения и профилактика». М: Оригинал-макет, 2008; 184 с.
- Thomas М, Gruffydd-Jones К, Stonham С, et al. Assessing asthma control in routine clinical practice: use of the Royal College of Physicians '3 questions'. Prim Care Respir J 2009; 18 (2): 83-8
- Malinovschi A, Fonseca JA, Jacinto T, et al. Exhaled nitric oxide levels and blood eosinophil counts independently associate with wheeze and asthma events in National Health and Nutrition Examination Survey subjects. J Allergy Clin Immunol 2013; 132 (4): 821-7. 4. Global Strategy for Asthma Management and Prevention. Global Initiative for Asthma (GINA) 2011. www.ginaasthma.com
- Stanley J. Szefler, Herman Mitchell, Christine A. Sorkness, et al. Adding Exhaled Nitric Oxide to Guideline-based Asthma Treatment in Inner-City Adolescents and Young Adults: a randomized controlled trial. Lancet 2008; 372 (9643): 1065-1072
- George W. Rodway, JiYeon Choi, Leslie A. Hoffman, et al. Exhaled nitric oxide in the diagnosis and management of asthma: clinical implications. Chron Respir 2009; 6 (1): 19-29
- Taylor DR, Pijnenburg MW, Smith AD, et al. Exhaled nitric oxide measurements: clinical application and interpretation. Thorax 2006; 61 (9): 817-27
- Petsky HL, Cates CJ, Lasserson TJ, et al. A systematic review and meta-analysis: tailoring asthma treatment on eosinophilic markers (exhaled nitric oxide or sputum eosinophils). Thorax 2012; 67 (3): 199-208
- Martha Scott, Abid Raza, Wilfried Karmaus, et al. Influence of atopy and asthma on exhaled nitric oxide in an unselected birth cohort study. Thorax 2010; 65 (3): 258-262
- Katayoun Bahadori, Mary M Doyle-Waters, Carlo Marra, et al. Economic burden of asthma: a systematic review. ВМС Pulm Med 2009; 9: 24
- Russian (Горбунов В.А., Магницкая О. В., Пономарева Ю.В. и др. Фармакоэкономическое обоснование выбора стартовой терапии неконтролируемой бронхиальной астмы у детей раннего возраста. Вестник Волгоградского государственного медицинского университета 2013: 4 (48): 110-112.


