Фармакокинетика 68Ga-NODA-аминоглюкозы в организме мышей с карциномой Эрлиха
Автор: Тищенко В.К., Петриев В.М., Михайловская А.А., Фдорова А.В., Степченкова Е.Д., Екатова Т.Ю.
Рубрика: Научные статьи
Статья в выпуске: 3 т.29, 2020 года.
Бесплатный доступ
Разработка новых туморотропных радиофармацевтических лекарственных препаратов (РФЛП) для конкретных клинических целей является одной из приоритетных задач ядерной медицины. Рост числа ПЭТ-центров в России диктует необходимость поиска РФЛП, внедрение которых в онкологическую практику позволит снизить стоимость процедуры ПЭТ и повысить доступность современных методов диагностики для населения нашей страны. Целью данной работы стало изучение фармакокинетических свойств нового соединения на основе NODA-аминоглюкозы и генераторного радионуклида галлия-68 (68Ga-NODA-АГ). Исследование проводили на интактных беспородных мышах и мышах с перевитой подкожно карциномой Эрлиха. Концентрацию 68Ga-NODA-АГ определяли методом прямой радиометрии. Также были рассчитаны периоды биологического и эффективного полувыведения 68Ga-NODA-АГ из органов и тканей. Эффективность связывания 68Ga с NODA-АГ составила более 95%. Радиохимические примеси не превышали 5%. Удельная активность 68Ga-NODA-АГ в опухоли снижалась с 3,19 %/г в срок 5 мин до 0,93 %/г, 0,34 %/г и 0,31 %/г через 1, 2 и 3 ч после введения. Относительно медленное выведение 68Ga-NODA-АГ из опухолевой ткани определяло повышенное накопление активности в опухоли по сравнению с окружающими органами и тканями. Элиминация препарата из организма осуществлялась через почки. Особо стоит отметить низкую концентрацию 68Ga-NODA-АГ в головном мозге и сердце. Накопление активности у мышей с опухолью было ниже, чем у интактных животных преимущественно в начальные сроки эксперимента. Значения периодов биологического и эффективного полувыведения из всех органов и тканей, за исключением головного мозга, у мышей с карциномой Эрлиха были выше, чем у интактных мышей. Таким образом, параметры фармакокинетики 68Ga-NODA-АГ являются оптимальными для диагностических препаратов.
Галлий-68, аминоглюкоза, позитронная эмиссионная томография, карцинома эрлиха, радиофармацевтический препарат, биологический и эффективный периоды полувыведения
Короткий адрес: https://sciup.org/170171543
IDR: 170171543 | УДК: 615.849.2:546.681.02.68:615.033/034:616-006.6-092.9 | DOI: 10.21870/0131-3878-2020-29-3-60-70
Текст научной статьи Фармакокинетика 68Ga-NODA-аминоглюкозы в организме мышей с карциномой Эрлиха
Неуклонный рост числа онкологических заболеваний в России и мире диктует необходимость поиска новых путей диагностики и терапии рака [1]. На сегодняшний день позитронная эмиссионная томография (ПЭТ) считается наиболее информативным методом ядерной медицины, позволяющим выявлять метаболические нарушения в организме на молекулярном уровне до появления структурных изменений. ПЭТ обладает более высокой чувствительностью, более высоким пространственным разрешением, улучшенными возможностями количественной оценки исследуемых процессов и низкой радиационной нагрузкой на пациента по сравнению с другими диагностическими методами.
Широкое распространение метода ПЭТ во многом определяется используемыми радиофармацевтическими лекарственными препаратами (РФЛП). На сегодняшний день основным диагностическим РФЛП для ПЭТ остается [18F]фтор-2-деокси-2-D-глюкоза (18F-ФДГ). Его использование позволяет не только выявлять опухоли различных локализаций, но и проводить
Тищенко В.К. – вед. научн. сотр., к.б.н.; Петриев В.М.* – зав. лаб., д.б.н., проф. НИЯУ МИФИ; Михайловская А.А. – ст. науч. сотр., к.б.н.; Фёдорова А.В. – вед. инженер; Степченкова Е.Д. – мл. научн. сотр.; Екатова Т.Ю. – мл. научн. сотр. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
дифференциальную диагностику злокачественных и доброкачественных новообразований, определять степень распространённости опухолевого процесса, выявлять рецидивы и отдалённые метастазы после проведённого лечения, планировать и оценивать эффективность противоопухолевой терапии [2].
Возможность применения 18F-ФДГ в качестве радиотрейсера для визуализации опухолей обусловлена патофизиологическими изменениями раковых клеток. Значимым признаком злокачественного перерождения клеток является нарушение их энергетического обмена, заключающееся в получении энергии преимущественно за счёт гликолиза, а не митохондриального окислительного фосфорилирования, даже в присутствии достаточного количества кислорода [3]. Считается, что такое метаболическое перепрограммирование позволяет опухолевым клеткам поддерживать высокую пролиферативную активность при гипоксии и избегать апоптоза из-за снижения функций митохондрий [3, 4].
Повышенное поступление глюкозы в раковые клетки является важным метаболическим маркером опухолевого процесса. Накопление 18F-ФДГ детерминировано повышенной экспрессией транспортных белков семейства GLUT в опухолевых клетках и возросшей активностью фермента гексокиназы, участвующего в фосфорилировании 18F-ФДГ в 18F-ФДГ-6-фосфат. Полученное соединение не участвует в дальнейшем метаболизме и остаётся внутри клетки, становясь её «метаболической меткой» [3].
Существенным недостатком 18F является циклотронный способ его получения. Ввиду короткого периода полураспада 18F (T 1/2 =110 мин), циклотрон должен находиться либо в самом медицинском учреждении, либо недалеко от него [5]. Поэтому были разработаны соединения на основе производных глюкозы и радионуклидов 99mTc, 123I, 11С, 68Ga, 64Cu, однако лишь 99mTc-этилендицистеин-деоксиглюкоза находится на этапе клинических исследований [6].
Альтернативой 18F может стать генераторный радионуклид 68Ga, обладающий оптимальными ядерно-физическими свойствами (Т 1/2 =68 мин, β+=89%, E+ β max =1,9 МэВ). Коммерчески доступный генератор 68Ga представляет компактное устройство, позволяющее получать галлий в катионной форме 68Ga3+ в течение 1-1,5 лет непосредственно в клинике и проводить метку препарата перед введением пациенту. В настоящее время 68Ga используется в основном в синтезе меченых производных октреотида [2]. Перспективным направлением считается разработка РФЛП на основе 68Ga и фосфоновых кислот [5, 7, 8], а также соединений, обладающих специфичностью к различным рецепторам-биомаркерам [9, 10].
Для введения радиоактивного металла в структуру молекулы предпочтительнее использовать производные глюкозы, имеющие в структуре атом азота или серы, либо бифункциональный хелатор [2]. Поэтому в качестве носителя 68Ga была выбрана аминоглюкоза, связанная с хелатором NODA. Цель работы – изучение фармакокинетических свойств нового соединения на основе NODA-аминоглюкозы и генераторного радионуклида 68Ga (68Ga-NODA-АГ).
Материалы и методы
Получение и контроль качества 68Ga-NODA-АГ. Для получения меченого препарата получали лиофилизат NODA-АГ во флаконе ёмкостью 10 см3, содержащий 0,1 мг NODA-АГ. Для этого во флакон помещали 1 мл раствора NODA-АГ, замораживали при -40 оС и проводили сушку в сублиматоре («VIRTIS», США) в течение 24 ч.
Далее во флакон с лиофилизатом вносили 0,5 мл деионизованной воды и перемешивали до полного растворения осадка, добавляли 0,5 мл 0,2 М ацетатного буфера с рН 4,6, переме- шивали и добавляли 37 МБк (1,0 мКи) 68GaCl3 в 0,5 мл 0,05 М HCl. Реакционную смесь перемешивали в течение 10 мин при комнатной температуре, доводили до объёма 2,0 мл деионизованной водой и фильтровали через фильтр с размером пор 0,22 мкм.
Количественное определение 68Ga, связанного с NODA-АГ, свободного (не связанного с NODA-АГ) и гидролизованного 68Ga осуществляли методом бумажной хроматографии. В качестве неподвижной фазы использовали Ватман-1 (Sigma-Aldrich, США). В качестве подвижных фаз были выбраны 1,0 М раствор ацетата натрия и 0,05% раствор лимонной кислоты. При элюировании 1,0 М раствором натрия ацетата 68Ga, связанный с NODA-АГ, двигался с фронтом элюента (Rf=0,85-0,95), свободный 68Ga оставался на старте (Rf=0). При элюировании 0,05% раствором лимонной кислоты гидролизованный 68Ga незначительно сдвигался со старта (Rf=0,05-0,10), а свободный 68Ga и связанный с NODA-АГ поднимался с фронтом элюента (Rf=0,85-0,95).
Количественное определение гидролизованного, свободного 68Ga и связанного с NODA-АГ проводили путём расчёта результатов радиометрии полосок хроматографической бумаги. Радиометрию проводили с помощью автоматического гамма-счётчика «Wizard» (версия 2480 фирмы PerkinElmer/Wallac, Финляндия).
Полученный РФЛП был предназначен для внутривенных инъекций. Радиохимические примеси в препарате 68Ga-NODA-АГ не превышали 5,0%.
Биологическая часть. В качестве тест-системы использовали беспородных мышей-самцов с массой тела 25±3 г. Животные были поделены на две равные группы по 16 мышей в каждой. Первая группа животных служила контролем: им в хвостовую вену вводили 68Ga-NODA-АГ в дозе 0,185 МБк в объёме 0,1 мл. Вторая группа включала животных с перевитой подкожно карциномой Эрлиха. Для получения солидного варианта опухоли Эрлиха перевивали асцитную жидкость, полученную от мышей-доноров на 8-10 сутки роста. Полученную взвесь, содержащую в 0,1 мл 3,5·106 клеток опухоли, вводили подкожно в область правого бедра. Через 7 дней, когда объём опухоли достигал 0,4-0,6 см3, животным внутривенно вводили 0,185 МБк 68Ga-NODA-АГ в объёме 0,1 мл.
Через 5 мин, 1, 2 и 3 ч после введения 68Ga-NODA-АГ по 4 животных на каждый срок подвергали эвтаназии путём декапитации (под наркозом), выделяли пробы органов и тканей, помещали их в пластиковые пробирки, взвешивали на электронных весах («Sartorius», Германия) и проводили радиометрию с помощью автоматического гамма-счётчика «Wizard» (версия 2480 фирмы PerkinElmer/Wallac, Финляндия). На момент введения в отдельные пробирки отбирали пробы 68Ga-NODA-АГ в объёме 0,1 мл для использования в качестве стандарта введённой дозы. По данным радиометрии на каждый срок наблюдения рассчитывали количество радиоактивности на 1 г органа или ткани в процентах от введённой дозы (%/г). Также были рассчитаны коэффициенты дифференциального накопления (КДН) как частное от деления величин концентрации активности в опухоли и остальных органах и тканях.
Расчёт периодов полувыведения 68Ga-NODA-АГ. Данные о биологических периодах полувыведения ( Т biol ) рассчитывали на основе получения экспоненциальной кривой, исходя из предположения, что активность радионуклида в органе, ткани со временем уменьшается (рис. 1).
Если угловой коэффициент A и константа скорости a максимально точно подобраны для построения кривой, то точка со значением половины введённой активности будет соответствовать биологическому периоду полувыведения T biol . Таким образом, из формулы A(t)=A·e–at легко выразить биологический период полувыведения T biol :
T biol
1 ( 2 A )
- • lnl I a I % ID о )
где T biol – биологический период полувыведения препарата из органа или ткани, ч; A – угловой коэффициент при экспоненте; a – константа скорости, ч-1; %ID 0 – первоначальная доля от введённой активности (percent of Injected Dose) в органе или ткани, %/орган.
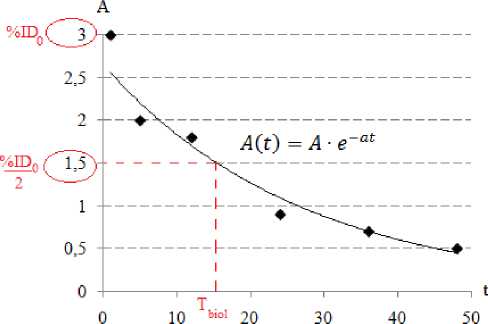
Рис. 1. Математическая модель динамики изменения концентрации радиофармпрепарата во времени в органе.
Данные об эффективных периодах полувыведения рассчитывали по формуле:
T biol " T 1 / 2
T eff = ’
T biol + T 1 / 2
где T eff – эффективный период полувыведения препарата, ч; T biol – биологический период полувыведения препарата из органа или ткани, ч; T 1/2 – физический период полураспада радионуклида, ч.
Аппроксимация экспериментальных данных и расчёт биологических периодов полувыведения проводились в программе OriginPro 2019b.
Статистическая обработка результатов. При статистической обработке результатов радиометрии определяли показатели средних арифметических значений (М) и стандартных ошибок среднего (±m) в программе Microsoft Excel 2010. Сравнение уровней накопления радиоактивности в группах проводилось с помощью t-критерия Стьюдента в программе OriginPro 2019b. Различия считались статистически значимыми при p<0,05.
Результаты и их обсуждение
При анализе полученных результатов было установлено, что биораспределение 68Ga-NODA-АГ в организме интактных мышей и мышей-опухоленосителей имеет ряд схожих особенностей. Так, пиковые концентрации 68Ga-NODA-АГ в органах были отмечены уже через 5 мин после введения препарата (табл. 1). Важно отметить, что статистически значимые различия в уровнях накопления активности в большинстве внутренних органов между интактными животными и животными с опухолью были выявлены через 5 мин.
Таблица 1
Распределение активности в организме интактных мышей и мышей с карциномой Эрлиха после внутривенного введения 68Ga-NODA-АГ
(в % от введённой дозы на 1 г ткани)
|
Наименование органа, ткани |
Время после введения препарата |
||||
|
5 минут |
1 час |
2 часа |
3 часа |
||
|
1 |
Кровь |
5,35±0,45* 8,41±0,63** р˂0,01 |
0,53±0,08 0,39±0,05 p>0,1 |
0,12±0,02 0,04±0,02 р˂0,05 |
0,110±0,010 0,020±0,001 р˂0,001 |
|
2 |
Лёгкие |
4,46±0,66 7,09±0,61 р˂0,05 |
0,42±0,12 0,44±0,04 p>0,5 |
0,15±0,04 0,15±0,02 p>0,5 |
0,12±0,02 0,08±0,01 p>0,1 |
|
3 |
Печень |
2,14±0,16 2,68±0,11 р˂0,05 |
1,40±0,37 1,19±0,13 p>0,5 |
0,78±0,02 0,99±0,09 p>0,05 |
0,72±0,10 0,59±0,04 p>0,25 |
|
4 |
Почки |
14,21±2,33 24,82±2,87 р˂0,05 |
3,18±0,29 2,99±0,22 p>0,5 |
2,84±0,19 2,06±0,23 p<0,05 |
1,85±0,12 1,79±0,27 p>0,5 |
|
5 |
Сердце |
1,85±0,25 3,26±0,13 р˂0,01 |
0,22±0,04 0,26±0,12 p>0,5 |
0,09±0,05 0,08±0,01 p>0,5 |
0,065±0,014 0,010±0,001 p<0,01 |
|
6 |
Селезёнка |
1,51±0,06 1,71±0,08 p>0,05 |
1,17±0,26 0,20±0,01 р˂0,01 |
1,04±0,27 0,13±0,01 р˂0,01 |
0,63±0,13 0,07±0,01 р˂0,02 |
|
7 |
Желудок |
2,16±0,29 3,98±0,24 р˂0,01 |
0,25±0,04 0,36±0,12 p>0,25 |
0,12±0,03 0,13±0,03 p>0,5 |
0,10±0,04 0,09±0,01 p>0,5 |
|
8 |
Кишечник |
1,78±0,36 2,47±0,06 p>0,1 |
0,25±0,06 0,19±0,04 p>0,25 |
0,11±0,03 0,12±0,01 p>0,5 |
0,08±0,01 0,07±0,01 p>0,5 |
|
9 |
Головной мозг |
0,21±0,02 0,32±0,04 р˂0,05 |
0,05±0,01 0,07±0,02 p>0,25 |
0,04±0,02 0,03±0,01 p>0,5 |
0,03±0,01 0,02±0,01 p>0,5 |
|
10 |
Мышца бедра |
1,42±0,13 2,00±0,07 р˂0,01 |
0,14±0,04 0,12±0,01 p>0,5 |
0,05±0,02 0,15±0,06 p>0,1 |
0,04±0,01 0±0 р˂0,01 |
|
11 |
Кость бедра |
2,34±0,36 2,92±0,18 p>0,1 |
0,22±0,04 0,34±0,10 p>0,25 |
0,08±0,03 0,34±0,17 p>0,1 |
0,02±0,01 0,08±0,03 p>0,1 |
|
12 |
Кожа |
3,77±0,44 6,96±0,78 р˂0,02 |
0,42±0,13 0,37±0,12 p>0,5 |
0,15±0,04 0,21±0,03 p>0,25 |
0,11±0,04 0,15±0,02 p>0,25 |
|
13 |
Опухоль |
3,19±0,53 – |
0,93±0,31 – |
0,34±0,03 – |
0,31±0,05 – |
68Ga-DOTA-DG клетками эпителиальной карциномы А431 in vivo составило 2,38 %/г в срок 10 мин, снижаясь за 1 ч до 0,39 %/г [11]. Таким образом, содержание 68Ga-NODA-АГ в опухоли было более чем в 2 раза выше, чем 68Ga-DOTA-DG. Изучение биораспределения другого препарата, 68Ga-ECG, проводили на крысах с перевитой подкожно мезотелиомой. Накопление 68Ga-ECG в опухоли возрастало со временем до 0,92 %/г в срок 1 ч [12], что схоже с концентрацией 68Ga-NODA-АГ через 1 ч после введения.
Таблица 2
Периоды полувыведения активности из органов и тканей интактных мышей и мышей с карциномой Эрлиха после внутривенного введения 68Ga-NODA-АГ
|
Наименование органа, ткани |
Периоды полувыведения, ч |
|||
|
Интактные мыши |
Мыши с карциномой Эрлиха |
|||
|
T biol |
T eff |
T biol |
T eff |
|
|
Кровь |
0,21 |
0,18 |
0,28 |
0,22 |
|
Лёгкие |
0,23 |
0,19 |
0,28 |
0,22 |
|
Печень |
0,53 |
0,36 |
0,97 |
0,52 |
|
Почки |
0,21 |
0,18 |
0,25 |
0,21 |
|
Сердце |
0,26 |
0,21 |
0,31 |
0,24 |
|
Селезёнка |
0,32 |
0,25 |
0,51 |
0,35 |
|
Желудок |
0,27 |
0,22 |
0,31 |
0,24 |
|
Кишечник |
0,26 |
0,21 |
0,34 |
0,26 |
|
Головной мозг |
0,37 |
0,28 |
0,26 |
0,21 |
|
Кожа |
0,22 |
0,19 |
0,30 |
0,24 |
|
Мышца бедра |
0,24 |
0,20 |
0,28 |
0,23 |
|
Опухоль |
– |
– |
0,43 |
0,31 |
Время, ч
-
—■— Опухоль/кровь • Опухоль/мышца
-
▲ Опухоль/печень —V— Опухоль/почки
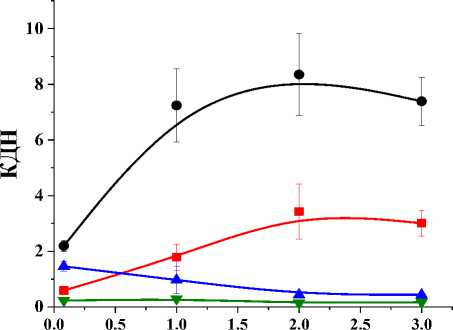
Рис. 2. Динамика изменения КДН у мышей с карциномой Эрлиха в различные сроки после внутривенного введения 68Ga-NODA-АГ.
Диагностическую эффективность 68Ga-NODA-АГ оценивали по коэффициентам дифференциального накопления (КДН), рассчитанным как частное от деления величин концентрации активности в опухоли и остальных органах и тканях. Уже через 5 мин после введения накопление 68Ga-NODA-АГ в опухоли было выше, чем в большинстве органов и тканей. В дальнейшем за счёт ускоренного клиренса внутренних органов по сравнению с опухолевой тканью наблюдался рост численных значений КДН со временем (рис. 2). Отношения опухоль/кровь возрастали с 0,59 в срок 5 мин до 3,43 в срок 2 ч после введения 68Ga-NODA-АГ. КДН опухоль/мышца за
2 ч увеличивались с 2,19 до 8,35. Обращают на себя внимание низкие (меньше 1) значения КДН опухоль/почки, опухоль/печень и опухоль/селезенка, что свидетельствует о повышенной концентрации 68Ga-NODA-АГ в этих органах по сравнению с опухолью.
В крови у мышей с опухолью начальная концентрация 68Ga-NODA-АГ была ниже, чем у интактных мышей, однако в сроки 2 и 3 ч концентрация 68Ga-NODA-АГ у мышей с карциномой Эрлиха была в 3-5,5 раза выше, чем у интактных мышей (p<0,05). У интактных животных концентрация активности в крови составляла 0,02-8,41 %/г, а у мышей с опухолью – 0,11-5,35 %/г (табл. 1).
Наиболее высокий уровень активности был отмечен в почках (табл. 1). У здоровых мышей содержание 68Ga-NODA-АГ в почках достигало 24,82 %/г в срок 5 мин, снижаясь за 1 ч более чем в 8 раз – до 2,99 %/г и продолжая снижаться до конца исследования. У мышей с опухолью максимальное содержание 68Ga-NODA-АГ было существенно ниже (до 14,21 %/г), однако в последующие сроки за счёт быстрого выведения концентрация 68Ga-NODA-АГ в почках быстро снижалась до 1,85-3,18 %/г. Вероятно, это связано с элиминацией препарата через мочевыделительную систему. Высокие уровни радиоактивности в почках были отмечены при введении других аналогов глюкозы, меченных различными радионуклидами [6, 11, 13]. Следует отметить, что минимальные значения периодов полувыведения 68Ga-NODA-АГ в обеих группах животных были отмечены в почках, что свидетельствует о быстром выведении активности из данного органа.
Минимальная концентрация активности была зарегистрирована в головном мозге. У интактных мышей накопление 68Ga-NODA-АГ не превышало 0,32 %/г, а у мышей с опухолью – 0,21 %/г (табл. 1). Эта особенность отличает 68Ga-NODA-АГ и другие меченные 68Ga производные глюкозы от 18F-ФДГ, концентрация которой в головном мозге, по разным данным, может составлять от 2,36 %/г до 5,81 %/г [11, 12]. Поэтому 68Ga-NODA-АГ может применяться для дифференциальной диагностики опухолей головного мозга.
В остальных органах и тканях содержание 68Ga-NODA-АГ было невелико. Лишь у мышей с карциномой Эрлиха была отмечена повышенная концентрация 68Ga-NODA-АГ (0,63-1,51 %/г) в селезёнке (табл. 1). Важно, что в отличие от 18F-ФДГ, накопление 68Ga-NODA-АГ в сердце было низким [11, 12].
Важной особенностью фармакокинетики 68Ga-NODA-АГ в организме мышей-опухоленоси-телей являлось замедленное выведение активности из внутренних органов и тканей по сравнению с интактными животными (табл. 2). Исключение составил лишь головной мозг: выведение 68Ga-NODA-АГ у мышей с опухолью осуществлялось быстрее, чем у здоровых животных. Тем не менее, значения периодов биологического и эффективного полувыведения для обеих групп животных не превышали 1 ч, что является положительной характеристикой диагностического препарата.
Заключение
Таким образом, при внутривенном введении 68Ga-NODA-АГ мышам с карциномой Эрлиха накопление активности в опухоли составило 0,31-3,19 %/г, что превышало аналогичные величины в большинстве органов и тканей на протяжении всего срока наблюдения. Наиболее высо- кий уровень активности как у интактных мышей, так и у мышей с карциномой Эрлиха, был зарегистрирован в почках, а минимальный – в головном мозге. Статистически значимые различия в концентрации 68Ga-NODA-АГ у здоровых животных и животных с опухолью были отмечены преимущественно через 5 мин после введения препарата. Обе группы животных характеризовались быстрым выведением активности из внутренних органов: значения периодов биологического и эффективного полувыведения не превышали 1 ч. При этом выведение 68Ga-NODA-АГ из всех органов и тканей, за исключением головного мозга, у мышей с опухолью осуществлялось медленнее, чем у интактных мышей. Следовательно, параметры фармакокинетики 68Ga-NODA-АГ являются оптимальными для диагностических препаратов, что предполагает возможность применения 68Ga-NODA-АГ для визуализации опухолей.
Исследования проведены при финансовой поддержке Министерства образования и науки Российской Федерации (соглашение от 26 ноября 2018 г. № 075-02-2018-097). Уникальный идентификатор проекта RFMEFI57518X0174.
Список литературы Фармакокинетика 68Ga-NODA-аминоглюкозы в организме мышей с карциномой Эрлиха
- Состояние онкологической помощи населению России в 2018 году /под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2019. 236 с.
- Петриев В.М., Тищенко В.К., Красикова Р.Н. 18F-ФДГ и другие меченые производные глюкозы для использования в радионуклидной диагностике онкологических заболеваний (обзор) //Химико-фармацевтический. журнал. 2016. Т. 50, № 4. С. 3-14.
- Potter M., Newport E., Morten K.J. The Warburg effect: 80 years on //Biochem. Soc. Trans. 2016. V. 44. P. 1499-1505.
- Gogvadze V., Orrenius S., Zhivotovsky B. Mitochondria in cancer cells: what is so special about them? //Trends Cell Biol. 2008. V. 18, N 4. P. 165-173.
- Тищенко В.К., Петриев В.М., Завестовская И.Н., Иванов С.А., Каприн А.Д. Остеотропные радио-фармацевтические препараты на основе фосфоновых кислот и 68Ga (обзор) //Радиация и риск. 2020. Т. 29, № 1. С. 102-119.
- Feng H., Wang X., Chen J., Cui J., Gao T., Gao Y., Zeng W. Nuclear imaging of glucose metabolism: beyond 18F-FDG //Contrast Media Mol. Imaging. 2019. V. 2019. ID 7954854.
- Тищенко В.К., Петриев В.М., Михайловская А.А., Сморызанова О.А., Иванов С.А., Каприн А.Д. Фармакокинетические свойства нового остеотропного соединения на основе N,N,N’N’-этилендиамин-тетракис(метиленфосфоновой кислоты), меченной 68Ga, у интактных крыс и крыс с экспериментальной моделью костной мозоли //Радиация и риск. 2019. Т. 28, № 4. С. 108-117.
- Тищенко В.К., Петриев В.М., Михайловская А.А., Степченкова Е.Д., Тимошенко В.Ю., Постнов А.А., Завестовская И.Н. Экспериментальное изучение биораспределения новых остеотропных соединений на основе фосфоновых кислот и галлия-68 //Бюллетень экспериментальной биологии и медицины. 2019. Т. 168, № 12. С. 739-743.
- Velikyan I. Prospective of 68Ga-radiopharmaceutical development //Theranostics. 2014. V. 4, N 1. P. 47-80.
- Jalilian A.R. An overview on Ga-68 radiopharmaceuticals for positron emission tomography applications //Iran J. Nucl. Med. 2016. V. 24, N 1. P. 1-10.
- Yang Z., Xiong C., Zhang R., Zhu H., Li C. Synthesis and evaluation of 68Ga-labeled DOTA-2-deoxy-D-glucosamine as a potential radiotracer in μPET imaging //Am. J. Nucl. Med. Mol. Imaging. 2012. V. 2, N 4. P. 499-507.
- Zhang Y.H., Bryant J., Kong F.L., Yu D.F., Mendez R., Kim E.E., Yang D.J. Molecular imaging of mesothelioma with 99mTc-ECG and 68Ga-ECG //J. Biomed. Biothecnol. 2012. V. 2012. ID 232863.
- Tishchenko V.K., Petriev V.M., Mikhailovskaya A.A., Smoryzanova O.A., Ivanov S.A., Kaprin A.D. Preliminary biological evaluation of 99mTc-glucosamine as a potential radiotracer for tumor imaging //J. Phys: Conf. Series. 2020. V. 1439. P. 012033.


