Фармакологическая коррекция патологических изменений у жизнеспособного потомства крыс, вызванных цитостатическим воздействием на стадии прогенеза
Автор: Боровская Татьяна Геннадьевна, Полуэктова Марина Евгеньевна, Вычужанина Анна Владимировна, Щемерова Юлия Александровна, Гольдберг Виктор Евгеньевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.18, 2019 года.
Бесплатный доступ
Введение. В связи с обнадеживающими результатами лечения ряда злокачественных новообразований возрастает количество женщин репродуктивного возраста, готовых реализовать свою детородную функ-цию. Потомство данной категории пациентов вследствие генотоксичности цитостатического лечения, относится к группе риска. Целью исследования является экспериментальное изучение возможности снижения отдаленных отрицательных последствий действия на потомство цитостатического препарата этопозид с помощью лекарственного средства Глутоксим, обладающего антиоксидантными свойствами. материал и методы. Эксперименты проведены на белых аутбредных крысах-самках Вистар (n=45), возраст - 2,5 мес; 15 из которых составили группу интактных животных (фон); 15 - контрольную (крысам вводили цитостатический препарат) и 15 - группу крыс, получавших Глутоксим® (Глутамил-Цистеинил-Глицин динатрия, Фарма Вам, Россия) в дозе 50 мкг/кг за 5 дней до и 5 дней после цитостатического воздействия. Результаты. Установлено, что в потомстве крыс-самок, получавших этопозид за 3 мес до скрещивания, отмечалось возрастание количества плодов с наружними кровоизлияниями и па-тологическими изменениями внутренних органов. У родившегося потомства наблюдалось снижение скорости формирования сенсорно-двигательных рефлексов, способности к обучению, адаптивному поведению. В потомстве крыс-самок, получавших сочетанное введение этопозида и Глутоксима, все исследуемые показатели не отличались от фоновых значений. выводы. Глутоксим является эффек-тивным лекарственным средством для коррекции патологических изменений в потомстве, полученном от крыс-самок, перенесших цитостатическое воздействие.
Отдаленные последствия, цитостатическая химиотерапия, потомство, крысы-самки, глутоксим, генотоксичность, генетический риск, яйцеклетка
Короткий адрес: https://sciup.org/140254245
IDR: 140254245 | УДК: 615.28:615.017:611-013.1:611-018]-092.9 | DOI: 10.21294/1814-4861-2019-18-1-79-85
Текст научной статьи Фармакологическая коррекция патологических изменений у жизнеспособного потомства крыс, вызванных цитостатическим воздействием на стадии прогенеза
Начало XXI века характеризуется революцион‑ ными событиями в различных областях онкологии [1]. В настоящее время, по данным Американского общества клинической онкологии (ASCO), 68 % взрослых и 81 % детей с диагнозом рак имеют длительные полные ремиссии. Таких пациентов насчитывается около 25 млн человек. Это боль‑ шое достижение по сравнению с последними десятилетиями прошлого столетия, когда 5‑летняя выживаемость наблюдалась у 50 % взрослых и 62 % детей. Сегодня одним из главных критери‑ ев успешного лечения является качество жизни пациентов [2, 3]. Важной составляющей качества жизни является реализация детородной функции [4, 5]. По данным исследователей из США, 1 из 60 женщин, перенесших терапию цитостатиками, была в возрасте до 39 лет, и почти половина из них хотели бы в будущем иметь детей [6].
Химиотерапия используется у значитель‑ ного числа онкологических пациентов, и на‑ рушение репродуктивной функции является закономерным следствием ее применения. Не‑ смотря на надежды, связанные с заморозкой тканей половых желез, эта технология далеко не всегда оправдывается [7]. В связи с этим важным является вопрос о сохранении овариаль‑ ного резерва после цитостатической терапии. В клинической практике существует такая возмож‑ ность, для этого используются гонадотропин – рилизинг‑гормоны, уменьшающие количество клеток мишеней (делящихся клеток) путем оста‑ новки функции яичников [8]. Однако это только одна сторона решения проблемы, которая стоит в тесной связи с другой – необходимостью сниже‑ ния риска генетических нарушений, вызываемых цитостатиками в созревающих ооцитах. Женщин, имеющих в анамнезе онкологическую патологию и решившихся на беременность, волнует вопрос о здоровье будущего ребенка [4], неслучайно долго‑ срочные побочные эффекты химиопрепаратов на потомство становятся предметом пристального внимания репродуктологов [9, 10].
Химиотерапия может вызвать трансгенерацион‑ ные отдаленные эффекты [5]. Возможность фор‑ мирования у плода врожденной патологии связана с тем, что не все поврежденные яйцеклетки после цитостатических воздействий элиминируются. Не подвергаются элиминации генетические и эпигене‑ тические изменения, вызываемые цитостатиками.
В связи с этим не вызывает сомнений тот факт, что такое потомство будет относиться к группе риска [4, 5, 9, 11]. В потомстве животных, получавших противоопухолевые препараты за 3 мес до скре‑ щивания, наблюдается повышенное количество плодов с наружными кровоизлияниями и с патоло‑ гическими изменениями внутренних органов [11]. Побочные эффекты у потомства могут проявляться в виде отклонений в функционировании мозга, так как цитостатические препараты вызывают измене‑ ние в системе репарации белков, участвующих в продуцировании миелина [5].
Установлено, что универсальным механизмом действия цитостатической терапии является ин‑ дукция окислительного стресса [12]. Повышен‑ ное образование свободных радикалов вносит существенный вклад в большинство побочных эффектов цитостатиков, а также в их генотоксиче‑ ское действие на созревающие половые клетки. В связи с этим оправданным является использование антиоксидантов в качестве модификаторов био‑ логических реакций цитостатических препаратов [13]. К числу корректорных свойств ряда антиок‑ сидантов относится способность снижать уровень цитогенетических нарушений в соматических и по‑ ловых клетках [14]. В литературе имеются данные о снижении токсического действия на потомство с помощью урометиксана, антиоксиданта из группы тиолсодержащих соединений. Однако степень вы‑ раженности корректорных свойств урометиксана оказалась невысокой [15].
Лекарственное средство Глутоксим® является структурным аналогом глутатиона – основного звена антиоксидантной системы клетки. Препарат имеет антирадикальные свойства и обладает спо‑ собностью регулировать процессы липоперокси‑ дации [16]. При этом спектр фармакологического действия Глутоксима является более широким. Он характеризуется цитопротекторными свойствами – способствует реализации действия регуляторных молекул пептидной природы на нормальные и трансформированные клетки, обладает способ‑ ностью стимулировать костномозговое кроветво‑ рение, восстанавливать подавленные иммунные реакции. Глутоксим показан для снижения гепато‑ и гематологической токсичности в онкологической практике [17, 18]. Важным свойством препарата является способность подавлять индуцированный мутагенез и механизмы передачи мутационных изменений дочерним клеткам [16].
Целью исследования явилось эксперимен‑ тальное изучение влияния препарата Глутоксим® на состояние потомства крыс‑самок, перенесших цитостатическое воздействие на стадии прогенеза (созревания половых клеток).
Материал и методы
Эксперименты проведены на белых аутбредных крысах‑самках Вистар (n=45), возраст – 2,5 мес.
Из них 15 крыс составили группу интактных жи‑ вотных (фон); 15 – контрольную (крысам вводили цитостатический препарат) и 15 – группу крыс, получавших Глутоксим® (Глутамил‑Цистеинил‑ Глицин динатрия, Фарма Вам, Россия) в дозе 50 мкг/кг за 5 дней до и 5 дней после цитостатиче‑ ского воздействия. Крыс содержали в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей (Страсбург, 1986). Животных размещали в клетках (VELAZ) со стерилизованной мелкой стружкой в качестве подстила в соответствии с нормами раз‑ мещения. Температура воздуха в виварии 20–24 ºС, относительная влажность – 50 ± 20 %, вентиляция воздуха через HEPA фильтр, воздухообмен – 12–15 объемов помещения/час, световой режим – 12:12 ч, уровень шума и освещенности – 50–55 дБ и 300– 350 Лк соответственно; определяемый датчиком диапазон значений концентрации летучих веществ (аммиак, оксид углерода) составлял 0,4–1 мг/м3. Температура и влажность постоянно контролиро‑ вались в каждой экспериментальной комнате.
В качестве модели цитостатического воздей‑ ствия использовался препарат этопозид (Vepeside, Bristol‑Myers Squibb), который вводили одно‑ кратно, внутривенно в максимально переносимой дозе (МПД), равной 30 мг/кг. Выбор этопозида обусловлен тем, что он является мощным ин‑ дуктором окислительного стресса и обладает выраженной мутагенной активностью [19, 20]. С другой стороны, в экспериментальных исследо‑ ваниях установлено, что потомство крыс‑самок, получавших этопозид за 3 мес до скрещивания, характеризуется повышением количества плодов с патологическими изменениями внутренних ор‑ ганов и рядом нарушений со стороны центральной нервной системы [11].
Крыс‑самок всех групп ссаживали с интактными самцами в отдаленные сроки после введения этопо‑ зида (через 3 мес), что соответствует проявлению последствий воздействия на яйцеклетки созреваю‑ щих (примордиальных) фолликулов. Спаривание регистрировали с помощью вагинальных мазков. Половину самок умерщвляли методом смещения шейных позвонков на 20‑й день беременности. После вскрытия проводили макроскопический осмотр живых плодов с оценкой количества на‑ ружных кровоизлияний. Кроме того, определяли массу и кранио‑каудальный размер плодов. Далее плоды помещали в раствор Боуэна для фиксации и последующего исследования внутренних органов по методу Вильсона. Оставшуюся часть беремен‑ ных самок оставляли до родов. У родившегося потомства на 5, 30 и 60‑й дни жизни оценивали функциональное состояние центральной нервной системы по тестам «избегание обрыва», «откры‑ тое поле», «условный рефлекс пассивного избе‑ гания» (УРПИ), тест избегания стресс‑ситуации
(Хандерсона в модификации Н.А. Бондаренко) [21]. Обработку полученных данных проводили с использованием U‑критерия Манна – Уитни и углового преобразования Фишера. Различия счи‑ тали значимыми при р≤0,05 [22].
Результаты и обсуждение
При внешнем осмотре плодов в сравниваемых группах грубые аномалии развития не выявля‑ лись. Плоды не отличались друг от друга ни по массе, ни по кранио‑каудальному размеру. Во всех группах наблюдалось появление плодов с наружными кровоизлияниями и патологическими изменениями внутренних органов (кровоизлияния, холестаз, нефроптоз, гидроцефалия гемоперикард, тимомегалия и др.), но степень выраженности этих эффектов существенно варьировала. В потомстве крыс‑самок, получавших этопозид (контроль) от‑ мечалось возрастание в 2,5 раза по сравнению с фоном (интактные животные) количества плодов с наружными кровоизлияниями (рис. 1), в 3 раза – количества плодов с различными патологическими изменениями внутренних органов. В тесте «избе‑ гание обрыва» (на 5‑й день жизни) количество жи‑ вотных, обладающих этим рефлексом, составило 78 % (рис. 2), фоновые значения – 90 % (р≤0,05). Изучение поведения животных в одномесячном возрасте в тесте «открытое поле» показало, что в контроле наблюдалось уменьшение (в 2,6 раза)
числа пересеченных ими квадратов и совершённых вертикальных стоек (рис. 3), что свидетельству‑ ет о нарушении ориентировочных рефлексов и угнетенном состоянии ретикулярной формации. При оценке поведения крыс контрольной группы в двухмесячном возрасте в тесте УРПИ оказалось, что время пребывания в светлой камере во второй день опыта сокращалось почти на 40 % по сравне‑ нию с фоном (таблица), что говорит о сниженной способности у потомства контрольной группы к обучению. В тесте Хандерсона (в модификации Н.А. Брондаренко) потомство во всех исследуемых группах обладало способностью избегать стресс‑ ситуацию. Время плаванья во внутреннем и внеш‑ нем цилиндре у животных всех групп оказалось сходным, но выполнение этого рефлекса на его терминальных стадиях (время поднятия на сетку) в контроле оказалось более продолжительным и составило 22,38 ± 3,77, у интактных животных – 3,90 ± 0,41 (р≤0,05).
Оценка состояния потомства самок, получав‑ ших Глутоксим, показала, что количество плодов с наружными кровоизлияниями и патологическими изменениями внутренних органов значимо ниже по сравнению с контролем и соответствовало фо‑ новым значениям (рис. 1). Спектр патологических изменений оказался прежним. Количество крысят со сформировавшимся рефлексом «избегания об‑ рыва» на 5‑й день жизни значимо выше по срав‑
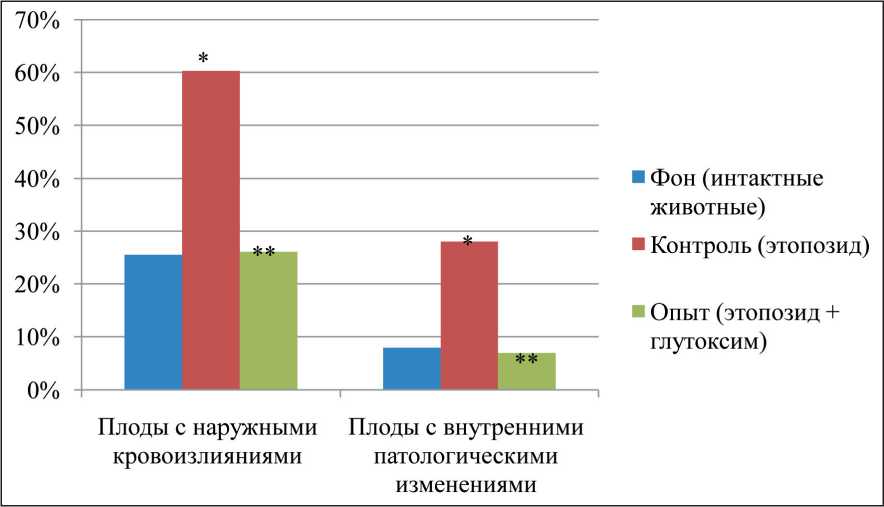
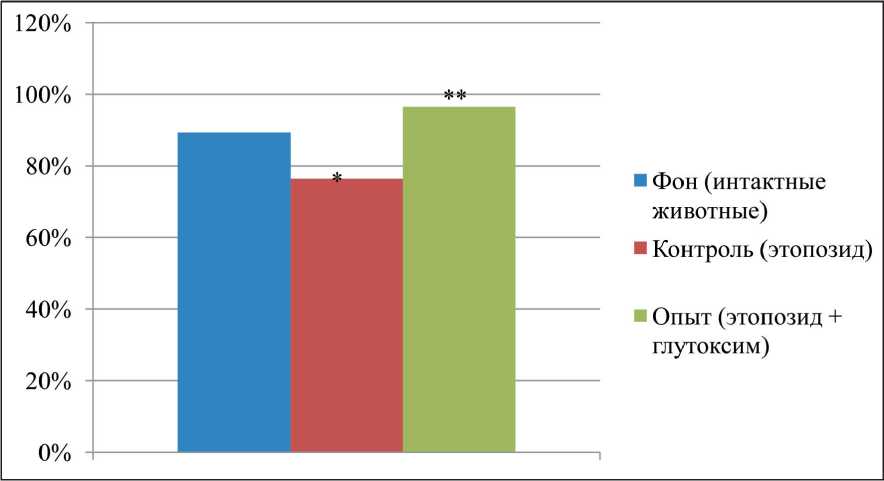
Рис. 1. Количество плодов с наружными кровоизлияниями и патологическими изменениями внутренних органов в потомстве крыс-самок, которые перенесли воздействие этопозида и глутоксима.
Примечания: * – различия статистически значимы по сравнению с фоном (рU≤0,05); ** – различия статистически значимы по сравнению с контролем (рU≤0,05)
Рис. 2. Количество крысят (на 5-й день жизни), способных к «избеганию края», из потомства крыс-самок, которые перенесли воздействие этопозида и глутоксима.
Примечания: * – различия статистически значимы по сравнению с фоном (рU≤0,05); ** – различия статистически значимы по сравнению с контролем (рU≤0,05)
таблица
Способность к обучению (тест УРПИ) крысят в двухмесячном возрасте в потомстве крыс-самок, которые перенесли воздействие этопозида и глутоксима
Группы животных
Количество крысят со сформировавшимся Время пребывания крысят‑самцов в светлой норковым рефлексом камере во 2‑й день, сек
Фон (интактные) 100 %
Контроль (этопозид) 100 %
Опыт (этопозид + глутоксим) 100 %
180 ± 0,0 108,8 ± 20,43* 172,40 ± 7,6**
Примечания: * – различия статистически значимы по сравнению с фоном (рU≤0,05); ** – различия статистически значимы по сравнению с контролем (рUU≤0,05).
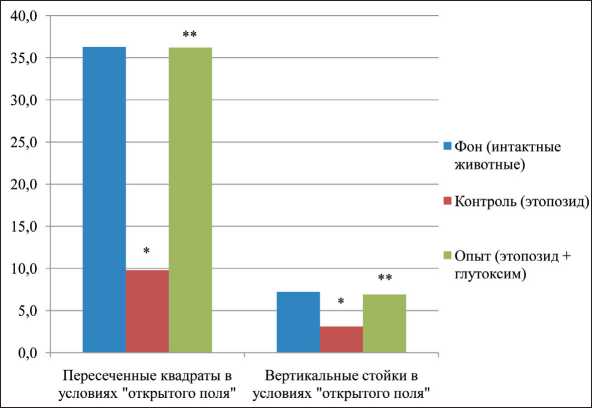
Рис. 3. Состояние двигательной активности крысят (на 30-й день жизни, тест «открытое поле») в потомстве крыс-самок, которые перенесли воздействие этопозида и глутоксима.
Примечания: * – различия статистически значимы по сравнению с фоном (рU≤0,05); ** – различия статистически значимы по сравнению с контролем (рU≤0,05)
нению с контролем и не отличалось от такового в группе интактных животных (рис. 2). Судя по тесту «открытое поле», потомство крыс, получавших этопозид в сочетании с Глутоксимом, характери‑ зовалось повышенной по сравнению с контролем вертикальной и горизонтальной двигательной активностью. Так, количество пересеченных ква‑ дратов и вертикальных стоек в эксперименталь‑ ной группе не отличалось от фоновых значений (рис. 3). Полученные данные свидетельствуют о нормализации на фоне использования Глутоксима ориентировочно‑исследовательского поведения у потомства. В тесте УРПИ было установлено, что способность к обучению у животных экс‑ периментальной группы сохранялась на уровне таковой у интактных животных. Так, время их пребывания в светлой камере во второй день опыта достоверно возрастало по сравнению с контролем и не отличалась от фоновых значений (таблица). Потомство экспериментальной группы животных по времени поднятия на сетку (тест Хандерсона в модификации Н.И. Бондаренко) не отличалось от фона (3,09 ± 0,41) и составило 5,22≤1,08 (р≥0,05).
Список литературы Фармакологическая коррекция патологических изменений у жизнеспособного потомства крыс, вызванных цитостатическим воздействием на стадии прогенеза
- Гарин А.М. Эволюция и революционные события в онкологической науке в конце XX и первом десятилетии ХХI века. Вестник РАМН. 2012; 3: 32-36. .
- Wisotzky E., Khanna A., Maltser N.H. Scope of practice in cancer rehabilitation. Current physical medicine and rehabilitation reports. 2017; 5 (1): 55-63.
- Чойнзонов Е.Л., Балацкая Л.Н., Дубский С.В., Чижевская С.Ю., Куприянова И.Е., Красавина Е.А., Тузиков С.А., Полищук Т.В., Попов Д.Н., Жогина Ж.А., Мусабаева Л.И., Слонимская Е.М., Бехер О.А., Коломиец Л.А., Чуруксаева О.Н., Молчанов С.В., Жуйкова Л.Д. Качество жизни онкологических больных. Томск: Печатная мануфактура, 2011. 152. .
- Даниленко А.А., Шахтарина С.В., Щелконогова Л.Н., Павлов В.В. Здоровье детей, родившихся у женщин после лучевого, химио-и химиолучевого лечения лимфомы Ходжкина. Онкогематология. 2014; 9 (2): 6-12. DOI: 10.17650/1818-8346-2014-9-2-6-12
- Kovalchuk A., Ilnytskyy Y., Woycicki R., Rodriguez-Juarez R., Metz G.A.S., Kovalchuk O. Adverse effects of paternal chemotherapy exposure on the progeny brain: intergenerational chemobrain. Oncotarget. 2018 Jan 23; 9 (11): 10069-10082. DOI: 10.18632/oncotarget.24311


