Фазовая диаграмма системы BaO-PbO-Fe2O3
Автор: Винник Денис Александрович, Трофимов Евгений Алексеевич, Зайцева Ольга Владимировна, Чернуха Александр Сергеевич, Живулин Владимир Евгеньевич, Резвый Александр Владимирович, Стариков Андрей Юрьевич, Судариков Михаил Викторович, Сенин Анатолий Владимирович, Михайлов Геннадий Георгиевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 3 т.9, 2017 года.
Бесплатный доступ
В статье представлены результаты проведенного исследования системы BaO-PbO-Fe2O3. С учетом экспериментальных данных подобраны и оптимизированы самосогласованные наборы значений термодинамических параметров, позволяющие моделировать реализующиеся в этой системе фазовые равновесия. Сформирована пользовательская база данных, позволяющая проводить расчёты с помощью программного пакета FactSage. С помощью программного пакета FactSage рассчитана фазовая диаграмма системы BaO-PbO-Fe2O3. Результаты расчётов представлены в виде изотермических и политермических разрезов фазовой диаграммы, а также поверхность ликвидуса исследуемой системы. В необходимых случаях на диаграммы нанесены изобары, отражающие равновесные парциальные давления оксида свинца. Полученные результаты будут востребованы для рационального выбора режимов выращивания кристаллов гексагональных ферритов из оксидного расплава.
Ферриты бария и свинца, термодинамическое моделирование, фазовые диаграммы, кристаллизация оксидных расплавов
Короткий адрес: https://sciup.org/147160396
IDR: 147160396 | УДК: 548.55 | DOI: 10.14529/chem170306
Текст научной статьи Фазовая диаграмма системы BaO-PbO-Fe2O3
Исследование физико-химических параметров, обеспечивающих стабильное образование кристаллов гексаферрита бария BaFe 12 O 19 и твердых растворов на его основе из оксидных систем [1], требует детальной информации о фазовых равновесиях, реализующихся в многокомпонентных системах. Одним из наиболее распространенных оксидов-растворителей, используемых для получения кристаллов гексаферрита из оксидного расплава (флюса), является оксид свинца. В рамках настоящей работы была поставлена задача проведения термодинамического анализа системы BaO–PbO–Fe 2 O 3 , моделирования фазовых равновесий, реализующихся в этой системе, что является чрезвычайно важным, поскольку позволит определить концентрационные и температурные интервалы, обеспечивающие кристаллизацию гексагонального феррита из оксидного расплава.
Термодинамическое описание тройной системы требует предварительного описания двойных систем BaO–Fe 2 O 3 , PbO–Fe 2 O 3 , BaO–PbO.
В настоящее время некоторые сомнения остаются даже о виде диаграммы состояния бинарной системы BaO–Fe2O3, которая является основой этого класса систем [2–8]. При описании этой системы мы использовали самые надёжные литературные данные, а также собственные данные о температурах плавления ферритов бария. Обзор данных о системе PbO–Fe 2 O 3 , вместе с результатами нашего моделирования этой системы, представлен в работе [9]. Для описания фазовых равновесий в системе BaO–PbO использованы результаты собственного экспериментального исследования. Изучалась область низкотемпературных расплавов системы BaO–PbO с преобладанием оксида свинца. Для этого использованы два подхода. Во-первых, с помощью печи сопротивления исследовались температуры плавления и гомогенизации предварительно подготовленных смесей оксида свинца и карбоната бария заданного состава. После охлаждения образцы подвергались рентгеноспектральному исследованию с целью определения полноты разложения карбоната бария. Показано, что во всех образцах в условиях эксперимента произошло полное разложение карбоната, в пользу чего свидетельствует факт отсутствия в них углерода. Также для определения температуры точки эвтектики было проведено исследование одного образца методом ДТА. Результаты моделирования вместе с результатами проведённых экспериментов представлены на рис. 1.
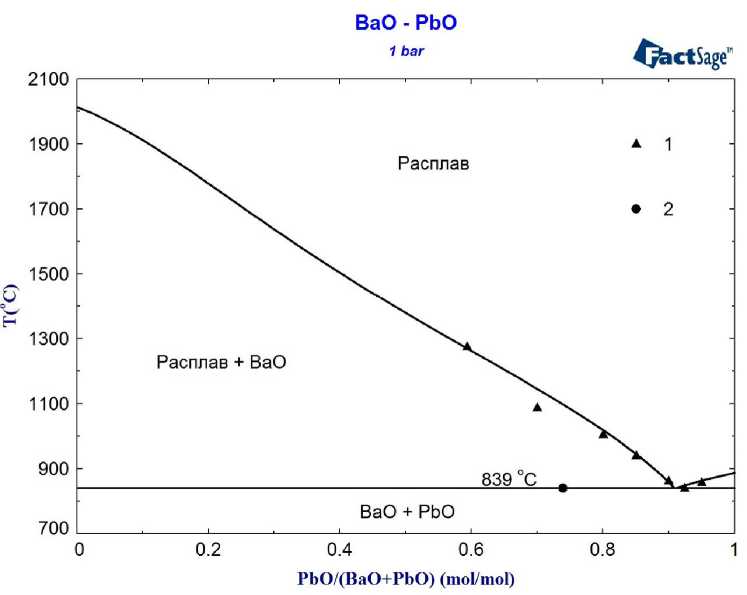
Рис. 1. Фазовая диаграмма системы BaO–PbO. Экспериментальные данные настоящей работы: 1 – температура гомогенизации расплава; 2 – ДТА
Используемые методы
В процессе исследования для подбора термодинамических характеристик, оптимизации модельных параметров и расчёта фазовых диаграмм использовался программный комплекс FactSage (версия 7.0) [10, 11], произведённый Thermfact (Canada) and GTT Technologies (Germany), и созданные в процессе исследования базы термодинамических данных, ключевые данные о содержании которых представлены в табл. 1–3. Значения термодинамических функций отчасти заимствованы из литературных источников, а отчасти стали результатом оптимизации параметров с целью получения согласующейся с экспериментальными данными картины фазовых равновесий в моделируемой системе. Данные для описания PbO и Fe2O3 заимствованы из базы SGPS (SGTE pure substances database, v13.1, 2013), данные для газообразного BaO, а также ΔH 298 , S 298 , T пл и ΔH пл для оксида бария заимствованы из базы FactPS (FACT pure substances database, 2015).
Таблица 1
Термодинамические характеристики оксида бария
|
BaO (твёрдый) 298.150–799.109 K 799.109–2286.000 K |
ΔH 298 = –548104 Дж/моль S 298 = 72.069 Дж/(моль ⋅ K) C p = 48.8610816 + 0.0088948188 ⋅ T – 379724.7031/T2 * C p = 50.610128561 + 0.006918282002 ⋅ T – 494977.8498/T2 * |
|
BaO (жидкий) 298.150–643.773 K 643.773–1600.010 K 1600.010–5000.000 K |
T пл = 2286 K ΔH пл = 59000 Дж/моль C p = 47.972692738 + 0.010207731 ⋅ T – 333748.541/T2 * C p = 51.320488471 + 0.006589285554 ⋅ T – 755792.448/T2 * C p = 66.944 * |
* – результат аппроксимации данных, представленных в справочнике [12].
Таблица 2
|
BaFe 2 O 4 (твёрдый) 298.150–2500.000 K |
AH 298 = -1518000 Дж/моль * S298= 123,2 Дж/(моль - К) * C p = 138.6 + 0.08742 - T - 929857.89/T2 [13] |
|
BaFe12O19 (твёрдый) 298.150–725.000 K 725.000–2000.000 K |
AH 298 = -5698000 Дж/моль * S298= 52 8,6 Дж/(моль - К) * |
|
C p = 348.6 + 1.16882 - T [14] C p = 695.79 + 0.1546 - T [14] |
|
|
Ba2Fe2O5 (твёрдый) 298.150–2500.000 K |
AH2 98 = -2109000 Дж/моль * S298= 189,2 Дж/(моль - К) * C p = 187.1 + 0.09592 - T - 1278526.46/T2 [13] |
|
Ba 2 Fe 6 O 11 (твёрдый) 298.150–2500.000 K |
AH 298 = -3 8 9 1 800 Дж/моль * S2 98 = 3 65,7 Дж/(моль - К) * C p = 398.94 + 0.1195 - T - 5991000/T2 [14] |
|
Ba 3 Fe 2 O 6 (твёрдый) 298.150–2500.000 K |
AH 298 = -2660300 Дж/моль * S298= 262,8 Дж/(моль - К) * C p = 235.6 + 0.10443 - T - 1627195.02/T2 [13] |
|
PbFe4O7 (твёрдый) 970.000–1050.000 K 1050.000–1160.000 K |
AH 298 = -18 3 7 3 95 Дж/моль * S2 98 = 275,85 Дж/(моль - К) * C p = -68799.35733 + 87.02944168 - T + 12912092477.8/T 2 -- 0.030796877225256 - T 2 ** Cp = 205.71869 + 0.12491108 - T + 33091497.8/T2 - 2.4726305256E-5 - T 2 ** |
|
PbFe 12 O 19 (твёрдый) 298.150–700.000 K 700.000–955.000 K 955.000–970.000 K 970.000–1050.000 K 1050.000–1160.000 K 1160.000–1812.000 K |
AH 298 = -5118 5 00 Дж/моль * S298= 643,74 Дж/(моль - К) * Cp = 907.27067 - 0.20773212 - T - 19161642.2/T2 + 0.000433515974744 - T2 ** C p = 3873.31667 - 5.77101972 - T - 268774962.2/T 2 + + 0.003367378574744 - T2 ** C p = -30250095.03733 + 41449.15926168 - T + 4774754120477.8/T2 - - 15.9732899972253 - T 2 ** C p = -206487.99733 + 261.06180168 - T + 38736836477.8/T2 -- 0.092390637225256 - T 2 ** C p = 527.23073 + 0.34820988 - T + 99833537.8/T2 - 7.4184465256E-5 - T2 ** Cp = 542.410281966394 + 0.3349482 - T + 100113060/T2 - 7.418724E-5 - T2 ** |
|
Pb 2 Fe 2 O 5 (твёрдый) 700.000–955.000 K 955.000–970.000 K 970.000–1050.000 K 1050.000–1160.000 K |
AH 298 = -12 1 6 8 80 Дж/моль * S298= 272,8 Дж/(моль - К) * C p = 727.98434 - 0.93752354 - T - 45308284.4/T2 + 0.000561234849488 - T2 ** C p = -5041600.07466 + 6908.21752336 - T + 795791840955.6/T2 - - 2.66221499445051 - T 2 ** C p = -34332.23466 + 43.53461336 - T + 6455626955.6/T2 -- 0.015398434450512 - T2 ** C p = 170.30335 + 0.08234806 - T + 16126465.6/T2 - 1.2358990512E-5 - T2 ** |
Термодинамические характеристики двойных оксидов
* – результат оптимизации.
** – рассчитано по правилу Неймана – Коппа, опираясь на данные для PbO и Fe 2 O 3 .
Таблица 3
Параметры модели, определённые в работе и использованные для описания оксидного расплава
|
Система |
Значения параметров, Дж/моль |
|
BaO–Fe 2 O 3 |
LBa 2 + F 3 + O - =" 250000 |
|
LBa 2 + = 20000 |
|
|
LBa 2 + ,Fe 3+ю2 - = 50000 |
|
|
BaO–PbO |
LBa 2 + ,Pb 2+»2 - = 66000 - 69T |
|
LB a 2 + ,Pb 2+»2 - = 4 30 00 - 29T |
|
|
Fe 2 O 3 –PbO |
L 0 Fe 3 + P :0 2 - = -31026 +5,054T |
|
L 1Fe3 + ,Pb 2 + : 0 2 - = -10315 +12,793 T |
Окончание табл. 3
|
Система |
Значения параметров, Дж/моль |
|
Ba2+T -0 L Ba2 + ,Fe3 + , Pb2 + : O2 = 0 |
|
|
BaO–Fe 2 O 3 –PbO |
Fe3 ' L B.-JC 3 + , - 2 - 0 2 - = — 300000 Pb2 + L Ba 2 + ,Fe 3 + , Pb 2 + : o 2 - = —500000 |
Для описания энергии Гиббса оксидного расплава для всех исследуемых систем использована двухподрешёточная модель ионной жидкости [15, 16]. Компонентами катионной подрешётки считаются положительные ионы (Ba2+, Fe3+, Pb2+). Анионная подрешётка состоит из ионов O2–. Для описания отклонения раствора компонентов подрешёток от идеальности использовались полиномы Редлиха – Кистера.
В рамках модели жидкость рассматривается как фаза, которая может быть описана общей формулой:
(Ba2+, Fe3+, Pb2+) p (O2–) q , где p и q – числа ионов (катионов и анионов, соответственно), вычисляемые по специальным формулам [15, 16].
Все расчёты выполнены исходя из предположения об общем давлении в системе равном 1 бар.
Результаты расчётов и их обсуждение
Известно, что гексагональные ферриты имеют набор изотропных модификаций – BaFe 12 O 19 , SrFe 12 O 19 , PbFe 12 O 19 . Существование твердых растворов, т. е. частичного замещения бария, например, свинцом, рассмотрено в работе [17].
В ходе собственных исследований получены данные [18], которые свидетельствуют о том, что гексаферриты бария и свинца могут образовывать непрерывный ряд твёрдых растворов. Исходя из таких представлений, рассчитана изображенная на рис. 2 фазовая диаграмма системы BaFe 12 O 19 –PbFe 12 O 19 . Для моделирования термодинамических характеристик твёрдого раствора использована подрешёточная модель, анионную подрешётку которой составляют анионы Fe 12 O 19 2–, а катионную подрешётку – ионы Ba2+ и Pb2+. При этом параметры, описывающие взаимодействие между катионами, принимали равными нулю.
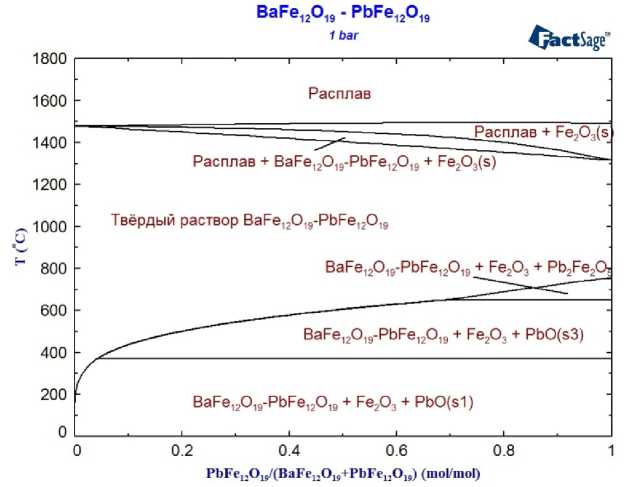
Рис. 2. Фазовая диаграмма системы BaFe 12 O 19 –PbFe 12 O 19
Кроме информации о двойных граничных системах, а также представления о твёрдых растворах в системе BaFe 12 O 19 –PbFe 12 O 19 , для моделирования фазовых равновесий в системе BaO–PbO–Fe 2 O 3 целесообразно оптимизировать параметры, характеризующие тройное взаимодействие в расплаве этой системы. На рис. 3 представлены результаты такой оптимизации в сопоставлении с полученными в ходе настоящей работы данными о температурах гомогенизации расплавов различного состава, которые и были использованы в ходе подбора значений параметров.
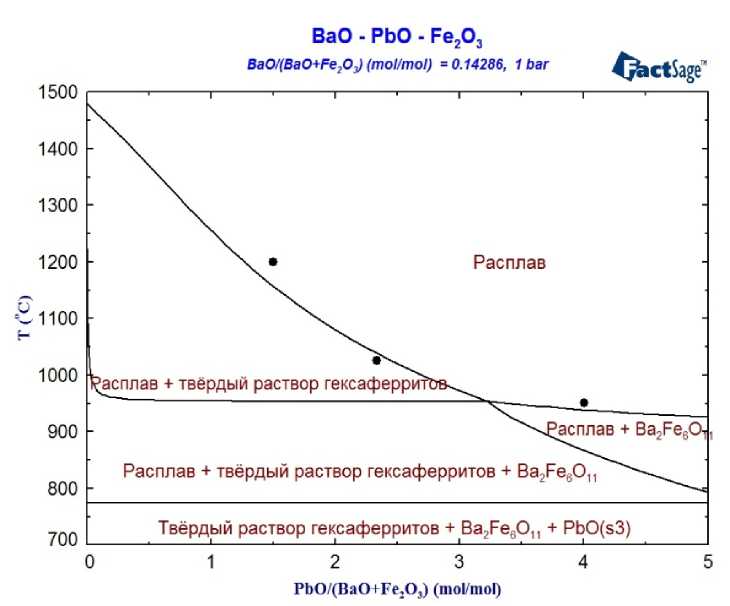
Рис. 3. Политермический разрез фазовой диаграммы системы BaO–Fe 2 O 3 –PbO на линии BaFe 12 O 19 –PbO.
Точки – экспериментальные данные работы [18] о температуре гомогенизации расплава
Набор оптимизированных параметров позволил осуществить расчёт изотермических разрезов фазовой диаграммы этой системы (рис. 4–6), а также координаты поверхности ликвидуса для этой системы, представленной на рис. 7. На последнем рисунке показано, как проходит линия разреза, соответствующего сечению BaFe 12 O 19 –PbO.
Анализ представленных результатов моделирования позволяет утверждать, что использование оксида свинца в качестве растворителя позволяет снизить минимальную температуру выращивания кристаллов гексаферрита на сечении PbO–BaFe 12 O 19 до величины порядка 960 °C и при этом использовать возможный интервал температур порядка 500 °C. То есть данный растворитель теоретически позволяет понизить нижний температурный предел проведения процесса выращивания, не снижая его верхнего значения, определённого по фазовой диаграмме системы BaO–Fe 2 O 3 . Особенностью данного растворителя, однако, является то, что образующиеся в результате кристаллы гексаферрита фактически будут представлять собою твёрдый раствор BaFe 12 O 19 –PbFe 12 O 19 (в котором, впрочем, как показывают результаты расчёта, гексаферрит бария при интересующих нас условиях будет преобладать).
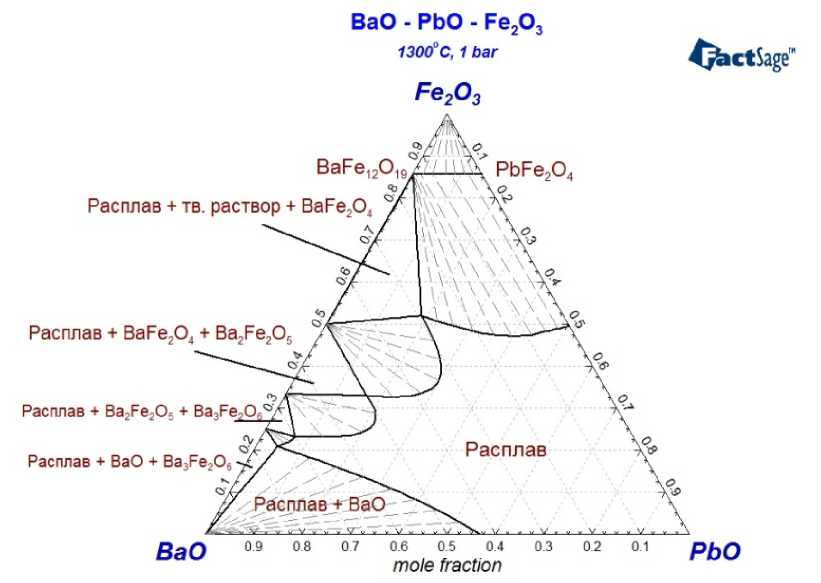
Рис. 4. Изотермический разрез фазовой диаграммы системы BaO–Fe 2 O 3 –PbO для Т = 1300 °С
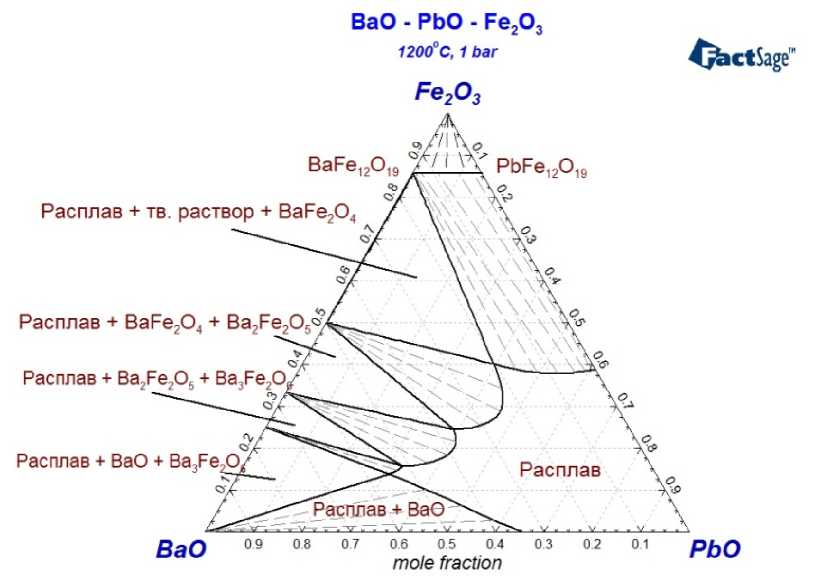
Рис. 5. Изотермический разрез фазовой диаграммы системы BaO–Fe 2 O 3 –PbO для Т = 1200 °С
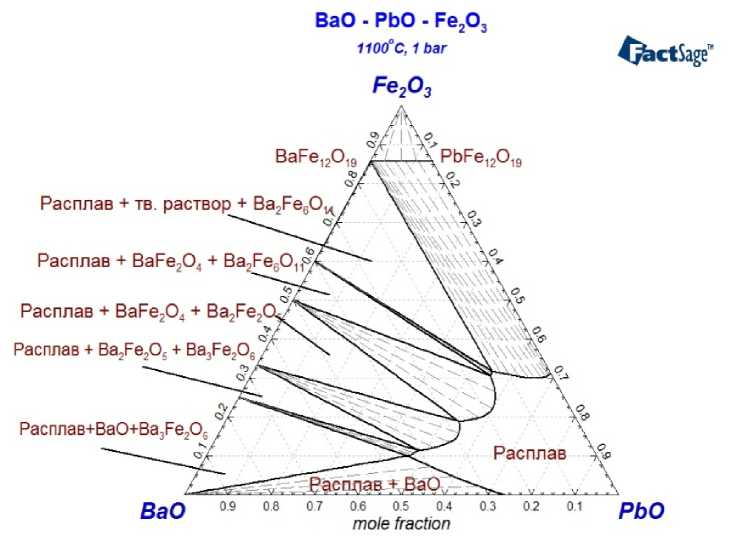
Рис. 6. Изотермический разрез фазовой диаграммы системы BaO–Fe 2 O 3 –PbO для Т = 1100 °С
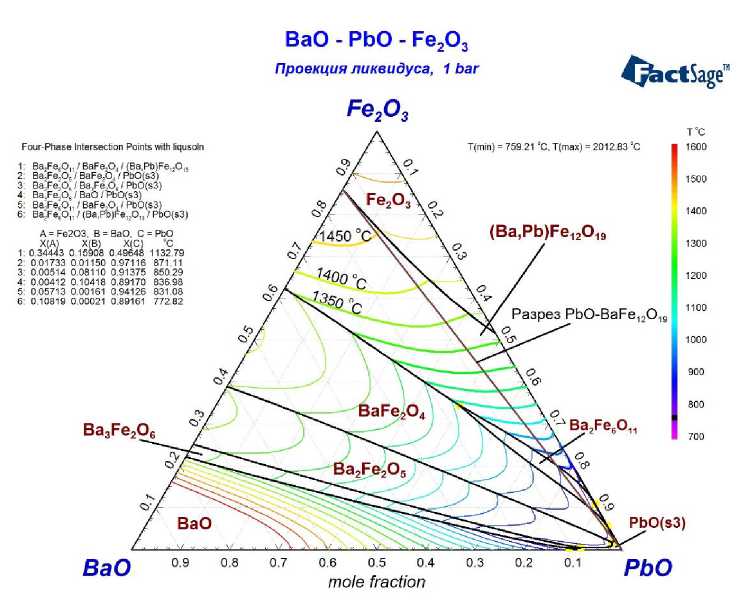
Рис. 7. Поверхность ликвидуса для фазовой диаграммы системы BaO–Fe 2 O 3 –PbO
Представление о соотношениях масс компонентов шихты, которую можно использовать для выращивания кристаллов гексаферрита, позволяет получить результаты расчёта политермическо-го разреза фазовой диаграммы системы BaO–Fe 2 O 3 –PbO на линии BaFe 12 O 19 –PbO, на которой состав системы выражен в массовых долях (рис. 8).
К сожалению, серьёзным недостатком использования такого растворителя является высокое давление его паров, о котором позволяют судить, в частности, изобары (давление выражено в барах), нанесённые на рис. 8. Это, учитывая токсичность свинца и требования к простоте конструкции оборудования для выращивания кристаллов, затрудняет использование PbO.
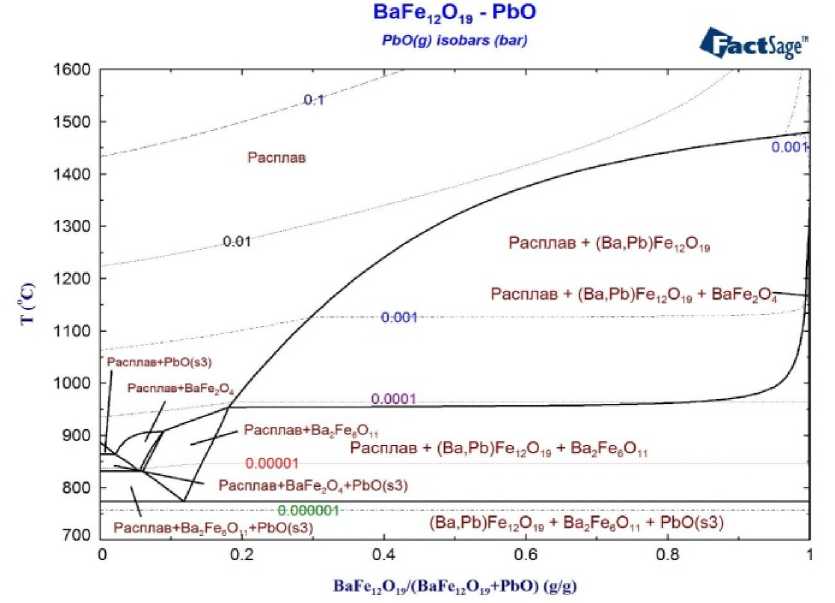
Рис. 8. Политермический разрез фазовой диаграммы системы BaO–Fe 2 O 3 –PbO на линии BaFe 12 O 19 –PbO в масс. долях. Нанесены изобары, отражающие равновесное парциальное давление PbO
Выводы
В результате проведенного исследования, опираясь на экспериментальные данные, подобраны и оптимизированы самосогласованные наборы значений термодинамических параметров, позволяющие моделировать фазовые равновесия, реализующиеся в системе BaO–PbO–Fe 2 O 3 . Сформирована пользовательская база данных, позволяющая проводить расчёты с помощью программного пакета FactSage. С помощью программного пакета FactSage рассчитана фазовая диаграмма системы BaO–PbO–Fe 2 O 3 . Результаты расчётов представлены в виде изотермических и политермических разрезов диаграммы, а также поверхности ликвидуса исследуемой системы. В необходимых случаях на диаграммы нанесены изобары, отражающие равновесные парциальные давления PbO. Анализ результатов моделирования позволяет утверждать, что использование оксида свинца в качестве растворителя позволяет снизить минимальную температуру выращивания кристаллов на сечении PbO–BaFe12O19 до величины порядка 960 °C и при этом использовать возможный интервал температур порядка 500 °C. Полученные результаты будут востребованы для рационального выбора режимов выращивания кристаллов гексагональных ферритов из раствора (флюса).
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект 16-08-01043_А), а также правительства Российской Федерации (постановление № 211 от 16.03.2013 г.), соглашение №02.A03.21.0011.
Список литературы Фазовая диаграмма системы BaO-PbO-Fe2O3
- Growth and Characterization of High Purity Single Crystals of Barium Ferrite/M.A. Wittenauer, J.A. Nyenhuis, A.I. Schindler et al.//Journal of Crystal Growth. -1993. -V. 130. -P. 533-542.
- Batti, P. Equilibrium Diagram of the System BaO-Fe2O3/P. Batti//Ann. Chim. (Rome). -1960. -V. 50. -P. 1461-1478 DOI: 10.1016/0022-0248(93)90542-5
- Van Hook, H.J. Thermal Stability of Barium Ferrite (BaFe12O19)/H.J. Van Hook//Journal of the American Ceramic Society. -1964. -V. 47, № 11. -P. 579-581 DOI: 10.1111/j.1151-2916.1964.tb13821.x
- Goto, Y. On the Phase Diagram of the Condensed System BaO-Fe2O3/Y. Goto, T. Takada//Journal of the Japan Society of Powder and Powder Metallurgy. -1960. -V. 7, № 2. -P. 35-40 DOI: 10.2497/jjspm.7.35
- Ropp Richard, C. Encyclopedia of the Alkaline Earth Compounds/C. Ropp Richard. -Elsevier. -2013. -1187 p.
- Ziolowski, Z. The Pseudobinary System BaO•6Fe2O3-BaO/Z. Ziolowski//Prace Institut Hutniczych. -1962. -V. 14. -P. 155-163.
- Wohlfarth, E.P. Handbook of Magnetic Materials/E.P. Wohlfarth. -North-Holland Publishing Company. -1982. -V. 3. -862 p.
- Vinnik, D.A. Experimental Study and Thermodynamic Modeling of Phase Equilibria in the System BaO-Fe2O3/D.A. Vinnik, E.A. Trofimov, D.A. Zherebtsov//Materials Science Forum. -2016. -V. 843. -P. 16-21 DOI: 10.4028/www.scientific.net/MSF.843.16
- Vinnik, D.A. Experimental Study and Thermodynamic Modeling of Phase Equilibria in the PbO-Fe2O3 system/D.A. Vinnik, E.A. Trofimov, D.A. Zherebtsov//Materials Science Forum. -2016. -V. 870. -P. 282-285 DOI: 10.4028/www.scientific.net/MSF.870.282
- FactSage Thermochemical Software and Databases/C.W. Bale, P. Chartrand, S.A. Degterov et al.//Calphad. -2002. -V. 26, № 2. -P. 189-228 DOI: 10.1016/S0364-5916(02)00035-4
- FactSage Thermochemical Software and Databases -Recent Developments/C.W. Bale, E. Bélisle, P. Chartrand et al.//Calphad. -2009. -V. 33, № 2. -P. 295-311 DOI: 10.1016/j.calphad.2008.09.009
- Chase, M.W. NIST-JANAF thermochemical tables (4th ed)/M.W. Chase. -American Chemical Society. -1998. -1962 p.
- Heat Capacities of Some Ternary Oxides in the System Ba-Fe-O Using Differential Scanning Calorimetry/S.K. Rakshit, S.C. Parida, Smruti Dash et al.//Journal of Alloys and Compounds. -2007. -V. 438. -P. 279-284 DOI: 10.1016/j.jallcom.2006.08.026
- Термодинамическая оценка образования ферритов бария/Г.Н. Шабанова, С.Н. Быканов, И.В. Гуренко, З.И. Ткачева//Сб. научн. тр. ХГПУ «Информационные технологии: наука, техника, технология, образование, здоровье». -2007. -Т. 438. -С. 279-284.
- A Two-sublattice Model for Molten Solutions with Different Tendency for Ionization/M. Hillert, B. Jansson, B. Sundman, J. Agren//Met. Trans. A. -1985. -V. 16A, № 2. -P. 261-266 DOI: 10.1007/BF02815307
- Sundman, B. Modification of the Two-sublattice Model for Liquids/B. Sundman//Calphad. -1991. -V. 15. -P. 109-120 DOI: 10.1016/0364-5916(91)90010-H
- Moore, P.B. Crystal Structure of Magnetoplumbite/P.B. Moore, P.K.S. Gupta, Y.Le. Page//Am. Mineral. -1989. -V. 74. -P. 1186-1194.
- Vinnik, D.A. Magnetic and Structural Properties of Barium Hexaferrite BaFe12O19 from Various Growth Techniques/D.A. Vinnik, A.Yu. Tarasova, D.A. Zherebtsov et al.//Materials. -2017. -V. 10. -P. 578-588 DOI: 10.3390/ma10060578


