Фазовая диаграмма системы FeO-SrO-BaO
Автор: Самойлова Ольга Владимировна, Макровец Лариса Александровна, Бакин Игорь Валерьевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 3 т.20, 2020 года.
Бесплатный доступ
В настоящее время все активнее внедряется в производство сталей и сплавов технология рафинирования с использованием лигатур, содержащих щелочноземельные металлы, в частности, барий и стронций. Построение диаграммы состояния системы FeO-SrO-BaO представляет интерес с точки зрения анализа фазовых равновесий, реализующихся в оксидной системе, сопряженной с расплавленным металлом. В ходе настоящей работы было проведено термодинамическое моделирование фазовых равновесий с последующим расчетом координат линий ликвидус и солидус для диаграмм состояния двойных оксидных систем FeO-SrO, FeO-BaO и SrO-BaO. С использованием полученных данных по двойным оксидным системам было выполнено термодинамическое моделирование фазовых равновесий с последующим построением проекции поверхности ликвидус для диаграммы состояния тройной оксидной системы FeO-SrO-BaO. Для каждой из исследуемых систем были определены энергетические параметры теории субрегулярных ионных растворов, описывающей активности компонентов оксидного расплава. Также был определен энергетический параметр теории регулярных ионных растворов, описывающей активности компонентов твердого раствора оксидов |SrO, BaO|тв.р. Диаграммы состояния систем FeO-SrO и FeO-BaO представляют собой диаграммы эвтектического типа с одной точкой эвтектики с координатами 18,00 мол. % SrO и 1060 °С; 31,58 мол. % BaO и 1066 °С, соответственно. Система SrO-BaO характеризуется неограниченной растворимостью компонентов как в жидком, так и в твердом состоянии. Для фазовой диаграммы системы FeO-SrO-BaO отмечается обширная область равновесия оксидного расплава с твердым раствором оксидов |SrO, BaO|тв.р.
Система feo-sro-bao, термодинамическое моделирование, фазовыеравновесия, фазовые диаграммы
Короткий адрес: https://sciup.org/147233959
IDR: 147233959 | УДК: 669.18 | DOI: 10.14529/met200301
Текст научной статьи Фазовая диаграмма системы FeO-SrO-BaO
Применение барий- и стронцийсодержащих лигатур для рафинирования стали достаточно активно обсуждается в современной научной литературе [1–8]. Широкое использование данных щелочноземельных металлов (ЩЗМ) и их композиций сдерживается различными факторами, в том числе неопределенностью количественного состава сплавов с ЩЗМ, которые планируется использовать при плавках. Эти проблемы могут быть решены в рамках научного моделирования процессов взаимодействия ЩЗМ с растворами неметаллических веществ в стали с образованием в качестве продуктов взаимодействия карбидов, сульфидов или, наиболее вероятно, оксидов. Но для понимания происходящих физикохимических процессов необходимы сведения по диаграммам состояния систем, включающих оксиды бария и стронция в качестве компонентов. В литературе приводится огра- ниченное количество данных о таких оксидных системах, а для многих систем информации не имеется совсем. Ранее нами были построены диаграммы состояния для систем FeO–BaO–SiO2 [3], FeO–BaO–Al2O3 [3], FeO– MgO–SrO [8], FeO–SrO–SiO2 [9].
Целью настоящей работы является построение фазовой диаграммы системы FeO– SrO–BaO. Для этого было выполнено термодинамическое моделирование фазовых равновесий с дальнейшим расчетом координат линий ликвидус и солидус для диаграмм состояния двойных оксидных систем FeO–SrO, FeO–BaO и SrO–BaO. С использованием полученных данных по двойным оксидным системам было выполнено термодинамическое моделирование фазовых равновесий с последующим построением проекции поверхности ликвидус для диаграммы состояния тройной оксидной системы FeO–SrO–BaO.
Подробно методика термодинамического моделирования фазовых равновесий в оксидных системах приведена в монографии [10]. Для проведения расчетов необходимы сведения о температурах и энтальпиях плавления оксидов (табл. 1), а также данные о параметрах используемой для расчетов термодинамической модели (необходимо учитывать, что предлагаемая методика подразумевает использование для проведения моделирования нескольких теорий). Для расчета координат линий ликвидус и поверхности ликвидус в ходе настоящей работы была использована теория субрегулярных ионных растворов, энергетические параметры которой приведены в табл. 2. Для расчета координат линий солидус, ограни- чивающих область существования твердого раствора оксидов |SrO, BaO|тв.р в системах SrO–BaO и FeO–SrO–BaO, использовалась теория регулярных ионных растворов с энергетическим параметром Q12 = +3150 Дж/моль.
Диаграмма состояния системы FeO–SrO (рис. 1) была построена нами ранее [8, 9] и хорошо согласуется с литературными данными [15]. Это диаграмма эвтектического типа с одной точкой эвтектики с координатами 18,00 мол. % SrO и 1060 °С (см. рис. 1).
Экспериментальных сведений о виде фазовой диаграммы системы FeO–BaO, а также о возможности образования твердых растворов или соединений в данной системе в литературе не имеется. Наиболее простым алго-
Таблица 1
Данные о температурах и энтальпиях плавления оксидов
|
Оксид |
Температура плавления, °С |
Энтальпия плавления, Дж/моль |
|
FeO |
1378 [11] |
33 470 [12] |
|
SrO |
2532 [13] |
80 950 [13] |
|
BaO |
1925 [11] |
57 768 [14] |
Таблица 2
Энергетические параметры теории субрегулярных ионных растворов
|
Система |
Энергетические параметры Q ijkl , Дж/моль |
||
|
FeO–SrO [8] |
Q 1112 = –71 828 |
Q 1122 = –22 026 |
Q 1222 = –20 905 |
|
FeO–BaO |
Q 1113 = –22 505 |
Q 1133 = –35 041 |
Q 1333 = –27 933 |
|
SrO–BaO |
Q 2223 = –19 193 |
Q 2233 = –36 625 |
Q 2333 = –9363 |
|
FeO–SrO–BaO |
Q 1123 = –139 162 |
Q 1223 = –90 793 |
Q 1233 = –101 819 |
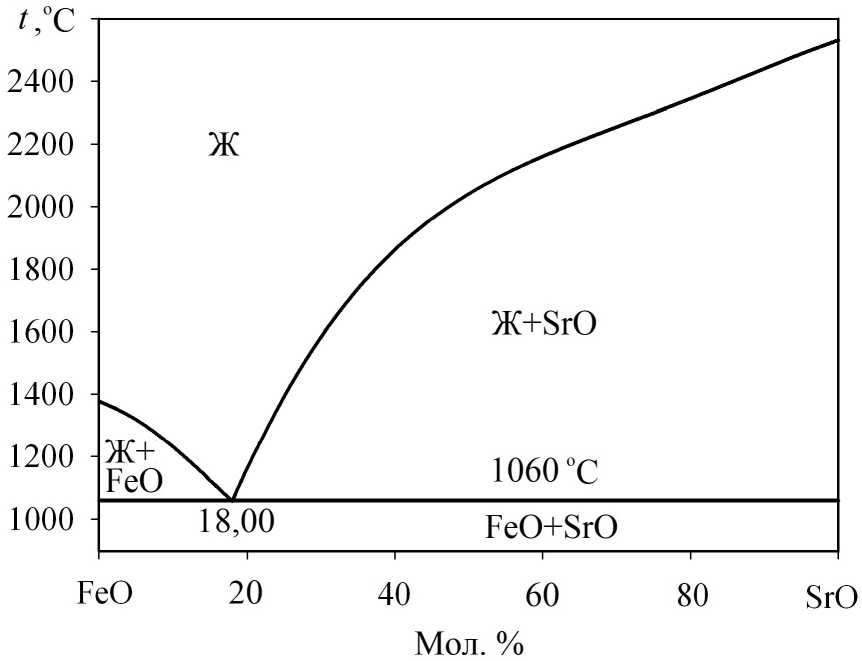
Рис. 1. Диаграмма состояния системы FeO–SrO: результаты моделирования [8]
ритмом в подобных случаях [10] является описание системы в виде диаграммы состояния эвтектического типа с одной точкой эвтектики (рис. 2). Координаты точки эвтектики в системе FeO–BaO согласно проведенным в ходе настоящей работы расчетам составляют 31,58 мол. % BaO и 1066 °С (см. рис. 2).
Для системы SrO–BaO имеются литературные экспериментальные данные о наличии непрерывного ряда твердых растворов при температурах выше 1083 °C [16]. Также в литературе есть результаты расчетов [17, 18], согласно которым фазовая диаграмма системы SrO–BaO характеризуется неограниченной растворимостью как в жидком, так и в твердом состоянии.
Результаты моделирования, проведенного в ходе настоящей работы, диаграммы состояния системы SrO–BaO представлены на рис. 3. Вид фазовой диаграммы хорошо согласуется
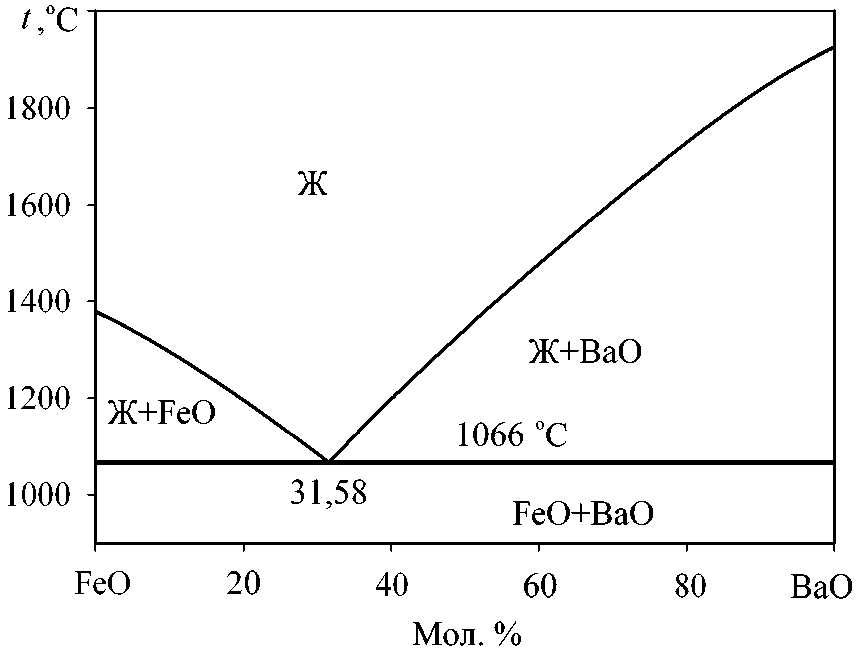
Рис. 2. Диаграмма состояния системы FeO–BaO: результаты моделирования
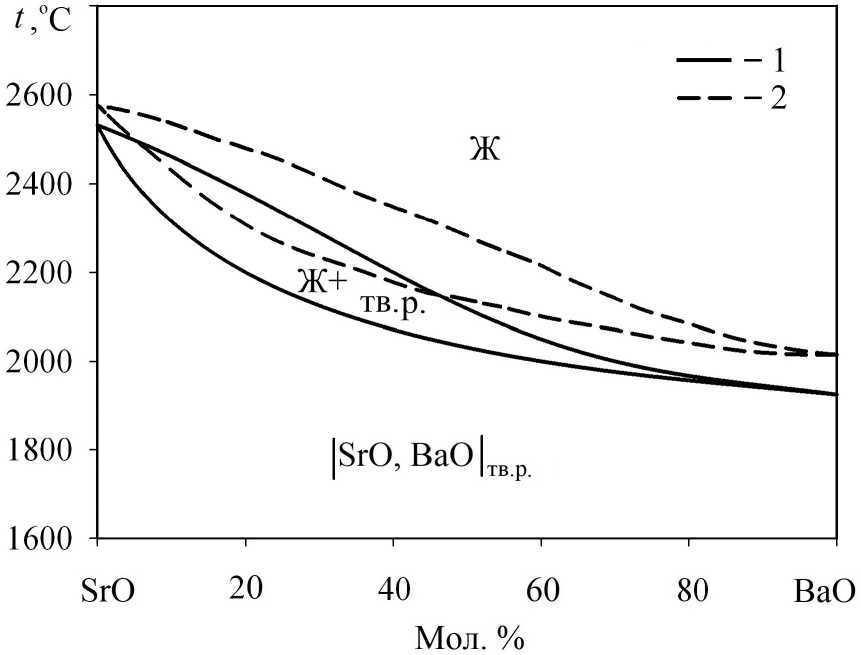
Рис. 3. Диаграмма состояния системы SrO–BaO:
1 – результаты моделирования; 2 – расчетные данные R. Zhang et al. [18]
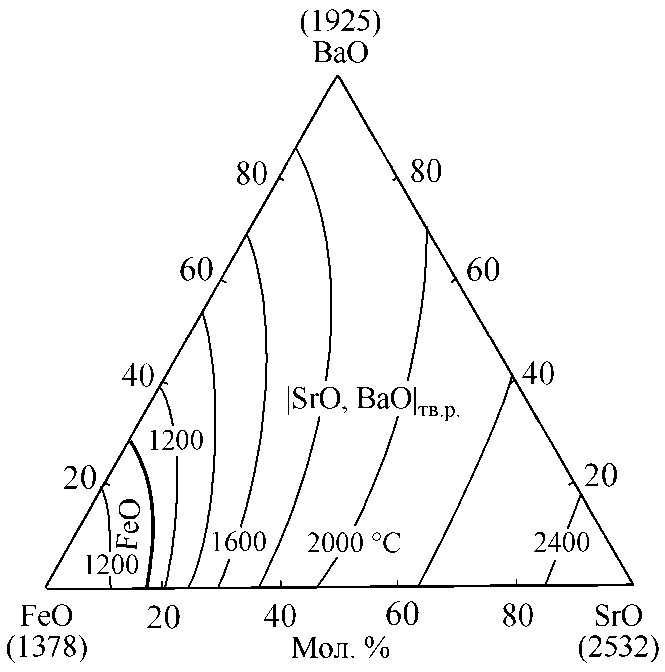
Рис. 4. Диаграмма состояния системы FeO–SrO–BaO: результаты моделирования поверхности ликвидус
с ли те р атурн ы м и расч е тными да н ны м и [ 18 ] , а имеющиес я р аз л ич и я по коо рдин а та м л и ний ли кви д у с и с о ли д ус м о жн о о тне с ти к ра з л и чи я м в и с хо д н ы х д а н ных п о те м пе ра тура м плавления чистых оксидов Sr O и BaO. Можно также о тм е ти ть, ч то по л уче н н а я л ин з а а с си- м е три ч на : д ля бол ь ш и х ко н це н тра ц и й о к с ида стр о нц и я дву х ф а зн а я об л а с т ь ра вн о вес и я «жидкость – тв е рдый р а створ о кс идов» д ос таточно обширн а, а при мал ы х к он ц ен тр ац и я х окс и да с тр он ци я л и ни и ли к в иду с и с ол и д ус пр а ктическ и сл и ваются. Э то о з н а ча е т, ч то кристалли з а ц ия в облас тях, о б о г ащ е нны х BaO , и м е е т п ракти че с ки нул е вой и н тер ва л.
Д анные по д иа грамм е со ст о я ния в сист ем е FeO–SrO–BaO в лите рату ре не пр ед ст авл ены. Тер м одинам ич еск ое м оде лир ование по вер хн о ст и лик в ид ус данной тройной оксид ной систе мы в х оде насто я щей работ ы в ыпо лня л ось на о снов е по л у ч ен ных пр едст ав лений о фазовы х р авно весиях в д в ойных ок сид ны х сис т ем ах (см. рис. 1–3). Результаты м о д ел иро вания по в ерх ност и л ик в иду с сис т ем ы FeO–SrO–BaO пр ед ст ав лены на рис. 4. Н а диаграмм у на несе ны изо термическ ие сечения в инт ерв але те мператур 1200–2400 ° С с шаго м в 200 г раду сов .
Минимальная температура на поверхности ликвидус системы FeO–SrO–BaO согласно расчетам составляет 1040,6 °С для состава 74,46 мол. % FeO, 11,50 мол. % SrO и 14,04 мол. % BaO.
Диаграмма состояния данной тройной оксидной системы характеризуется обширной областью равновесия оксидного расплава с твердым раствором оксидов |SrO, BaO| тв.р . При увеличении содержания оксидов стронция и бария достаточно резко увеличивается температура плавления в системе.
Выводы
Выполнено термодинамическое моделирование диаграмм состояния двойных оксидных систем FeO–SrO, FeO–BaO и SrO–BaO. Полученные результаты по положению линий ликвидус и солидус хорошо согласуются с немногочисленными разрозненными сведениями, представленными в литературе для этих систем. На основании полученных данных по двойным оксидным системам выполнен расчет координат поверхности ликвидус тройной оксидной системы FeO–SrO–BaO.
Список литературы Фазовая диаграмма системы FeO-SrO-BaO
- Скок, Ю.Я. Исследование раскислительной способности комплексных сплавов, содержащих ЩЗМ и РЗМ/Ю.Я. Скок //Процессы литья. - 2010. - № 3 (81). - С. 8-12.
- Перспективы применения барийсодержащих лигатур для раскисления и модифицирования транспортного металла /К.В. Григорович, К.Ю. Демин, А.М. Арсенкин, А.К. Гарбер //Металлы. -2011. - № 5. - С. 146-156.
- Михайлов, Г.Г. Барий как раскислитель и модификатор жидкой стали / Г.Г. Михайлов, Л.А. Макровец, Д.А. Выдрин // Вестник ЮУрГУ. Серия «Металлургия». - 2013. - Т. 13, № 1. -С. 45-50.
- Критерии оценки качества раскислителей и модификаторов для стали / И.В. Рябчиков, B.Г. Мизин, Р.Г. Усманов и др. // Сталь. - 2015. - № 2. - С. 24-27.
- Модифицирование стали барием и стронцием /И.Д. Рожихина, О.И. Нохрина, В.И. Дмитриенко, М.А. Платонов // Известия высших учебных заведений. Черная металлургия. - 2015. -Т. 58, № 12. - С. 871-876. DOI: 10.17073/0368-0797-2015-12-871-876
- Модификатор для внепечной обработки стали, содержащий щелочноземельные металлы / И.Б. Проворова, Е.В. Розенберг, К.Э. Барановский и др. // Литье и металлургия. - 2016. -№ 2 (83). - С. 14-18.
- Экспериментальное исследование рафинирования и модифицирования стали сплавами Si-Ca, Si-Sr и Si-Ba / И.В. Бакин, Н.А. Шабурова, И.В. Рябчиков и др. // Сталь. - 2019. - № 8. - C. 14-18.
- Термодинамический анализ раскислительной способности стронция в жидком железе: диаграмма стабильности фаз в системах Fe-Sr-O и Fe-Mg-Sr-O / Г.Г. Михайлов, Л.А. Макровец, О.В. Самойлова, И.В. Бакин // Черная металлургия. Бюллетень научно-технической и экономической информации. - 2019. - Т. 75, № 12. - С. 1366-1373. DOI: 10.32339/0135-5910-2019-121366-1372
- Самойлова, О.В. Термодинамическое моделирование фазовых равновесий в оксидной системе FeO-SrO-SiO2 / О.В. Самойлова, Л.А. Макровец, И.В. Бакин // Вестник ЮУрГУ. Серия «Металлургия». - 2019. - Т. 19, № 4. - С. 10-18. DOI: 10.14529/met190402
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем / Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. - М. : Издат. Дом МИСиС, 2009. - 520 с.
- Кубашевский, О. Металлургическая термохимия / О. Кубашевский, С.Б. Олкокк. - М. : Металлургия, 1982. - 392 с.
- Darken, L.S. The system iron-oxygen. II. Equilibrium and thermodynamics of liquid oxide and other phases / L.S. Darken, R. W. Gurry // Journal of American Chemical Society. - 1946. - Vol. 68. -P. 798-816.
- Иргашов, Х. Термодинамические свойства оксида стронция в твердой и жидкой фазах / Х. Иргашов, В.Д. Тарасов, В.Я. Чеховской // Теплофизика высоких температур. - 1985. - Т. 23, № 1. - С. 86-91.
- Физико-химические свойства окислов. Справочник / под ред. Г.В. Самсонова. - М. : Металлургия, 1969. - 456 с.
- Revzin, B. Model evaluations of phase diagrams of the systems SrO-(Mn, Fe, Co, Ni)O / B. Revzin, J. Pelleg // Materials Research Society Symposium Proceedings. - 1996. - Vol. 398. -P. 649-654.
- Jacob, K. T. Solid-state miscibility gap and thermodynamics of the system BaO-SrO / K. T. Jacob, V. Varghese // Journal of Materials Chemistry. - 1995. - Vol. 5, no. 7. - P. 1059-1062.
- Binary alkaline earth oxide mixtures: estimation of the excess thermodynamic properties and calculation of the phase diagrams / W.J.M. van der Kemp, J.G. Blok, P.R. van der Linde et al. // Calphad. - 1994. - Vol. 18, no. 3. - P. 255-267. DOI: 10.1016/0364-5916(94)90032-9
- Zhang, R. Thermodynamic descriptions of the BaO-CaO, BaO-SrO, BaO-SiO2 and SrO-SiO2 systems / R. Zhang, H. Mao, P. Taskinen // Calphad. - 2016. - Vol. 54. - P. 107-116. DOI: 10.1016/j. calphad.2016.06.009


