Фазовая диаграмма системы Na-Na2O
Автор: Зайцева Ольга Владимировна, Трофимов Евгений Алексеевич, Самойлова Ольга Владимировна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Металловедение и термическая обработка
Статья в выпуске: 2 т.18, 2018 года.
Бесплатный доступ
Фазовые равновесия в системе Na-O представляют интерес в связи с тем, что металлический натрий широко используется в ядерных реакторах в качестве теплоносителя. Целью работы стало термодинамическое моделирование системы Na-O в области Na-Na2O и построение фазовой диаграммы этой системы. В ходе работы проанализированы имеющиеся экспериментальные данные о растворимости кислорода в жидком натрии. Используя литературные данные, в ходе нашей работы осуществлено моделирование фазовых равновесий и расчёт координат фазовой диаграммы области Na-Na2O. В процессе проведённой работы для расчётов использованы возможности программного комплекса FactSage. Использованы данные базы SGPS (SGTE pure substances database) о стандартных энтальпиях образования, стандартных энтропиях и параметрах фазовых переходов, а также температурных зависимостях молярных теплоёмкостей для твёрдых и жидких веществ, образующих систему твёрдого и жидкого Na, кристаллических модификаций Na2O и его расплава. Моделирование расплава Na-Na2O выполнено посредством двухподрешёточной модели ионной жидкости. Параметр взаимодействия для этой модели, температурная и концентрационная зависимость которого выражена посредством полинома Редлиха - Кистера, определён в ходе работы. Согласно результатам моделирования система Na-O в области Na-Na2O характеризуется наличием области расслаивания на две жидких фазы. Координаты критической точки: температура 2457 К, содержание кислорода ~26 ат. %. Крайняя левая точка кривой расслаивания на две жидкие фазы характеризуется следующими координатами: температура 1405 К, содержание кислорода ~4,8 ат. %.
Натрий, кислород, фазовая диаграмма, термодинамическое моделирование
Короткий адрес: https://sciup.org/147157133
IDR: 147157133 | УДК: 669.017.11 | DOI: 10.14529/met180205
Текст научной статьи Фазовая диаграмма системы Na-Na2O
Фазовые равновесия в системе Na–O представляют интерес, поскольку металлический натрий широко используется в ядерных реакторах в качестве теплоносителя. В процессе эксплуатации натрий может вступать (прежде всего в аварийных ситуациях) во взаимодействие как с газообразным кислородом, так и с различными оксидными фазами. В ходе изучения такого взаимодействия важное место занимает исследование условий сосуществования металлической фазы с оксидными фазами в этой системе.
Целью настоящей работы стало термодинамическое моделирование системы Na–O в области Na–Na 2 O и построение фазовой диаграммы этой системы.
Изучению системы Na–O посвящено множество работ. Подробный обзор, сделанный H.A. Wriedt [1], показывает, однако, что область Na–Na2O исследована недостаточно и только в части растворимости кислорода в жидком натрии при температурах ниже 900 К. Очевидно, это связано с серьёзными трудностями экспериментального изучения этой системы, особенно возрастающими при повышении температуры. Вместе с тем та область, которая стала объектом внимания исследователей, изучена достаточно хорошо. В литературе [2–9] представлена информация о сотнях экспериментально определённых значениях растворимости кислорода в натрии. В работе [2] приводятся 17 литературных зависимостей растворимости (в мас. %) кислорода в натрии от температуры, полученных для различных интервалов температур от 110 до 555 °С, а также результаты обобщения собственных экспериментальных данных.
Обобщение результатов экспериментальных работ (107 экспериментальных точек из литературы) позволило автору работы [3] ре-
комендовать следующую зависимость
lg X O =
- 2447
T
+ 0,396.
Автор работы [4], анализируя результаты 268 измерений различных авторов, рекомен-
дует следующую зависимость
-2444 5
lg X о + 0,4145-
Автор [5] в ходе анализа собственных и литературных данных получил следующую
зависимость
lg X о =
- 2372
T
+ 0,32
Надо сказать, что результаты большей части проведённых исследований хорошо соотносятся между собой, о чём, в частности, позволяет судить рис. 1, на котором показаны результаты расчёта по трём приведённым зависимостям для интервала температур 400–833 К,
а также в виде точек представлена некоторая часть экспериментальных данных о растворимости кислорода в натрии в зависимости от температуры.
Представленная в обзоре [1] фазовая диаграмма для области Na–Na 2 O носит схематический характер и в значительной степени опирается на предположения. Используя зависимость из работы [4], а также предположения о виде фазовой диаграммы анализируемой системы, приводимые автором работы [1], в ходе нашей работы осуществлено моделирование фазовых равновесий и расчёт координат фазовой диаграммы этой системы для области Na–Na 2 O (рис. 2). Отметим, что расчёт проведён без учёта фазовых равновесий с участием газовой фазы, т. е. для условий, когда давление в системе обеспечивает существование только конденсированных фаз и при этом не влияет на положение границ между конденсированными фазами.
В процессе проведённой работы для расчётов использован программный комплекс FactSage [10–12] версия 7.0. Расчёт фазовой диаграммы проводился посредством модуля «Phase Diagram», формирование базы индивидуальных веществ – с помощью модуля «Compound», а формирование базы термодинамических параметров для описания фаз
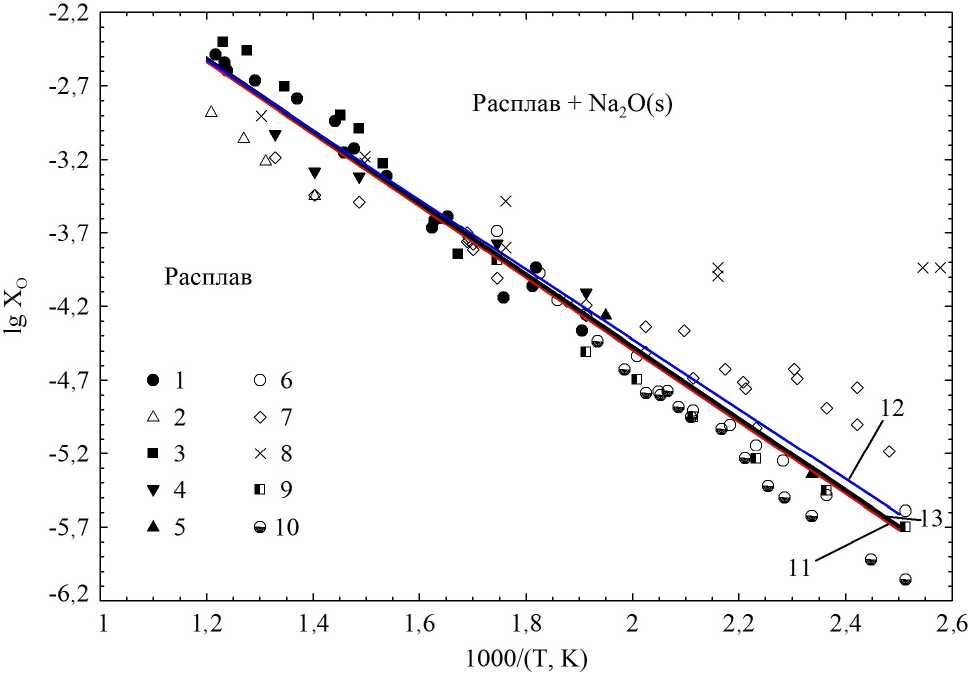
Рис. 1. Растворимость кислорода в натрии для интервала температур 400–833 K: 1 – S.L. Walters (1950) согласно [3]; 2 – A.D. Bogard и D.D. Williams (1951) согласно [3]; 3 – J.D. Noden и K.Q. Bagley (1954) согласно [3]; 4 – S. Dorner (1966) согласно [3]; 5 – K.S. Bergstresser и др. (1965) согласно [3]; 6 – V.J. Rutkauskas и G.E. Meadows (1967) согласно [3]; 7 – [6]; 8 – [7]; 9 – [8]; 10 – [9]; 11 – расчёт по зависимости из [3]; 12 – расчёт по зависимости из [5]; 13 – расчёт по зависимости из [4], результаты которого практически совпадают с результатами моделирования, проведённого в ходе настоящей работы
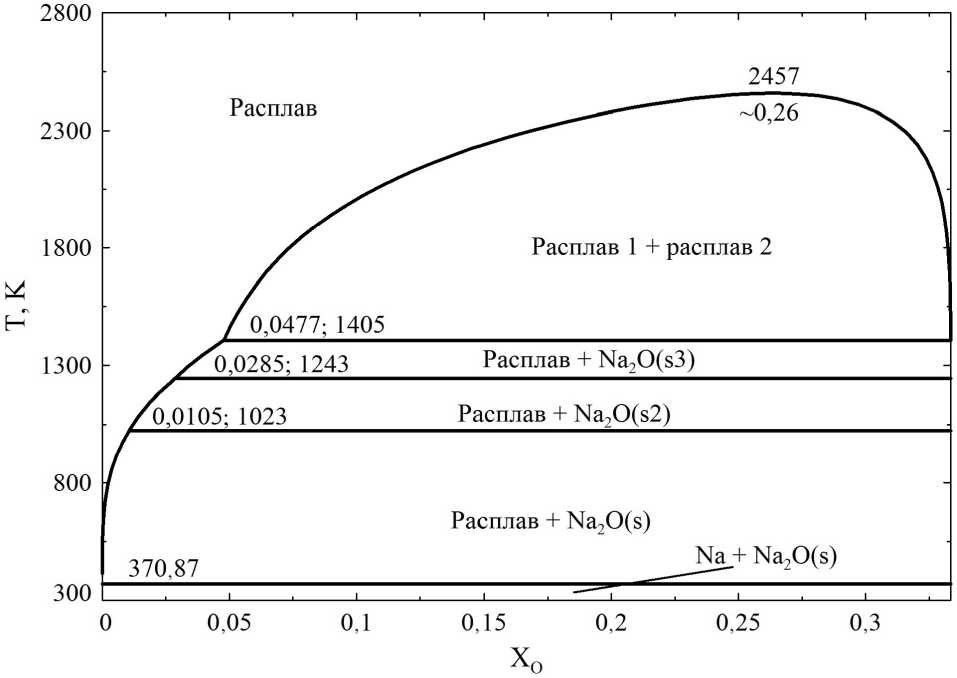
Рис. 2. Фазовая диаграмма системы Na–Na 2 O. Результаты расчёта для конденсированных фаз
переменного состава – с помощью модуля «Solution».
Данные для расчёта энергий Гиббса твёрдых и жидких веществ, образующих систему твёрдого и жидкого Na, кристаллических модификаций Na 2 O (α, β и γ формы с кристаллами кубической сингонии) и его расплава заимствованы из базы данных SGPS [13]. К заимствованным данным относятся стандартная энтальпия образования, стандартная энтропия и параметры фазовых переходов, а также температурные зависимости молярных теплоёмкостей этих веществ при условии постоянства давления.
Для моделирования расплава Na–Na 2 O использовалась двухподрешёточная модель ионной жидкости, описанная в работах [14, 15]. Формула ионной жидкости для данного расплава приняла следующий вид:
(Na+) p (O–2, Va– q ) q ; (1)
q = У Na + = 1; (2)
p = 2 У O - 2 + qy Va = 2 У O - 2 + y Va . (3) Здесь Va – вакансия; y s – доля компонента s в катионной или анионной подрешётке. Избыточная энергия Гиббса согласно используемой модели рассчитывается по формуле
G m У Na + У O - 2 У Va L Na + :O - 2,Va
= У O - 2 У Va L Na + :O - 2 ,Va , (4) где L – параметр взаимодействия, температурная и концентрационная зависимость которого выражены посредством полинома Ред-лиха – Кистера. В настоящей работе эта зависимость определена следующим образом:
L Na + :O 2 - ,Va - = 92699 " 21,33 T +
+ ( 107912 - 60,71 T + 3-KT6 T 3 )( У O 2 - - У Va - ) . (5)
В процессе расчёта фазовых диаграмм предусматривалась возможность одновременного сосуществования двух жидких фаз.
О качестве проведённого моделирования позволяет судить рассчитанная линия растворимости кислорода в натрии, представленная на рис. 1.
Крайняя левая точка кривой расслаивания на две жидкие фазы на рассчитанной нами диаграмме (см. рис. 2) характеризуется более высоким содержанием кислорода в системе, нежели показано на диаграмме в работе [1] (~ 4,8 ат. % против 4,7 ат. %). Поскольку экспериментальные данные для условий гипотетического монотектического равновесия отсутствуют, а значение 4,7 ат. % получено экстраполяцией экспериментальных значений, полученных в интервале температур от 114 до 555 °С на область температур порядка 1130 °С, указанное расхождение вряд ли можно считать существенным недостатком проведённого моделирования.
Заключение
В ходе исследования, опираясь на представленные в литературе экспериментальные данные, осуществлено термодинамическое моделирование фазовых равновесий в системе Na–Na 2 O. Получен набор модельных параметров. Рассчитана фазовая диаграмма исследованной системы.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 16-38-60144 мол_а_дк.
Список литературы Фазовая диаграмма системы Na-Na2O
- Wriedt H.A. The Na-O (Sodium-Oxygen) System//Bulletin of Alloy Phase Diagrams, 1987, vol. 8, no. 3, pp. 234-246 DOI: 10.1007/BF02874915
- Alcock C.B. and Stavropoulos G.P. Galvanic Cell Measurements on the Sodium-Oxygen System//Can. Metall. Q., 1971, vol. 10, no. 4, pp. 257-265 DOI: 10.1179/cmq.1971.10.4.257
- Eichelberger R.L. Solubility of Oxygen in Liquid Sodium. U.S. At. Energy Comm. Rep. AI-AEC-12685, 1968 DOI: 10.2172/4808140
- Noden J.D. General Equation for the Solubility of Oxygen in Liquid Sodium. Addendum//J. Br. Nucl. Energy Soc., 1973, vol. 12, no. 3, pp. 329-331.
- Claxton K.T. Solubility of Oxygen in Liquid Sodium and the Interpretation of Predictions for the Corrosion Rate of Stainless Steels in Liquid Sodium. Junta Energ. Nucl. (Spain), Rep. JEN-446, 1979. (in Spanish)
- Beisswenger H., Dorner S. Solubility of Oxygen in Liquid Sodium//J. Nucl. Mater., 1968, vol. 28, no. 3, pp. 297-302 DOI: 10.1016/0022-3115(68)90196-7
- Salmon N. and Cashman T.J. The Solubility of Sodium Monoxide in Liquid Sodium, KAPL-1653, 1956.
- De la Torre Cabezas M. Behavior of Oxygen in Liquid Sodium. Junta Energ. Nucl. (Spain), Rep. JEN-310, 1975. (in Spanish)
- Smith D.L. and Lee R.H. Characterization of the Vanadium-Wire Equilibration Method for Measurement of Oxygen Activity in Liquid Sodium. Argonne Natl. Lab Rep. ANL-7891 Argonne, IL, 1972.
- Bale C.W., Chartrand P., Degterov S.A., Eriksson G., Hack K., Ben Mahfoud R., Melançon J., Pelton A.D., Petersen S. FactSage Thermochemical Software and Databases//Calphad, 2002, vol. 26, no. 2, pp. 189-228 DOI: 10.1016/S0364-5916(02)00035-4
- Bale C.W., Bélisle E., Chartrand P., Decterov S.A., Eriksson G., Hack K., Jung I.-H., Kang Y.-B., Melançon J., Pelton A.D., Robelin C., Petersen S. FactSage Thermochemical Software and Databases -Recent Developments//Calphad, 2009, vol. 33, no. 2, pp. 295-311 DOI: 10.1016/j.calphad.2008.09.009
- Bale C.W., Bélisle E., Chartrand P., Decterov S.A., Eriksson G., Gheribi A.E., Hack K., Jung I.-H., Kang Y.-B., Melançon J., Pelton A.D., Petersen S., Robelin C., Sangster J., Spencer P., Van Ende M.-A. FactSage thermochemical software and databases, 2010-2016//Calphad, 2016, vol. 54, no. 1, pp. 35-53 DOI: 10.1016/j.calphad.2016.05.002
- SGPS database (SGTE pure substances database), FactSage 7.0.
- Hillert M., Jansson B., Sundman B., Agren J. A Two-Sublattice Model for Molten Solutions with Different Tendency for Ionization//Met. Trans. A, 1985, vol. 16A, pp. 261-266 DOI: 10.1007/BF02816052
- Sundman B. Modification of the Two-Sublattice Model for Liquids//Calphad, 1991, vol. 15, no. 2, pp. 109-119 DOI: 10.1016/0364-5916(91)90010-H


