Фазовые превращения в жидкой магнийсодержащей стали
Автор: Михайлов Г.Г.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 3 (43), 2005 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/147156529
IDR: 147156529 | УДК: 669.017.3
Текст обзорной статьи Фазовые превращения в жидкой магнийсодержащей стали
Широкое внедрение в практику металлургии новых технологий рафинирования и доводки стали с использованием агрегатов печь - ковш, циркуляционного и порционного вакуумирования, разливки стали под уровень с использованием рафинирующих шлакообразующих смесей казалось бы должны снять проблему неметаллических включений в стали. На массовых углеродистых и низкоуглеродистых конструкционных марках стали, электротехнических и сталях для производства автомобильного листа многие проблемы действительно сняты, благодаря стандартизации технологии выплавки, рафинирования и разливки. Однако неизбежный контакт с футеровкой разливочных и промежуточных ковшей, транспорт кислорода через футеровку, защитный шлак, достаточно быстро приводят металл к равновесным концентрациям по кислороду по отношению к сопряженным фазам. В связи с этим избежать образования вторичных и третичных включений вряд ли удастся. Сохраняется, несомненно, и часть первичных включений, не удалившихся в процессе рафинирующей продувкипорош-ковыми смесями или аргоном. Поэтому целью рафинировочного цикла производства стали по-прежнему остается обеспечение стабильных эксплуатационных свойств стали путем обеспечения необходимой макроструктуры стали, благоприятного фазового состава, размеров и распределения неметаллических включений.
С одной стороны, в научной литературе накоплен огромный экспериментальный материал по процессам взаимодействия кислорода, углерода, азота, серы и фосфора с компонентами реальных металлических расплавов, с другой стороны, в виду сложности в целом этих высокотемпературных физико-химических систем, многие задачи решаются дедуктивными методами с получением качественной и не всегда однозначной картины процесса, к которой приходят от общих представлений. В данной статье делается попытка представить некую схему решения проблемы фазовых равновесий в сложных высокотемпературных системах. Вообще говоря, имеется возможность проведения термодинамических исследований процессов раскисления стали в условиях существования многокомпонентных металлических расплавов. При этом допускается следующее.
-
1. Имеющаяся база термодинамических данных в основном позволяет с определенной степенью достоверности определять термодинамические функции элементарных реакций сталеварения.
-
2. Имеющиеся разработки по теории фаз переменного состава, твердых и жидких растворов, шлаковых расплавов дают возможность рассчиты
вать активности составляющих эти фазы компонентов.
В настоящее время имеются обширные сведения о параметрах взаимодействия, теплотах и энергиях смешения, стандартных теплотах образования и т.д., которые можно использовать при проведении термодинамических расчетов. Наибольшей информационной способностью при термодинамическом анализе физико-химических систем обладают диаграммы состояний. Для анализа сталеплавильных процессов предлагается метод построения так называемых поверхностей растворимости компонентов в жидком металле (ПРКМ), описанный в работах [1-3].
При выплавке стали в печи жидкий металл приходит в контакт с магнезиальной футеровкой, набивной подиной или доломитовой заправкой стен конвертеров или ковшей. В шлаках сталеплавильных производств содержание MgO доходит до 12-15 %. Кроме того, в некоторых технологиях применяется специально раскисляющие комплексы, содержащие магний [4, 5]. В таком случае представляет интерес рассмотреть роль магния в процессах образования неметаллических включений в стали, тем более что практически в любой стали основного процесса в том или ином виде имеются включения, содержащие магний.
В соответствии с принципами построения ПРКМ состав неметаллических и оксидных фаз определяется сопряженной с областью существования жидкого металла оксидной системой. Если железо раскисляется, например, магнием, такой оксидной системой является диаграмма состояния FeO-MgO, если металл раскисляется кремниймагниевой лигатурой, то состав оксидных фаз определяется на диаграмме состояний FeO-MgO-SiO2, а в частных случаях возможно равновесие с оксидами диаграммы SiO2-SiO и т.д. Такой подход позволяет построить систему определения природы основных фазовых равновесий при взаимодействии компонентов металлического расплава с кислородом. На рис. 1а приведена диаграмма состояния Fe-Mg-O, а на рис. 16 система FeO-MgO, являющаяся квазибинарным сечением диаграммы состояний Fe-Mg-O.
При глубоком раскислении стали отмечается и рост концентрации магния в жидкой стали и участие оксида магния в формировании неметаллических включений, жидкооксидных, шпинельных и силикатных [5]. В целом процессы взаимодействия кислорода с компонентами металлических расплавов, содержащих так же и микропримеси магния слабо описаны в литературе [6].
-7 -6 -5 -4 -3 -2 lg[Mg]
Рис. 1. ПРКМ системы Ее-Мд-О: С^д - 0,1 МПа; d,d4 -0,2 МПа
В соответствии с принципами построения поверхностей растворимости компонентов в жидком металле (ПРКМ) состав равновесных с жидким металлом неметаллических фаз определен на равновесной с жидким металлом сопряженной оксидной системой, опирающейся на жидкий оксид железа, близкий по составу к FeO. Так состав продуктов раскисления железа магнием определяется на диаграмме состояний FeO-MgO и MgO-Mg. Если в раскислении принимают участие магний и алюминий, то продукты раскисления определяются на диаграммах FeO - MgO - А12О3 и в зависимости от содержания магния и алюминия, возможна реализация равновесий жидкого металла с системами MgO-Mg, А12О3 - А1 и т.д. Такой подход позволяет систематизировать отдельные сведения по реакциям рафинирования, связать состав металла с составом равновесных оксидных фаз и отсюда сделать практически важные рекомендации и выводы.
При взаимодействии магния с кислородом в жидкой стали протекающие процессы могут быть описаны следующими реакциями:
|
(FeO) = [Fe]+[O]; |
>Ho] . a(FeO) |
(1) |
|
[MgO) = [Mg]+[O]; |
a(MgO) |
(2) |
|
lFeO|TBp =[Fe] + [O]; |
к 1У321. >°L.P |
(3) |
|
|MgO|TB.p=[Mg] + [O]; |
Л(4) ~ ~ ’ |
(4) |
|
{Mg} = [Mg]; |
K _ >g] . \5) - p ’ "{Mg} |
(5) |
|
Mg« = {Mg}; |
A(6) = ^Mg} • |
(6) |
Если в стали еще есть и углерод, то необходимо учесть так же возможность протекания реакций [С]+[О] = {СО}т; £(7)=2М_; (7)
а[с]а[о]
-
[С] + 2[О] = {СО2}го; К^=^-. (8)
Свойства твердых растворов FeO в MgO близки к идеальным, оксидный расплав FeO-MgO, принят субрегулярным. В частности, ^ °(FeO) = lo X] + £Зх2Х2 й 112 + XjX2 (2 - ЗХ! )й122 + +х23(1-Зх])Й222]/(^), (9)
-
111 ^MgO) = In Хз +[х^(1 - Зхз) Q ] 12 -ьх^Хз (2 -3X2) Q122 + +Зх12Х22Й222]/(^), . (Ю)
где X] - ионная доля катионов железа в расплаве оксидов; х2 - ионная доля катионов магния в расплаве оксидов, ОуН - энергетические параметры теории; Т - температура, К. йш =-10450 Дж/моль; йц22 =-20900 Дж/моль; Q.xm =-10450 Дж/моль.
Приведенные данные позволяют рассчитать все составляющие многомерной поверхности растворимости компонентов в жидком металле системы Fe-Mg-O. Так, если в равновесии находятся жидкий металл и оксидный расплав (FeO, MgO), то необходимо рассмотреть реакции (1) и (2). Можно задаться температурой и составом жидкого шлака, например, учитывая при этом очевидные нормировочные соотношения
[Fe] + [Mg] + [О] =100 %; (11)
X(Fe2+)+X(Mg2+)=L (12)
По заданному значению ^Fe2+j определяется из (12) ^Mg2+p а следовательно, и ^FeOj и a(MgO) из (9, 10). Из уравнений (1,2) определяется a^Oj и a^Mgj.
При проведении расчетов использовались следующие значения констант равновесия:
lg£(8) =^-2,51.(20)
Активности кислорода и магния в железе связаны с составом металла выражениями:
lga[o]=lg[O] + e°[O] + ^s[Mg];(21)
lg«[Mg] =lg[Mg]+^g [O]+e^[Mg],(22)
где eg =-0,2; e^8 = -1,98; e^g =-3,008;
eMg =-0,085.
Далее из (2) и (22) определялись концентрации магния и кислорода в стали.
Некоторые результаты таких расчетов приведены на рис. 1 в виде набора изотермических сечений ПРКМ, изотерм раскислительной способности. Изотермы в области I определяют состав металла, находящегося в равновесии с жидкими оксидами (FeO, MgO). Такая фаза, в зависимости от температуры, может выделяться из металла в качестве избыточной при содержании магния до 0,0001 мае. % и высокой концентрации кислорода. Это фактически нераскисленный металл. В области II изотермы определяют составы металла, равновесного с твердыми растворами FeO-MgO, при концентрации магния в металле более 0,0001 мае. %, фактически с чистым MgO. Далее необходимо учитывать, что при температурах сталеварения магний обладает высокой упругостью пара и по различным данным [7] составляет от 1,8 до 2,5 МПа, растворимость магния в железе при этом изменяется от 0,004 до 0,1 мае. %. Низкая растворимость магния в металле, высокая упругость пара приводит к своеобразному виду изотермы раскислительной способности магния. Схема фазовых равновесий представлена на рис. 1а. Следует учесть, что на ПРКМ (рис. 1) римские цифры отнесены только к составу металла, а на рис. 1а римскими цифрами обозначены области гетерогенных равновесий. Так, например, в области II на рис. 1 заданы составы металла ([О] и [Mg]), равновесного с твердыми оксидами, а на рис. 1а область IV - это область существования двух фаз - жидкого металла состава дс4 и растворов оксидов состава 34. Металл состава ка находится в равновесии с оксидными расплавами переменного состава (FeO, MgO), на участке 1-2 диаграммы FeO-MgO. Металл состава точки а находится в равновесии с жидкими оксидами и твердыми растворами FeO в MgO. Металл состава ас4 находится в равновесии с твердыми растворами FeO-MgO. В точке с4 задан состав металла, равновесного с MgO и паром Mg. Точка с4 при температуре 1823 К характеризует предельную растворимость магния в железе при давлении 0,10 МПа. На участке изотермы с4с5 заданы составы металла, равновесного с парами чистого магния. При давлении, отвечающем давлению конденсации паров магния, на т4/и5 задан состав металла, равновесного с жидким магнием. В области IV восстановительный потенциал магния в металле настолько велик, что MgO в равновесии с металлом существовать не может, он будет восстанавливаться. По расчетам в точке с4 концентрация магния может составлять 0,0015 мае. %, в точке с3 - 0,001 мае. %. Концентрация кислорода при этом в металле может составлять порядка 0,0003 мае. %. Такие концентрации кислорода могут быть получены в настоящее время при вакуумировании стали или при комплексном раскислении одновременно кальцием и алюминием. В этом случае восстановление магния из футеровки глу-бокораскисленной сталью возможно.
На рис. 2 представлена ПРКМ системы Fe-Mg-C-O, своеобразная термодинамическая модель раскисления стали магнием и углеродом. Четырехкомпонентная система может быть описана только изотермическими сечениями ПРКМ, поэтому диаграмма на рис. 2 отнесена к температуре 1873 К. Контрастными линиями нанесены границы фазовых равновесий, тонкими линиями представлены составы металла с равной концентрацией кислорода, изокислородные сечения ПРКМ.
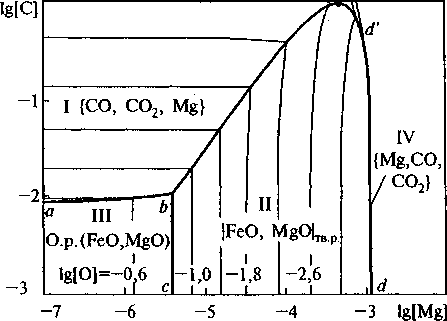
Рис. 2. ПРКМ системы Fe-Mg-C-O, Т = 1873 К; Робщ = 0Л МПа
Итак, в области I заданы составы металла, равновесного с газовой фазой, состоящей из СО, СО2 и примеси паров магния. В основном газовая фаза состоит из СО. Примесь СО2 и паров магния - незначительна. В области II заданы составы металла, равновесного с твердыми растворами FeO в MgO. В области III при исчезающе малых концентрациях магния в металле заданы составы металла, равновесного с жидкими оксидами (FeO, MgO). Область IV ортогональна плоскости рисунка. Вообще говоря, и область I, и область IV - это области составов металла, равновесных с газовой фазой. Но по мере роста концентрации магния в металле область I вырождается в область IV, которая скрыта под линией dxd4 и расположена практически ор- тогонально к плоскости рисунка. С увеличением давления граница dxd4 будет смещаться в область больших концентраций магния. На рис. 3 показано влияние углерода на раскислительную способность магния. Рис. 3 представляет собой изоугле-родные сечения рис. 2. Линии 1, 2, 3 соответствуют различным содержаниям углерода: 0,01, 0,1, 1 мае. % и давлению 0,1 МПа. Здесь также, как и на рис. 2, на линиях I заданы составы металла, равновесного с газовой фазой, состоящей в основном из СО и СО2 с примесью паров магния, на линиях II заданы составы металла, равновесного с твердыми растворами FeO в MgO, на линии Ш металл находится в равновесии со шлаковой фазой, жидкими оксидами (FeO, MgO). На линиях IV, в области сильно восстановленного металла, жидкий металл находится в равновесии с чистыми парами магния. Из рис. 3 видно, что даже при обычных давлениях и концентрации углерода порядка десятых долей процента возможно восстановление MgO и получение в металле тысячных долей процента магния. Естественно, что восстановленный магний впоследствии либо связывается в неметаллические включения типа алюминатов, хромитов или силикатов магния, либо испаряется.

Рис. 3. Кривые раскислительной способности магния, Т= 1873 К; Ро6щ = 0,1 МПа;
[С]: 1- 0,01; 2 - 0,1; 3 -1 мае. %
На рис. 4 приведена ПРКМ системы Fe-Mg-Al-O при Робщ = 0,1 МПа. Здесь в области I заданы составы металла, равновесного с твердыми растворами (FeO, MgO) на основе MgO, в области II заданы составы металла, равновесного с растворами шпинелей (MgAl2O4, FeAl2O4), причем, начиная с концентрации алюминия порядка 0,0001 мае. %, шпинель представляет собой практически чистый алюминат магния. В области III заданы составы металла, равновесного с корундом. На линии кс заданы составы металла, находящегося в равновесии с MgO и паром магния, а под линией кс находится область составов металла, равновесного с чистым паром магния. Из рис. 4 видно, что при тысячных долях процента алюминия и магния в стали возможно образование в качестве неметаллических включений тугоплавких алюмомагние-вых шпинелей.
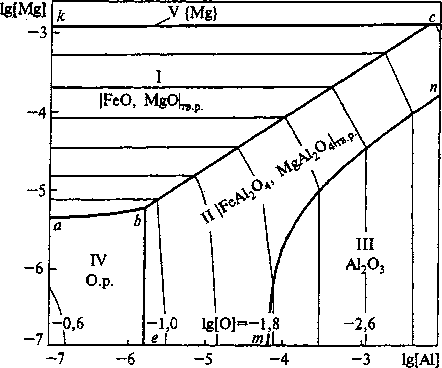
Рис. 4. ПРКМ системы Fe-Mg-AI-O, 7 = 1873 К; Робщ = 0Л МПа
В связи с тем, что в футеровке печей используется магнезитохромовые огнеупоры и значительное количество марок сталей содержит хром, представляет интерес рассмотреть ПРКМ системы Fe-Mg-Cr-C-O. Эта диаграмма представлена на рис. 5. Диаграмма построена при концентрации углерода 0,4 мае. %, что соответствует содержанию углерода в конструкционных легированных марках стали. Из диаграммы видно, что при концентрации хрома 0,8-1,5 мае. % и концентрации магния порядка 0,0001-0,001 мае. % в равновесии с металлом будет находиться хромит магния с ничтожной примесью FeO. Следует учитывать, что под линией abf находится поверхность, на которой заданы составы металла, равновесного с играми магния.
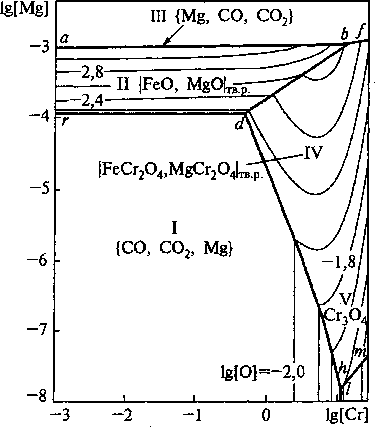
Рис. 5. ПРКМ системы Fe-Mg-Cr-C-O, 7 = 1873 К; [С] = 0,4 мае. %; Р^ = 0,1 МПа
На рис. 6 приведена ПРКМ системы Fe-Mg-Si-C-O. Следует отметить, что повышение давления до 0,2 МПа несколько увеличивает растворимость магния и это приводит к возможности образования в качестве неметаллических включений оксидных расплавов (FeO, MgO, SiO2), силикатов магния 2(Fe, Mg)OSiO2.
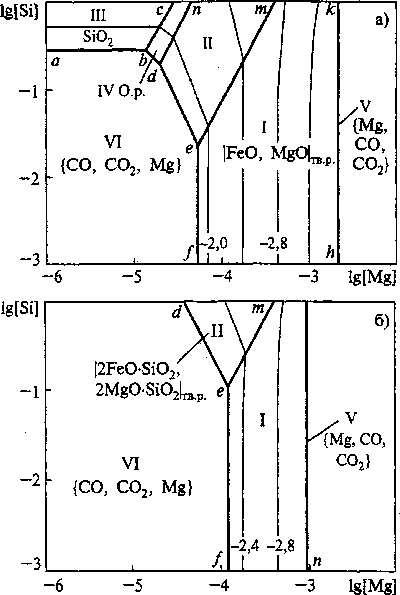
Рис. 6. ПРКМ системы Fe-Mg-Si-C-O, Г = 1873 К; [С] = 0,4 мае. %: а) Робщ = 0,2 МПа; б) Р^ = 0,1 МПа
При выплавке легированных сталей в качестве раскислителя используется алюминий и сили-кокальций. Для того чтобы рассмотреть поведение магния в этих условиях построена ПРКМ системы Fe-Mg-Ca-Si-Al-C-O (рис. 7). Здесь, как и ранее, контрастными линиями введены составы металла, равновесного с двумя оксидными фазами, на пересечении линий задан состав металла, равновесного с тремя оксидными фазами. В области VII в равновесии с металлом находится газовая фаза (СО, СО2, Mg Са), состоящая в основном из СО, но содержащая незначительные количества СО2, а также паров магния и кальция. Под линией nbm находятся поверхности, на которых заданы составы металла, равновесного с парами магния и кальция с примесью СО и СО2. Металл, состав которого задан на линии nb находится в равновесии с оксидом магния и газовой фазой, а на линии Ът - с MgAl2O4 и газовой фазой, В точке / задан состав металла, находящегося в равновесии с оксидным расплавом (FeO, СаО, MgO , SiO2, А12О3, Сг2О3), шпинельными твердыми растворами (Fe, Mg)(Al, Сг)2О4 и алю минатами кальция. Отмечаемые в различных работах образования крупных глобулей, видимо, связаны с равновесием, заданным точкой / В частности, гло-були в шарикоподшипниковой стали состоят из алюминатов магния и кальция, спаянных силикатной фазой. В составе глобулей отмечается также хромит и корунд, опять таки спаянные силикатной фазой.
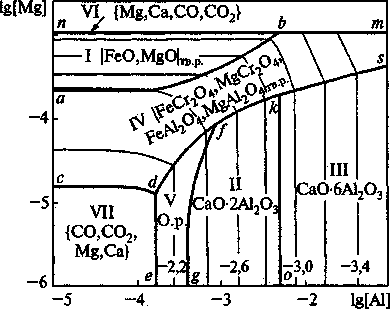
Рис. 7. ПРКМ системы Fe-Mg-Ca-AI-Cr-Si-C-O, Т= 1873 К; Ро6щ = 0,1 МПа; [Si] = 0,1 мае. %;
[Са] = 0,001 мае. %; [Сг] = 1,5 мае. %; [С] = 0,4 мае. %
Точка зрения на генезис глобулей различна. Ряд авторов, Виноград М.И., Гудим Ю.А. [8, 9] отмечают, что глобули - это экзогенные образования, связанные с запутыванием основного рафинировочного шлака в металле, так как элементный состав шлака и глобулей близки. Для того чтобы избежать образования глобулей предлагается не раскислять шлак перед выпуском из печи и не иметь оксида магния в шлаке более 12 мае. %, не сливать шлак вместе с металлом. Версия эндогенного образования крупных глобулей в стали тоже может иметь место. Наличие крупных глобулей отмечается так же и при современных технологиях разливки стали, даже и при донном выпуске, т.е. в случае, когда процесс захвата шлака струями металла практически исключен. Из рис. 7 (точка У) следует, что образование шлако-хромито-алюминатных конгломератов возможно при определенном составе стали и эндогенно. Следует отметить, что магнохромиты и алюминаты встречаются в качестве включений в стали даже и тогда, когда магнийсодержащие лигатуры в сталь не вводились. В.Е. Рощин, например, отмечает появление магнезиальных шпинелей даже на конечных стадиях плавки слитков ЭШП [10]. Видимо в данном случае, по мере наплавления слитков концентрация магния увеличивалась, благодаря ликвации в жидкую фазу и достигала критических концентраций, при которых происходило образование магнийсодержащих неметаллических включений. При производстве вакуумированных хорошо раскисленных сталей возможно восстановление магния и кальция из футеровки, что при избытке алюминия может привести к затягиванию погружных стаканов [И]. Причем погружные стаканы могут требовать замены уже по- еле разливки 2-3 плавок. В состав отложений могут входить тугоплавкие алюминаты и шпинелиды переменного состава. Отложения алюминатов проявляется при повышенном содержании алюминия в стали. В отложениях также отмечается и наличие оксида магния. Рассмотрение поведения магния в условиях современных технологий рафинирования и разливки стали позволяет прийти к следующим выводам:
-
1. Магний может восстанавливаться из футеровки и технологического шлака в металл при вакуумировании стали и ее раскислении алюминием и кальцием до десятитысячных и тысячных долей процента. При таких концентрациях в процессе разливки и кристаллизации стали магний способен участвовать в образовании неметаллических включений. По-видимому, вторичное окисление стали происходит в основном на участке ковш - промковш - кристаллизатор, что и приводит к явлению затягивания сто-порных устройств и погружных стаканов.
-
2. Магнийсодержащие включения и отложения встречаются даже в том случае, если сталь специально не раскислялась и не модифицировалась лигатурами, содержащими магний.
-
3. Для повышенной стойкости разливочных стаканов и стопорных устройств необходимо отслеживать содержание магния, кальция и алюминия в стали и максимально избегать вторичного окисления глубокораскисленного металла в ковше, промковше, погружных стаканах и кристаллизаторах.
Список литературы Фазовые превращения в жидкой магнийсодержащей стали
- Михайлов Г.Г., Поволоцкий Д.Я. Термодинамика раскисления стали. -М.: Металлургия, 1993. -144 с.
- Михайлов Г.Г., Вильгельм Е.М., Чернова Л.А. Термодинамический метод определения соотношения между компонентами в сплавах для раскисления//Изв. вузов. Черная металлургия. -1988. -№ 12. -С. 1-7.
- Образование фаз при раскислении стали кремнием и алюминием/Г.Г. Михайлов, Е.М. Вильгельм, Л.А. Чернова и др.//Изв. вузов. Черная металлургия. -1988. -№ 4. -С. 10-16.
- Жучков В.И., Лукин С.В., Шилина И.В. Раскисление стали кальций-магний-кремниевыми ферросплавами//Изв. вузов. Черная металлургия. -1977. -№ 12. -С. 69-71.
- Жалыбин В.И., Ершов Г.С. О восстановлении магния футеровки при выплавке стали, легированной алюминием//Известия АН СССР. Металлы. -1966. -№ 1. -С. 49-53.
- Механизм загрязнения подшипниковой стали неметаллическими включениями оксидов/В.Ф. Мазуров, А.Ф. Каблуковский, О.Т. Пикина//Теория металлургических процессов: Сб. -М.: Металлургия, 1975. -С. 231-247.
- Воронова H.A. Десулъфурация чугуна магнием. -М.: Металлургия, 1980. -239 с.
- Виноград М.И., Громова Г.П. Включения в легированных сталях и сплавах. -М.: Металлургия, 1972. -211 с.
- Неметаллические включения в слитке подшипниковой стали/Д.Я. Поволоцкий, Ю.А. Гудим, Р.З. Нагамазьянов и др.//Современные проблемы электрометаллургии стали: Сб. трудов Всесоюзной конференции. -Челябинск, 1975. -С. 123-129.
- Процессы изменения оксидных включений при электрошлаковом переплаве стали/Д.Я. Поволоцкий, В.Е. Рощин, В.А. Голубцов и др.//Изв. вузов. Черная металлургия. -1975. -№ 4. -С. 74-77.
- Процессы непрерывной разливки: Монография/А.Н. Смирнов, В.Л. Пилющенко, A.A. Минаев и др. -Донецк: ДонНТУ, 2002. -536 с.


