Фазовые равновесия при взаимодействии бария с компонентами жидкой стали
Автор: Михайлов Геннадий Георгиевич, Макровец Лариса Александровна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 2 т.14, 2014 года.
Бесплатный доступ
Выполнен термодинамический анализ процессов финишного раскисления стали барием, магнием и алюминием. Установлено, что образующиеся включения даже при малых концентрациях бария, алюминия и магния являются, скорее всего, тугоплавкими и мелкими, что может привести к модифицированию жидкой стали, блокированию роста первичного литого зерна, снижению анизотропии и повышению технологической пластичности. Эффект модифицирования может быть усилен за счет снижения добавками бария межфазного натяжения при протекании в стали гетерогенных реакций.
Барий, магний, модификатор, сталь, диаграммы состояния, поверхности растворимости
Короткий адрес: https://sciup.org/147156869
IDR: 147156869 | УДК: 669.18.054:669.893
Текст научной статьи Фазовые равновесия при взаимодействии бария с компонентами жидкой стали
Современные методы плавки стали позволяют в настоящее время за счет развития внепечных технологий стабильно получать металл с предельно низким содержанием кислорода, порядка 4–5 ppm, и серы ~20–40 ppm. В этих условиях может существенно изменяться химия раскисления стали и состав неметаллических включений. При этом необходимо учитывать, что растворимость бария в железе вряд ли превысит 0,001 мас. %. Точнее растворимость бария в жидком металле не установлена. Растворимость кальция составляет при открытой плавке 0,015–0,020 мас. %. При столь глубоком раскислении металла в сталь может восстанавливаться магний из шлака и футеровки и достигать концентрации порядка 0,001 мас. %. Тогда встает вопрос: какие фазы образуются в металле при столь малых концентрациях магния, бария, алюминия и кислорода? Для прояснения проблемы необходимо построить поверхность растворимости компонентов в металле (ПРКМ) и выделить облас- ти фазовых равновесий при малых концентрациях примесей.
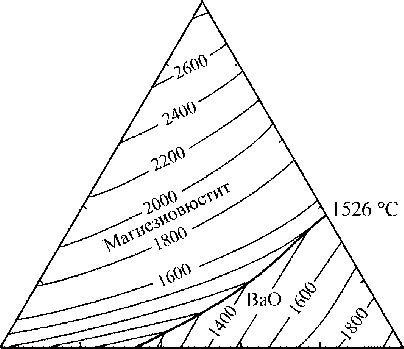
Построение ПРКМ всегда связано с определением оксидных фаз, сопряженных с областью существования жидкого металла. Так в равновесии с металлом, содержащим в качестве примесей барий, магний и кислород, будут фазы, определяемые на диаграмме состояния BaO–MgO. На рис. 1 в верхнем левом углу приведен вид такой оксидной диаграммы [1], здесь же представлен расчет основных элементов данной диаграммы с использованием теории субрегулярных ионных растворов [2]. Как видно из рис. 1, диаграмма состояния BaO–MgO является диаграммой с простой эвтектикой. Температура эвтектического превращения составила 1526 °С, точка эвтектического превращения задана при x BaO = 0,62. На рис. 1 нанесены литературные экспериментальные данные ▲ и + [3], а также точка эвтектики • [1]. Диаграмма состояний FeO–BaO (рис. 2) также представляет
Рис. 1. Расчетная диаграмма состояния системы BaO–MgO: • – [1]; ▲ – [3]; + – [3]
Рис. 2. Расчетная диаграмма состояния системы FeO–BaO
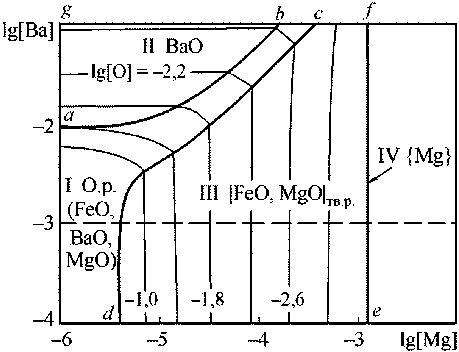
диаграмму с простой двойной эвтектикой. Диаграмма FeO–MgO (рис. 3) говорит о неограниченной растворимости компонентов в твердом и жидком состоянии. Линии ликвидус этих диаграмм состояния хорошо описываются в рамках теории субрегулярных растворов. На рис. 4 представлена диаграмма состояний системы FeO–BaO–MgO. В литературе такая диаграмма состояний не построена, но по данным двойных диаграмм системы удалось подобрать параметры теории субрегулярных ионных растворов для тройной системы. Параметры теории представлены в табл. 1.
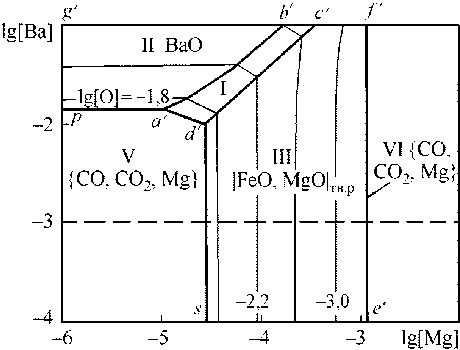
Были выполнены расчеты координат ПРКМ для условий раскисления стали магнием и барием (рис. 5) по методике, изложенной в работе [2].
В металле всегда остается какое-то количество остаточного алюминия, который вступает во взаимодействие с остаточным кислородом и другими компонентами расплава, образуя шпинельные и алюминатные фазы. В этом случает необходимо иметь сведения о диаграмме состояний BaO–MgO–Al2O3. При раскислении и модифици- ровании стали необходимо учесть также и наличие в стали углерода.
В табл. 2 приведены сведения об основных соединениях, которые образуются при раскислении стали барием, магнием, алюминием и углеродом и приведены температурные зависимости констант равновесия для реакций образования этих соединений из компонентов жидкого металла. Коэффициенты активности компонентов жидкого металла рассчитывались с помощью параметров взаимодействия e i j , приведенных в табл. 3.
На рис. 6 построен расчетный вариант диаграммы состояний BaO–MgO–Al 2 O 3 . Диаграмму удалось построить, опираясь на термодинамические данные диаграмм состояний BaO–MgO, BaO–Al 2 O 3 и MgO–Al 2 O 3 . Из внешнего вида этой диаграммы состояний следует, что поля кристаллизации оксидных твердых фаз из шлаков крайне невелики. При взаимодействии магния, бария и алюминия с кислородом в стали жидкоподвижные включения выпадать не будут. Все образующиеся
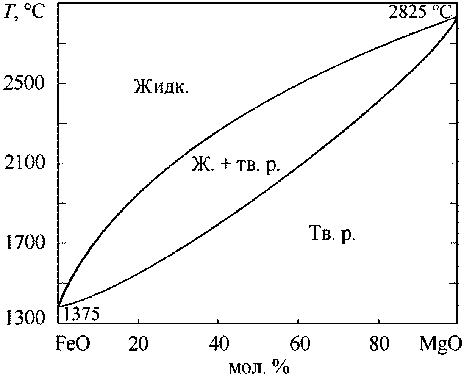
Рис. 3. Расчетная диаграмма состояния системы FeO–MgO
MgO
FeO 20 1066 40 60 80 BaO
мол. %
Рис. 4. Расчетная диаграмма состояния системы FeO–MgO–BaO
Таблица 1
Энергетические параметры теории субрегулярных ионных растворов для оксидных расплавов FeO–BaO–MgO–Al 2 O 3
|
Система |
Параметры теории Qijkl , кал/моль |
||
|
FeO–BaO |
–5000 |
–10 000 |
–5000 |
|
FeO–MgO |
–2500 |
–5000 |
–2500 |
|
FeO–Al 2 O 3 |
661 |
–16 329 |
–4917 |
|
BaO–MgO |
–10 000 |
–10 000 |
–20 000 |
|
BaO–Al 2 O 3 |
–21 194 |
–10 073 |
–32 395 |
|
MgO–Al 2 O 3 |
–14 517 |
2876 |
–1539 |
|
FeO–BaO–MgO |
–25 000 |
–35 000 |
–20 000 |
|
FeO–BaO–Al 2 O 3 |
–10 000 |
–20 000 |
–30 000 |
|
FeO–MgO–Al 2 O 3 |
–16 000 |
–23 000 |
–16 000 |
|
BaO– MgO–Al 2 O 3 |
–50 000 |
–90 000 |
–30 000 |
Таблица 2
Зависимость констант равновесия от температуры
|
№ |
Реакция |
Константа равновесия, K ; a – активность, мас. % |
lg K = – A / T + B |
|
|
A |
B |
|||
|
1 |
(FeO) = [Fe] + [O] |
K = [Fe] a [O]/ a ( FeO ) |
6320 |
4,734 |
|
2 |
(BaO) = [Ba] + [O] |
K = a [Ba] a [O] (a ( BaO ) |
20 384 |
7,36 |
|
3 |
(MgO) = [Ca] + [O] |
K = a [Mg] a [O]/ a ( MgO ) |
22 457 |
6,54 |
|
4 |
(Al 2 O 3 ) = 2[Al] + 3[O] |
K = a 2Ai] a 30] ] a ( A1 2 O 3 ) |
58 320 |
18,02 |
|
5 |
|BaO| = [Ba] + [O] |
K = a [Ba] a [O] |
23 400 |
8,73 |
|
6 |
|FeO| = [Fe] + [O] |
K = [Fe] a [O]/ a FeO |
8069 |
5,8 |
|
7 |
|MgO| = [Ca] + [O] |
K = a [Mg] a [O]/ a |MgO| |
26 500 |
7,85 |
|
8 |
|Al 2 O 3 | = 2[Al] + 3[O] |
23 K = a [Al] a [O] |
64 000 |
20,48 |
а)
Рис. 5. ПРКМ системы Fe–Ba–Mg–O–C, Т = 1600 °C, P общ = 1 атм: а) [C] = 0; б) [C] = 0,1 мас. %
б)
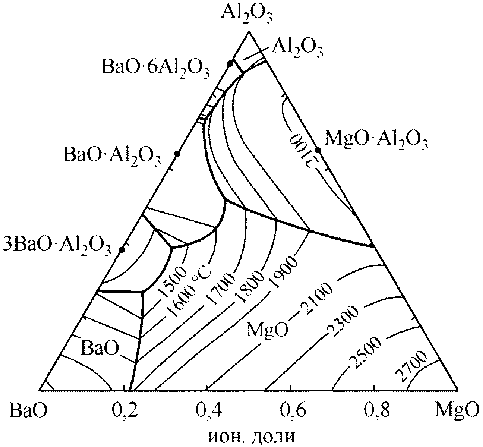
Рис. 6. Расчетный вариант диаграммы состояний BaO–MgO–Al 2 O 3
Окончание табл. 2
|
9 |
I ВаО^А1 2 О з | = [Ba] + 2[Al] + 4[O] |
24 K = a \ Ba ] a [A1] a [O] |
84 000 |
25,76 |
|
10 |
I BaO^6A№ | = [Ba] + 12[Al] + 19[O] |
12 19 K = a [ Ba ] a [A1] a [O] |
402 350 |
125,99 |
|
11 |
{CO} = [C] + [O] |
K = a [C] a [O]/ p {CO} |
1168 |
–2,07 |
|
12 |
{CO 2 } = [C] + 2[O] |
K = a [C] a[O]] p {CO2} |
9616 |
2,51 |
|
13 |
{Mg} = [Mg] |
K = P { Ca } / a [ Ca ] |
6670 |
–6,48 |
Таблица 3
Параметры взаимодействия компонентов ei j в жидком металле при T = 1873 К
|
Элемент i |
Элемент j |
||||
|
Al |
O |
С |
Ba |
Mg |
|
|
Al |
0,045 |
–1,62 |
0,0966 |
–0,064 |
–0,000998 |
|
O |
–0,96 |
–0,2 |
–0,45 |
–0,95 |
–1,98 |
|
С |
0,043 |
–0,34 |
0,14 |
–0,006 |
0,007 |
|
Ba |
–0,325 |
–8,155 |
–0,068 |
0 |
–0,12838 |
|
Mg |
–0,0089 |
–3,008 |
0,14 |
–0,0195 |
–0,0085 |
а)
б)
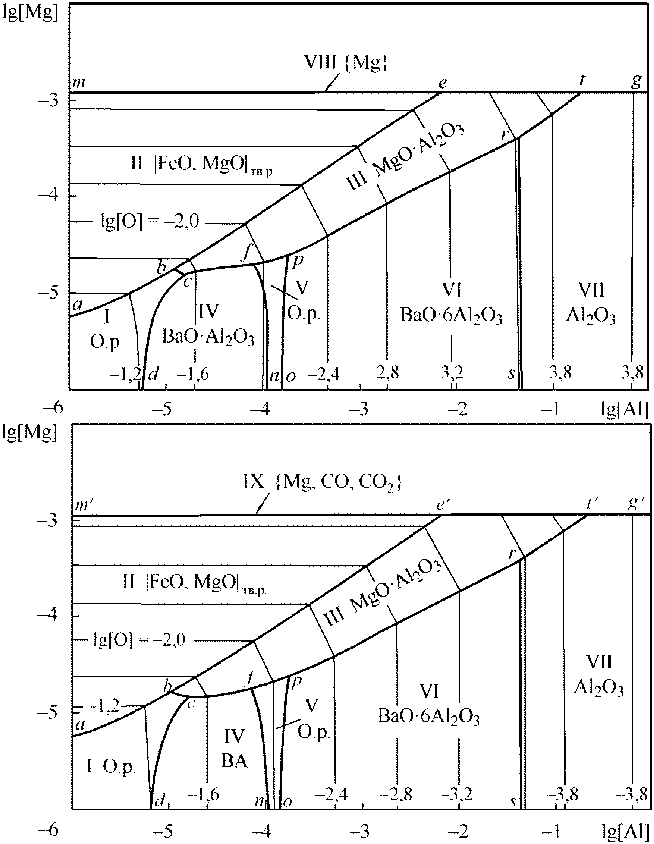
Рис. 7. ПРКМ системы Fe–0,001 % Ba–Mg–Al–O–C, Т = 1600 °C, P общ = 1 атм: а) [C] = 0; б) [C] = 0,1 мас. %
в системе Fe–Mg–Bа–Al–O включения – тугоплавкие.
На рис. 7, а приведена ПРКМ системы Fe–Mg–Bа–Al–O при [Ba] = 0,001 мас. %. Из вида этой диаграммы следует: при предельной концентрации бария и содержании магния порядка 0,001 мас. % в равновесии с металлом в зависимости от концентрации алюминия могут находиться оксид магния MgO и магнезиальная шпинель. И только при очень низкой концентрации магния, порядка 10–5 мас. %, возможно образование алюминатов бария. Естественно, что по механизму эндогенного раскисления образования неметаллических включений образования включений с барием не происходит.
На рис. 7, б приведена поверхность растворимости компонентов системы Fe–Mg–0,0001 % Bа– Al–O–С при 1873 К и [C] = 0,1 мас. %. Можно здесь отметить, что присутствие углерода фактически не сказалось на распределении образующихся фаз по концентрационным полям диаграммы ПРКМ. Только в области IX в равновесии с металлом образуется газовая фаза, содержащая также некоторое количество CO и CO 2 .
Из рассмотренных диаграмм ПРКМ при низких концентрациях магния, бария, алюминия и кислорода следует, что образующиеся включения периклаза, шпинелей, алюминатов бария – это мелкие тугоплавкие частицы, образование которых может модифицировать структуру кристалли- зующегося металла, измельчить первичное литое зерно стали, снизить анизотропию и повысить технологическую пластичность.
Выводы
При низких концентрациях бария, магния и алюминия в металле возможно образование тугоплавких микрофазных образований, в результате которых при кристаллизации стали может реализоваться модифицирующий эффект.
Модифицирующий эффект микросодержаний магния, бария и алюминия может усилиться за счет влияния бария на межфазное натяжение при протекании гетерогенных реакций образования неметаллических включений.
Список литературы Фазовые равновесия при взаимодействии бария с компонентами жидкой стали
- Levin, E.M. Phase Diagrams for Ceramists/E.M. Levin, C.R. Robbins, H.F. McMurdie. -Columbus, Ohio, The American Ceramic Society. -1964. -Vol. 1. -265 p.
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем/Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов -М.: Издат. Дом МИСИС. -2009. -519 с.
- Wartenberg, H.V. Schmelzdiagramme höchstfeuerfester Oxyde. V. Systeme mit MgO/H.V. Wartenberg, E. Prophet//Zeitschrift für anorganische und allgemeine Chemie. -1932. -Vol. 208, no. 4. -P. 369-379 DOI: 10.1002/zaac.19322080405