Фазовые равновесия, реализующиеся в системе Al-Mg-O в условиях существования металлического расплава
Автор: Трофимов Евгений Алексеевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 39 (298), 2012 года.
Бесплатный доступ
Представлены результаты расчета поверхности растворимости компонентов в металле для системы Al-Mg-O. Результаты расчетов сопоставлены с собственными и литературными экспериментальными данными.
Жидкий алюминий, магний, кислород, оксидные фазы
Короткий адрес: https://sciup.org/147156737
IDR: 147156737 | УДК: 541.123+669.71
Текст научной статьи Фазовые равновесия, реализующиеся в системе Al-Mg-O в условиях существования металлического расплава
В ходе выплавки алюминиевых сплавов происходит окисление жидкого металла и находящихся в нем примесей с образованием неметаллических включений, загрязняющих металл и ухудшающих его потребительские характеристики. Образуется оксидная пленка, которая в зависимости от состава может в той или иной степени защищать металл от дальнейшего окисления. На характер окисления жидкого алюминия определенное влияние оказывают примеси других металлов. Особенно заметно это влияние проявляется в присутствии активных щелочно-земельных металлов.
Для анализа фазовых равновесий в ходе окисления сплавов на основе алюминия целесообразно использовать методику построения поверхностей растворимости компонентов в металле (ПРКМ) -диаграмм состояния, связывающих количественные изменения в составе жидкого металла с качественными изменениями в составе равновесных неметаллических фаз [1, 2]. Ранее диаграмма такого рода была построена и для системы Al-Mg-O [3].
Составы металла, находящегося в равновесии с одной или несколькими оксидными фазами, и парциальные давления газообразных веществ рас-
Температурные зависимости констант равновесия процессов взаимодействия газа с конденсированными фазами
|
Процесс |
Константа равновесия K ; a - активность, мольные доли; p - давление, атм |
Температурная зависимость lg K |
|
/AI 2 O 3 / = 2[Al] + 1,5{O 2 } |
K = <} |
-88258 / T + 17,250 |
|
{AI 2 O} = 2[Al] + 0,5{O 2 } |
K = -p lOL p AO |
-8920 / T - 2,580 |
|
{Al 2 O 2 } = 2[Al] + {O 2 } |
K = p {O2} p { Al2O2 } |
-24596 / T + 1,509 |
|
[Al] = {Al} |
K = P { Al } |
-15918 / T + 5,721 |
|
/MgO/ = [Mg] + 0,5{O2} |
K = a [ Mg ] • P^ } |
-32687 / T + 6,447 |
|
XlgAMr = [Mg] + 2[Al] + 2{O 2 } |
K = a [ Mg ] • P {02} |
-122803 / T + 23,588 |
|
[Mg] = {Mg} |
к P { Mg } K = a [Mg] |
-5882 / T + 4,166 |
Трофимов Е.А.
считывались в ходе решения систем уравнений, составленных с помощью выражений для констант равновесия реакций между компонентами жидкого алюминия и присутствующим в газовой фазе кислородом (см. таблицу), которые приводят к образованию в качестве продуктов реакции различных оксидных фаз [3].
Для расчета активности магния, растворенного в жидком алюминии, использовалось следующее значение мольного параметра взаимодействия:
ε M M g g = –12700 / T + 10,025.
Диаграмма системы Al–Mg–O [3] изображена на рис. 1. Продукты окисления алюмомагниевого расплава и порядок их чередования определены по диаграмме состояния системы MgO–Al 2 O 3 , приведенной в справочнике [4].
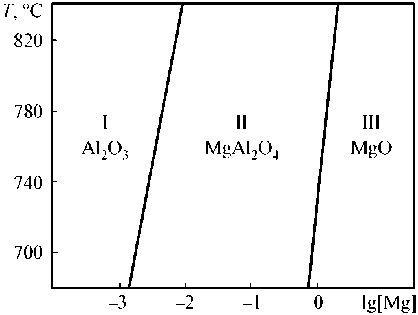
Рис. 1. ПРКМ системы Al–Mg–O
С помощью диаграммы, представленной на рис. 1, можно проследить, как меняется состав продуктов окисления алюмомагниевого расплава в зависимости от содержания в жидком металле магния. Концентрация магния (мас. %) в логарифмической шкале отражена на оси абсцисс.
В области I в результате реакции между расплавленным металлом и кислородом образуется твердый оксид алюминия (Al2O3), в области II – кристаллический алюминат магния (MgAl2O4), а в области III – твердый оксид магния (MgO).
Парциальные давления кислорода, соответствующие установлению в системе ра в новесия, чрезвычайно малы. Так, пр и температу р е 760 °C для образования Al 2 O 3 при взаимодействии металлического расплава (состав которого соответствует области I) достаточно, чтобы давление кислорода в газе было выше 10–46,5 МПа. Для других продуктов взаимодействия аналогичное значение еще меньше.
Эти результаты можно сопоставить с экспериментальными данными, полученными другими авторами. В частности, в ра б оте [5] показано, что при содержании магния в металле свыше 1 % равновесным продуктом окисления сплава является MgO. Электронографическое исследование оксидных пленок, образующихся на расплавленных алюминиевых сплавах, проведенное авторами работы [6], позволяет прийт и к тем же выводам. Гра н ица фазовых равновеси й между областями I и II, согласно данным этой работы, проходит при содержании магния порядка 0,005–0,02 мас. %, что несколько превышает рассчитанные значения. Вероя т но, такое завышение связано с происходившим в ходе окисления мета л ла переходом магния из м еталла в оксидную пленку. В результате фактическое равновесное содержание магния в металле после образования пленки несколько ниже, чем содержание магния до окисления. Чем м еньше в сплаве магния, тем эта разница будет больше. Этим можно объяснить и некоторую размытость границ фазовых равновесий, демонст р ируемую результатами, полученными в ходе эксперимента авторами работы [6].
В ходе эксперименталь н ой части настоящей работы были выплавлены образцы алюмомагние-вых сплавов с содержание м магния 6; 1,5; 0,25; 0,001 ат. %. Выплавка проводилась при температуре порядка 800 °C в электропечи сопротивления в алундовых тиглях. В процессе выплавки расплав пер е мешивался кварцевой палочкой с ц елью до-

Рис. 2. Прослойки, образованные кристаллами MgO в металле, содержащем 6,0 ат. % магния

Рис. 3. Прослойки, образованные кристаллами MgO в металле, содержащем 1,5 ат. % магния

Рис. 4. Включение MgAl 2 O 4 , образовавшееся в металле, содержащем 0,25 ат. % магния

Рис. 5. Прослойка Al 2 O 3 , образовавшаяся в металле, в котором содержание магния методом микрорентгеноспектрального анализа не фиксируется
биться частичного окисления металла кислородом воздуха (чему без перемешивания препятствовала бы пленка оксида алюминия). По достижении температуры 800 °C образцы выдерживались при этой температуре 0,5 часа, а затем вынимались из печи и охлаждались в воде. Далее тигли разбивались, слитки освобождались от осколков тиглей и разрезались вдоль вертикальной оси, после чего из них изготавливались микрошлифы, которые исследовались на растровом электронном микроскопе JEOL JSM-6460LV, оснащенном спектрометром энергетической дисперсии фирмы Oxford Instruments для проведения качественного и количественного рентгеноспектрального микроанализа.
На рис. 2–5 показаны формы и виды включений сложных веществ, относящихся к исследуемой системе, которые были обнаружены в ходе электронно-микроскопического изучения поверхностей шлифов алюминиевых сплавов с различным содержанием магния.
Заключение
Представлен набор термодинамических параметров, позволяющий рассчитывать равновесные составы расплава на основе алюминия и сопряженных с ним неметаллических фаз в системе Al–Mg–O для температур 680–840 °C. Приведена построенная посредством термодинамических расчетов диаграмма ПРКМ системы Al–Mg–O, которая может быть использована для анализа технологических процессов производства алюминия и сплавов на основе алюминия. Осуществлен анализ литературных данных, а также собственное экспериментальное исследование, результаты которых подтверждают достоверность результатов расчета.
Работа проведена по научной программе Министерства образования и науки РФ «Развитие научного потенциала высшей школы (2009–2011 годы)», код проекта 375 (10955), а также при финансовой поддержке РФФИ (проект № 04-03-32081-а).
Список литературы Фазовые равновесия, реализующиеся в системе Al-Mg-O в условиях существования металлического расплава
- Михайлов Г.Г. Термодинамика металлургических процессов и систем/Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. -М.: Издат. дом МИСиС, 2009. -520 с.
- Трофимов Е.А. Термодинамический анализ фазовых равновесий, реализующихся в системах Cu-Pb-O, Cu-Sn-O, Cu-Sn-Pb-O при высоких температурах/Е.А. Трофимов, Г.Г. Михайлов//Расплавы. -2007. -№ 3. -С. 85-94.
- Трофимов Е.А. Термодинамический анализ процессов взаимодействия в системе Al-Mg-Na-K-O при температурах 680-840 °С/Е.А. Трофимов, Ю.Г. Кадочников//Металлы. -2006. -№ 4 -С. 23-29.
- Диаграммы состояния силикатных систем: справ./под ред. Н.А. Торопова. -Л.: Наука, 1965. -Вып. 1: Двойные системы. -547 с
- Silva M.P. Oxidation of liqcid aluminium -magnésium alloys/M.P. Silva, D.E.J. Talbot//Light Metals 1989: Proc. Techn. Sess. TMS Light Metals Comm. 118 TMS Annu. Meet., (Las Vegas, Nev., Febr. 27 -March 3). -1989. -P. 1035-1040.
- Мальцев М.В. Электронографическое исследование окисных пленок, образующихся на жидком алюминии и его сплавах/М.В. Мальцев, Ю.Д. Чистяков, М. И. Цыпин//Изв. АН СССР. -1956. -Т. XX, № 7. -С. 824-828.