Фазовые равновесия в системе Hg-Se при вакуумной дистилляции
Автор: Королев Алексей Анатольевич, Шунин Владимир Александрович, Тимофеев Константин Леонидович, Мальцев Геннадий Иванович, Воинков Роман Сергеевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Металлургия техногенных и вторичных ресурсов
Статья в выпуске: 1 т.22, 2022 года.
Бесплатный доступ
Одним из возможных способов рекуперации компонентов из Hg-Se сплава, образующегося при переработке медеэлектролитного шлама, является вакуумная перегонка. Объект исследования: Hg-Se сплавы состава, моль %: 0,01-99,99 Hg; 99,99-0,01 Se, образование которых возможно в процессе переработки медеэлектролитного шлама при получении товарного концентрата селена. Цель работы: расчет равновесных состояний «газ - жидкость» VLE (vapor liquid equilibrium), включая зависимости состава фаз от температуры (Т - х) и давления (Р - х) для Hg-Se сплава при вакуумной перегонке. Используемые методы и подходы. Расчет коэффициентов активности компонентов Hg-Se сплава выполнен с помощью упрощенной версии объемной модели молекулярного взаимодействия simple molecular interaction volume model (SMIVM). Для предварительного выбора температуры и давления системы, оценки эффективности разделения компонентов при вакуумной перегонке используют фазовые диаграммы температуры (Т - х) и давления (Р - х). Новизна: расчет коэффициентов активности с использованием упрощенной версии модели SMIVM. Основные результаты. В интервале температур 823-1073 К рассчитаны давления насыщенного пара для Hg (pHg* = 1,418•106-1,046•107 Па) и Se (pSe* = 1,42•104-3,66•105 Па). Высокие значения соотношения pHg*/pSe* = 100,2-28,6 и коэффициента разделения lgβHg = 2,73-1,01 создают теоретические предпосылки для селективного выделения этих металлов вакуумной дистилляцией, когда ртуть обогащается в газовой фазе (βHg > 1), а селен - в жидкой. Мольная доля селена в газовой фазе уSe = 0,553-1,43•10-12 уменьшается со снижением температуры 1073-823 К и мольной доли элемента в сплаве хSe = 0,99-0,01. Для границы раздела фаз «жидкость - газ» Hg-Se сплава определены значения изменения избыточных энергии Гиббса, энтальпии и энтропии -ΔGmE = 0,8-3,0 кДж/моль; -ΔHmE = 1,86-5,39 кДж/моль; -ΔSmE = 0,99-2,94 Дж/моль•К. Практическая значимость: сокращение количества трудоемких и дорогостоящих установочных опытов при переработке Hg-Se композиций для оптимизации значений температуры и давления процесса вакуумной дистилляции с целью получении Sе-содержащих продуктов заданного состава.
Равновесная фазовая диаграмма, вакуумная дистилляция, молекулярная объемная модель взаимодействия, ртуть, селен, газовая фаза, жидкая фаза, коэффициент активности
Короткий адрес: https://sciup.org/147236551
IDR: 147236551 | УДК: 661.849:661.691.9:66.048.1-982 | DOI: 10.14529/met220106
Текст научной статьи Фазовые равновесия в системе Hg-Se при вакуумной дистилляции
Для разделения компонентов металлических сплавов используют вакуумную перегонку ‒ экологически безопасную и высокопроизводительную пирометаллургическую технологию, основанную на различии в давлении насыщенных паров чистых металлов ( Р* ) при одинаковой температуре, характеризующихся коэффициентами разделения (β) при распределении металлов между газовой и жидкой фазами [1–4]. Состав продуктов воз-
гонки и степень разделения компонентов сплава при заданных значениях температуры и давления осуществляют при помощи рассчитанных равновесных фазовых диаграмм VLE ( vapor liquid equilibrium ), в частности, температура – состав « Т – х » и давление – состав « Р – х » [5–8]. Для определения β необходимо рассчитать коэффициенты активности компонентов (γ i , γ j ), зависящие от температуры и состава cплава, с использованием объемной модели молекулярного взаимодействия
MIVM (molecular interaction volume model) . При расчете используют значения координационных чисел ( Z ), молярных объемов ( Vm ) и потенциальных энергий парного взаимодействия ( В ) компонентов сплава. Диаграммы VLE помогают выявить вероятностные диапазоны температуры и давления процесса дистилляции, соответствующие заданной степени разделения компонентов исходного сплава и составу образующихся конденсата и огарка. Поскольку процесс расчета MIVM является относительно сложным, особенно расчет первых координационных чисел Z i и молекулярного объема V mi компонентов сплавов, использовали метод прогнозирования, включающий меньшее число параметров системы, так называемый упрощенный MIVM или SMIVM (simple molecular interaction volume model) . Поэтому активность компонентов Hg–Se сплавов и фазовые диаграммы VLE были рассчитаны с использованием модели SMIVM . Оптимальные параметры процесса разделения компонентов сплавов можно оперативно получить из VLE фазовых диаграмм [9–12].
Теоретический анализ
Летучесть (фугитивность) каждого компонента в газовой и жидкой фазах равны, когда система достигает равновесия. Соотношение общего равновесия для VLE может быть выражено следующим образом:
ф(ViP) = фр1(XiY)exp|V (Ркрi )]. (1) где ф^ и ф^ - коэффициенты летучести (фугитивности) i-компонента в газовой фазе и при давлении насыщенного пара; xi и yi ‒ молярные доли жидкой и газовой фазы i-компонента; P и T ‒ общее давление и температура в равновесной системе; γi ‒ коэффициент активности в жидкой фазе; рfat- давление насыщенного пара чистого г-компонента при температуре T; Vi - молярный объем жидкости; R ‒ универсальная газовая постоянная.
При низком давлении ( Р ≤ 133 Па), используемом в данном исследовании, коэффициент
Г vl( Р - р S at)l exp| •- |
Пойнтинга
-
1. В добавлении, газовая фаза может рассматриваться как идеальный
газ и зависимостью фугитивности жидкой фазы от давления можно пренебречь. Уравнение (1)
может быть выражено следующим образом:
V i p = X i Y i p ,"1 ( i = 1, 2, .... N) .
Если жидкая смесь идеальна, то по закону Рауля γ i = 1. Для бинарного сплава:
xi + xj = 1, yi + yj = 1, p = p?at yi^Xi + pfatYjXj = p-at yiXi + pjat yj (1 - Xi).
Из уравнений (2) и (4) можно выразить x i и у i как:
_ Р - P, “' y , _
X i = n satv. satv ,. y i = р [ Y i р , Y ,
P S atY i X i
Р .
Модель MIVM считается одной из наиболее удобных и надежных. Однако до сих пор её практическое применение было затруднено из-за сложного процесса расчета координационных чисел ( Z) и отсутствия молярных объемов в жидком состоянии (V j^ ) некоторых компонентов (например, С, Ta, V 2 O 5 , Cu 2 S, CaSiO 3 ). Упрощение MIVM достигнуто путем придания обоим Z i и Z j значений, равных 10, и заменой молярного объема i -компонента в жидком состоянии на его молярный объем в твердом состоянии ( V i ) [13–16].
При расчете VLE коэффициент активности компонента в жидкой фазе является существенным параметром. Согласно MIVM, молярный избыток энергии Гиббса G:^ жидкой смеси i-j мож- но представить как:
G m j (
— = X; ln
ЯГ i \
______ Vmi ______\ + x . In (______ V ™-, ______^ — X i X j ( Z i BpnB jl । z j B lj^ nB lj X l V m i +X j V m j Bji) ^' X^j^ j mmj+XimjBiljij/ 2 \ Xi +X j B ji X j +X i B ij
), (6)
где xi и x j ‒ молярные доли i- и j -компонентов; Z i и Z j ‒ первые координационные числа; Vmi и Vm j ‒ молярные объемы i- и j -компонентов в жидкой фазе; Bi j и B j i ‒ параметры потенциальной энергии парного взаимодействия (уравнение (7)); R ‒ универсальная газовая постоянная.
Значения B ij и B ji из уравнения (6) определяются выражениями:
где k – константа Больцмана; ε ij , ε ii и ε jj – потенциальные энергии парного взаимодействия i–j , i–i , j–j систем, где ε ij = ε ji [17–20].
Координационное число определяли следующим образом:
=
tV2^ / r^; |L
3 ^mi _^ oi
') Р^ехр
/ ^H mi (T mi T) к Z c RTT mi
),
где pt = N i /V i = 0,6022 - молекулярная плотность; V i - мольный объем и N i - число молекул; ^Hm i - энтальпия плавления; Тт 1 - температура плавления; Z c = 12 - координационное число плотной упаковки; Т – температура жидкого металла, К; R – газовая постоянная; r оi = 0,918 d covi – доля атомного ковалентного диаметра ( d covi ); r mi = σ i , где σ i – атомный диаметр.
Для бинарной смеси i-j с помощью термодинамического соотношения (dG m /dx i ) T , p , x , ^ i , коэффициенты активности i- и j- компонентов могут быть получены из уравнения (6) соответственно как :
l = ln f у тл ) + x. f y mj Bjiy mi B j ) _ x j [ Z i B ji lnB ji + Z j B>B ij "
-
1 \xi y m, i ^^ j y mj B ji) 7 \xi y m, i ^^ j y mj B ji x j y m,j +x i y m,i B ij / 2 [(x i +x j B ji )2 (x у +x ^ B ^у )2
Iny. = ln f----^----A + X i f--- ymBjymBj--- A _ ^\ Z j B>Btj2 + Z i B>B ja (10)
-
7 Xxjym+xxiym,iBij/ Xxjym,jxxiym,iBij xiym,i+xjym,jBji/ 2 [(Х у +Х ^ У ^у ) (X^+XjBjf) J
Необходимые двоичные параметры Bi j и B j i могут быть рассчитаны из уравнений (10) и (11) с помощью метода Ньютона – Рафсона, если коэффициенты активности бесконечного разбавления, а именно: y ^ и y ^ , бинарных жидких сплавов и соответствующие параметры их компонентов ( V mi и Z i ), доступны.
Значения B ij и B ji при любой температуре могут быть рассчитаны из уравнения (11) предполагая, что -С^^) и -( £;\£“ ) в уравнении (7) не зависимы от температуры:
.
T( 1)/ T (2) T (1)/ T (2)
B ij (2) = B ij (1) ; B ji (2) = B ji (1)
Координационное число Z i жидких металлов может быть рассчитано из уравнения (8), однако это несколько сложнее, поскольку ряд параметров, включая молекулярные объемы для некоторых компонентов, отсутствует в литературе. Следовательно, упрощение MIVM необходимо для расширения области его применения, поскольку метод прогнозирования, включающий только некоторые параметры, является необходимым.
Фактически в решеточной теории растворов Z имеет одно и то же постоянное значение между 6 и 12. Кроме того, Z ≈ 10 для типичных жидкостей в обычных условиях. Установлено, что разница между координационными числами компонентов незначительно влияет на точность прогнозирования MIVM. Однако лучшие результаты получены, когда Z близко к 10. Таким образом, в целях упрощения MIVM значения Zi и Zj могут быть равны 10. Кроме того, молярный объем i-компонента в жидком состоянии Vmi может быть заменен его молярным объемом в твердом состоянии Vi, поскольку разность плотностей для вещества между жидким и твердым состояниями небольшая, то уравнение (7) можно упростить:
в т i / — = X[ ln ■ RT 1 V
y i
x i y i +x j y j B ji
)
, , / yj A r /B ji lnB ji B ij lnB ijX
+ X,- In ---------- _ 5x j Xi —--- — +— ---- .
J V x j y j +x i y i B ij/ 7 \xi +x j B ji x j +x i B ij/
Уравнения (9) и (10) также можно упростить до следующего вида:
InY i = 1 + ln
y i x i y i +x j y j B ji
)_f
x i y i x i y i +x j y j B ji
, X jyi B ij )
X j y j +X i y i B ij)
_ 5X 2 f B>B ji + B>B ij )
7 \(x i +x j B ji )2 (x j +x i B ij) 2 /,
Iny, = 1 + ln f---- Уу ----) - f--- X j y ---+ X i y j B ji ) - 5x 2 f BvlnBij + B ji lnB ji )
7 \x j y j +x i y i B ij/ \ x j y j +x iyi B ij x i y i +x j y j B ji/ 1 'Xy+ixxi.13lf)2 (x i +x j B ji )2 /
Уравнения (13), (14), относящиеся к SMIVM , не содержат координационного числа чистого компонента, что делает эту модель более удобной, по сравнению с MIVM [21–26].
Давление насыщенных паров чистых компонентов, необходимое для расчета VLE , может быть получено следующим образом:
lg psat = AT ‒1 + B lg T + CT + D , (15)
где psat ‒ давление насыщенных паров чистого компонента, Па; T ‒ абсолютное значение температуры, К; коэффициенты A - D являются константами испарения.
Для проверки адекватности расчетных значений содержания компонентов сплавов в жидкой и газовой фазах сравнили их с экспериментальными данными. Для этого были вычислены показания среднего относительного отклонения (5 ; , %) и среднего квадратичного отклонения (5 j , мольные доли):
5 = ± too Zp_ |x(y)i,e.p-x(y)i,cai| _ 100 %, (16) ; П 1-1 | X(y)i,exp | г -1210,5
П ^ -А^Хехр - x(y) i,cal \ J , (17) где x ( y ) i , exp и x ( y ) i , cal – экспериментальные и расчетные значения содержания мольных долей компонента i в жидкой ( х ) и газовой ( у ) фазах соответственно; n – количество экспериментальных данных.
Методика исследований
Образцы сплавов Hg–Se для эксперимента массой 50–100 г каждый были подготовлены с использованием чистых ртути и селена (99,99 мас. %). Навески исходных металлов были проплавлены в индукционной печи в атмосфере аргона высокой чистоты для получения Hg–Se сплавов состава Hg/Se, мол. %: 20/80; 30/70; 40/60; 50/50; 60/40; 70/30; 80/20.
Лабораторные эксперименты по дистилляции компонентов сплавов проводились в вертикальной вакуумной печи. Давление в печи во время эксперимента составляло Р = 1,33–133 Па, температура Т = 823–1073 К. Состав образцов возгонов и остатков определяли из предварительно полученных растворов атомно-абсорбционным методом на установке GBC 933 АВ Plus . В экспериментах использовали образцы сплавов цилиндрической формы. Сначала образец помещали в цилиндрический тигель ( h = 40 мм, d = 40 мм) из тонкодисперсных зерен графита высокой плотности. Затем тигель переносили в вакуумную печи и нагревали, контролируя температуру. Для предотвращения испарения ме-
таллов на стадии плавления образца процесс осуществляли в атмосфере аргона при нормальном давлении. Разряжение в рабочей камере производили паромасляным диффузионным насосом при достижении необходимой температуры – этот момент считали началом вакуумной перегонки ( t = 0). Затем поддерживали в камере давление и температуру в течение заданного времени эксперимента. По окончании опыта выключали обогреватель, аргон заполнял камеру, давление в которой нормализовалось. Компоненты сплавов, перешедшие в возгоны, конденсировались на холодной пластине, подключенной к циркуляционной водной системе. При температуре 40 °С возгоны и остаток вынимали из печи и взвешивали.
Результаты и их обсуждение
Исходные характеристики Hg–Se сплава приведены в табл. 1.
Ртуть более легко возгоняется (p Hg = = 1,4·104–3,7·105 Па) по сравнению с селеном (P se = 1.3^10 8 3.5^Ю 4 Па), который преимущественно концентрируется в жидкой фазе, что позволяет их разделить вакуумной дистилляцией до определенной степени (табл. 2). Возможность отделения Hg от Se из их сплава вакуумной дистилляцией характеризуется коэффициентом разделения (β), для расчета которого используют коэффициенты активности (табл. 3, 4).
Значения β Hg > 1, поскольку cодержание Hg в газовой фазе больше, чем в жидкой ( у Hg >> x Hg ). Ртуть концентрируется в газовой фазе, селен – в кубовом остатке ( x Se >> у Se ), что разделяет исходный сплав Hg–Se на ртуть и селен. Коэффициент разделения ртути и селена возрастает (lgβ Hg = 1,0–2,73) по мере снижения температуры процесса (1073–823 К) и доли селена ( x Se = 0,9–0,1) в составе бинарного сплава (рис. 1).
Таблица 1
Значения параметров у " , у " , B tj , B jb Z t , Z j , p j , p j , V m ( i, ) сплава Hg-Se
Table 1
Parameter values у " , у " , Bu , B j t , Z t , Z j , p ^ , p j , V m y, ) alloy Hg-Se
|
i–j сплав |
Т , К |
∞ ∞ Y Hg /Y Se |
В |
Z |
|||
|
SHg-Se |
SSe-Hg |
Hg |
Se |
||||
|
Hg/Se |
705 |
0,398/0,482 |
1,0762 |
1,2714 |
10 |
10 |
|
|
Металл |
–А |
–В |
С |
D |
V m = f ( T ), см3/моль |
||
|
Hg |
3066 |
– |
– |
9,877 |
15,3[1 + 1,9·10‒4( T ‒ 752,9)] |
||
|
Se |
4990 |
– |
– |
10,214 |
16,2[1 + 2,1·10–4( T – 773,4)] |
||
Таблица 2
Рассчитанные давления паров Hg и Se
Table 2
Calculated vapor pressures Hg and Se
|
Т , К |
P Hg , Па |
P se , Па |
P Hg /P se |
|
823 |
1,418·106 |
1,415·104 |
100,21 |
|
923 |
3,591·106 |
6,423·104 |
55,91 |
|
1023 |
7,585·107 |
2,169·105 |
34,97 |
|
1073 |
1,046·107 |
3,66·105 |
28,58 |
Таблица 3
Рассчитанные значения коэффициентов активности Hg и Se в расплаве
Table 3
Calculated values of the activity coefficients Hg and Se in the melt
|
T , К |
γ |
x Hg |
||||
|
0,1 |
0,3 |
0,5 |
0,7 |
0,9 |
||
|
823 |
γ Hg /γ Se |
0,253/0,984 |
0,415/0,855 |
0,621/0,629 |
0,833/0,380 |
0,978/0,181 |
|
923 |
0,295/0,985 |
0,460/0,870 |
0,658/0,666 |
0,853/0,430 |
0,981/0,227 |
|
|
1023 |
0,334/0,987 |
0,499/0,883 |
0,689/0,696 |
0,868/0,473 |
0,984/0,270 |
|
|
1073 |
0,352/0,988 |
0,516/0,888 |
0,702/0,709 |
0,875/0,492 |
0,984/0,291 |
|
Таблица 4
Рассчитанные значения коэффициента разделения Hg и Se ( lgβHg )
Table 4
Calculated values of the separation coefficient Hg and Se ( lgβ Hg )
|
T , К |
x Hg |
0,1 |
0,3 |
0,5 |
0,7 |
0,9 |
|
823 |
lgβ Hg |
1,411 |
1,687 |
1,995 |
2,342 |
2,733 |
|
lg у Se |
‒0,587 |
‒1,339 |
‒2,0 |
‒2,71 |
‒3,688 |
|
|
923 |
lgβ Hg |
1,224 |
1,471 |
1,742 |
2,045 |
2,383 |
|
lg у Se |
‒0,456 |
‒1,136 |
‒1,750 |
‒2,415 |
‒3,338 |
|
|
1023 |
lgβ Hg |
1,073 |
1,296 |
1,539 |
1,807 |
2,105 |
|
lg у Se |
‒0,365 |
‒0,976 |
‒1,552 |
‒2,178 |
‒3,060 |
|
|
1073 |
lgβ Hg |
1,008 |
1,22 |
1,452 |
1,706 |
1,985 |
|
lg у Se |
‒0,329 |
‒0,909 |
‒1,467 |
‒2,078 |
‒2,940 |
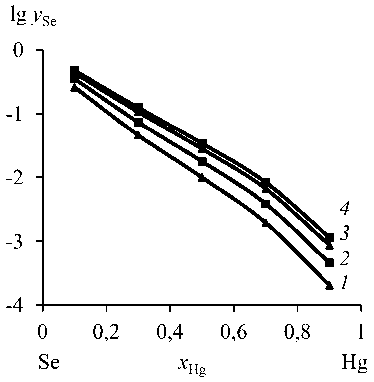
Рис. 2. Cодержание Se в возгонах при температуре, К: 823 ( 1 ); 923 ( 2 ); 1023 ( 3 ); 1073 ( 4 )
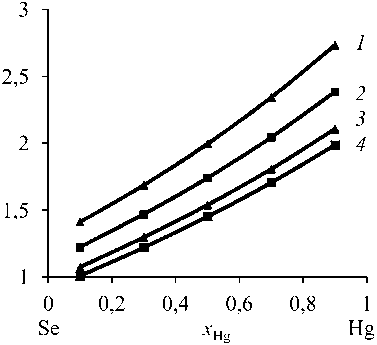
Рис. 1. Коэффициент разделения селена при вакуумной дистилляции Hg–Se сплава при температуре, К: 823 ( 1 ); 923 ( 2 ); 1023 ( 3 ); 1073 ( 4 )
Fig. 1. Selenium separation coefficient during vacuum distillation of Hg–Se alloy at temperature, K: 823 ( 1 ); 923 ( 2 ); 1023 ( 3 ); 1073 ( 4 )
Fig. 2. Selen content in sublimations at a temperature, K: 823 ( 1 ); 923 ( 2 ); 1023 ( 3 ); 1073 ( 4 )
Таблица 5
Данные по количественному составу продуктов дистилляции представлены на рис. 2 и в табл. 4, 5. Ртуть можно отделить от селена возгонкой при температуре ≤ 550 °С. Исходя из состава сплава ( x Se ) можно прогнозировать температуру, при которой количество возгоняемой примеси селена в конденсированной ртути не будет превышать заданную величину: для x Se (ат. %/мас. %), равного10/4,2, при 550 °С значение у Se (ат. %/мас. %) составляет 2,15·10–4/0,9·10–4, а для 800 °С ‒ у Se (ат. %/мас. %) достигает 11,48·10–4/4,82·10–4. В этом случае при увеличении температуры возгонки на 250 °С содержание селена в Hg-конденсате возрастает в ~ 5 раз.
Активности Hg и Se ( a Hg , a Se ) в расплаве определены с использованием рассчитанных значений коэффициентов активности этих компонентов (γ Hg , γ Se ) (рис. 3, табл. 3).
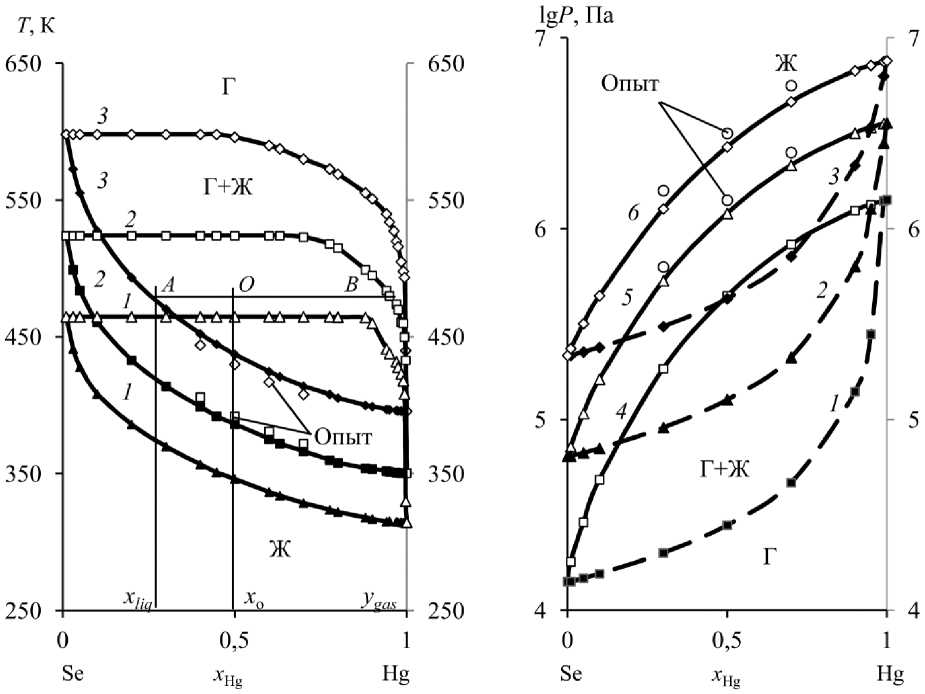
При построении « Т – х » диаграммы бинарной системы Hg–Se для каждой фиксированной температуры подбирали состав сплава ( х Hg ), при котором сумма парциальных давлений ртути и селена уравнивала внешнее давление (табл. 6, рис. 4 а ).
Установлено, что при увеличении глубины вакуума переход из жидкой в газовую фазу происходит в более узком диапазоне температур и способствует разделению Hg и Se, а именно: для получения конденсата ртути c возгонкой 90‒99 % элемента при давлении 133/13,3/1,33 Па и температуре 527‒598/460‒524/408‒464 К содержание примеси селена составит не более 0,553/0,369/0,224 мольных долей, что свидетельствует о благоприятном воздействии низкого остаточного давления в системе и, соответственно, температуры процесса на селективность при задан-
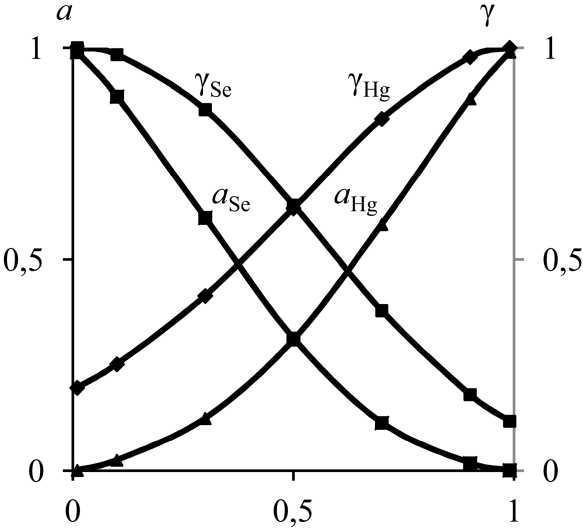
Рис. 3. Активности ( а ) и коэффициенты активности ( γ ) компонентов Hg–Se сплава при 823 К
Fig. 3. Activity ( а ) and activity coefficients ( γ ) of Hg–Se alloy components at 823 K
Рассчитанные значения lg у Se сплавa Hg–Se
Table 5
Calculated values of lg у Se Se of Hg–Se alloy
|
T , К |
x Hg |
0,01 |
0,03 |
0,05 |
0,07 |
0,09 |
|
823 |
γ Hg /γ Se |
0,197/1,0 |
0,208/0,999 |
0,220/0,996 |
0,233/0,992 |
0,246/0,987 |
|
lg у Se |
‒0,079 |
‒0,216 |
‒0,335 |
‒0,443 |
‒0,540 |
|
|
923 |
γ Hg /γ Se |
0,236/1,0 |
0,248/0,999 |
0,261/0,996 |
0,274/0,993 |
0,288/0,988 |
|
lg у Se |
‒0,054 |
‒0,155 |
‒0,248 |
‒0,335 |
‒0,417 |
|
|
1023 |
γ Hg /γ Se |
0,272/1,0 |
0,285/0,999 |
0,298/0,997 |
0,312/0,994 |
0,326/0,989 |
|
lg у Se |
‒0,040 |
‒0,117 |
‒0,190 |
‒0,262 |
‒0,330 |
|
|
1073 |
γ Hg /γ Se |
0,289/1,0 |
0,303/0,999 |
0,316/0,997 |
0,330/0,994 |
0,345/0,990 |
|
lg у Se |
‒0,035 |
‒0,103 |
‒0,169 |
‒0,234 |
‒0,298 |
Таблица 6
a)
b)
Рис. 4. Фазовые диаграммы « Т – х » ( а ) и « Р – х » ( b ) Hg–Se сплава при Р , Па:
1,33 ( 1 ); 13,33 ( 2 ); 133,3 ( 3 ) и Т , К: 823 ( 4 ); 923 ( 5 ); 1023 ( 6 )
Fig. 4. Phase diagrams of “ Т – х ” ( а ) and “ Р – х ” ( b ) Hg–Se alloy at P , Pa: 1,33 ( 1 ); 13,33 ( 2 ); 133,3 ( 3 ) and T , K: 823 ( 4 ); 923 ( 5 ); 1023 ( 6 )
ной степени возгонки ртути. Одновременно в кубовом остатке в указанных интервалах давления и температуры содержание селена возрастает на те же 90‒99 % металла.
Определены значения относительного (S i = 1,34 %) и квадратичного (S ^ = 6,82 К) отклонений между вычисленными и опытными значениями температур Т = 823‒1023 К и давлений Р = 1,33‒133,3 Па (рис. 4). Было получено порядка 20 экспериментальных значе-
ний температур плавления при различных давлениях в системе (рис. 4 а ) и столько же опытных значений давления при различных температурах (рис. 4 b ). Относительно невысокие абсолютные значения вычисленных средних отклонений свидетельствуют об адекватности модели процесса вакуумной дистилляции бинарного сплава в исследованных интервалах изменения давления ( Р ) и температуры ( Т ).
Рассчитанные значения T liq , у Se Hg–Se сплавa для « Т – х » диаграмм
Table 6
Calculated values of T liq , у Se Hg–Se alloy for “ Т – х ” diagrams
|
P , Па |
x Hg |
0,01 |
0,03 |
0,05 |
0,10 |
0,90 |
0,95 |
0,99 |
|
133 |
Т liq , К |
598,1 |
572,7 |
555,3 |
527,5 |
399,1 |
396,9 |
395,7 |
|
y Se |
0,553 |
0,231 |
0,120 |
0,0374 |
341,56·10‒10 |
66,24·10‒10 |
5,956·10‒10 |
|
|
13,3 |
Т liq , К |
524,2 |
499,1 |
484 |
460,8 |
353,4 |
351,6 |
350,45 |
|
y Se |
0,369 |
0,120 |
0,057 |
0,0159 |
300,35·10‒11 |
41,93·10‒11 |
3,26·10‒11 |
|
|
1,33 |
Т liq , К |
464,8 |
441,3 |
428 |
408,4 |
317,1 |
315,4 |
314,5 |
|
y Se |
0,224 |
0,059 |
0,025 |
0,0065 |
239,38·10‒12 |
25,21·10‒12 |
1,43·10‒12 |
Таблица 7
Таблица 8
Для фазовых диаграмм VLE может быть использовано правило рычага (правило отрезков) для прогнозирования количества вещества, остатков и возгонов при заданной температуре. Предполагая, что мольная доля Hg в сырье сплава х о = 0,5, соответствующая температура перегонки 480 К и давление 133 Па, по правилу «рычага» может быть построена линии связи АВ на « Т – х » диаграмме (рис. 4 а ), где кривые жидкости и пара пересекаются в точке А и В соответственно. Когда система достигает равновесия, составы А и В равняются х liq и y gas соответственно. По правилу рычага можно получить:
Пи д _ X 0 -y gas _ |0S| = 0,5-0,999 = 0,499
nqas "" Xltq-Xo - |ОЛ| 0,25-0,5 0,25 , где nliq = 0,499 и ngas = 0,25 – количество вещества в остатках и возгонах; |0S| и |0А| -
длина соответствующих отрезков на линии AB . Общее количество молей вещества ис-
ходного сплава n , то n = n liq + n gas :
Xo-Vgas |OS|0,499
Ицп _----—И _ -—"И =И
"'' XUq-ygas |ЛВ|0,749
0,666 n ,
И даз _
Xliq-Xo |ОЛ|0,25
—----И _ -—-и =И
Xltq-Vgas i^Bj0,749
0,334 n .
Результаты расчета диаграмм « Р – х » представлены на рис. 4 b , табл. 7, 8.
Диаграмма « Р – х » позволяет прогнозировать процесс дистилляции Hg–Se сплава по-
средством изменения величины остаточного давления в системе при фиксированной температуре. Например, при температуре 823 К и давлении Р gas = 1,4·105 Па равновесное содержание селена в Hg-возгонах/Se-остатке равняется 0,1/0,756 мольной доли. При повышении температуры до 1023 К аналогичный состав газовой фазы (Hg/Se = 0,9/0,1) сохраняется при более высоком давлении ( Р gas = 21,47·105 Па) и уменьшении содержания селена в кубовом остатке до ~ 0,58 мольных долей. В целом, данные « Р – х » диаграмм дополняют сведения « Т – х » диаграмм для бинарного сплава Hg–Se.
Изменение энергии Гиббса ДС Щ для бинарной смеси Hg–Se, определяется процессом удерживания вещества в пограничном слое фаз при переходе «жидкость – газ», обусловленном соотношением компонентов в сплаве и температурой системы (рис. 5, табл. 9).
Величина изменения энтальпии пограничного слоя (АН щ ) определяется энергией Гиббса и теплотой образования поверхности (ТА5:Щ ), где А5, Щ - изменение энтропии. Отрицательные значения изменения энтальпии АН Щ < 0 свидетельствуют об экзотермическом процессе дистилляции компонентов Hg–Se сплава. Небольшие абсолютные значения из-
Рассчитанные значения Р liq ·105 (Па) Hg–Se сплавa
Table 7
Calculated values Рliq ·105 (Pa) Hg–Se Alloy
|
Т , К |
x Hg |
||||
|
0,1 |
0,3 |
0,5 |
0,7 |
0,9 |
|
|
823 |
0,484 |
2,729 |
4,446 |
8,279 |
12,47 |
|
923 |
1,629 |
5,346 |
12,02 |
21,53 |
31,70 |
|
1023 |
4,457 |
12,71 |
26,85 |
46,34 |
67,30 |
Значения у Hg , P gas (Па), γ Hg , γ Se = 1,0 для « Р – х » диаграмм Hg–Se сплава
Table 8
Values of у Hg , P gas (Pa), γ Hg , γ Se = 1,0 for “ Р – х ” diagrams of Hg–Se alloy
|
T , К |
y Hg |
0,1 |
0,3 |
0,5 |
0,7 |
0,9 |
|
823 |
x Hg ·10–3 |
5,661 |
20,86 |
45,33 |
92,97 |
244,33 |
|
γ Hg |
0,194 |
0,203 |
0,218 |
0,248 |
0,364 |
|
|
P gas ·104 |
1,557 |
2,001 |
2,802 |
4,67 |
14,01 |
|
|
923 |
x Hg ·10–3 |
8,372 |
30,60 |
65,35 |
130,3 |
327,2 |
|
γ Hg |
0,235 |
0,248 |
0,271 |
0,317 |
0,487 |
|
|
P gas ·104 |
7,065 |
9,084 |
12,72 |
21,19 |
63,58 |
|
|
1023 |
x Hg ·10–3 |
11,52 |
41,55 |
87,37 |
170,68 |
419,02 |
|
γ Hg |
0,273 |
0,292 |
0,324 |
0,387 |
0,608 |
|
|
P gas ·104 |
23,86 |
30,67 |
42,94 |
71,57 |
214,7 |
Значения изменения термодинамических параметров Hg–Se сплавa
Values of changes in the thermodynamic parameters of the Hg–Se alloy
Таблица 9
Table 9
3. Равновесные диаграммы « Т – х » и « Р – х » для систем Hg–Se можно использовать, в частности, на предварительных этапах проектирования опытно-промышленного обо-
рудования для вакуумной дистилляции, а также для обоснования выбора диапазонов температуры и давления в системе с целью получения продуктов возгонки необходимого состава, минимизируя количество трудоемких и дорогостоящих установочных опытов.
Список литературы Фазовые равновесия в системе Hg-Se при вакуумной дистилляции
- Distribution model of lowly volatile impurity in rare earth metal purified by vacuum distillation / L. Zhang, X.-w. Zhang, Z.-a. Li et al. // Separation and Purification Technology. 2021. Vol. 262, 118314. DOI: 10.1016/j.seppur.2021.118314
- Experimental investigation and modeling of the Cu–Sn system in vacuum distillation / D. Wang, Y. Chen, Y. Li, B. Yang // Calphad. 2020, Vol. 70, 101991. DOI: 10.1016/j.calphad.2020.101991
- Королев А.А., Краюхин С.А., Мальцев Г.И. Фазовые равновесия для Pb–Sb–Sn сплава при вакуумной дистилляции // Вестник СамГТУ. Серия «Технические науки». 2018. № 1 (57). С. 128–141. eLIBRARY ID: 35302304
- Королев А.А., Краюхин С.А., Мальцев Г.И. Фазовые равновесия для сплава Pb–Sb–Ag при вакуумной дистилляции // Металлы. 2018. № 3. С. 57–67. eLIBRARY ID: 35110356
- Xiong N., Tian Y., Yang B. Results of recent investigations of magnesia carbothermal reduction in vacuum // Vacuum. 2019. Vol. 160. P. 213. DOI: 10.1016/j.vacuum.2018.11.007
- Liu T., Qiu K. Removing antimony from waste lead storage batteries alloy by vacuum displacement reaction technology // J Hazard Mater. 2018. Vol. 347. P. 334–340. DOI: 10.1016/j.jhazmat.2018.01.017
- Переработка Zn–Pb–Ag сплавов вакуумной дистилляцией / А.А. Королев, Г.И. Мальцев, К.Л. Тимофеев и др. // Расплавы. 2018. № 2 (1). С. 235–246. eLIBRARY ID: 34978976
- Равновесные фазовые диаграммы сплава Zn–Ag / А.А. Королев, Г.И. Мальцев, К.Л. Тимофеев, В.Г. Лобанов // Обработка металлов (технология, оборудование, инструменты). 2018. Т. 20, № 3. С. 72–84. DOI: 10.17212/1994-6309-2018-20.3-72-84
- Xiao J., Li J., Xu Z. Recycling metals from lithium ion battery by mechanical separation and vacuum metallurgy // Journal of Hazardous Materials. 2017. Vol. 338. P. 124–131. DOI: 10.1016/j.jhazmat.2017.05.024
- Zhang L., Xu Z. An environmentally-friendly vacuum reduction metallurgical process to recover germanium from coal fly ash // Journal of Hazardous Materials. 2016. Vol. 312. P. 28–36. DOI: 10.1016/j.jhazmat.2016.03.025
- Jia G.-b., Yang B., Liu D.-c. Deeply removing lead from Pb-Sn alloy with vacuum distillation // Transactions of Nonferrous Metals Society of China. 2013. Vol. 23, no. 6. P. 1822–1831. DOI: 10.1016/S1003-6326(13)62666-7
- Process optimization for vacuum distillation of Sn-Sb alloy by response surface methodology / A. Wang, Y. Li, B. Yang et al. // Vacuum. 2014. Vol. 109. P. 127–134. DOI: 10.1039/C9NR00932A
- Bolzoni L., Ruiz-Navas E.M., Gordo E. Quantifying the properties of low-cost powder metallurgy titanium alloys // Materials Science and Engineering: A. 2017. Vol. 687. P. 47–53. DOI: 10.1016/j.msea.2017.01.049
- Metallurgical and mechanical examinations of molybdenum/graphite joints by vacuum arc pressure brazing using Ti-Zr filler materials / L. Dong, W. Chen, L. Hou et al. // Journal of Materials Processing Technology. 2017. Vol. 249. P. 39–45. DOI: 10.1016/j.jmatprotec.2017.06.007
- Influence of sinter-cooling rate on the mechanical properties of powder metallurgy austenitic, ferritic, and duplex stainless steels sintered in vacuum / F. Martín, C. García, Y. Blanco, M.L. Rodriguez-Mendez // Materials Science and Engineering: A. 2015. Vol. 642. P. 360–365. DOI: 10.1002/jbm.b.34494
- Experimental investigation and modelling of phase equilibria for the Ag–Cu–Pb system in vacuum distillation / W.L. Jiang, C. Zhang, N. Xu et al. // Fluid Phase Equilibria. 2016. Vol. 417. P. 19–24. DOI: 10.1016/j.fluid.2016.02.026
- Application of MIVM for Pb-Sn System in Vacuum Distillation / L.X. Kong, Y.F. Li, B. Yang et al. // Journal of Vacuum Science and Technology. 2012. Vol. 32. P. 1129–1135. DOI: 10.1007/s11663-012-9726-3
- Thermodynamics of removing impurities from crude lead by vacuum distillation refining / X.F. Kong, B. Yang, H. Xiong et al. // Transactions of Nonferrous Metals Society of China. 2014. Vol. 24. P. 1946–1950. DOI: 10.1016/S1003-6326(14)63275-1
- Calculation of phase equilibrium in vacuum distillation by molecular interaction volume model / H.W. Yang, B.Q. Xu, B. Yang et al. // Fluid Phase Equilibria. 2012. Vol. 341. P. 78–81. DOI: 10.2298/JMMB140508021L
- Thirunavukarasu G., Chatterjee S., Kundu S. Scope for improved properties of dissimilar joints of ferrous and non-ferrous metals // Transactions of Nonferrous Metals Society of China. 2017. Vol. 27. iss. 7. P. 1517–1529. DOI: 10.1016/S1003-6326(17)60172-9
- Klippenstein S.J. From theoretical reaction dynamics to chemical modeling of combustion // Proceedings of the Combustion Institute. 2017. Vol. 36, iss. 1. P. 77–111. DOI: 10.1016/j.proci.2016.07.100
- Kenig E.Y., Blagov S. Chapter 10 – Modeling of Distillation Processes // Distillation. Fundamentals and Principles / Eds. A. Gorak, E. Sorensen. Academic Press, 2014. P. 383–436. DOI: book/2463094/bf9871
- Separation of boron and phosphorus from Cu-alloyed metallurgical grade silicon by CaO–SiO2–CaCl2 slag treatment / L. Huang, H. Lai, C. Gan et al. // Separation and Purification Technology. 2016. Vol. 170. P. 408–416. DOI: 10.1007/s12613-018-1698-0
- Jaeger W. Heat transfer to liquid metals with empirical models for turbulent forced convection in various geometries // Nuclear Engineering and Design. 2017. Vol. 319. P. 17–27. DOI: 10.1016/j.nucengdes.2014.11.001
- Isobaric vapor-liquid equilibria of hexamethyl disiloxane + ethyl acetate system at normal pressure / W.L. Zhang, N. Meng, R.Y. Sun, C.L. Li // Advanced Materials Research. 2011. Vol. 396–398. P. 968–972. DOI: 10.4028/www.scientific.net/AMR.396-398.968
- Wilson G.M. Vapor-Liquid Equilibrium. XI: A New Expression for the Excess Free Energy of Mixing // J. Am. Chem. Soc. 1964. Vol. 86. P. 127–130. DOI: 10.1021/je00030a018


