Фазовые равновесия в жидких железоуглеродистых сплавах, легированных иттрием и хромом
Автор: Михайлов Геннадий Георгиевич, Макровец Лариса Александровна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 3 т.17, 2017 года.
Бесплатный доступ
В рамках термодинамического моделирования рассматривается взаимодействие между компонентами металлического расплава и кислородом применительно к анализу процессов раскисления и легирования низкоуглеродистых низколегированных сталей, содержащих хром и иттрий. В данной работе использован метод построения поверхностей растворимости компонентов в жидком металле термодинамической системы Fe-Y-Cr-O-С. В рамках реализации этого метода детально исследована система Y2O3-Cr2O3, определены энтальпия и энтропия образования соединения Y2O3•Cr2O3, уточнены координаты точек эвтектического преобразования в системе Y2O3-Cr2O3. На основании уточненных координат линий ликвидус для оксидных двойных систем FeO-Cr2O3, FeO-Y2O3, и Y2O3-Cr2O3 определены энергетические параметры Qijkl в уравнениях зависимости активностей компонентов оксидного расплава FeO-Cr2O3-Y2O3 от состава в модели субрегулярных ионных растворов и рассчитаны координаты поверхности ликвидус оксидной системы FeO-Cr2O3-Y2O3. Так как углерод не растворим в оксидной системе, сопряженной с областью существования жидкого металла, установлено, что в качестве конденсированных неметаллических фаз после легирования металла хромом и модифицирования иттрием образуются оксиды Y2O3 и Cr2O3, соединение Y2O3•Cr2O3, оксидный расплав (FeO, Cr2O3, Y2O3) и газовая фаза {CO, CO2}. Дополнительные термодинамические расчеты показали возможность наличия в оксидном расплаве до 2 % двухвалентного хрома (Cr2+). Разработанная схема фазовых равновесий позволила установить константы равновесия образования оксидов, соединения оксидов, оксидных компонентов расплава и газовых фаз. Рассчитаны также по методу Вагнера активности компонентов металлических расплавов. Совокупность установленных термодинамических параметров позволила построить диаграмму поверхности растворимости компонентов в жидком металле (ПРКМ) и таким образом связать составы жидкой металлической фазы с составом сопряженных оксидных фаз.
Фазовые равновесия, иттрий, хром, диаграммы состояний, термодинамика, раскисление
Короткий адрес: https://sciup.org/147157102
IDR: 147157102 | УДК: 669.017 | DOI: 10.14529/met170301
Текст научной статьи Фазовые равновесия в жидких железоуглеродистых сплавах, легированных иттрием и хромом
В современном сталеплавильном процессе при выплавке углеродистых малолегированных конструкционных марок сталей повышение механических и эксплуатационных свойств стали добиваются введением в глубо-кораскисленный и провакуумированный металл сплавов, содержащих редкоземельные элементы [1, 2]. Введение РЗМ существенно измельчает литое зерно стали [3, 4], глобуля-ризирует неметаллические включения в стали [4]. Иттрий вводится в металл с целью повышения поверхностной жаростойкости стали. Значительная часть публикаций по этим проблемам отмечает суммарное действие многокомпонентных по РЗМ сплавов [5].
Приводятся также данные по использованию сплавов РЗМ цериевой группы [6], иттриевой группы [7], мишметалла [8]. Но зачастую в табличных данных приводятся просто цифры суммарного содержания редкоземельных элементов – Ce, La, Pr, Nd под общим обозначением РЗМ. Несмотря на в целом схожие химические свойства, в неметаллических включениях присутствуют РЗМ и в виде оксидных, и в виде сульфидных фаз в разных кристаллических образованиях [1]. Это связано и с разным химическим составом используемых сплавов, и с разным сродством редкоземельных металлов к кислороду. Для того чтобы появилась возможность дифференци- рования участия редкоземельных металлов в процессе раскисления, необходимо рассмотреть частные жидкометаллические системы, содержащие отдельные редкоземельные элементы. Вообще говоря, иттрий не относится формально к редкоземельным элементам, но по своим химическим свойствам он близок к редкоземельным металлам. Кроме того, оксиды иттрия входят в состав редкоземельных сырьевых материалов. В настоящей работе предлагается подробно рассмотреть термодинамику процессов раскисления стали иттрием. В методику расчетов входит выполнение ряда операций [9]. В частности, необходимо установить значения констант равновесия для реакций раскисления стали иттрием с образованием оксидов, комплексных оксидных соединений, значения констант равновесия для реакций образования жидких и газообразных фаз [9]. Далее, необходимо построить диаграммы состояний равновесных с металлом оксидных диаграмм состояний и на основании этих данных разработать метод построения поверхностей растворимости компонентов
(иттрия, хрома, кислорода и углерода) в жидком металле (ПРКМ) [10]. На таких диаграммах устанавливаются составы металла, находящегося в равновесии с соответствующими оксидными фазами.
На рис. 1 приведены результаты расчета координаты линий ликвидус, точек эвтектических превращений, а так же определены температуры и теплоты плавления оксидов Y 2 O 3 , Сr 2 O 3 и соединения Y 2 O 3 ·Cr 2 O 3 . Штриховой линией обозначены литературные данные [11], сплошной линией приведены данные, полученные расчетным путем в данной работе. Температуры плавления оксидов и соединения, используемые в расчете, взяты из справочника [11]. Некоторые расхождения с литературными данными наблюдаются в химическом составе эвтектик. Эти данные приведены в табл. 1. При получении расчетных табличных данных использовалась теория субрегулярных растворов. Расчетные формулы активностей в соответствии с этой теорией получены в приближении квадратичной зависимости координационного числа катионов в
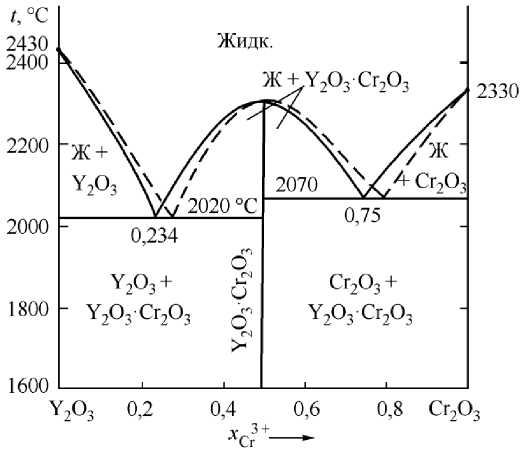
Рис. 1. Диаграмма состояний системы Y 2 O 3 –Сr 2 O 3 : сплошная линия, пунктир – литературная [11]
Таблица 1
Координаты инвариантных точек для системы Y 2 O 3 –Cr 2 O 3
Для оксидных расплавов системы Y2O3– Cr2O3 активности оксидов можно представить следующими выражениями:
In a 1 = 2ln x 1 + 21^3 x 1 x 2 Q 1 1 12 +
+ x 1 x 2 ( 2 - 3 x 1 ) Q 1122 + x 2 ( 1 - 3 x 1 ) Q 1222 ]/ ( RT ) ;
ln a 2 = 2ln x 2 + 2 1^ x 3 ( 1 - 3 x 2 ) Q 1112 +
+ x 1 x 2 ( 2 - 3 x 2 ) Q 1122 + 3 x 1 x 2 Q 1222 J/ ( RT ) , где Y2O3 – 1-й компонент, Cr2O3 – 2-й компонент.
По характерным экспериментальным координатам диаграммы состояний Y 2 O 3 –Cr 2 O 3 (см. рис. 1) установлены величины энергий смешения:
Q 1112 = –7075,
Q 1122 = –23 192,
Q 1222 = –5395 кал/моль, а так же рассчитаны термодинамические данные для образования соединения Y 2 O 3 ·Cr 2 O 3 (энтальпия и энтропия) из компонентов оксидного расплава:
A m H ° o = 63 340 кал/моль, T m
A mSL = 15,64 кал/(моль-К).
T m
В табл. 2 приведены константы реакций плавления, используемые для расчета диаграммы состояний системы Y 2 O 3 –Cr 2 O 3 (реакции (2)–(4)).
При введении в сталь иттрия и хрома состав продуктов раскисления определяется на диаграмме состояний FeO–Y 2 O 3 –Cr 2 O 3 . В литературе отсутствуют какие-либо надежные сведения о диаграмме состояний FeO–Y 2 O 3 –Cr 2 O 3 . Поэтому по данным уже исследованных двойных диаграмм состояний FeO–Y 2 O 3 [13], FeO–Cr 2 O 3 [14] и изученной в данной работе системы Y2O3–Cr2O3 были установлены энергетические параметры теории субрегулярных растворов для тройных систем [9]. Эти сведения представлены в табл. 3.
На рис. 2 представлен расчетный (смоделированный) вариант диаграммы состояний FeO–Y 2 O 3 –Cr 2 O 3 . Были выполнены также расчеты координат (состав и температура) инвариантных равновесий для данной диаграммы (табл. 4).
Из вида тройной оксидной диаграммы следует, что в легированной хромом и модифицированной иттрием стали, в зависимости от температуры и состава металла, возможно образование твердых оксидов |Cr 2 O 3 | и |Y 2 O 3 |, соединений |FeO·Cr 2 O 3 | и |Y 2 O 3 ·Cr 2 O 3 | и оксидного расплава (FeO, Y 2 O 3 , Cr 2 O 3 ). Но оксидный расплав может включать в себя еще и оксид хрома (II). Его активность была приравнена к ионной доле. Активности остальных компонентов оксидного расплава FeO, Y 2 O 3 , Cr 2 O 3 рассчитывали по теории субрегулярных ионных растворов с использованием параметров, приведенных в табл. 3.
Таблица 2
Термодинамические данные для реакций фазовых превращений, K – константа плавления оксидов и их соединений
|
№ |
Реакция |
lg K = – A / T + B |
|
|
A |
B |
||
|
1 |
|FeO| = (FeO) |
1749 |
1,061 |
|
2 |
|Y 2 O 3 | = (Y 2 O 3 ) |
4372 |
1,617 |
|
3 |
|Cr 2 O 3 | = (Cr 2 O 3 ) |
6557 |
2,519 |
|
4 |
|Y 2 O 3 ·Cr 2 O 3 | = (Y 2 O 3 ) + (Cr 2 O 3 ) |
13 845 |
3,419 |
|
5 |
|FeO·Cr 2 O 3 | = (FeO) + (Cr 2 O 3 ) |
12 093 |
4,894 |
Таблица 3
Параметры теории субрегулярных ионных растворов FeO–Y 2 O 3 –Cr 2 O 3
|
Система |
Энергетические параметры, кал/моль |
Источник |
||
|
FeO–Y 2 O 3 |
0 |
0 |
0 |
[13] |
|
FeO–Cr 2 O 3 |
1042 |
6382 |
1283 |
[14] |
|
Y 2 O 3 –Cr 2 O 3 |
–7075 |
–23 l92 |
–5395 |
Данная работа |
|
FeO–Y 2 O 3 –Cr 2 O 3 |
–9000 |
–18 000 |
–17 000 |
Данная работа |
Таблица 4
Инвариантные точки системы FeO–Y 2 O 3 –Cr 2 O 3
|
№ точки |
Равновесие |
Состав, ион. доли |
Т , °С |
||
|
x Fe2 + |
x Y 3 + |
x Cr3 + |
|||
|
1 |
FeO + Y 2 O 3 ·Cr 2 O 3 + Y 2 O 3 + жидкость |
0,77 |
0,22 |
0,01 |
1216 |
|
2 |
FeO·Cr 2 O 3 + FeO + Y 2 O 3 ·Cr 2 O 3 + жидкость |
0,90 |
0,06 |
0,04 |
1314 |
|
3 |
FeO·Cr 2 O 3 + Cr 2 O 3 + Y 2 O 3 ·Cr 2 O 3 + жидкость |
0,37 |
0,15 |
0,48 |
1789 |
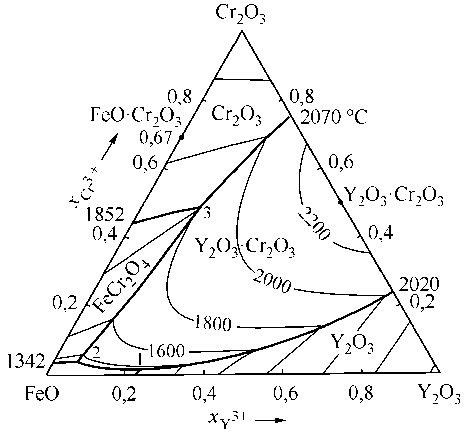
Рис. 2. Расчетные координаты поверхности ликвидус системы FeO–Y 2 O 3 –Cr 2 O 3 для температур выше 1400 °С
В табл. 5 приведены все возможные реакции, протекающие в хромсодержащем железе, раскисленном иттрием.
Активность компонентов в металлическом расплаве рассчитывалась с помощью параметров взаимодействия (по теории Вагнера), их численные значения приведены в табл. 6. Параметр eCYr в литературе не приво- дится. Но известны параметры взаимодействия хрома с сильными раскислителями [16]:
eCLra = 0,0108, eCCre = 0,00642, eCZrr = 0,013, eCMrg = 0,01213, eCCra= 0,016, eCArl = 0,00255.
Видно, что параметр взаимодействия хрома e C Y r в этом случае может быть порядка 0,01. Были проведены расчеты ПРКМ Fe–Y–Cr–O–C
Таблица 5
Зависимости констант равновесия реакций раскисления от температуры
|
№ |
Реакция |
lg K = – A / T + B |
|
|
A |
B |
||
|
1 |
(FeO) = [Fe] + [O] |
6320 |
4,734 |
|
2 |
(Y 2 O 3 ) = 2[Y] + 3[O] |
67 028 |
20,19 |
|
3 |
(Cr 2 O 3 ) = 2[Cr] + 3[O] |
33 460 |
14,85 |
|
4 |
(CrO) = 2[Cr] + [O] |
8203 |
4,51 |
|
5 |
|Y 2 O 3 | = 2[Y] + 3[O] |
71 400 |
21,81 |
|
6 |
|Cr 2 O 3 | = 2[Cr] + 3[O] |
40 014 |
17,37 |
|
7 |
|FeO·Cr 2 O 3 | = [Fe] + 2[Cr] + 4[O] |
51 870 |
24,48 |
|
8 |
|Y 2 O 3 ·Cr 2 O 3 | = 2[Y] + 2[Cr] + 6[O] |
114 333 |
38,459 |
|
9 |
{CO} = [C] + [O] |
1168 |
–2,07 |
|
10 |
{CO 2 } = [C] + 2[O] |
9616 |
2,51 |
Таблица 6
Параметры взаимодействия e i j в жидком железе, T = 1600 °С [15–17]
|
Элемент i |
Элемент j |
|||
|
Cr |
Y |
O |
С |
|
|
Cr |
–0,0003 |
0 |
–0,133 |
–0,104 |
|
Y |
0 |
0,030 |
–4,41 |
–1,21 |
|
O |
–0,041 |
–0,79 |
–0,2 |
–0,45 |
|
С |
–0,024 |
–0,16 |
–0,34 |
0,14 |
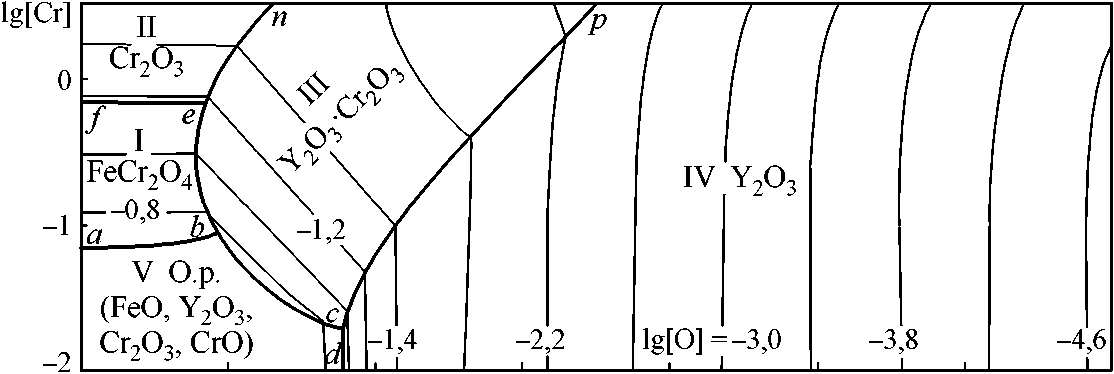
8 -7 -6 -5 -4 -3 -2 lg[Y]
а)
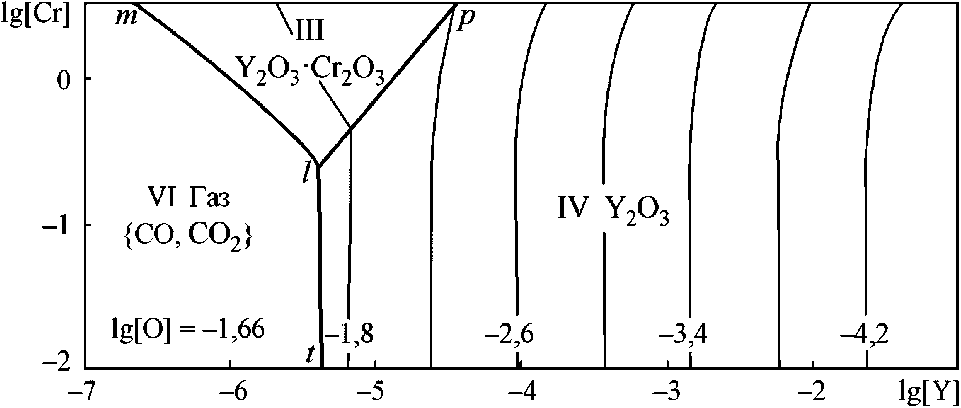
б)
Рис. 3. ПРКМ системы Fe–Y–Cr–O–С, 1600 °C, P общ = 1 атм: а) [C] = 0; б) [C] = 0,1 мас. %
для условий e C Y r = 0 и e C Y r = 0,01. Незначительная разница в результатах расчета начинает проявляться только при [Y] > 10–4 мас. % и [Cr] > 1 мас. %. Поэтому при более низких концентрациях Cr и Y можно считать величину e C Y r ≈ 0, что и было принято в расчетах.
Для расчета координат поверхности растворимости необходимо так же определить константы равновесия для основных реакций раскисления. Эти данные представлены в табл. 5.
На рис. 3, а представлены ПРКМ системы Fe–Y–Cr–O при 1600 °С. На полях рисунка заданы составы металла, равновесного с указанными на этих полях оксидными фазами.
На контрастных линиях заданы составы металла, равновесного с двумя соседними оксидными фазами, в узлах пересечений определены составы металла, равновесного с тремя оксидными фазами. Тонкими линиями обозначены изокислородные сечения ПРКМ. На рис. 3, б представлена ПРКМ системы Fe–Y–Cr–O–С при [C] = 0,1 мас. %. В области VI заданы составы жидкого металла, равновесного с газовой фазой (CO, CO 2 ) на основе CO.
Заключение
-
1. Рассмотрены термодинамические закономерности процессов раскисления иттрием хромсодержащей конструкционной стали. Впервые в приближении теории субрегуляр-
- ных ионных растворов построены диаграммы состояний оксидных систем Y2O3–Cr2O3 и FeO–Y2O3–Cr2O3. В результате расчетов диаграммы Y2O3–Cr2O3 подобраны термодинамические данные для образования соединения У-Оз^Сг-Оз (A mH ° =63 340 кал/моль, A mS° =
-
2. Установлены оксидные фазы, образующиеся после введения иттрия в хромсодержащую малоуглеродистую сталь. Показано, что в зависимости от температуры и исходного состава стали в качестве неметаллических включений могут образовываться твердые Y 2 O 3 , Cr 2 O 3 , FeO·Cr 2 O 3 , Y 2 O 3 ·Cr 2 O 3 , жидкие оксиды (FeO, Cr 2 O 3 , Y 2 O 3 , CrO) и газовая фаза {CO, CO 2 }.
-
3. Разработана методика расчета построения поверхностей растворимости компонентов (ПРКМ) в жидком металле системы Fe–Y–Cr–O–С. Установлена возможность образования в качестве неметаллических включений твердого Y 2 O 3 и соединения Y 2 O 3 ·Cr 2 O 3 .
T m T m
= 15,64 кал/(моль·К)) из компонентов оксидного расплава.
Статья выполнена при поддержке Правительства РФ (Постановление № 211 от 16.03.2013 г.), соглашение № 02.A03.21.0011.
Список литературы Фазовые равновесия в жидких железоуглеродистых сплавах, легированных иттрием и хромом
- Голубцов, В.А. Модифицирование стали для отливок/В.А. Голубцов, В.В. Лунев. -Челябинск; Запорожье: ЗНТУ, 2009. -356 с.
- Рябчиков, И.В. Модификаторы и технологии внепечной обработки железоуглеродистых сплавов/И.В. Рябчиков -М.: ЭКОМЕТ, 2008. -400 с.
- Лунев, В.В. Применение комплексных лигатур с РЗМ и ЩЗМ для улучшения свойств литых и деформированных сталей/В.В. Лунев, Ю.В. Шульте//Влияние комплексного раскисления на свойства сталей: темат. отраслевой сб. МЧМ СССР. -М.: Металлургия, 1982. -С. 33-50.
- Применение редкоземельных металлов в металлургии. -http://www.urm.ru/ru/75-journal124-article64.
- Аверин, В.В. Применение РЗМ в металлургии стали/В.В. Аверин//Металлургические методы повышения качества стали: сб. -М., 1979. -С. 33-40.
- Куликов, И.С. Раскисление металлов/И.С. Куликов. -М.: Металлургия, 1975. -504 с.
- Лопато, Л.М. Фазовые отношения в системах окись магния -окислы РЗЭ цериевой группы/Л.М. Лопато, Л.И. Лугин, А.В. Шевченко//Журнал неорганической химии. -1971. -Т. 16, № 1. -С. 131-133.
- Keune, H. Chimica -ein Wissensspeicher. Wiley-VCH Verlag GmbH & Co, KGaA, Weinheim, 1959 DOI: 10.1002/bbpc.19840880624
- Михайлов, Г.Г. Термодинамика раскисления стали/Г.Г. Михайлов, Д.Я. Поволоцкий. -М.: Металлургия, 1993. -144 с.
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем/Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. -М.: Издат. Дом МИСИС. -2009. -519 с.
- Диаграммы состояния силикатных систем. Справочник. Выпуск первый. Двойные системы/Н.А. Торопов, В.П. Барзаковский, В.В. Лапин, Н.Н. Курцева. -Л.: Наука, Ленингр. отд-ние, 1969. -822 с.
- Preliminary data on subsolidus phase equilibria in the La2O3-Сr2O3-Y2O3 and La2O3-Сr2O3-ZrO2 systems/M. Hrovat, S. Bernik, J. Holc et al.//Journal of Materials Science Letters. -1995. -No. 14. -P. 1684-1687 DOI: 10.1007/BF00422675
- Михайлов, Г.Г. Термодинамическое моделирование фазовых равновесий с оксидными системами, содержащими РЗМ. Сообщение 2. Диаграммы состояния оксидных систем с Y2O3/Г.Г. Михайлов, Л.А. Макровец//Вестник ЮУрГУ. Серия «Металлургия». -2014. -Т. 14, № 4. -С. 5-10 DOI: 10.14529/met150401
- Михайлов, Г.Г. Термодинамический анализ процессов раскисления корозионностойкой стали Х18Н10Т кальцием и барием/Г.Г. Михайлов, Л.А. Чернова//Известия вузов. Черная металлургия. -1991, № 12. -С. 37-40.
- Bůžek, Z. Vliv přechodných kovú na aktivitu a rozpustnost kysliku v železe při 1600 °C/Z. Bůžek, M. Macoszek, J. Szlauer//Hutnické listy. -1972. -vol. 27, no 8. -P. 547-557.
- Параметры взаимодействия первого порядка. -http://steelcast.ru/first-order_ interaction_coefficients.
- Балковой, Ю.В. Параметры взаимодействия первого порядка в расплавах на основе железа: Обзор. информ./Ю.В. Балковой, Р.А. Алеев, В.К. Баканов. -М.: Ин-т «Черметинформация», 1987. -42 с.


