Фазовые равновесия в жидкой стали при введении церия
Автор: Михайлов Геннадий Георгиевич, Макровец Лариса Александровна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 2 т.13, 2013 года.
Бесплатный доступ
Рассмотрены термодинамические аспекты процессов раскисления стали сплавами, содержащими церий. На основании данных о теплотах и температурах плавления в приближении теории совершенных растворов был установлен вид диаграмм состояния систем FeO-Ce 2O 3, FeO-CeO 2, CeO 2-Ce 2O 3. Построена поверхность растворимости церия, кислорода и углерода в жидком железе. Установлено, что включения CeO 2 могут появляться в стали при супернизких концентрациях церия и высоком содержании кислорода. При обычных концентрациях, достигаемых при вводе церия в металл (200-300 г/т), в качестве неметаллических включений возможно образование либо комплексных оксидных расплавов, либо Ce 2O 3.
Церий, неметаллические включения, диаграммы
Короткий адрес: https://sciup.org/147156828
IDR: 147156828 | УДК: 669.18.046.552
Текст научной статьи Фазовые равновесия в жидкой стали при введении церия
Редкоземельные металлы, от Ce до Lu, в периодической системе элементов обратили на себя внимание металлургов как эффективные модификаторы. Широкому внедрению в сталеплавильное производство редкоземельных металлов мешает их дороговизна, отсутствие стабильного производителя модификаторов редкоземельных металлов (РЗМ), сложность определения рационального количества вводимых модификаторов и необходимость неукоснительного выполнения технологии модифицирования. Установлено, что введение в сталь РЗМ измельчает первичное зерно литого металла и тем самым повышает технологическую пластичность стали, а также снижает анизотропию механических свойств. РЗМ имеют высокое сродство к кислороду, сере, фосфору, к ряду примесей цветных металлов в стали, образуя тугоплавкие соединения с этими примесями.
В настоящее время в промышленном масштабе выпускают комплексные модификаторы, получаемые в основном кремнийтермическими методами. Компания НПП «Технология» разработала серию комплексных модификаторов кристаллической структуры, содержащих Ca, Ba, Al, РЗМ, Ti, Si, объединенных общей маркой INSteel. Эти модификаторы успешно применены для модифицирования стали на Челябинском трубопрокатном заводе, заводе Волгоцеммаш, Ижевском механическом и Минском автомобильном заводах. Подробно производство модификаторов, технология их использования, составы модификаторов изложены в содержательной монографии И.В. Рябчикова [1].
В связи с расширением производства сталей, модифицированых лигатурами с РЗМ, необходимо рассмотреть термодинамические закономерности, лежащие в основе модифицирования, установить концентрационные области реализующихся фазовых равновесий в глубокораскисленных сталях. Рафинирование стали в агрегатах комплексной обработки с последующим вакуумированием позволяет стабильно получать металл с содержанием кислорода 1–4 ppm и серы с содержанием 20 ppm.
Как показано во многих работах, стали нефтекомплексов не должны содержать в качестве неметаллических включений сульфидов кальция, марганца, алюминатов кальция и магния, которые активируют процессы локальной коррозии в сероводородных и солевых средах [2, 3]. Эти включения – коррозионно-активны (КАНВ). В современных трубных сталях таких включений не должно содержаться более двух на 1 мм2 поля зрения. В работе [4] предлагается использовать церий как модификатор КАНВ путем создания на поверхности КАНВ защитной оболочки из химических соединений CeO2 и Ce2O3. На основе разработанных представлений рекомендовано иметь порядка 50 ppm Ce в предварительно раскисленной (5–10 ppm общего кислорода и 10–20 ppm серы) стали.
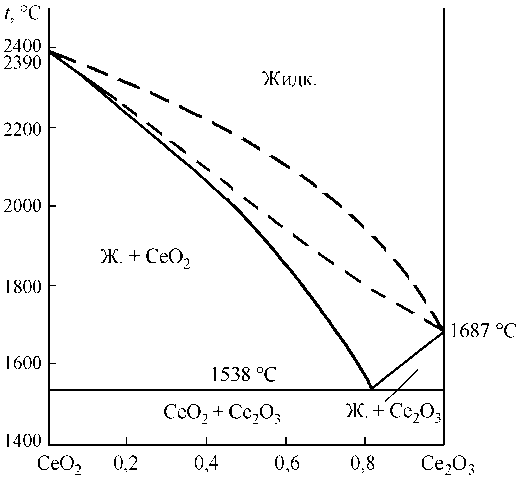
Для выполнения расчетов фазовых равновесий необходимо иметь информацию о строении диаграмм состояния систем FeO–Ce 2 O 3 , FeO–CeO 2 , CeO 2 –Ce 2 O 3 . К сожалению, абсолютно точного вида этих диаграмм установить не удалось. В литературе не указывается даже вид диаграммы состояний CeO2–Ce2O3. В связи с этим на основании данных о теплотах и температурах плавления в приближении теории совершенных растворов был установлен вид диаграмм состояния этих систем. Результаты расчетов представлены на рис. 1–3. Исходные данные для расчетов приведены в табл. 1.
На рис. 3 представлено 2 варианта строения диаграммы CeO 2 –Ce 2 O 3 :
-
1. Учтена неограниченная взаимная растворимость CeO 2 и Ce 2 O 3 в жидком и твердом состоянии (штриховая линия).
-
2. Допущена полная растворимость в жидком состоянии и полная нерастворимость в твердом с наличием эвтектического превращения.
В многочисленных промышленных источниках указывается, что CeO2 практически не встречается в качестве неметаллических включений в стали, модифицированной церием. В основном во включениях содержится Ce 2 O 3 . В связи с тем, что
Таблица 1
Исходные данные для расчета диаграмм состояния
|
Оксид |
Δ H пл , кал |
T on T пл , С |
lg K пл |
|
FeO |
8000 |
1375 |
–1750/ T + 1,061 |
|
CeO 2 |
19 000 |
2390 |
–4154/ T + 1,56 |
|
Ce 2 O 3 |
20 000 |
1687 |
–4372/ T + 2,23 |
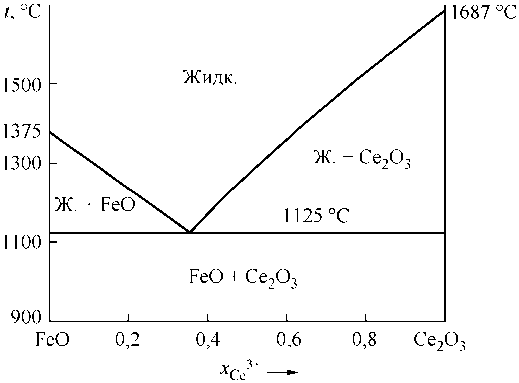
Рис. 1. Диаграмма состояния системы FeO–Ce 2 O 3
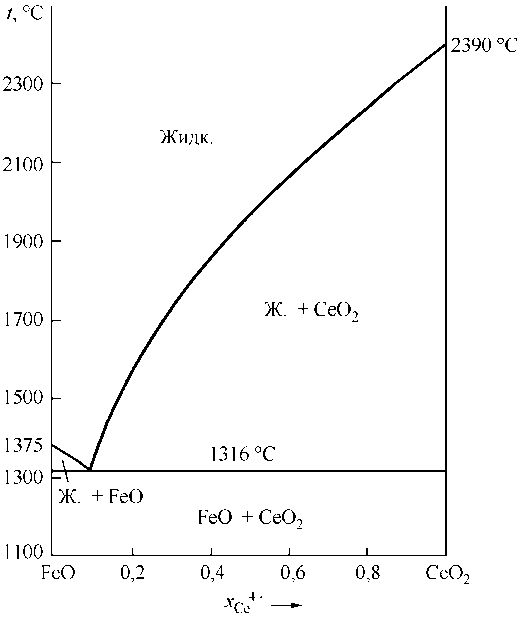
Рис. 2. Диаграмма состояния системы FeO–CeO 2
^Ce3+
Рис. 3. Диаграмма состояния системы CeO 2 –Ce 2 O 3
фаза типа CeO 2 обнаруживается в стали редко, предпочтение следует отдать 2 варианту строения диаграммы CeO 2 –Ce 2 O 3 .
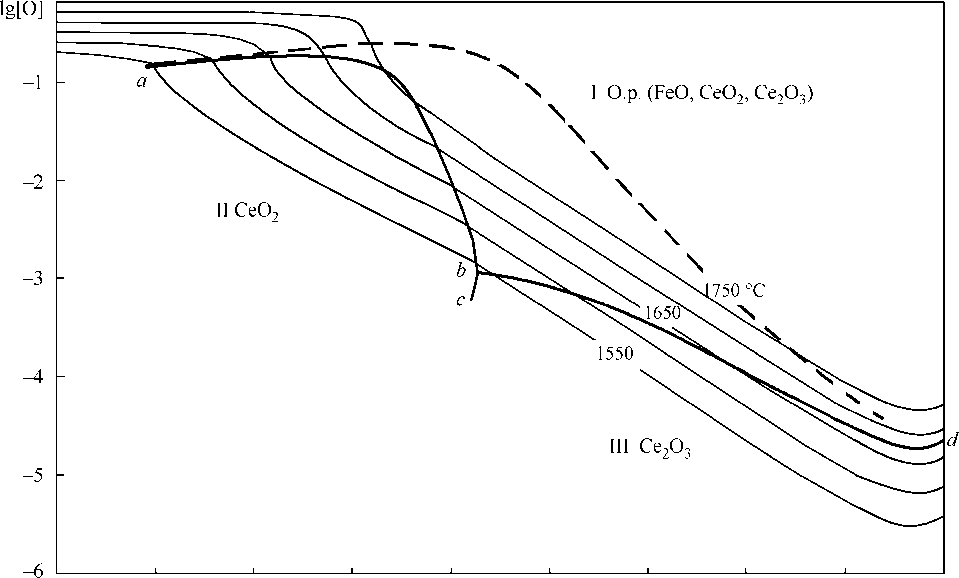
Анализ литературных данных позволил заключить, что в равновесии с металлическим расплавом могут находиться твердые оксиды церия (трех- и четырехвалетного) и оксидный расплав (FeO, CeO2, Ce2O3). В присутствии углерода возможно образование газовой фазы (СО, СО2). Соответствующие зависимости констант равновесия от температуры приведены в табл. 2. На рис. 4 приведена поверхность растворимости компонентов в металле (ПРКМ) системы Fe–Ce–O. На ПРКМ нанесены составы жидкого металла, равновесного с оксидными фазами. Тонкими линиями показаны изотермические сечения поверхности растворимости. При выполнении расчетов принималось, что оксидные расплавы представляют собой идеальные ионные растворы. Активности компонентов металлического расплава определялись с помо- щью параметров взаимодействия (табл. 3). Методика расчета ПРКМ изложена в [5]. Из рис. 4 видно, что фаза CeO2 может зарождаться в металле при концентрации кислорода от тысячных до 0,1 мас. % и содержании церия менее 0,00001 мас. %. Штриховая линия на рис. 4 показывает возможную границу в составе металла, равновесного с жидкой и твердой оксидными фазами переменного состава (вариант 1 диаграммы CeO2–Ce2O3, см. рис. 3). Но тогда при температурах сталеварения было бы возможно появление кристаллоподобных неметаллических включений. Между тем, отмечается, что включения с церием имеют глобулярную форму.
Влияние углерода (рис. 5) качественно ничего не меняет. В области V заданы составы металла, равновесного с газовой фазой. При таких соотношениях концентраций углерода и церия в металле раскислителем является углерод, а церий влияет только на коэффициенты активности. На ПРКМ присутствуют две области составов жидкого металла, равновесного с оксидными расплавами, как это следует из рис. 4. В области I нанесены составы жидкого металла, равновесного с оксидным расплавом на основе FeO и CeO2 со следами Ce2O3, в области IV оксидный расплав содержит x Ce 3 + > 0,7.
Таблица 2
Зависимость констант равновесия от температуры
|
Реакция |
lg K = – A / T + B |
|
|
A |
B |
|
|
(FeO) = [Fe] + [O] |
6320 |
4,734 |
|
(CeO 2 ) = [Ce] + 2[O] |
39 540 |
11,99 |
|
(Ce 2 O 3 ) = 2[Ce] + 3[O] |
64 128 |
17,37 |
|
|CeO 2 | = [Ce] + 2[O] |
43 694 |
13,55 |
|
|Ce 2 O 3 | = 2[Ce] + 3[O] |
68 500 |
19,60 |
|
{CO} = [C] + [O] |
1168 |
–2,07 |
|
{CO 2 } = [C] + 2[O] |
9616 |
2,51 |
Таблица 3
Параметры взаимодействия ei j , Т = 1600 °С, растворитель – жидкое железо [6]
|
Элемент i |
Элемент j |
||
|
Ce |
O |
С |
|
|
Ce |
0,0039 |
–4,55 |
–1,24764 |
|
O |
–0,52 |
–0,2 |
–0,45 |
|
С |
–0,103 |
–0,34 |
0,14 |
-9 -8 -7 -6 -5 -4 -3 -2 -1 lg[Ce]
Рис. 4. Поверхность растворимости системы Fe–Ce–O: штриховая линия – |CeO 2 , Ce 2 O 3 | тв.р
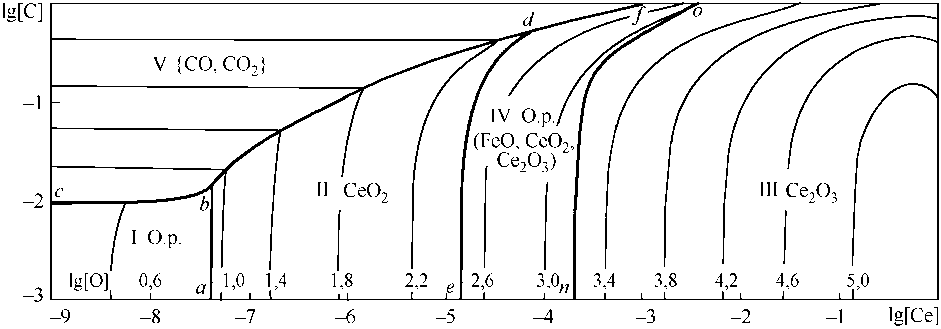
Рис. 5. ПРКМ системы Fe–Ce–C–O, P общ = 1 атм, T = 1600 °C
При содержании углерода в металле порядка 0,4 мас. % (см. рис. 5) чистая фаза CeO2 может образоваться при концентрации церия в металле порядка 10–5 мас. % и ниже. Это не отвечает металлургической практике.
Выводы
-
1. Построена поверхность растворимости церия, кислорода и углерода в жидком железе.
-
2. Установлено, что включения CeO2 могут появляться в стали при супернизких концентрациях церия и высоком содержании кислорода.
-
3. При обычных концентрациях, достигаемых при вводе церия в металл (200–300 г/т) в качестве неметаллических включений возможно образование либо комплексных оксидных расплавов, либо Ce 2 O 3 .
Работа выполнена в рамках Государственного задания Министерства образования и науки РФ и частично поддержана грантом РФФИ № 13-08-12167.
Список литературы Фазовые равновесия в жидкой стали при введении церия
- Рябчиков, И.В. Модификаторы и технологии внепечной обработки железоуглеродистых сплавов/И.В. Рябчиков. -М.: Экомет, 2008. -400 с.
- Реформатская, И.И. Роль неметаллических включений и микроструктуры в процессе локальной коррозии углеродистых и низколегированных сталей/И.И. Реформатская, И.Г. Родионова, Ю.А. Бейлин//Защита металлов. -2004. -Т. 40, № 5. -С. 498-503.
- Голованов, А.В. Освоение производства проката и труб из сталей 20-КСХ с гарантированной чистотой по коррозионноактивным неметаллическим включениям в углеродистых и низколегированных сталях/А.В. Голованов, П.П. Степанов, И.Г. Родионова//Сборник трудов научнопрактического семинара -Череповец: Металлургиздат, 2005. -С. 34-38.
- Совершенствование режимов обработки трубной стали церием/Д.А. Мовенко, Г.И. Котельников, А.Е. Семин и др.//Электрометаллургия. -2012. -№ 8. -С. 7-12.
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем/Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов -М.: Издат. Дом МИСИС. -2009. -519 с.
- Buzek, Z. Zakladni termodynamicke udaje o metalurgickych reakciah/Z. Buzek//Hutnicke listy. -1979. -Т. 20, № 1-2. -S. 3-111.


