Фенолоксидазная активность штаммов микромицетов, выделенных из ризосферы овощных бобовых культур
Автор: Куркина Ю.Н.
Журнал: Овощи России @vegetables
Рубрика: Защита растений
Статья в выпуске: 6 (50), 2019 года.
Бесплатный доступ
Актуальность. Микроскопические грибы проявляют наибольшую экзоферментативную активность, а ксилотрофны способны обладают комплексом оксидазных и гидролазных ферментов для разрушения лигнина. Методы. Среди почвообитающих микромицетов, выделенных из ризосферы однолетних бобовых культур, проведен поиск штаммов, перспективных с точки зрения технологии эффективных микроорганизмов, для создания оптимальных условий повышения плодородия почвы и урожайности сельскохозяйственных культур. Выявление общей фенолоксидазной активности осуществляли по методу Бавендамма, культивируя штаммы на микробиологическом агаре с добавлением ароматического производного лигнина (0.06 % танина) и вычисляли ростовой коэффициент. О целлюлазной активности штаммов судили по степени гидролиза фильтровальной бумаги. Выявлено, что штаммы Alternaria alternate, Bipolaris, Botrytis fabae, Cunninghamella echinulata, Curvularia lunata, Macrophoma phaseolicola, Trichoderma koningii, Trichoderma viride и Ulocladium botrytis способны расщеплять лигнин и целлюлозу...
Ферменты грибов, фенолоксидазная активность, грибы ризосферы, овощные бобовые культуры, бобы, фасоль, арахис, вигна, болезни растений
Короткий адрес: https://sciup.org/140245797
IDR: 140245797 | УДК: 579.582.28:635.65 | DOI: 10.18619/2072-9146-2019-6-109-112
Текст научной статьи Фенолоксидазная активность штаммов микромицетов, выделенных из ризосферы овощных бобовых культур
Фенолоксидазная активность штаммов микро-мицетов, выделенных из ризосферы овощных бобовых культур. Овощи России. 2019;(6):109-112.
Овощные бобовые культуры пользуются обоснованным спросом во всем мире и не только входят в состав продуктов питания высокой биологической ценности (с высоким содержанием растительного белка, витаминов и микроэлементов), но и являются важным звеном в севооборотах (обогащая почву азотом). Кроме того, микофлора ризосферы бобовых куль- тур может представлять интерес и с точки зрения технологии эффективных микроорганизмов, которая внедряется для сохранения и воспроизводства почвенного плодородия и нацелена на создание оптимальных условий для повышения урожайности возделываемых культур [1, 2]. Благодаря таким прогрессивным технологиям с использованием биологических агентов, лигноцеллюлозные растительные отходы сельского хозяйства могут быть переработаны в ценные целевые продукты при снижении темпов загрязнения окружающей среды. Так, известно, что микромицеты проявляют наибольшую экзоферментативную активность и используют до 60% субстрата на построение своих клеток, но только ксилотрофные грибы, обладая комплексом оксидазных и гидролазных ферментов, способны преодолеть лигнин, строение которого делает его труднодоступным для ферментных систем других микроорганизмов [3-7].
С другой стороны, сельскохозяйственные почвы накапливают фитопатогенное начало. В литературе проводятся данные о ферментативной активности фитопатогенных грибов, например, Fusarium, Bipolaris, Alternaria [8, 9]. При развитии инфекционного процесса патоген проникает в растение, задействуя именно ферментные комплексы. Поэтому среди многочисленных ферментов грибов особый интерес представляют те, которые необходимы для разрушения клеточной стенки растений. Известно, что способность микроскопических грибов синтезировать, например, целлюлазы, свидетельствует о патогенности [9, 10].
Способность некоторых патогенных грибов выделять различные ферменты исследована в ряде работ [9-11]. Однако число этих грибов невелико и патогены в данном аспекте исследованы недостаточно. В наших предыдущих исследованиях выявлены различия по видо- вому составу и численности микромицетов между образцами почв из-под разных бобовых [12], однако, микофлора ризосферы часто возделываемых овощных бобовых культур, как источников грибов-биодеструкторов, требует более детальных исследований. В связи с этим, целью данной работы явилось изучение фенолоксидазной способности микроскопических грибов, выделенных из ризосферы популярных овощных бобовых культур.
Материал и методы исследования
Исследованные грибы были выделены из ризосферы овощных бобов ( Vicia faba L.) и фасоли ( Phaseolus vulgaris L.), вигны ( Vigna radiata L.) и арахиса ( Arachis hypogaea L.). В качестве материала для исследований использовали почвенные образцы, отобранные в области ризосферы (0-4 мм). За каждый образец корневой почвы принимали не менее 10 растений одного вида без симптомов поражения болезнями, отобранных в период бутонизации – цветения с каждой опытной делянки в ботаническом саду НИУ «БелГУ». Почва исследованных участков – чернозем типичный, средний суглинок, мелкокомковатый по структурному составу, рН водной вытяжки (активная кислотность) на уровне 7,6; рН солевой вытяжки (обменная кислотность) – 6,9. Выделение грибов в чистую культуру проводили согласно общепринятым методикам [13], таксономическую принадлежность грибов определяли по совокупности культурально-морфологических признаков с помощью специальных руководств [14, 15].
Выявление общей фенолоксидазной активности осуществляли по методу Бавендамма, для чего исследуемые штаммы культивировали на микробиологическом (голодном) агаре с добавлением ароматического производного лигнина (0.06 % танина) и инкубации при температуре 25...27°С в течение 10 суток. Штаммы с наиболее выраженной активностью (интенсивное образование пигмента) отбирали для последующего измерения диаметра колоний и вычисления ростового коэффициента (отношение диаметра колонии на субстрате с добавлением танина к диаметру колонии без танина) [3]. О целлюлазной активности штаммов судили по степени гидролиза фильтровальной бумаги, визуально
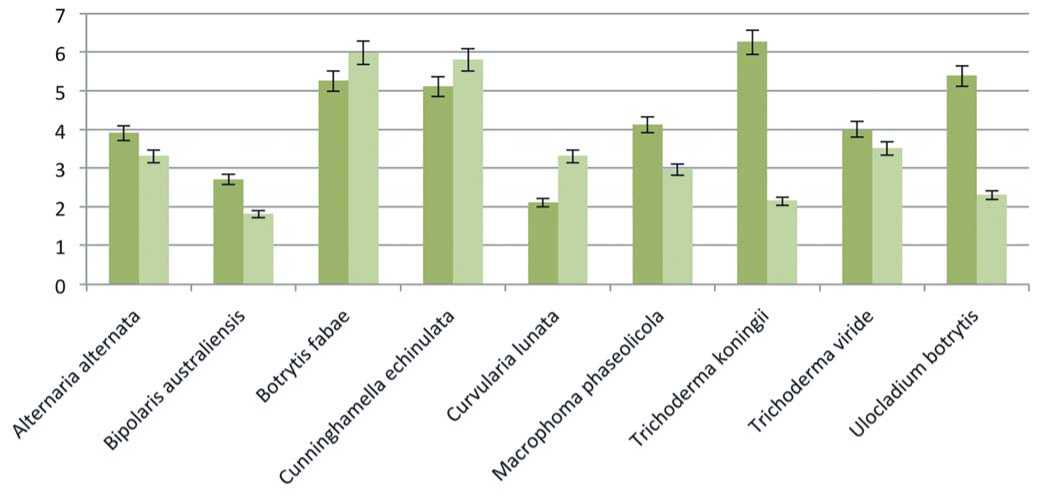
Рис.1. Диаметр колоний микромицетов на агаре с добавлением 0.06% танина (темный, левый столбец) и без добавления танина (светлый, правый столбец), планки погрешностей приведены с использованием 5% значений
Fig. 1. The diameter of the colonies of micromycetes on agar with the addition of 0.06% tannin (dark, left column) and without the addition of tannin (light, right column), error bars are given using 5% values
отмечая ее разрушение по 5-балльной шкале на 14-е сутки [7].
Результаты и их обсуждение
В лаборатории микологии из ризосферы овощных бобовых культур выделены более 100 штаммов мирко-мицетов. Для определения ферментативной активности отобраны штаммы 9-ти видов ( Alternaria alternata (Fr.) Keissl., Bipolaris australiensis (M.B. Ellis) Tsuda&Ueyama, Botrytis fabae Sard., Cunninghamella echinulata Thaxter, Curvularia lunata (Wakker) Boedijn, Macrophoma phaseolicola L.A. Kantsch., Trichoderma koningii Oudem, Trichoderma viride Pers., Ulocladium botrytis Preuss), встречающихся в почвенных образцах большинства исследуемых культур и/или известных своими фитопатогенными свойствами [16-18].
Штаммы A. alternata, B. australiensis, M. phaseolicola,
T. koningii, T. viride, U. botrytis проявили реакцию Бавендамма, однако их радиальная скорость роста и ростовой коэффициент существенно различались (рис. 1, табл.).
Данные диаграммы свидетельствуют, что диаметр колоний B. fabae, C. echinulata, C. lunata на контрольной среде (без добавления танина) был достоверно больше, чем на питательной среде с танином, однако реакция Бавендамма отмечена и для этих видов. У остальных штаммов диаметр колоний, выросших на среде с танином, был достоверно выше, чем в контроле. Причем, визуальное проявление фенолоксидазной активности было наиболее выражено у представителей: T. koningii и U. botrytis (рис. 2).
Однако выделить образцы с достоверно большей среди изучаемых образцов грибов фенолоксидазной активностью, используя лишь диаметр роста колоний,
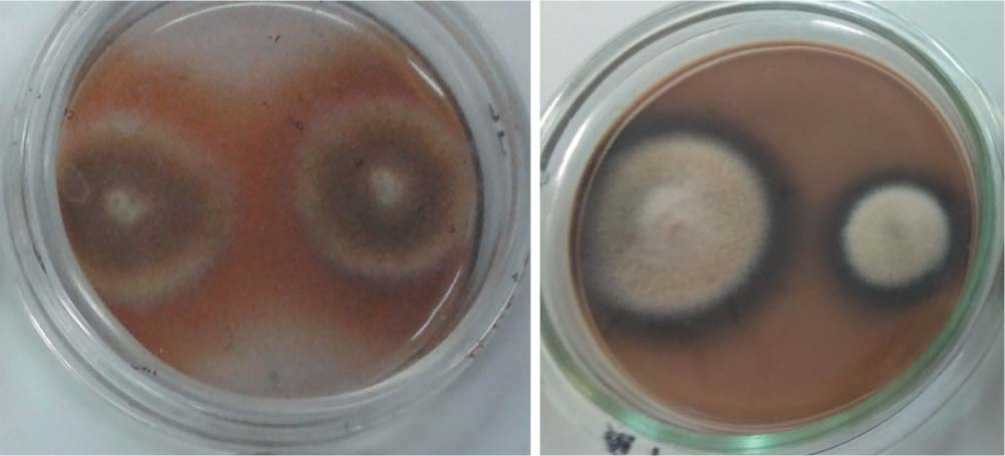
Рис. 2. Проявление реакции Бавендамма в чашках с Trichoderma koningii и Ulocladium botrytis, культивируемых на агаре с добавлением танина
Fig. 2. The manifestation of the reaction Bevendamm cups with Trichoderma koningii and Ulocladium botrytis, cultivated on agar with the addition of tannin
Таблица. Значения ростового коэффициента проявление целлюлазной активности разных штаммов Table. The values of growth coefficient manifestation of cellulase activity of different strains
|
Виды микромицетов |
Патогенность штамма |
Ростовой коэффициент при определении фенолоксидазной активности |
Целлюлазная активность, балл |
|
Alternaria alternata (Fr.) Keissl. |
ФП |
1.2 |
1.8 |
|
Bipolaris australiensis (M.B. Ellis) Tsuda & Ueyama |
ФП |
1.5 |
1.8 |
|
Botrytis fabae Sard. |
ФП |
1 |
1 |
|
Cunninghamella echinulata Thaxter |
НП |
1 |
0.5 |
|
Curvularia lunata (Wakker) Boedijn |
ФП |
0.6 |
3.8 |
|
Macrophoma phaseolicola L.A. Kantsch. |
ФП |
1.4 |
2 |
|
Trichoderma koningii Oudem |
НП |
2.9 |
1.8 |
|
Trichoderma viride Pers. |
НП |
1.1 |
3 |
|
Ulocladium botrytis Preuss |
ФП |
2.3 |
4.7 |
Условные обозначения: ФП – фитопатогенный, НП – непатогенный.
представляется затруднительным. Ростовой коэффициент, средние значения которого представлены в таблице, позволяет провести ранжирование штаммов. Так, у штаммов T. koningii и U. botrytis ростовой коэффициент наибольший по опыту (соответственно 2.9 и 2.3).
Штаммы T. koningii и U. botrytis , которые могут представлять интерес для биотехнологии еще и высокой целлюлазной активностью, что согласуется с литературными данными [19]. Они могут быть использованы для улучшения технологии деградации отходов древесной промышленности. В сочетании с высокой целлюлазной активностью (4.8 баллов) грибы U. botrytis могут проявлять фитопатогенные свойства, которые доказаны для овощных форм бобов и фасоли [17, 18].
Вырабатывали большое количество целлюлаз, приводящих к деструкции фильтровальной бумаги, но при невысокой фенолоксидазной активности (см. таблицу), штаммы C. lunata (3.8 балла), A. alternata и B. australiensis (по 1.8 балла), которые могут найти применение при подборе продуцентов целлюлаз. Однако, штаммы с высокой активностью целлюзоразрушающих ферментов, согласно нашим данным, согласующимися с литературными [9, 10], могут представлять опасность для здоровых растений и это необходимо учитывать в разработке технологии защиты растений. С учетом этого, перспективным может стать непатогенный штамм C. echinulata, способный к деструкции лигнина, но обладающий невысокой целлюлазной активностью и может быть рассмотрен в разрезе использования в составе препаратов – деструкторов стерни.
Способностью избирательно разрушать лигнин, не затрагивая ценную целлюлозную составляющую древесины (см. данные таблицы), обладали так называемые биоделигнификаторы, штаммы C. echinulata, B. fabae, M. phaseolicola .
Однако вопрос корреляции патогенности штаммов с комплексной ферментативной активностью микроми-цетов требует дальнейшего изучения.
Выводы
Таким образом, все изученные штаммы способны расщеплять лигнин и целлюлозу. При сравнении фенолоксидазной активности штаммов предложено учитывать ростовой коэффициент, выражающийся отношением диаметра колонии на субстрате с добавлени-ем0.06% танина (ароматическое производное лигнина) к диаметру колонии без танина, позволяющий выделить перспективные по комплексной активности ферментов штаммы T. koningii и U. botrytis . Штаммы C. lunata, A. alternata и B. australiensis проявили высокую целлюлазную активность. Особый интерес может представлять штамм непатогенного почвенного гриба C. echinulata, обладающий способностью к деструкции лигнина.
Об авторах:
Yulia N. Kurkina – Ph.D. (Agriculture), Associate professor of the Department of Biotechnology and Microbiology
Список литературы Фенолоксидазная активность штаммов микромицетов, выделенных из ризосферы овощных бобовых культур
- Солдатенко А.В., Пивоваров В.Ф., Разин А.Ф., Мещерякова Р.А., Шатилов М.В., Иванова М.И., Тактарова С.В., Разин О.А. Экономика овощеводства: состояние и современность. Овощи России. 2018;(5):63-68. DOI: 10.18619/2072-9146-2018-5-63-68
- Хрусталева Г.А., Аллахвердиев С.Р. Эффективные микроорганизмы и азотное питание растений. Успехи современного естествознания. 2014;8:28-30.
- Рязанова Т.В., Чупрова Н.А., Лунева Т.А. Воздействие гриба рода Trichoderma на лигнин коры древесных пород. Катализ в промышленности. 2014;6:64-70.
- Рогожин В.В. Практикум по биологической химии. СПб. 2006:256.
- Санданова И.Б. Микробиологическая деструкция растительного опада степных экосистем юго-восточного Забайкалья: дисс.кбн.2007:127.
- Казарцев И.А., Рощин В.И., Соловьев В.А. Разложение углеводов древесины Populus tremula и под действием лигнинразрушающих грибов. Микология и фитопатология. 2014;48(2):112-117.
- Вырасткова К.А., Широких И.Г. Исследование природных изолятов микромицетов на целлюлозолитическую активность. Advancedscience. 2017;1:7.
- Саданов А.К., Созинова Л.Ф. Клеточная селекция мягкой пшеницы на устойчивость к болезням. Астана. 2006:266.
- Тагиманова Д.С., Хапилина О.Н., Созинова Л.Ф., Какимжанова А.А. Изучение ферментативной активности фитопатогенных штаммов гриба Drechslera triticirepentis. Вестник КазНУ. Серия биологическая. 2014;1/2(60):349-351.
- Еюбов Б.Б., Меджунова А.А., Гахраманова Ф.Х., Алиева Ф.А., Мамедова Ф.Р. Способность патогенных грибов выделять гидролитические ферменты. Вестник МГОУ. Серия Естественные науки. 2009;4:92-95.
- Бицадзе Н.Г. Способность к выделению пектолитических, целлюлолитических ферментов и токсических веществ патогенным грибом Coniothyrium cerasi. Микология и фитопатология. 2006;40(5):433-437.
- Нгуен Тхи Лан Хыонг. Экологические особенности комплексов микромицетов травянистых растений семейства Бобовые (Fabaceae Lindl.) в условиях юга Среднерусской возвышенности: дисс.к.б.н. М. 2015:212.
- Билай В.И., Элланская И.А., Кириленко Т.С. Микромицеты почв. Киев. 1984:264.
- Литвинов М.А. Определитель микроскопических почвенных грибов. Л., 1967:312.
- Пидопличко Н.М. Грибы-паразиты культурных растений: Определитель. Т.3. Пикнидиальные грибы. 1978:230.
- Куркина Ю.Н. Патогенность штаммов ризосферных микромицетов бобовых культур. Защита и карантин растений. 2017;8:49-51.
- Куркина Ю.Н. Болезни овощных бобов, вызываемые микроскопическими грибами. Овощи России. 2018;(3):99-104.
- DOI: 10.18619/2072-9146-2018-3-99-104
- Касатова Е.С. Активность экзооксидоредуктаз микроскопических грибов в связи с биодеструкцией ими природных и синтетических полимеров: автореф..к.б.н. Н.Новгород. 2011:18.


