Феномен краудинга при раке молочной железы как фактор прогноза
Автор: Крахмаль Н.В., Завьялова М.В., Вторушин С.В., Таширева Л.А., Перельмутер В.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 т.22, 2023 года.
Бесплатный доступ
Цель исследования - оценить морфологические проявления феномена краудинга при инвазивной карциноме молочной железы и сопоставить полученные данные с параметрами прогрессирования опухолевого процесса. материал и методы. В группу исследования включены 107 больных раком молочной железы (средний возраст - 57,2 ± 11,2 года) без неоадъювантной химиотерапии. Проводили морфологическое и иммуногистохимическое исследование образцов опухоли молочной железы, полученных в результате оперативного лечения. Гистологический тип рака молочной железы устанавливали согласно рекомендациям ВОЗ (The WHO Classification of Breast Tumours, 5th Edition, 2019). В исследование включали только случаи с инвазивной карциномой неспецифического типа. Оценку клинических параметров проводили на основании данных анализа медицинских карт пациентов. Статистический анализ проведен с помощью программы Statistica 10.0, различия считались значимыми при уровне статистической значимости р
Феномен краудинга, клеточная экструзия, опухолевая инвазия, рак молочной железы
Короткий адрес: https://sciup.org/140300182
IDR: 140300182 | УДК: 618.19-006.6-039.36-037 | DOI: 10.21294/1814-4861-2023-22-3-66-75
Текст научной статьи Феномен краудинга при раке молочной железы как фактор прогноза
Опухолевая инвазия представляет собой первый шаг, начальное звено в процессе прогрессирования злокачественного новообразования. Механизмы, которые лежат в основе данного процесса и его регулируют, несмотря на значительный прогресс в изучении карцином, остаются изученными не до конца [1]. Известно, что опухолевая инвазия осуществляется посредством двух основных типов инвазивного клеточного роста: коллективной (групповой) и индивидуальной (инвазия отдельными клетками). При коллективной инвазии происходит миграция целых групп опухолевых клеток, которые соединены друг с другом посредством коммуникационных контактов и молекул адгезии. В свою очередь, индивидуальная инвазия характеризуется миграцией отдельных опухолевых клеток, распространяющихся в окружающие ткани изолированно друг от друга [2–6]. При изучении данных литературы выяснилось, что ряд исследователей при детальном рассмотрении механизмов инвазивного роста описывают такой феномен, как краудинг, который лежит в основе самых первых проявлений как коллективной, так и индивидуальной опухолевой инвазии [1, 7].
Краудинг (от англ. Crowding – скучивание, вытеснение), собственно, явление «скучивания»
клеток, возникает в тот момент, когда количество эпителиальных клеток начинает превышать в определенном объеме ткани нормальные цифры в 1,6– 1,8 раза [7]. Вслед за этим на клеточной мембране «лишней» клетки, которая в физиологических условиях является клеткой, завершившей свой жизненный цикл, экспрессируется Sphingosine-1-Phosphate (S1P), вследствие чего на соседних клетках активируется рецептор Sphingosine-1-Phosphate receptor 2 (S1P2). Эти процессы одновременно сопровождаются определенной переориентацией микротубул. В результате происходит апикальная экструзия – «выдавливание» погибающей, завершившей жизненный цикл клетки из пласта эпителия в противоположном от базальной мембраны направлении [8, 9]. Так в эпителиальных тканях происходят процессы физиологической регенерации, посредством которых в структуре пласта эпителия поддерживается постоянное количество клеток. Апикальная экструзия не нарушает барьерной функции эпителия благодаря полному сохранению целостности эпителиального пласта и базальной мембраны [8, 10‒12].
Однако некоторые мутации могут приводить к изменениям, при которых злокачественно трансформированные эпителиальные клетки в условиях роста и усиленного деления начинают осуществлять клеточную экструзию в базальном направлении, проникая через мембрану в подлежащие ткани, где под воздействием определенных хемотаксических сигналов становятся способными к миграции [8, 13].
К возникновению базальной экструзии может приводить нарушение адекватной перестройки микротубул [14]. Полагают, что базальной экструзии может способствовать секреция опухолевыми клетками металлопротеиназ или же клетки могут проникать в межклеточный матрикс без деградации базальной мембраны. Клетки, подвергшиеся базальной экструзии, сохраняют способность к делению, в них отмечена позитивная экспрессия Е-кадхерина. Комплексы таких клеток способны к коллективному движению [1, 11]. Одной из причин базальной экструзии может быть мутация в гене K-Ras , которая приводит к невозможности апикальной экструзии клеток вследствие нарушения активации рецепторов S1P and S1P2. В этих условиях происходит сокращение актина в области апикального края, что и приводит в итоге к базальной экструзии клеток [1]. Высказывается предположение, что в основе механизма, инициирующего процесс опухолевой инвазии, могут лежать краудинг и базальная клеточная экструзия [1, 13, 15].
Морфологически феномен апикальной или базальной экструзии в опухоли достоверно определить трудно. В отличие от клеточной экструзии краудинг может быть выявлен при исследовании препаратов, окрашенных гематоксилином и эозином. Изменения на светооптическом уровне, характерные для данного феномена, морфологически проявляются формированием участков «скученности» или «наслоения» ядер опухолевых клеток. На наш взгляд, не исключено, что обнаружение данных морфологических изменений в различных структурах опухоли может быть сопряжено с параметрами прогрессирования опухолевого процесса.
Рак молочной железы (РМЖ) представляет собой крайне гетерогенное злокачественное новообразование [16–19]. В инфильтративном компоненте опухоли отмечается большое разнообразие морфологических структур, являющихся, в определенном отношении, проявлением различных вариантов инвазивного роста. Понимание механизмов, лежащих в основе инициации опухолевой клеточной инвазии, может иметь существенное значение для разработки способов ее ингибирования [1, 20]. Таким образом, можно предположить, что краудинг и клеточная экструзия самым тесным образом могут быть связаны с морфогенезом различных структур инвазивного рака молочной железы, обладающих разными потенциями к прогрессированию. В связи с этим представляется интересным оценить феномен краудинга при инвазивной карциноме молочной железы и определить наличие возмож- ной взаимосвязи с параметрами прогрессирования опухолевого процесса.
Цель исследования состоит в оценке морфологических проявлений краудинга при инвазивной карциноме молочной железы и сопоставлении полученных данных с параметрами прогрессирования опухоли.
Материал и методы
Группу исследования составили 107 больных раком молочной железы стадии T1–4N0–3M0 в возрасте 29–85 лет (средний возраст – 57,2 ± 11,2 года), проходивших лечение в отделении общей онкологии НИИ онкологии ФГБНУ «Томский НИМЦ РАН». Неоадъювантная терапия не проводилась. Основные клинико-морфологические характеристики представлены в табл. 1.
В работе выполняли морфологическое исследование операционного материала. Макроскопически оценивали ткань первичной опухоли и все удаленные аксиллярные лимфатические узлы. Проводку материала и изготовление гистологических препаратов осуществляли по стандартной методике с окраской срезов гематоксилином и эозином. Морфологическое исследование выполняли с использованием светового микроскопа Carl Zeiss Axio Lab.A1 (Германия). Гистологический тип рака молочной железы устанавливали согласно рекомендациям ВОЗ (The WHO Classification of Breast Tumours, 5th Edition, 2019). В исследование включали только случаи с инвазивной карциномой неспецифического типа. В каждом случае оценивали степень злокачественности карциномы молочной железы, анализируя морфологически в баллах наличие тубулярных структур в опухоли, ядерный полиморфизм и количество митозов (Nottingham histological Grade). В каждом случае определяли молекулярно-генетический тип опухоли (luminal A-like; luminal B-like HER2-negative; luminal B-like HER2-positive; HER2-positive; triple-negative) на основе оценки экспрессии в опухоли рецепторов эстрогенов, прогестерона, белка ERBB2 (HER2) и Ki67 (13th St. Gallen International Breast Cancer Conference; 2013). В инфильтративном компоненте опухоли молочной железы определяли различные паттерны с определением альвеолярных, трабекулярных, тубулярных и солидных структур, а также дискретных групп опухолевых клеток. В каждом случае оценивали количество разных типов структур в инфильтративном компоненте, которое варьировало от 1 до 5 соответственно. Во всех присутствующих в опухоли многоклеточных типах структур (альвеолярные, трабекулярные, тубулярные и солидные структуры) определяли наличие либо отсутствие морфологических проявлений феномена краудинга (рис. 1). Далее при наличии краудинга в каждом из присутствующих типов структур карциномы молочной железы оценивали его вариант – вариант по типу «скучивания» или
Таблица 1/table 1
Клинико-морфологическая характеристика больных инвазивной карциномой неспецифического типа молочной железы clinical and morphological characteristics of patients with invasive breast carcinoma of no special type
|
Параметры/Parameters |
Частота встречаемости/ Frequency of occurrence |
|
|
Объем операции/ |
Радикальная мастэктомия/Radical mastectomy |
52 (49 %) |
|
Extent of surgery |
Секторальная резекция/Sectoral resection |
55 (51 %) |
|
>35 лет/>35 years |
2 (2 %) |
|
|
Возраст/Age |
35–50 лет/35–50 years |
25 (23 %) |
|
<50 лет/<50 years |
80 (75 %) |
|
|
Менструальная функция cохранена/Preserved menstrual function |
31 (29 %) |
|
|
Менопауза/Menopaus |
76 (71 %) |
|
|
I стадия/Stage I |
49 (46 %) |
|
|
IIA стадия/Stage IIA |
33 (31 %) |
|
|
Стадия заболевания/ |
IIB стадия/Stage IIB |
14 (13 %) |
|
Stage |
IIIА стадия/Stage IIIA |
9 (8 %) |
|
IIIB стадия/Stage IIIB |
1 (1 %) |
|
|
IIIC стадия/Stage IIIC |
1 (1 %) |
|
|
<2 см (T1)/<2 cm (T1) |
63,5 % (n=68) |
|
|
Размер первичной опухоли/ Size of primary tumor (T) |
2–5 см (T2)/2–5 cm (T2) |
34,5 % (n=37) |
|
>5 см (T3)/>5 cm (T3) |
1 (1 %) |
|
|
T4 |
1 (1 %) |
|
|
Локализация |
Наружные квадранты/Outer quadrants |
53 (48 %) |
|
первичной опухоли/ |
Внутренние квадранты/Inner quadrants |
28 (25,5 %) |
|
Localization of primary |
Граница квадрантов/Quadrant boundary |
27 (24,5 %) |
|
tumor |
Центральные отделы/Central parts |
2 (2 %) |
|
Luminal A-like |
39 (36 %) |
|
|
Молекулярногенетический тип/ |
Luminal B-like HER2-negative |
36 (34 %) |
|
Luminal B-like HER2-positive |
14 (13 %) |
|
|
genetic type |
Triple-negative |
14 (13 %) |
|
HER2-positive |
4 (4 %) |
|
|
Лимфогенные метастазы/ |
Присутствуют/Present |
40 (37 %) |
|
Lymph node metastases |
Отсутствуют/Absent |
67 (63 %) |
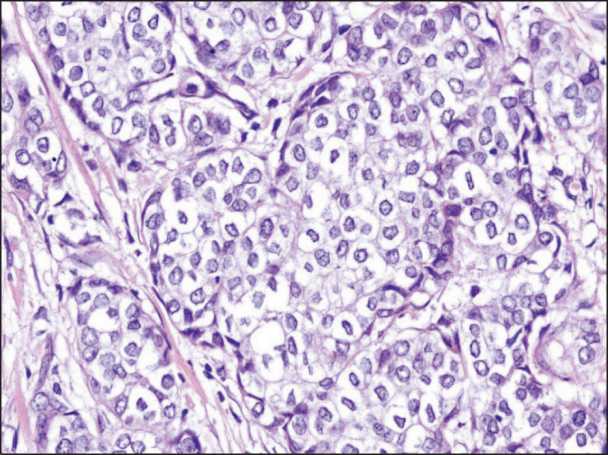
Рис. 1. Солидный паттерн инфильтративного компонента инвазивной карциномы неспецифического типа молочной железы с отсутствием краудинга. Окраска гематоксилином и эозином, ×400
Fig. 1. Solid pattern of infiltrative component of invasive breast carcinoma of no special type without Crowding. Hematoxylin and eosin stain, ×400
вариант по типу «наслоения» клеток. Морфологически при краудинге по типу «скучивания» клеток (тип 1) мы понимали наличие в структурах опухоли участков с близким расположением клеток и их ядер друг к другу (ближе, чем средний диаметр ядра опухолевых клеток) (рис. 2). При варианте краудинга по типу «наслоения» клеток (тип 2) понимали наличие в структурах опухоли участков с отчетливо определяемым наслоением ядер этих клеток друг на друга (рис. 3).
Оценку индекса пролиферативной активности опухоли (Ki67) выполняли с использованием метода иммуногистохимии (стандартный протокол, антитело к Ki67; клон MIB-1, RTU). Экспрессию Ki67 в опухоли (общий процент экспрессии Ki67) оценивали по процентному содержанию клеток, ядра которых имели позитивную экспрессию маркера (в 10 полях зрения на 1000 клеток при ×400). Далее в каждом случае во всех имеющихся типах структур инфильтративного компонента карциномы оценивали процент экспрессии Ki67 в участках с отсутствием краудинга, а при наличии краудинга
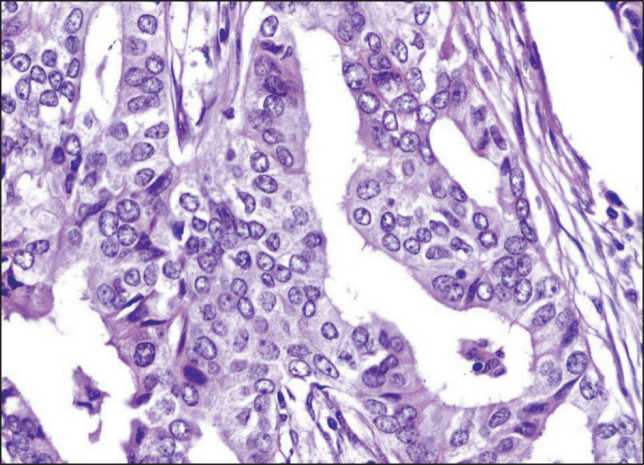
Рис. 2. Краудинг по типу «скучивания» (тип 1) в структурах инфильтративного компонента инвазивной карциномы неспецифического типа молочной железы. Окраска гематоксилином и эозином, ×400
Fig. 2. Crowding (type 1) in the structures of infiltrative component of invasive breast carcinoma of no special type. Hematoxylin and eosin stain, ×400
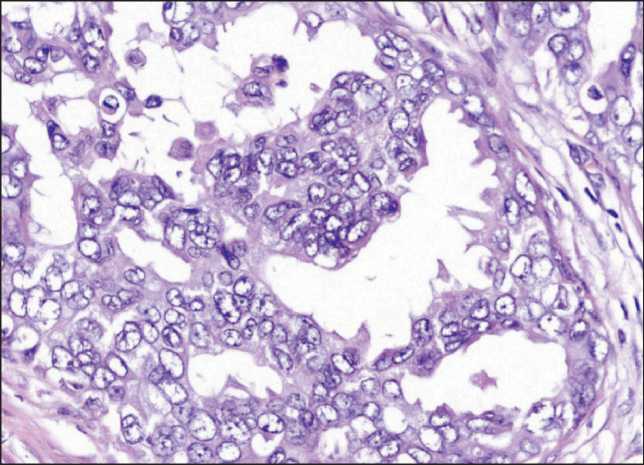
Рис. 3. Краудинг по типу «наслоения» (тип 2) в структурах инфильтративного компонента инвазивной карциномы неспецифического типа молочной железы. Окраска гематоксилином и эозином, ×400
Fig. 3. Crowding (type 2) in the structures of infiltrative component of invasive breast carcinoma of no special type. Hematoxylin and eosin stain, ×400
оценивали данный параметр в участках краудинга (краудинг тип 1 и краудинг тип 2).
При морфологическом исследовании в строме опухоли оценивали наличие и выраженность гиалиноза и воспалительной инфильтрации по 3-балльной системе (1 балл – слабая степень выраженности, 2 балла – умеренная степень выраженности, 3 балла – показатель резко выражен).
Иммуногистохимическое исследование проводили в соответствии со стандартным протоколом с использованием антител к интегрину β3 ab75872 (Сlone EPR2417Y; rabbit monoclonal; 1:250; Ab-cam) и к интегрину β1 ab3167 (Сlone 4B7R; mouse monoclonal; 1:20; Abcam). Оценивали наличие экспрессии (позитивная экспрессия) маркеров в разных структурах инфильтративного компонента инвазивной карциномы неспецифического типа молочной железы в участках с наличием морфологических проявлений краудинга.
Во всех удаленных и взятых при макроскопическом исследовании лимфатических узлах оценивали наличие очагов метастатического поражения. Оценку клинических параметров проводили на основании данных анализа медицинских карт пациентов. Исследование одобрено на заседании этического комитета ГБОУ ВПО «Сибирский государственный медицинский университет» Минздрава России 24.02.14 (регистрационный номер 3593).
Статистический анализ проведен с помощью программы Statistica 10.0. Количественные признаки, распределение которых отличалось от нормального, представлены в виде медианы (Me) и интерквартильного размаха (Q1÷Q3). Номинальные признаки описывали с указанием абсолютных значений и процентных долей. Для сравнения независимых совокупностей использовали непараме- трический U-критерий Манна–Уитни. Сравнение номинальных данных проводилось при помощи критерия χ2 Пирсона и точного теста Фишера. Различия считались статистически значимыми при уровне статистической значимости р<0,05.
Результаты
Краудинг в структурах инфильтративного компонента опухоли был обнаружен в 91 (85 %) случае. Оценка частоты феномена краудинга в зависимости от ряда клинико-морфологических параметров представлена в табл. 2. Оценка частоты лимфогенного метастазирования в зависимости от наличия и типа краудинга в опухоли (морфологическая гетерогенность опухоли не учитывалась) не выявила значимых различий (табл. 3).
Определенный интерес представляла оценка наличия краудинга в опухоли и его варианта с учетом различных паттернов инфильтративного компонента новообразования (морфологическая гетерогенность). Результаты работы позволили определить наличие взаимосвязи между лимфогенным метастазированием и наличием краудинга в определенных опухолевых структурах инфильтративного компонента инвазивной карциномы молочной железы. При наличии краудинга в солидных структурах значимо чаще регистрировались регионарные метастазы, важно отметить, что в этой группе изучаемый морфологический признак выявлен в 100 % случаев в отличие от больных без метастатического поражения лимфоузлов (100 vs 83 %; χ 2=5,1; р=0,02) (табл. 4). Вариант краудинга в разнообразных паттернах инфильтративного компонента новообразования не имел значимых различий у пациентов с позитивным и негативным нодальным статусом.
Таблица 2/table 2
Частота встречаемости краудинга в инвазивной карциноме молочной железы в зависимости от клинико-морфологических параметров
Frequency of crowding occurrence in invasive breast carcinoma depending on clinical and morphological parameters
|
Параметры/Parameters |
Краудинг/Crowding |
|
|
Отсутствует/Absent (n=16) |
Присутствует/Present (n=91) |
|
|
Возраст/Age, Ме (Q1÷Q2) |
55,5 (52,0÷62,0) |
58,0 (49,0÷65,0) |
|
Менструальная функция cохранена/ Menstrual function preserved |
6/16 (37,5 %) |
25/91 (27,4 %) |
|
Менопауза/Menopaus |
10/16 (62,5 %) |
66/91 (72,5 %) |
|
Размер первичной опухоли/Size of primary tumor (T) |
||
|
Т1 |
10/16 (62,5 %) |
58/91 (64 %) |
|
Т2 |
6/16 (37,5 %) |
31/91 (34 %) |
|
Т3 |
0/16 |
1/91 (1 %) |
|
Т4 |
0/16 |
1/91 (1 %) |
|
Степень гистологической злокачественности/Degree of histological grade |
||
|
Grade 1 |
3/16 (19 %) |
8/91 (9 %) |
|
Grade 2 |
10/16 (63 %) |
69/91 (76 %) |
|
Grade 3 |
3/16 (18 %) |
14/91 (15 %) |
|
Паттерн инфильтративного компонента/Pattern of infiltrative component |
||
|
Альвеолярный/Alveolar |
10/16 (63 %) |
68/91 (75 %) |
|
Тубулярный/Tubular |
9/16 (56 %) |
44/91 (48 %) |
|
Трабекулярный/Trabecular |
12/16 (75 %) |
79/91 (87 %) |
|
Солидный/Solid |
7/16 (44 %) |
62/91 (68 %) |
|
Дискретные клетки/Discrete cells |
12/16 (75 %) |
68/91 (75 %) |
|
Количество паттернов в опухоли/ Number of patterns in a tumor, Ме (Q1÷Q2) |
3,0 (2,0÷4,0) |
4,0 (3,0÷4,0) |
|
Выраженность гиалиноза в строме/Severity of hyalinosis in the stroma |
||
|
Слабо выражен/Mild |
14/16 (88 %) |
70/91 (77 %) |
|
Умеренно выражен/Moderate |
2/16 (12 %) |
14/91 (15 %) |
|
Резко выражен/Severe |
0/16 |
7/91 (8 %) |
|
Выраженность воспалительной инфильтрации в строме/Severity of inflammatory infiltration in the stroma |
||
|
Слабо выражена/Mild |
11/16 (69 %) |
39/91 (43 %) |
|
Умеренно выражена/Moderate |
3/16 (19 %) |
28/91 (31 %) |
|
Резко выражена/Severe |
2/16 (12 %) |
24/91 (26 %) |
|
Молекулярно-генетический тип/Molecular genetic type |
||
|
Luminal A-like |
6/16 (37,5 %) |
34/91 (37 %) |
|
Luminal B-like HER2-negative |
6/16 (37,5 %) |
29/91 (32 %) |
|
Luminal B-like HER2-positive |
3/16 (19,75 %) |
11/91 (12 %) |
|
Triple-negative |
1/16 (6,25 %) |
13/91 (14 %) |
|
HER2-positive |
0/16 |
4/91 (5 %) |
|
Процент экспрессии Ki67/percentage of Ki67 expression, Ме (Q1÷Q2) |
22,4 (15,3÷34,0) |
25,0 (13,0÷36,0) |
|
Лимфогенные метастазы/Lymph node metastases |
||
|
Отсутствуют/Absent |
10/16 (62,5 %) |
57/91 (63 %) |
|
Присутствуют/Present |
6/16 (37,5 %) |
34/91 (37 %) |
При исследовании показателя пролиферативной активности опухоли было установлено, что общий процент экспрессии Ki67 не имел значимых различий в группах больных с наличием (n=40) и отсутствием (n=67) лимфогенных метастазов – 25,5 (15,5÷33,0) vs 24,0 (13,1÷39,8). Однако изучение данного показателя в разных структурах инфильтративного компонента опухоли с учетом особенностей краудинга позволило обнаружить, что в группе с наличием лимфогенных метастазов процент Ki67 в солидных структурах в участках с наличием краудинга 1-го типа (вариант краудинга по типу «скучивания» клеток) имеет более низкие значения по сравнению со случаями, в которых отсутствовало метастатическое поражение лимфатических узлов – 20,5 (12,5÷30,0) vs 56,0 (38,0÷60,0) (р=0,002).
Полученные результаты позволяют расценивать данную связь как прогностический признак, ассоциированный с лимфогенной диссеминацией.
Таблица 3/table 3
Частота лимфогенного метастазирования в зависимости от наличия и варианта краудинга the frequency of lymph node metastases depending on the presence and type of crowding
Лимфогенные метастазы/Lymph node metastases
|
Параметры/Parameters |
Отсутствуют/ Absent |
Присутствуют/ Present |
|
Краудинг в опухоли/Crowding in the tumor |
||
|
Отсутствуют/Absent |
10/67 (15 %) |
6/40 (15 %) |
|
Присутствуют/Present |
57/67 (85 %) |
34/40 (85 %) |
|
Вариант краудинга в опухоли/Type of crowding in the tumor |
||
|
Вариант краудинга по типу «скучивания» клеток (тип 1)/ Type 1 of Crowding |
29/57 (51 %) |
16/34 (47 %) |
|
Вариант краудинга по типу «наслоения» клеток (тип 2)/ Type 2 of Crowding |
28/57 (49 %) |
18/34 (53 %) |
Таблица 4/table 4
Частота лимфогенного метастазирования в зависимости от наличия краудинга в различных структурах инфильтративного компонента опухоли (морфологическая гетерогенность) the frequency of lymph node metastases depending on the crowding presence in different structures of infiltrative component of tumor (morphological heterogeneity)
|
Лимфогенные метастазы/ Параметры/Parameters Lymph node metastases Отсутствуют/Absent Присутствуют/Present |
||
|
Краудинг в альвеолярных структурах/Crowding in alveolar structures |
||
|
Отсутствуют/Absent |
7/41 (17 %) |
8/27 (30 %) |
|
Присутствуют/Present |
34/41 (83 %) |
19/27 (70 %) |
|
Краудинг в тубулярных структурах/Crowding in tubular structures |
||
|
Отсутствуют/Absent |
15/27 (55 %) |
7/17 (41 %) |
|
Присутствуют/Present |
12/27 (45 %) |
10/17 (59 %) |
|
Краудинг в трабекулярных структурах/Crowding in trabecular structures |
||
|
Отсутствуют/Absent |
1/49 (2 %) |
3/30 (10 %) |
|
Присутствуют/Present |
48/49 (98 %) |
27/30 (90 %) |
|
Краудинг в солидных структурах/Crowding in solid structures |
||
|
Отсутствуют/Absent |
6/35 (17 %) |
0/27 |
|
Присутствуют/Present |
29/35 (83 %) |
27/27 (100 %) χ 2=5,1; р=0,02 |
Для уточнения фундаментальных аспектов обнаруженной взаимосвязи проведено иммуногистохимическое исследование с оценкой экспрессии поверхностных рецепторов в опухолевых клетках – интегринов, осуществляющих взаимодействие со структурами внеклеточного матрикса и определяющих такие особые для миграции свойства, как форма и подвижность [21, 22]. Установлено, что у пациенток с метастатическим поражением лимфатических узлов именно в солидных структурах в участках с наличием краудинга значимо реже регистрировалась позитивная экспрессия интегрина β1, чем у больных без метастазов, – 50 vs 94 % (χ2=5,4; p=0,01). При изучении особенностей экспрессии интегрина β3 подобной взаимосвязи с лимфогенной диссеминацией опухоли не выявлено.
Обсуждение
Наличие феномена краудинга в злокачественной опухоли свидетельствует об увеличении количества клеток в единице объема новооб- разования. Представляется, что описанные два морфологических проявления краудинга могут быть последовательными фазами одного процесса. Краудинг по типу «скучивания» клеток (тип 1) демонстрирует первую фазу, а краудинг по типу «наслоения» (тип 2) – вторую. В пользу такой очередности свидетельствует тот факт, что «скучива-ние» клеток опухоли может быть изолированным, в то время как феномен «наслоения» клеток всегда сочетается с их «скучиванием». Таким образом, переход одной фазы краудинга в другую может свидетельствовать о сохранении значительного увеличения количества клеток в единице объема опухолевой ткани вследствие нарушения механизмов как апикальной, так и базальной экструзии. В доступной литературе нам не встретилось подобного сравнения двух морфологических вариантов проявления краудинга.
Морфологические проявления краудинга «скучивание» и «наслоение» свидетельствуют о патологии процесса обновления эпителия. В условиях физиологической нормы своевременно развивающаяся апикальная экструзия с апоптозом экструдированных клеток предотвращает не только наслоение, но и скучивание [23]. Результаты исследования позволили показать, что подобного рода изменения в клетках опухоли оказались связанными с такой формой опухолевой прогрессии, как лимфогенное метастазирование, при этом особое значение имела внутриопухолевая гетерогенность новообразования. Во всех случаях с метастатическим поражением регионарных лимфоузлов регистрировался краудинг в солидных структурах, при этом необходимо отметить, что в участках краудинга по типу «скучивания» клеток зарегистрирован меньший процент экспрессии Ki67, что может говорить о возможном снижении пролиферативной активности опухоли в участках, характеризующихся избыточным количеством опухолевых клеток. Важным является и тот факт, что в
Список литературы Феномен краудинга при раке молочной железы как фактор прогноза
- Slattum G.M., Rosenblatt J. Tumour cell invasion: an emerging role for basal epithelial cell extrusion. Nat Rev Cancer. 2014 Jul; 14(7): 495-501. https://doi.org/10.1038/nrc3767. Epub 2014 Jun 19.
- Pankova K., Rosel D., Novotny M., Brabek J. The molecular mechanisms of transition between mesenchymal and amoeboid invasiveness in tumor cells. Cell Mol Life Sci. 2010 Jan; 67(1): 63-71. https://doi.org/10.1007/s00018-009-0132-1.
- Friedl P., Locker J., Sahai E., Segall J.E. Classifying collective cancer cell invasion. Nat Cell Biol. 2012 Aug; 14(8): 777-83. https://doi.org/10.1038/ncb2548.
- Spano D., Heck C., De Antonellis P., Christofori G., Zollo M. Molecular networks that regulate cancer metastasis. Semin Cancer Biol. 2012 Jun; 22(3): 234-49. https://doi.org/10.1016/j.semcancer.2012.03.006.
- Cheung K.J., Gabrielson E., Werb Z., Ewald A.J. Collective invasion in breast cancer requires a conserved basal epithelial program. Cell. 2013 Dec 19; 155(7): 1639-51. https://doi.org/10.1016/j.cell.2013.11.029.
- Haeger A., Wolf K., Zegers M.M., Friedl P. Collective cell migration: guidance principles and hierarchies. Trends Cell Biol. 2015 Sep; 25(9): 556-66. https://doi.org/10.1016/j.tcb.2015.06.003.
- Eisenhoffer G.T., Loftus P.D., Yoshigi M., Otsuna H., Chien C.B., Morcos P.A., Rosenblatt J. Crowding induces live cell extrusion to maintain homeostatic cell numbers in epithelia. Nature. 2012; 484(7395): 546-9. https://doi.org/10.1038/nature10999.
- Slattum G., Gu Y., Sabbadini R., Rosenblatt J. Autophagy in oncogenic K-Ras promotes basal extrusion of epithelial cells by degrading S1P. Curr Biol. 2014 Jan 6; 24(1): 19-28. https://doi.org/10.1016/j.cub.2013.11.029.
- Gudipaty S.A., Rosenblatt J. Epithelial cell extrusion: Pathways and pathologies. Semin Cell Dev Biol. 2017; 67: 132-140. https://doi.org/10.1016/j.semcdb.2016.05.010.
- Tabasinezhad M., Samadi N., Ghanbari P., Mohseni M., Saei A.A., Sharifi S., Saeedi N., Pourhassan A. Sphingosin 1-phosphate contributes in tumor progression. J Cancer Res Ther. 2013; 9(4): 556-63. https://doi.org/10.4103/0973-1482.126446.
- Kuipers D., Mehonic A., Kajita M., Peter L., Fujita Y., Duke T., Charras G., Gale J.E. Epithelial repair is a two-stage process driven first by dying cells and then by their neighbours. J Cell Sci. 2014 Mar 15; 127(Pt 6): 1229-41. https://doi.org/10.1242/jcs.138289.
- Ngo P.A., Neurath M.F., Lopez-Posadas R. Impact of Epithelial Cell Shedding on Intestinal Homeostasis. Int J Mol Sci. 2022 Apr 9; 23(8): 4160. https://doi.org/10.3390/ijms23084160.
- Gu Y., Forostyan T., Sabbadini R., Rosenblatt J. Epithelial cell extrusion requires the sphingosine-1-phosphate receptor 2 pathway. J Cell Biol. 2011 May 16; 193(4): 667-76. https://doi.org/10.1083/jcb.201010075.
- Slattum G., McGee K.M., Rosenblatt J. P115 RhoGEF and microtubules decide the direction apoptotic cells extrude from an epithelium. J Cell Biol. 2009 Sep 7; 186(5): 693-702. https://doi.org/10.1083/jcb.200903079.
- Kelley L.C., Lohmer L.L., Hagedorn E.J., Sherwood D.R. Traversing the basement membrane in vivo: a diversity of strategies. J Cell Biol. 2014; 204(3): 291-302. https://doi.org/10.1083/jcb.201311112.
- Tamimi R.M., Colditz G.A., Hazra A., Baer H.J., Hankinson S.E., Rosner B., Marotti J., Connolly J.L., Schnitt S.J., Collins L.C. Traditional breast cancer risk factors in relation to molecular subtypes of breast cancer. Breast Cancer Res Treat. 2012 Jan; 131(1): 159-67. https://doi.org/10.1007/s10549-011-1702-0.
- Prat A., Ellis M.J., Perou C.M. Practical implications of geneexpression-based assays for breast oncologists. Nat Rev Clin Oncol. 2011 Dec 6; 9(1): 48-57. https://doi.org/10.1038/nrclinonc.2011.178.
- Denisov E.V., Litviakov N.V., Zavyalova M.V., Perelmuter V.M., Vtorushin S.V., Tsyganov M.M., Gerashchenko T.S., Garbukov E.Y., Slonimskaya E.M., Cherdyntseva N.V. Intratumoral morphological heterogeneity of breast cancer: neoadjuvant chemotherapy efficiency and multidrug resistance gene expression. Sci Rep. 2014 Apr 16; 4: 4709. https://doi.org/10.1038/srep04709.
- Luond F, Tiede S., Christofori G. Breast cancer as an example of tumour heterogeneity and tumour cell plasticity during malignant progression. Br J Cancer. 2021 Jul; 125(2): 164-175. https://doi.org/10.1038/s41416-021-01328-7.
- Goldhirsch A., Winer E.P., Coates A.S., Gelber R.D., Piccart-Gebhart M., Thurlimann B., Senn H.J.; Panel members. Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013. Ann Oncol. 2013 Sep; 24(9): 2206-23. https://doi.org/10.1093/annonc/mdt303.
- Romagnoli M., Bresson L., Bi-Cicco A., Perez-Lanzon M., Legoix P., Baulande S., de la Grange P., De Arcangelis A., Georges-Labouesse E., Sonnenberg A., Deugnier M.A., Glukhova M.A., Faraldo M.M. Laminin-binding integrins are essential for the maintenance of functional mammary secretory epithelium in lactation. Development. 2020; 147(4): dev181552. https://doi.org/10.1242/dev.181552.
- Smeland H.Y., Askeland C., Wik E., Knutsvik G., Molven A., Edelmann R.J., Reed R.K., Warren D.J., Gullberg D., Stuhr L., Akslen L.A. Integrin a11p1 is expressed in breast cancer stroma and associates with aggressive tumor phenotypes. J Pathol Clin Res. 2020 Jan; 6(1): 69-82. https://doi.org/10.1002/cjp2.148.
- Andrade D., Rosenblatt J. Apoptotic regulation of epithelial cellular extrusion. Apoptosis. 2011 May; 16(5): 491-501. https://doi.org/10.1007/s10495-011-0587-z.


